配位化合物
第五章配位化合物

[Ag(S2O3)2]3-, [Fe(CN)6]4-, [Fe(SCN)6]3-, [HgI4]2- , [Fe(CN)6]3-等 或原子)和一定数目 配位单元:由中心离子(或原子 配位单元:由中心离子 或原子 和一定数目 的中性分子或阴离子以配位键结 合而成的中性分子或复杂离子。 合而成的中性分子或复杂离子。 [Ni(CO)4], [Co(NH3)3F3], [Pt(NH3)2Cl2], K3[Fe(SCN)6], [Ag(NH3)2]NO3。 配合物: 含配位单元的化合物。 配合物 含配位单元的化合物。
6
{
多齿配体数≠( ) 多齿配体数 (<) 配位数 中心离子的配位数一般等于其电荷数的二倍 如:M+——2、M2+——4、M3+——6 、 、 ④.配离子的电荷数 a. 配离子的电荷数等于中心原子的氧化数 和配体总电荷数的代数和。 和配体总电荷数的代数和。 b. 外层电荷数的相反数。 外层电荷数的相反数。 K3[Fe(SCN)6] [Ag(NH3)2]NO3 中心离子的电荷数: 中心离子的电荷数 +3(Ⅲ) +1(Ⅰ) [Pt(NH3)2NO2NH2 Cl2] +4(Ⅳ) Ⅳ
13
[Co(NH3)5(ONO)]Cl2 氯化亚硝酸根•五氨合钴 Ⅲ) 氯化亚硝酸根 五氨合钴(Ⅲ 五氨合钴 六氯合铂( 六氯合铂(Ⅳ)酸 H2[PtCl6] Na3[Ag(S2O3)2] [Cu(NH3)4](OH)2 K3[Fe(SCN)6] 二硫代硫酸根合银(Ⅰ 酸钠 二硫代硫酸根合银 Ⅰ)酸钠 氢氧化四氨合铜(Ⅱ 氢氧化四氨合铜 Ⅱ) 六硫氰合铁(Ⅲ 酸钾 六硫氰合铁 Ⅲ)酸钾
12
首页 上页 下页 返回
[Ag(S2O3)2]3[Cr(NH3)5(H2O)]3+ [Cu(NH3)4]2+ [Fe(NH3)2(en)2]3+ [Co(NH3)5(ONO)]2+ [Cr(NH3)3Cl3]
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
配位化合物

• 配位反应与氧化还原反应的关系 配位离解平衡与氧化还原平衡的关系,主 要体现在配位化合物的生成对电极电势的影 响。
根据能斯特方程: 若氧化型生成配位化合物,浓度减小,则E减小; 若还原型生成配位化合物,浓度减小,则E增大。
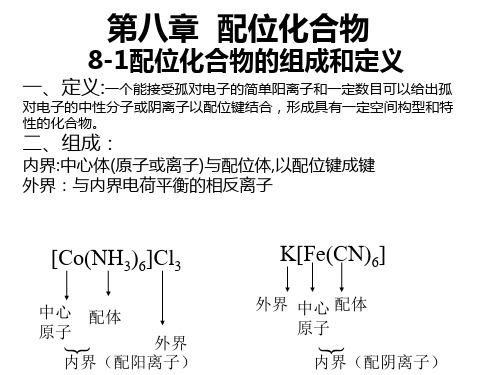
中心原子(阳离子或原子)与一定数目的配体(离子或 中性分子) ,通过配位键结合,并按一定组成和空间 构型形成的复杂离子称为配离子
例如, [Cu(H2O)4] 2+
含有配离子的化合物以及中性配位分子统称为 配合物。 例如, H[AuCl4] 、[Co(NH3)Cl3]
配位键 配体 中心原子
[Cu (NH3)4]SO4 [Cu (NH3)4]2+
• 当配位体接近中心离子时,为了增强成键 的能力,中心离子用能量相近的空轨道进 行杂化,形成数目相同,能量相等的具有 一定方向性的杂化空轨道,以容纳配位体 提供的电子形成配位键。配离子的空间构 型、配位数及稳定性等主要取决于杂化轨 道的数目和类型。 • M :L(L代表配位体)
第三节 配位化合物的离解平衡
中 心 离 子 配 位 配 体 位 原 子 配 位 数 离 子 电 荷
内界(配离子)
外界 SO42-
内界
在配合物化学式中用方括号表示内界。 配合物的内界能稳定地存在于晶体及水溶液中。 它是配合物的特征部分,它的结构和性质与其他离 子不同。 如: [ Cu (NH3) 4 ]2+
外界
不在内界的其他离子,如SO42- 构成配合物的外界。 写在方括号外,
单齿配体:一个配体中只有一个配位原子 例如: Ag+ 与NH3 结合
配位化合物

Ni2+可以利用丁二肟在氨溶液中与Ni2+配位生成桃红 色絮状螯合物沉淀物来鉴定。
首页
上一页
下一页
末页
32
利用硫氰根负离子可以与Co2+形成蓝紫色的四硫氰 根 合 钴 ( II ) [Co(SCN)4]2- 来 检 验 Co2+ 的 存 在 。 与 Fe3+形成血红色配合离子可供检验Fe3+的存在。
K4[Fe (CN)6]
六氰合铁(Ⅱ)酸钾
H4[Fe (CN)6]
六氰合铁(Ⅱ)酸
[Co(NH3)5H2O]Cl3
氯化五氨·水合钴(Ⅲ)
首页
上一页
下一页
末页
18
配合物的类型
(1)简单配合物 由单齿配体与中心原子直接配位而成的配位化合 物。
例:[Ag(NH3)2]+ BF4[Fe(H2O)6]Cl3 [CoCl3(NH3)3] 等
28Ni 3d84s2 3d
Ni2+
4s 4p
[Ni(CN)4]2-
dsp2杂化
CN- CN- CN-CN-
首页
上一页
下一页
末页
24
[NiCl4]2-的空间构型为四面体。
28Ni 3d84s2
3d
Ni2+
4s 4p
[NiCl4]2-
3d sp3杂化
4s
4p
Cl- Cl- Cl- Cl-
首页
上一页
下一页
首页
上一页
下一页
末页
38
配合物与配位作用用于医学
什么是配位化合物?络合反应?

什么是配位化合物?络合反应?配位化合物和络合反应是无机化学中的重要概念。
配位化合物是由一个中心金属离子与络合体中化合物中的配体配位形成的化合物。
而络合反应就是配体与金属离子之间的配位过程。
一、配位化合物的定义及特点配位化合物是由一个中心金属离子与一个或多个配体通过均一或均四电子共轭配位键构成的化合物。
配体可以是有机物,也可以是无机物。
配位化合物可以具有很多不同的性质和应用。
1. 配位键配位键是指金属离子与配体之间的化学键。
根据不同的金属离子和配体,配位键可以分为配位共价键、氢键、离子键等。
配位共价键是对称的、电性的、共价性的。
氢键是轻元素或者氢与非金属之间形成的一种特殊化学键。
离子键是由电负性不同的原子或离子之间形成的化学键。
2. 配位度配位度是指配位体中与金属离子形成配位键的配位原子或配位基团的个数。
例如,水为配体的配位度为2,而乙二胺为配体的配位度为2。
3. 配位数配位数是指配位化合物中一个金属离子周围配位体数目的总数。
例如,六配位化合物的配位数为6。
4. 配位子配位子是指形成配位化合物的配体或配体的综合物。
配位子可以是一个原子或一个离子,也可以是一个配体络合物或一个配体的反应物。
二、络合反应的机理及应用络合反应是指金属离子与配体之间形成配位化合物的化学过程。
络合反应可以通过配位键的形成和断裂来实现。
1. 配位键的形成配体通过自旋被阻止以及相互接近的方式与金属离子形成配位键。
配位键的形成过程涉及电子供体与电子受体之间的配体静态效应和动态效应。
2. 配位键的断裂配位键的断裂是指配位体离开金属离子所需的能量。
配位键的断裂通常涉及与其他配体相互作用,或者通过外界条件改变。
3. 应用领域络合反应在无机化学、有机化学、生物化学以及材料科学等领域具有广泛的应用。
在无机化学中,络合反应可用于合成具有特定性质的金属配位聚合物和金属配位材料。
在有机化学中,络合反应可用于合成金属有机化合物,如金属有机催化剂。
在生物化学中,络合反应在生物体内维持金属离子的稳定性和活性。
什么是配位化合物

什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。
配位化合物
[Cu(NH3)2]Ac + CO + NH3 ===== [Cu(NH3)2]Ac.CO
减压加热
H = -35kJ
Cu2+ + 5CN- = Cu(CN)43- + 0.5(CN)2 K稳 =2×1030 (极为稳定,加入H2S也无沉淀,Ksp=2.5×10-50))
Cu(CN)4 3 - + e == Cu + 4CNE = -1.27V Zn(CN)42- + 2e == Zn + 4CNE = -1.26V 这两个电对的电势值相近,所以镀黄铜(Cu-Zn合金)所 用的电镀液为上述混合物.
[AlCl4][BF4][AgI4]2- 从这些配离子你看出配位数有什么规律? 从这些配离子你看出配位数有什么规律?
二,化学键理论
维尔纳(Werner.A):Nobel Prize提出三点: 维尔纳( 提出三点: 提出三点 1,主价和副价 , 主价指氧化数,副价指配位数. 主价指氧化数,副价指配位数. 2,倾向于既要满足主价,又要满足副价. ,倾向于既要满足主价,又要满足副价. 3,副价指向空间的确定位置. ,副价指向空间的确定位置. 1,价键理论:中心离子和配位原子都是通过杂化了的共价配位键 ,价键理论: 结合的. 结合的. (1)配位键的本质: )配位键的本质: a,σ配位键: 配位键: , 配位键
2,复盐 ,
CsRh(SO4)2.4H2O + BaCl2 无沉淀出现. 无沉淀出现. [Rh(H2O)4(SO4)2]-(二硫酸根四水合铑(III)) 二硫酸根四水合铑( )) 二硫酸根四水合铑 KCl.MgCl2.6H2O不是配合物 不是配合物
3,组成 ,
(1)配位体:是含有孤电子对的分子和离子 )配位体:
配位化合物知识总结
VS
磁性配合物在磁学、磁记录、信息存 储和分子基磁体等领域有广泛的应用 前景。
Part
04
配位化合物的应用
在化学反应中的作用
催化反应
配位化合物可以作为催化剂,通 过与反应物结合,改变反应途径,
降低反应活化能,从而加速化学 反应的进行。
分离和提纯
利用配位化合物的独特性质,如选 择性络合、稳定性差异等,可以实 现化学物质的分离和提纯。
配位化合物的稳定性取决于多个因素 ,包括中心离子的性质、配位体的类 型和数量、以及配位环境等。
稳定性规律
一般来说,中心离子的电荷数越高、 半径越小,配位化合物的稳定性越强 ;配位体的电子给予能力越强、数目 越多,稳定性也越高。
配位化合物的合成方法
有机合成
通过有机合成方法,可以制备出结构复杂、功能多样的配 位化合物。常见的合成方法包括重氮化反应、氧化还原反 应等。
配位化合物的分类
按中心原子分类
根据中心原子的种类,可以将配位化合物分为金属配位化合物和非金属配位化合物。金属配位化合物是指中心原 子为金属元素的配位化合物,如铜、钴、铁等;非金属配位化合物是指中心原子为非金属元素的配位化合物,如 硫、氮、磷等。
按配位数分类
根据配位数的大小,可以将配位化合物分为低配位数(2-4)和高配位数(≥6)的配位化合物。低配位数配位化 合物是指中心原子周围参与配位的配位体数目较少的配位化合物;高配位数配位化合物是指中心原子周围参与配 位的配位体数目较多的配位化合物。
02
动态配位化合物
03
超分子配位化合物
具有可逆的结构变化和反应性, 可用于传感器、分子机器等领域。
由多个分子或离子通过非共价相 互作用形成的复杂结构,具有独 特的物理和化学性质。
配位化合物
总解离反应: [Ag(NH3)2]+(aq) 总解离常数(不稳定常数):
Ag+(aq)+2NH3(aq) Kd
{c(Ag )}{c( NH3 )}2 Kd Kd1Kd 2 {c(Ag(NH3 ) 2 )}
无机及分析化学
显然,Kd 越大, 配合物越不稳定。
西南科技大学
13
2. 配位平衡
• 稳定
•
加热不放出氨气
[Co(NH3)6]Cl3
2. 特征: 有[内界]外界,如:[Ag(NH3)2]Cl;
外层 内层
从溶液中析出配合物 时,配离子常与带有相反 电荷的其他离子结合成盐, 这类盐称为配盐。
K3 [Fe ( C N )6 ]
形 成 体
配配 配 位体 位 原 数 子
西南科技大学
2
无机及分析化学
无机及分析化学
西南科技大学
14
在溶液中,配离子的生成一般是分步进行的,因此溶液中 存在着一系列的配位平衡,每一步都有相应的稳定常数,称为 逐级稳定常数。 c Ag+(aq)+NH3(aq)
(1)简单配合物
单基配位体和中心原子所形成的配合物,如 [Ag(NH3)2]Cl。
(2)螯合物
多基配位体以一个或两个配位原子与同一中 心原子配位所形成的环状化合物, 如[Zn(en)2]2+,en:NH2CH2CH2NH2 (乙二胺)。
(3)多核化合物
由配位体与多个中心原子所形成的配合物, 如[(H20)4Fe(OH)2Fe(H2O)4]4+。
(4)羰合物
以羰基配位体与金属形成的一类化合物,如 Ni(CO)4。
无机及分析化学 西南科技大学
8
配位化合物
配位数
2 3 4 4 5 5 6 6
中心 杂化方式
构型
实例
sp sp2 sp3 dsp2 dsp3 sp3d sp3d2 d2sp3
直线形 [ Ag( NH3)2 ]+ 三角形 [ Cu(CN)3 ]2- 四面体 [ Zn(NH3)4 ]2+ 正方形 [ N(i CN)4 ]2-
三角双锥 [ F(e CO)5 ] 三角双锥 [ Fe(SCN)5 ]2-
2 溶剂合异构
当溶剂分子取代配位基团而进入配离子的内界所
产生的溶剂合异构现象。与电离异构极为相似, 最熟悉 的例子是:
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O 在配合物的内界,各含有6、5、4个配位水分子 和0、1、2个配位氯离子, 在配合物的外界各含有0、1 、2个溶剂合水分子和3、2、1个可电离的氯离子。这 些异构体在物理和化学性质上有显著的差异,如它们的 颜色分别为绿、蓝绿、蓝紫。
4p 4s
dsp2杂化
Ni(CN)24
八面体构型
对于F-,H2O等配体而言,配位原子F,O的电负性大, 不易给出孤对电子对,所以对中心体的3d轨道上的 电子不发生明显的影响,因此3d轨道上的电子排布 情况不发生改变 ,形成外轨型配合物。
对于CN-,CO等配位体而言,配位原子C的电负性小, 较易给出孤对电子对,对中心体的3d轨道发生重大 影响,从而使3d发生了电子重排,腾出能量较低的 内层(n-1)d轨道与ns,np轨道杂化,形成内轨型配合 物。
en
en
AACoe Nhomakorabea enCo
en
en
[Co(en)3])
A M
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
异构现象(isomerism) 结构异构
电离异构、水合异构、配位异构、键合异构、配体异构 电离异构:
[Co(NH3)5Br]SO4 [Co(NH3)5Br]2+ + SO42[Co(NH3)5SO4]Br [Co(NH3)5SO4]2+ + Br配位异构:
[Co(NH3)6][Cr(CN)6]和[Cr(NH3)6][Co(CN)6]
32
Jahn-Teller效应:d轨道图
33
18电子规则
又称有效原子序数法则,用于预测
金属配合物的结构和稳定性。
过渡金属价电子层有5个d、1个s和3
个p轨道,共可容纳29 = 18个电子。
举例:
Cr(CO)6 Fe(CO)5 Ni(CO)4 二茂铁(II)
34
配合物的颜色
22
范夫莱克
John H. van Vleck, 1899-1980 美国固体物理学家 获1977年Nobel物理学奖
d轨道的分裂:八面体场
0
球形场
八面体场d轨道分裂能为o
23
d轨道的分裂:四面体场
d轨道
24
d轨道在正方形场里的分裂
sp
25
同种构型配合物的分裂能:
总的规律:中心离子与配体间的斥力大小决定分裂能
与KClO3的命名比较
配阳离子配合物
[Ag(NH3)2]Cl
一氯化二氨合银(I)
与AgCl比较
中性配合物
[Ni(CO)4]
8
四羰基合镍(0)
注意:不要忘记标出中心原子或离子的价态。
对于多配体配合物,命名的原则是:
无机配体列前,有机配体列后 先带负电,再中性,后带正电
同类配体,按照配位原子元素符号的英文字母顺序
I-, Br-, Cl-, F-, OH-, H2O, NCS-, NH3, en, NO2, CN-, CO 弱场配体
为什么存在如上顺序?
强场配体
以H2O为界,可以把配体分为强场和弱场配体。
根本原因是配位键的性质(配体场理论解释得更清楚)。
电子配对能 P
电子配对能反映了在d电子轨道处于近简并情况下,电子 选择平行化的倾向(铁磁相互作用)。
晶体场理论的局限 中心离子-配体之间没有共价键。 不能解释光谱化学序列的顺序。
28
CFSE对离子水化热的影响
同周期过渡金属离子有效核
电荷数依次增加,水化热理 论值应递增(虚线)。
但由于H2O是弱场配体,d电
子采取高自旋排布,屏蔽效 应减弱,实测水化热增加。
29
CFSE对离子半径的影响
35
36
四、多核配合物
金属-金属键
1964年,F. A. Cotton测定了K2[Re2(Cl)8]的晶体结构,提
出了Re-Re四重键的概念。
37
金属-金属五重键
2005年,Power等人发现了Cr-Cr五重键。
38
Cr-Cr五重键轨道图
39
Cruz-Taube离子
1969年,加拿大无机化学家Henry Taube发现如下混和价
与中心离子电荷有关。同一元素,电荷越高,越大; 与中心离子半径有关。带有相同电荷的不同中心离子, 离子半径越大,分裂能越大。 与配体的电荷和极性有关。 问题一:八面体场为什么会分裂,难道不是每个d轨道都受 到静电排斥吗?
问题二:为什么四面体场分裂小于八面体场?
26
光谱化学序列(配体对晶体场分裂的影响)
量子理论原理
简并轨道不均匀占据时,轨道会重组(线性组合),使得重 组后的轨道分裂,配合物形状改变,对称性下降。
31
Jahn-Teller效应:拉伸 vs. 压缩
Jahn-Teller效应并不能预言配合物会拉伸
会压缩,只是说会变形。
Jahn-Teller形变如右图所示,左、右代表
不同的形变方向。
电子配对能与d轨道分裂能相互竞争,决定了中心离子d
电子的排布形式。
27
晶体场稳定化能(CFSE)
o = 10 Dq (注意:Dq不是定值,而是参数符号) CFSE = -4Dq n
电子配对能(P) 电子自旋配对所需要的能量。~ 30,000 cm-1,大约在可
见光区波长范围内。电子配对能的来源是电子的库仑 斥力的增加以及交换能的丧失。
17
情况二:
d2sp3杂化,八面体 3d 4s 4p
称为内轨型配合物,或低自旋配合物。 未成对电子少,磁矩小。
18
磁矩
什么是磁矩?
其中, B是Bohr磁子,又称Lande因子,是一个常数;n是 体系中的单电子数。
19
配合物磁矩的测定(Gouy天平)
20
三、晶体场理论(CFT)
1928年,Hans Bethe提出用静电相互作用解释
[Ti(H2O)6]3+的颜色。
1935年,van Vleck改进上述理论,增加共价成分,成
为配体场理论的基础。
晶体场理论的核心思想是中心离子的d轨道在配体所 形成的静电场中发生分裂。
21
晶体场(1928)和配体场(1935)
汉斯·贝特
Hans Bethe, 1906-2005.3.6 德裔美国核物理学家 获1967年Nobel物理学奖
同样,过渡金属离子半径
同周期递减,由于有效核 电荷递增(实心点)。
但由于H2O是弱场配体,d
电子呈高自旋排布。对于 同一离子,高自旋状态的 半径大于低自旋状态的半 径。
30
Jahn-Teller效应
《结构化学基础》:
Jahn-Teller理论,当简并d轨道(例如eg)中电子数不同时, 轨道会发生分裂,从而消除简并态,配合物发生形变。
[CoCl2(NH3)2(H2O)2]Cl,一氯化二氯二氨二水合钴(III)
若配位原子也相同,按配体原子数,先少后多
[PtNO2NH3(NH2OH)(py)]Cl, 一氯化硝基氨羟胺吡啶合铂(II)
若配位原子数目也相同,按配体中与配位原子相邻原子的英
文字母顺序 [PtNH2NO2(NH3)2],氨基硝基二氨合铂(II)
13
配位数与异构体个数的关系
配位数2
直线型:无异构体
配位数4
四面体:无异构体 平面四方形:2种,顺式(cis-)和反式(trans-)
14
配位数6
八面体
单一配体 X=5, Y=1
X=4, Y=2
X=3, Y=3
X=2, Y=2, Z=2
15
二、配位化合物的价键理论
价键理论
1930’s,Pauling开始用价键理论解释配位化合物的
离子,并证实其中存在电子转移现象。
1983年,Henry Taube因上述发现获得诺贝尔化学奖。
Cruz-Taube离子
40
本章结束
41
卞 江 北京大学化学与分子工程学院
一座连接无机与有机化学的桥梁
旧金山·金门大桥
2
内容
配位化合物的基本概念 价键理论 晶体场理论 多核配合物
3
命名
中国化学会无机化学委员会提出命名规则(1979)
配阴离子配合物
K4[Fe(CN)6]
六氰合铁(II)酸钾
(俗称亚铁氰化钾,黄血盐)
键合异构 :SCN硫氰根 :ONO- 亚硝酸根
:NCS-
异硫氰根
:NO2-
硝基
10
空间异构
几何异构 顺式-和反式Pt(NH3)2Cl2,顺式具有抗癌活性,而反式 则没有。
旋光异构(镜像异构,光学异构,手性) 两个异构体互为镜像
11
配合物镜像异构体
12
手性分子的光学活性
手性分子能够偏转偏振光。两种光学异构体的光转动角度相同,方 向相反。故分别称为右旋(dextro,缩写为d或(+))和左旋(levo,缩写 为l或(-))异构体。
成键规律。
价键理论要点 中心金属离子提供空轨道,配位体提供孤对电子,
配位键是共价键。
16
配位数:6 [FeF6]3Fe 3d64s2 Fe3+ 3d5 有两种情况。 情况一:
3d
4s
4p
4d
sp3d2杂化,八面体
这种利用中心金属离子d轨道外层的配合物称为“外 轨型配合物”。此时内层d轨道的单电子充分占据简 并能级,具有高磁矩,故又称“高自旋配合物”。这 类配合物未成对电子数多,表现顺磁性,磁矩大。
