分光光度法测定碘含量
分光光度法测定盐水中微量碘

分光光度法测定盐水中微量碘黄静静;郭礼波【摘要】用分光光度法测量了盐水中微量碘浓度.通过控制反应时间和酸度,令分析结果稳定准确.【期刊名称】《氯碱工业》【年(卷),期】2016(052)011【总页数】3页(P35-37)【关键词】盐水;碘;分光光度法;测定【作者】黄静静;郭礼波【作者单位】四川大学化工学院,四川成都610064;四川大学化工学院,四川成都610064【正文语种】中文【中图分类】TQ506.6【分析与测试】在离子膜法烧碱生产过程中,为保护离子膜,必须严格控制进电解槽的二次盐水的质量。
这其中碘含量是一个重要的指标。
盐水中的碘离子在电解槽环境中会被氧化成高碘酸根,并与Na+、Ba2+、Ca2+、Mg2+等离子(即使其浓度极低)生成不溶的高碘酸盐化合物,在膜中沉积下来,随着时间的迁移对膜造成不可逆的损害,降低电流效率,最终缩短膜的使用寿命,造成巨大的经济损失。
因此,必须控制I-的质量分数在1×10-6以下。
在相关的国家和行业标准中,尚未规定盐水中I-的测定方法。
本文中研究了采用分光光度法对盐水中微量碘进行测定的具体步骤和条件,通过酸度和反应时间的控制,建立了简便的操作程序,结果稳定可靠。
1.1 方法原理过量溴水使盐水中的I-氧化形成用甲酸钠除去过量的溴,加入过量碘化钾还原生成;析出的单质碘与淀粉形成蓝色吸附物,在一定的条件下其吸光度与盐水中的碘含量成正比。
据此,通过标准曲线方程进行定量计算[1],反应方程式如下:1.2 试剂及材料(1)乙酸钠溶液:pH值为4.6。
(2)磷酸。
(3)甲酸钠溶液:质量浓度为100 g/L。
(3)碘化钾溶液:质量浓度为50 g/L。
(4)饱和溴水:在市售质量分数为3%的溴水中加入少量溴素(可在瓶底见到深色溴素),保存在深色玻璃瓶中。
(5)淀粉指示剂溶液:质量浓度为5 g/L。
(6)碘标准储备溶液:ρ(I-)= 1 mg/mL。
制备方法:将基准碘酸钾置于(110±2)℃的烘箱内干燥2 h至质量恒定,准确称取0.843 2 g,溶解于水后移至500 mL容量瓶中,定容,摇匀。
水质碘化物的测定分光光度法

水质碘化物的测定分光光度法
碘化物是水中溶解的碘元素,是污染水体的重要指标,碘化物的浓度超标会影响水体的生态环境,因此碘化物的测定是评价水质的一个重要指标。
碘化物的测定主要通过分光光度法。
分光光度法是将溶液中的碘化物吸收到一定量的紫外光中,根据吸收光谱的不同波长的紫外线,测量其有效吸收率确定碘化物含量,进而推算出碘化物的浓度。
首先,选择溶液样本,将样品加入分光光度仪中,调节分光光度仪的参数,对样品进行分光光度测量。
将样品的吸收光谱的不同波长的吸收率和标准曲线进行比较,确定碘化物在样品中的浓度。
其次,在分光光度测量中,应注意样品的准备,样品的准备应该符合分光光度仪的要求,如果样品太稀或太浓,则可能会影响测量结果的准确性。
此外,在使用分光光度仪测量碘化物时,应尽量选择具备良好的稳定性和可靠性的仪器。
如果仪器的稳定性和可靠性不足,则可能会对测量结果产生较大的影响。
最后,应注意校正分光光度仪的参数,分光光度仪的参数在使用前应进行校正,以确保测量结果的准确性。
总之,碘化物的测定主要通过分光光度法,在进行分光光度测量时,需要注意仪器的稳定性和可靠性,样品的准备,以及校正分光光度仪的参数,这样才能得出准确的测量结果,做出相应的污染防治措施。
分光光度法测定食盐中碘含量方法的评述

分光光度法测定食盐中碘含量方法的评述分光光度法测定食盐中碘含量方法的评述随着人们生活水平的提高,大多数居民都能吃上加碘盐。
而有些人为了防治甲状腺病而大量吃海带、紫菜等富含碘的食物,以至碘过量,引起机体一系列的不良反应,甚至危及健康。
因此,及时、准确地测定食盐中的碘含量具有重要意义。
目前常用的测定食盐中碘含量的方法有三种:碘量瓶直接测定法;碘溶液比色测定法和分光光度法。
①分光光度法是一种可以同时测定吸光度和相对强度的物理方法,适合于现场操作,且灵敏度高,准确性好。
但操作繁琐,只适合小批量检测。
②碘量瓶法是将固定在架子上的塑料量筒底部烧灼后磨去,再用铅笔填写被测样品的量,最后将瓶口磨平封死,作为碘的标准液。
然后用分光光度计进行比色测定。
这种方法操作简单,但由于反复磨损,量筒内壁附着大量的铅,会影响到比色的精密度。
另外,由于量筒的大小限制,也使它不能满足批量检测的要求。
③分光光度法是将玻璃比色皿或金属比色皿放在分光光度计下面,当入射光线经过单色器通过棱镜时发生折射和干涉现象,形成各种颜色的光谱。
根据这些光谱的强度和颜色,便可求出待测元素的含量。
该方法操作简单,测定快速,但受客观条件限制较多,比如量程选择不当,将造成假阳性;波长选择不当,会导致吸收峰的损失;样品浓度太低或太高,都将使检测误差增大。
(1)测定样品应用分光光度法,以铁为基准标准。
当仪器校正完毕并做好空白样品测定时,将空白液直接注入已调零的比色管中,关闭玻璃阀门,待其自然沉降后即可读取吸光度。
(2)测定过程要注意条件控制,样品的处理温度、试剂、反应时间以及比色管内的空气要一致。
并使用恒温加热装置,避免温度升得过快。
(3)读数需要借助检流计,仪器采用自动电位滴定器。
并将所用的仪器以及电极和相应的参比溶液全部校正到仪器所给定的参考点。
另外,还应记录仪器测定过程中出现的吸光度值、 A/D变化值、仪器误差等,并与计算值对比,作出检验结果。
(4)试验结束后,试验人员应首先检查结果的精密度和准确度。
分光光度法测海带中碘的含量

( 1滨 州 医学院 药学 院 ,山 东 烟台 2 6 4 0 0 3 ;2滨 州 医学院 临床 医学 院 , 山东 烟台 2 6 4 0 0 3 ;3滨 州 医学院烟 台附属 医院 ,山 东 烟台 2 6 4 1 0 0 )
捅 要 :通过灰化 、氧化 和萃取三步从干海带 中提取 出了碘 。采 用紫外 可见分光光 度法测 定 了碘 在氯仿 中 的吸收光谱 ,碘 在氯仿 中的最大 吸收波长 为 5 1 1 a m,用吸收光谱测定 了海带 中碘 的含 量 ,标准 曲线 回归方程 为 A b s =0 . 0 0 2 1 4 c + 0 . 0 0 2 8 6 ,相 关系 数 R= 0 . 9 9 9 8 ,回收率 大于 9 7 %。结 果显示 ,该方法可以准确 的测 出海带 中碘的含量 ,海 带上半部分 含碘 量为 0 . 0 3 1 6 % ,下半 部 分海带 中碘含量 为 0 . 0 2 2 % ,上半部 分碘 的含量高于下半部分 。
c u r v e r e g r e s s i o n e q u a t i o n wa s Ab s= 0. 0 0 21 4c +0. 0 0 28 6 . R = 0. 9 9 9 8. Th e r e c o v e r y r a t e wa s g r e a t e r t h a n 9 7% . Th e
Bi n z h o u Me d i c a l Un i v e r s i t y,S ha nd o n g Ya n t a i 2 6 4 0 03;3 Ya n t a i Af il f i a t e d Ho s p i t a l ,
B i n z h o u Me d i c a l U n i v e r s i t y , S h a n d o n g Y a n t a i 2 6 4 1 0 0 C h i n a )
实验九 分光光度法测定海带中碘含量

实验九分光光度法测定海带中碘含量本实验采用分光光度法测定海带中碘含量。
利用碘对淀粉溶液的显色反应,在一定波长下测定淀粉-碘复合物的吸光度,计算海带中碘的含量。
实验原理:1.分光光度法分光光度法是一种测量物质含量(浓度)的方法,它通过测量吸收或透过样品之后光线的变化来得到样品中特定物质含量的信息。
分光光度法的基本关系式是比尔定律,即:A=εbc,其中,A为吸光度,ε为摩尔吸光系数,b为光程,c为浓度。
2.碘对淀粉的显色反应淀粉对碘有极强的亲合力,碘加入淀粉溶液后,可以形成淀粉-碘复合物,导致溶液变为深蓝色或蓝紫色。
淀粉-碘复合物在一定波长下有吸收特性,可以应用于分光光度法测定碘的含量。
实验步骤:1.制备标准曲线(1)准备5个量筒,分别注入0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL 10-3 mol/L 碘酸钾溶液。
(2)将每个量筒逐个加入去离子水至10 mL,搅拌均匀。
(4)在吸收波长610 nm下测定各个比色皿的吸光度。
(5)根据标准曲线计算样品中碘的含量。
2.测定样品(1)取少量海带,粉碎均匀。
(2)称取0.5 g 海带粉末,加入烧杯中,加入50 mL 1% 碳酸钠溶液,搅拌均匀。
(3)置于热板上煮沸,加热30 min,待凉。
(4)从烧杯中取出1 mL 溶液,加入试管中,加入1 mL 10% 硫酸,用急促手振法煮沸15 s,待凉。
(5)加入20 mL 去离子水,转移于100 mL 容量瓶中,用去离子水补足容量。
(6)取2 mL 溶液,加入比色皿中。
(7)按上述方法测定其吸光度,计算海带中碘的含量。
实验记录:测定碘酸钾溶液的吸光度,记录如下表:|稀释倍数|试剂量(mL)|比色皿体积(mL)|吸光度(D.O.)||-|-|-|-||0|0.0|2.0|0||1|0.2|2.0|0.236||2|0.4|2.0|0.472||3|0.6|2.0|0.711||4|0.8|2.0|0.942|利用上表制作标准曲线,计算出样品海带中碘的含量,结果如下表:海带溶液中的碘含量=样品吸光度×系数其中系数为:每1 mL 浓度为6.32 μg/mL 碘的标准溶液对应的吸光度为0.236。
加碘酸钾食盐中碘含量的紫外分光光度法测定

Ξ加碘酸钾食盐中碘含量的紫外分光光度法测定刘翠格, 默丽萍, 魏永巨(河北师范大学化学学院,河北石家庄 050016)摘 要:根据碘(I 2)、碘离子(I -)和碘三离子(I 3-)的紫外吸收光谱,拟订了加碘酸钾食盐中碘含量的光度测定方法.在p H 2.4,KI 浓度为0.01mol/L 的HCl 介质中,1mol 碘酸钾可定量转变为3mol I 3-,通过测量I 3-在288nm 或350nm 处的吸光度,可计算食盐样品中碘的含量.方法的加入回收率在96.8%~102.6%之间.本文中,笔者分析了2种市售碘盐样品,结果令人满意.关键词:碘;食盐;紫外分光光度法中图分类号:O 657.32 文献标识码:A 文章编号:100025854(2003)0520497203碘是人体内合成甲状腺素所必需的微量元素.适量的甲状腺素有促进机体生长、调节能量转换、稳定神经系统等作用.缺碘会影响机体代谢,引起甲状腺肿,严重者可致发育停滞、痴呆.按国际推荐标准,成人每日需碘0.1~0.3mg [1].防止碘缺乏的一个重要措施是推广食用加碘食盐.食盐中加碘的方法有2种,一是加入碘化钾,二是加入碘酸钾.1994年,国家规定在食盐中加入碘酸钾[2,3].目前市售加碘酸钾食盐中碘含量一般为(35±15)mg/kg.食盐含碘量的测定方法有多种[2],如滴定分析法、吸光光度法[3~6]、荧光及化学发光法[7]、离子选择电极法、极谱法、色谱法和专用测碘仪法[8]等.笔者在研究碘(I 2)、碘离子(I -)和碘三离子(I 3-)的紫外光谱时,观察到I 3-的紫外光谱与I 2和I -的紫外光谱有明显不同.根据这种光谱差异和碘的化学性质,拟订了加碘酸钾食盐中碘含量的测定方法,实验结果令人满意.1 原 理在酸性介质中,KIO 3与过量KI 反应生成I 2: IO 3-+5I -+6H +=3I 2+3H 2O.(1)I 2与I -结合生成I 3-: I 2+I -=I 3-.(2)反应完成后,溶液中含有I 3-和过量的I -.由于I 3-在260nm 以上有灵敏的光吸收,而I 2和I -在260nm 以上没有吸收(见图1),因而可以通过测定溶液的吸光度而得知I 3-的浓度,进而推算加碘酸钾食盐中碘的含量.2 实验部分2.1 仪器与试剂UV 2501PC 分光光度计(日本,岛津).I 2:分析纯,天津市天大化工实验厂出品,配制成0.500mmol/L 水溶液;KI :分析纯,中国医药公司进口分装,配制成0.050mol/L 水溶液,使用时适当稀释;KIO 3:化学纯,上海化学试剂总厂出品,配制成0.100mol/L 水溶液,使用时适当稀释;HCl :分析纯,配制成水溶液并标定其准确浓度;NaCl :分析纯,1.0mol/L 水溶液;实验用水为蒸馏水.2.2 实验方法在25mL 容量瓶中分别加入I 2,KI ,KIO 3,HCl ,NaCl 等溶液,用水稀释至刻度,摇匀,以水为参比,Ξ收稿日期:20030403;修回日期:20030531作者简介:刘翠格(1954),女,河北保定人,河北师范大学副教授,从事无机化学的教学与研究.第27卷第5期2003年 9月河北师范大学学报(自然科学版)Journal of Hebei Normal University (Natural Science Edition )Vol.27No.5Sep.20031cm 吸收池,扫描吸收光谱,或读取一定波长的吸光度.根据加入HCl 标准溶液的浓度和体积,计算显色溶液的p H 值,加入NaCl 溶液以控制离子强度.3 结果与讨论3.1 I 2,I -和I 3-的吸收光谱按实验方法测量I 2,I -和I 3-的吸收光谱,得图1.图1中I 2的吸收峰在202nm ,I -的吸收峰在193和226nm ,I 2和I -在260nm 以上没有吸收;I 3-的吸收峰在288和350nm ,摩尔吸光系数(ε)分别为3.52×104和2.33×104L/(mol ・cm ).根据反应式(1)和(2),1mol KIO 3可以定量转变为3mol I 3-,因此,KIO 3的反应是一个有倍增效应的高灵敏度显色反应.3.2 溶液酸度的影响溶液酸度对反应(1)有显著影响,实验表明在p H 1.4~3.4之间较为合适(见图2).在高酸度条件下(p H <1.4),I -可与溶解氧发生反应:4I -+4H ++O 2=2I 2+2H 2O ,产生正误差;而在低酸度条件下(p H >3.4),I 2发生歧化反应:3I 2+6OH -=5I -+IO 3-+3H 2O ,此时I 3-将不能生成.本实验控制p H为2.4.λ/nmI 2与I -的浓度均为0.060mmol/L ;I 3-为0.040mmol/L I 2+0.010mol/L KI图1 I 2,I -和I 3-的紫外吸收光谱p HKIO 3:5.0μmol/L ;KI :0.010mol/L ;0.2mol/L NaCl 介质图2 溶液酸度对显色反应的影响3.3 KI 用量的影响I 2:0.040mmol/L ;曲线1和2的测量波长分别为350,288nm图3 KI 用量对显色反应的影响由于I 3-的稳定常数较小(lg K =2.96)[9],为了保证反应(2)进行完全,必须加入过量的KI (见图3).本实验取KI 浓度为0.01mol/L.3.4 显色溶液的稳定性在过量KI 存在下,I 3-是相当稳定的.显色溶液在50min 内吸光度基本不变;时间再延长,溶液吸光度有所下降[5].3.5 共存物质的影响本方法基于氧化还原反应(1),只有氧化性离子如MnO 4,Cr 2O 72-,Cu 2+等才能产生干扰,但在食盐中,这些离子一般不存在,因此,本方法基本不存在干扰物质[4].3.6 工作曲线在p H 2.4,NaCl 浓度为0.2mol/L 的条件下,用KIO 3标准溶液制作工作曲线,回归方程分别如下:288nm :A =0.009+0.787c I ,r =0.99997;894河北师范大学学报(自然科学版)第27卷350nm :A =0.005+0.518c I ,r =0.99995.3.7 加入回收实验在碘盐样品溶液中定量加入KIO 3标准溶液,与样品溶液同时显色后,以样品显色溶液为参比,测量由于加入KIO 3所产生的吸光度增加值,再根据回归方程计算加入碘的浓度,进而计算回收率.以不同样品为基体,做了7次加入回收实验,分别在288和350nm 波长下测量,结果列于表1.表1中回收率在96.8%~102.6%之间,在光度分析允许误差范围内.表1 加入回收实验结果加入碘/(mg ・L -1)288nm吸光度增加值测得碘/(mg ・L -1)回收率/%350nm吸光度增加值测得碘/(mg ・L -1)回收率/%0.2540.20330.24797.20.13540.25299.20.2540.20230.24696.80.13490.25198.80.3810.30860.381100.00.20300.382100.30.3810.30410.37598.40.20000.37698.70.5080.41160.512100.80.27140.514101.20.3810.31430.388101.80.20760.391102.60.2540.20300.24797.20.13290.24797.23.8 样品分析称取市售加碘酸钾食盐10.00g ,溶解后转移至100mL 容量瓶中,以水定容.移取此溶液2.00~4.00mL 至25mL 容量瓶中,加入5.0mL 0.05mol/L KI ,1.0mL 0.1mol/L HCl ,用水稀释至刻度,摇匀,在288或350nm 测量吸光度,由工作曲线计算样品中碘的含量.笔者测定了2种市售加碘酸钾食盐样品,测量数据与计算结果列于表2.其中样品1为自然精制碘盐(执行标准QB 2446—99),样品2为碘盐洗粉(执行标准G B 5461—2000).这2种样品的含碘量标签值均为(35±15)mg/kg.由表2可见,样品2的含碘量平均值 x 与标签值一致,而样品1的含碘量平均值比标签值略低.表2 食盐样品碘含量的测定结果V /mL 样品1288nmAw /(mg ・kg -1)350nmAw /(mg ・kg -1)样品2288nmAw /(mg ・kg -1)350nmAw /(mg ・kg -1)2.000.136620.20.088320.00.243037.10.158837.03.000.189419.10.123219.00.344335.50.227035.74.000.248319.00.161818.90.461035.90.302635.9x ±s 19.4±0.719.3±0.636.2±0.836.2±0.8参考文献:[1] 周爱儒.生物化学[M ].第5版.北京:人民卫生出版社,2000.396.[2] 刘占广.碘盐含碘量分析综述[J ].海湖盐与化工,1999,28(6):33235.[3] 王彦,薛斌.分光光度法测定食盐中的碘含量[J ].辽宁化工,1996,(1):57258.[4] 胡章记.倍增反应紫外吸光光度法测定食盐中微量碘[J ].化学研究,2002,13(1):43244.[5] 马卫兴,薛婉立.紫外光度法测定食盐中的添加剂碘酸钾[J ].中国调味品,1997,(6):22224.[6] 王末肖,高磊红,刘春艳,等.吸光光度法测定碘酸钾的研究[J ].理化检验(化学分册),2002,38(5):2432244.[7] 张子红,杜凌云,王术皓,等.停流流动注射化学发光法测定碘盐中的碘酸根[J ].光谱实验室,2001,18(5):5842587.[8] 陈焕文,于爱民,韩松柏,等.手持式测碘仪现场测定食盐中的碘[J ].分析化学,2001,29(7):8552858.[9] 刘翠格,默丽萍.分光光度法测定I 3-的稳定常数[J ].化学通报,2003,66(3):2132214.(下转第530页)994第5期刘翠格等:加碘酸钾食盐中碘含量的紫外分光光度法测定035河北师范大学学报(自然科学版)第27卷界的物种多样性和遗传多样性的基因库.因此,在白洋淀建立湿地自然保护区,实施保护措施,防止湿地生态环境的破坏和生态功能的退化,无论是从保护湿地生态系统的特殊性、典型性和生物多样性的稀有性上,还是淡水湖泊资源本身所具有的社会经济价值上衡量,都具有十分重要的保护地位.但是,由于保护不力,白洋淀生态环境退化日益严重,已经给淀周边地区的经济和社会发展造成了巨大损失,并制约了淀区社会经济的发展,阻碍了人民生活水平的迅速提高,影响了社会的可持续发展战略的实施.因此,建议尽快建立白洋淀湿地自然保护区,以便使白洋淀能够迅速得到切实、有效的保护.白洋淀湿地自然保护区建立以后,应以生态学、生态经济学和可持续发展理论为指导,以保护湿地资源、生态环境和生物多样性为中心,以确保自然资源永续利用和生态系统的良性循环为目标,严格保护白洋淀湿地生态系统,大力改善和建设湿地生态环境,加大科技投入,积极开展科学研究,科学合理地利用自然资源,实现湿地生态系统的良性循环,促进区域社会经济的持续、稳定、健康发展,把白洋淀湿地自然保护区建设成为集自然保护、科研、宣传教育、生态旅游等多种功能于一体的综合效益显著的湿地类型自然保护区.参考文献:[1] 安新县地方志办公室.白洋淀志[M].北京:新华出版社,1996.[2] 安新县地方志编纂委员会.安新县志[M].北京:新华出版社,2000.On Establishing the N ature Preserve of B aiyangdian EvergladeWEN Zhi2guang(College of Resource and Environment Sciences,Hebei Normal University,Hebei Shijiazhuang 050016,China) Abstract:Illuminates the necessary of the nature preserve of Baiyangdian everglade through analyzing the worthiness of the ecological protect,economic and social benefits,and illuminates the urgent character of establishing the nature preserve of Baiyangdian everglade though analyzing the existent problems in the ecological protect,finally,advises establishing the nature preserve of Baiyangdian everglade as soon as possible and puts forward instructional thought and developmental direction of the constructing the nature preserve of Baiyangdian everglade.K ey w ords:Baiyangdian everglade;marsh;ecology;nature preserve(责任编辑 蔡丹英)(上接第499页)Determination of Iodine in Edible Salt AddedPotassium Iodate by U ltraviolet SpectrophotometryL IU Cui2ge, MO Li2ping, WEI Y ong2ju(College of Chemistry,Hebei Normal Universit y,Hebei Shijiazhuang 050016,China)Abstract:According to the ultraviolet absorption spectra of iodine,iodide ion and triiodide ion,a method for determination of iodine in edible salt added potassium iodate was proposed.In the medium of HCl with p H2.4,0.01mol/L KI,1mol potassium iodate may be quantitatively converted into3mol I3-. By measuring the absorbance of I3-at288or350nm,quantity of iodine in edible salt can be calculated.A recovery percent of this method was found to be96.8%~102.6%.Two samples of edible salt purchased from market were analyzed.The results were satisfactory.K ey w ords:iodine;edible salt;ultraviolet spectrophotometry(责任编辑 邱 丽)。
紫外分光光度法测定食盐中碘的含量
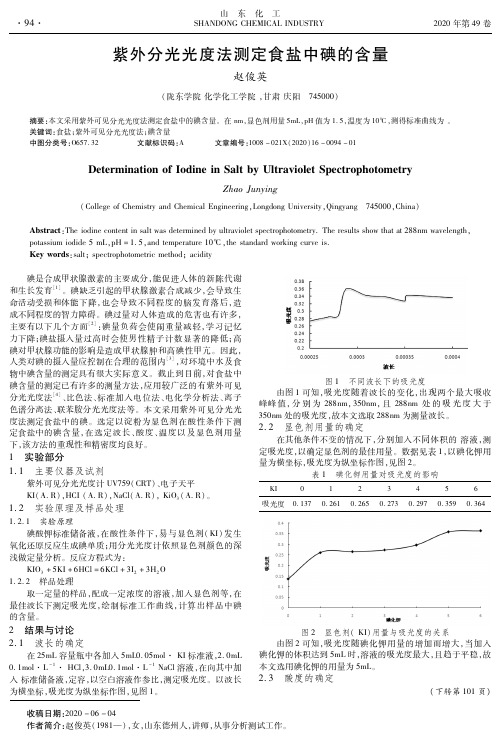
山 东 化 工 收稿日期:2020-06-04作者简介:赵俊英(1981—),女,山东德州人,讲师,从事分析测试工作。
紫外分光光度法测定食盐中碘的含量赵俊英(陇东学院化学化工学院,甘肃庆阳 745000)摘要:本文采用紫外可见分光光度法测定食盐中的碘含量。
在nm,显色剂用量5mL,pH值为1.5,温度为10℃,测得标准曲线为。
关键词:食盐;紫外可见分光光度法;碘含量中图分类号:O657.32 文献标识码:A 文章编号:1008-021X(2020)16-0094-01DeterminationofIodineinSaltbyUltravioletSpectrophotometryZhaoJunying(CollegeofChemistryandChemicalEngineering,LongdongUniversity,Qingyang 745000,China)Abstract:Theiodinecontentinsaltwasdeterminedbyultravioletspectrophotometry.Theresultsshowthatat288nmwavelength,potassiumiodide5mL,pH=1.5,andtemperature10℃,thestandardworkingcurveis.Keywords:salt;spectrophotometricmethod;acidity 碘是合成甲状腺激素的主要成分,能促进人体的新陈代谢和生长发育[1]。
碘缺乏引起的甲状腺激素合成减少,会导致生命活动受损和体能下降,也会导致不同程度的脑发育落后,造成不同程度的智力障碍。
碘过量对人体造成的危害也有许多,主要有以下几个方面[2]:碘量负荷会使闹重量减轻,学习记忆力下降;碘盐摄入量过高时会使男性精子计数显著的降低;高碘对甲状腺功能的影响是造成甲状腺肿和高碘性甲亢。
因此,人类对碘的摄入量应控制在合理的范围内[3],对环境中水及食物中碘含量的测定具有很大实际意义。
地下水—碘化物的测定—淀粉分光光度法

FHZDZDXS0072 地下水碘化物的测定淀粉分光光度法F-HZ-DZ-DXS-0072地下水—碘化物的测定—淀粉分光光度法1 范围本方法适用于地下水中碘离子的测定。
最小检测量为0.5μg,若取20mL水样测定,最低检测浓度为2.5μg /L。
测定范围:25μg/ L~500μg /L。
2 原理在磷酸介质中,加入溴水可以将溶液中存在的碘离子定量地氧化为碘酸根离子。
反应生成的碘酸根离子与碘化钾作用生成碘,碘再与淀粉作用生成蓝色化合物,借以进行比色或光度测定。
过量的溴用甲酸钠破坏。
过剩的甲酸钠,在酸性介质中经煮沸可以除去。
3 试剂除非另有说明,本方法所用试剂均为分析纯,水为二次去离子水。
3.1 饱和溴水:在少量蒸馏水中滴加液态溴(Br2),直到溶液上层出现橙色溴的蒸气,于磨口瓶中保存(用时现配)。
3.2 磷酸溶液(1+2)。
3.3 甲酸钠溶液(HCOONa,200g/L)。
3.4 碘化钾溶液(KI,10g/L)。
3.6 碘离子标准溶液3.6.1 碘离子标准贮备溶液,0.20 mg/mL:称取0.2616g碘化钾(KI,99.99%)溶于少量蒸馏水中,移入1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
此溶液1.00mL含0.20mg碘离子。
3.6.2 碘离子标准溶液,1.00μg /mL:吸取5.00mL碘离子标准贮备溶液(0.20mg/mL)于1000mL 容量瓶中,用蒸馏水中稀释至刻度,摇匀。
此溶液1.00mL含1.00μg碘离子。
3.7 淀粉溶液(5g/L):称取0.5g可溶性淀粉,加100mL蒸馏水,加热搅拌,直至溶液清亮透明。
4 仪器设备分光光度计。
5 试样制备5.1 取澄清原水样进行测定。
试样量20mL。
6 操作步骤6.1 水样分析取20.0mL水样于100mL烧杯中,加入6滴磷酸溶液(1+2),加10滴饱和溴水,放在电热板上,加热至恰沸腾时取下,趁热加入10滴甲酸钠溶液(200g/L),搅拌,此时溶液中溴的颜色应完全褪去。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸亚铁铵标准溶液的配置
准备溶液
1.硫酸-磷酸混合溶液:在不断搅拌下,将150mL硫酸(M=98)缓慢注人700mL水中,再加人150mL磷酸(M=98)混合。
2.硫酸(1+1)
3.重铬酸钾(M=29
4.18)基准溶液[c(1/6K2Cr2O7)=0.05mol/L]:称取2.4515g预先在150-170℃烘干2h并于干燥器中冷却至室温的重铬酸钾(99.99%),溶于500mL水中,移入1000mL容量瓶中,用水稀释至刻度,摇匀。
4.二苯胺磺酸钠1g/L
5.配置硫酸亚铁铵(六水合M=392.14)标准滴定溶液(c(NH4)2Fe(SO4)2)=0.05mol/L
分光光度法测定醋酸产物中碘含量方案
一、实验目的:由于滴定法测定产物中含碘离子浓度的方法人为误差很大,导致测定结果不准,因此,本实验采用NH 4Fe(SO 4)2作为氧化剂,邻二氮菲作为显色剂,间接测定I -的浓度的分光光度法进行测定。
二、实验内容
1.实验前检验碘的存在形式:需要检查是否是以I -形式存在的。
若是,则能用下面的方法。
取1mL 样品,1D5%淀粉溶液和1D 0.1mol/L FeCl 3溶液,变蓝则有I -存在。
2.原理
在弱酸性条件下,Fe 3+可与I -发生如下氧化还原反应:
为了使反应速度加快,可加入过量的Fe 3+ 溶液。
在pH=2-9的溶液中,Fe 2+与邻二氮菲(phen)生成稳定的桔红色的螯合物Fe(Phen)32+
Fe 2+N
N
+
3
3.药品及作用 蒸馏水——溶剂
NH 4Fe(SO 4)2.12H 2O ——作为氧化剂,将I -氧化为I 2 邻二氮菲——作为显色剂
可溶性淀粉——在有碘离子存在时,能与极微量的碘生成蓝色的吸附化合物
盐酸羟胺——由于Fe 3+也能与邻二氮菲生成淡蓝色的络合物,因此,在加入显色剂时,先用还原剂盐酸羟胺将Fe 3+还原成Fe 2+。
H2SO4——使得在弱酸性条件下,Fe 3+与I -发生氧化还原反应 FeCl 3——提供Fe 3+
NaAc ——醋酸钠缓冲溶液,使待测物体系稳定在较小的pH
范围内 KI ——选择最大吸收波长时,提供I - 4.使用仪器
TU-1901双光束紫外可见分光光度计,配?cm 的比色皿 100mL 容量瓶——3个
50mL容量瓶——8个
25mL比色管——5个
滴瓶——2个
5.步骤
5.1配置溶液
配置成浓度为100mg/L的铁标准溶液。
0.15%邻二氮菲水溶液
10%盐酸羟胺水溶液
样品溶液取50mL在100mL容量瓶中,准确加入5mL 100mg/L铁标准溶液,再加入2mL邻二氮菲,5mL NaAc,加水定容,摇匀。
5.2 选择最大吸收波长
吸取5.0μg I- 于25mL比色管中,按制备标准曲线的方法显色(分别移入0.0,1.0,2.0,3.0,4.0,5.0mL 20mg/L 铁标准溶液,分别加入1mL盐酸羟胺、2.0 mL邻二氮菲,5.0mL NaAc,用水稀释至刻度,摇匀静置10min),于波长400nm-700nm范围内进行光谱自动扫描,得到Fe2+—Phen的光吸收曲线图,得出其吸收波长为多少。
可以选择最大吸收波长。
5.3绘制工作曲线(浓度-吸光度曲线)
标准铁溶液的配制:移取标定之后的100mg/L Fe2+标准液20mL于100mL容量瓶中,加入2mL (1:1)H2SO4,用水定容,得到20mg/L铁标准溶液。
在6个50mL容量瓶中,分别移入0.0,1.0,2.0,3.0,4.0,5.0mL 20mg/L铁标准溶液,分别加入1mL盐酸羟胺、2.0 mL邻二氮菲,5.0mL NaAc,用水稀释至刻度,摇匀静置10min,以试剂空白为参比,在最大吸收波长(515nm)处测定其吸光度。
作出浓度-吸光度曲线,结果表明Fe2+溶液在0.2-2.0mg/L内符合朗伯比尔定律,其线性回归方程是什么?即是吸光度A与浓度的方程(A=0.0082+0.1C)C的单位是mg/L,计算出相关系数。
5.4样品的分析
取样品溶液,每个样测定三次取平均值,得出A,由线性回归方程计算对应的浓度
1
2 3 4 5 6。
