西南科技大学材料科学基础相图整理
材料科学基础 第5章 相 图剖析

由于 所以
dni dni
dG (i i )dni
在 相和 相处于平衡时,dG=0 ,故:
i i
即两相平衡的条件是两相中同一组元的化学 位相等。此时,在两相之间转移趋于平衡。 若多元系中有C个组元,P个相,则它们的相 平衡条件可以写成:
由热力学原理可知,当组元在不同相间转 移时,将引起体系自由能的变化。对于一个多 元系,这种自由能变化可用下式表示:
dG Vdp SdT
dn
i
i
在等温等压条件下,可简化为:
dG
dn
i
i
如果体系中只有 和 两相,当极少量(d n i)的 i 组元从 相转移到 相中,则B
Pb
10
20
30
40
50
60
70
80
90
500 400 tA 300 327.5℃ 231.9℃ M α +L 183℃ 19 α +β F Pb 10 20 30 40 50 60 70 80 90 G Sn E 61.9 L+β N β 97.5 L
200 α 100
tB
W W1 W2
2的质量 Wx W1 x1 体系中相 W21 x 体系中相 的质量 体系中物质的总质量 2
t1 t2 M R P Q
L1
L2 L E x x2 20 40 K S N B 100
由上两式可得:
体系中 相1 相 中 B2 组元的含量 B 中 组元的含量 B组元的含量
W1 (x x1 ) W2 (x 2 x)
1083
时间
Cu 0
30
材料科学基础-8-二元相图(2)
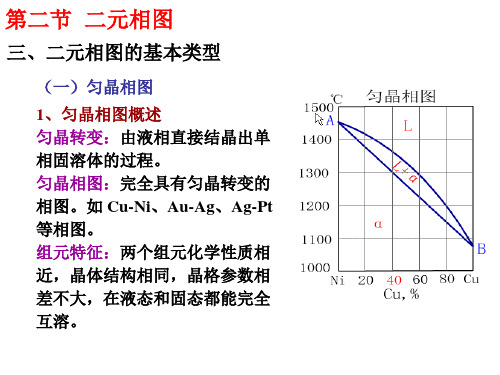
第二节 二元相图
(一)匀晶相图
2、固溶体的平衡凝固
(3)固溶体的结晶规律
c.固溶体的凝固过程与纯金
属一样,也包括形核与长大
两个阶段
e. 平衡凝固得到的固溶体显
微组织和纯金属相同,除了
晶界外,晶粒之间和晶粒内
部的成分却是相同的。
d.合金结晶形核时需要能量
起伏和成分起伏
a. 固溶体的结晶与纯金属不同,它不在
(2)压力加工性:压力加工合金通常是相图上单相固溶体
成分范围内的单相合金或含有少量第二相的合金。
——单相固溶体合金切削加工性能
不够好,而具有两相组织的合金切
削加工性一般比较好。
(4)热处理性:
相图上无固态相变或固溶度变化的
合金不能进行热处理。
孔等缺陷。
——我国20世纪60年代开始研制Pt-Ag合金,但至今无法批量
稳定发展
——国内外通过添加Pd(钯)制成Pt-Pd-Ag三元合金,虽综合
性能不如Pt-Ag合金,但加工性能得以改善。
第二节 二元相图
(三)包晶相图
2、包晶合金的凝固及其平衡组织
(1)ω (Ag)为42.4%的Pt-Ag合金(合金I)
′
% =
× %
第二节 二元相图
1186℃
A
LP+αC ↔ βD
(三)包晶相图
f=2-3+1=0
包晶点
• 1、包晶相图
• 包晶转变:由一个固相与
液相作用生成另一个固相
的过程。
• 包晶相图:两组元在液态
无限互溶,固态下有限互
溶,并发生包晶反应的二
元系相图。
第二节 二元相图
2、包晶合金的凝固及其平衡组织
材料科学基础_第5章_相 图

的曲线。 6.用相分析法测出向图中各相区所含的相,将他们的名称填
入相应的相区内,就得到了Cu—Ni合金的二元相图。
30
热分析法建立的Cu—Ni相图
31
5.1.4 相图热力学基础
➢ 相平衡的热力学条件 ➢ 相平衡:
1、热分析法 原理:根据系统在冷却过程中温度随时间的变化情况来
判断系统中是否发生了相变化。 做法: (1) 将样品加热成液态; (2) 令其缓慢而均匀地冷却,记录冷却过程中系统在不
同时刻的温度数据; (3) 以温度为纵坐标,时间为横坐标,绘制成温度-时
间曲线,即步冷曲线(冷却曲线); (4) 由若干条组成不同的系统的冷却曲线就可以绘制出
90 80 70
60
B% 50 40
30 20
10
10 20 30 40 C% 50 60
70 80 90
A
C
90 80 70 60 50 40 30 20 10
← A% 25
(3) 等腰成分三角形 当三元系中某一组元含量较少,而另两组元含量较大
时,合金成分点将靠近等边成分三角形的某一边。为了使 该部分相图清晰的表示出来,常采用等腰三角形,即将两 腰的刻度放大,而底边的刻度不变。
相图。
29
5.1.3 相图的建立
➢ 下面以热分析法为例说明如何测绘Cu—Ni相图,其步骤如 下:
1. 按质量分数先配制一系列具有代表性成分不同的Cu—Ni 合金。
2. 测出上述所配合金及纯Cu、纯Ni的冷却曲线。 3. 求出各冷却曲线上的临界点。 (曲线的转折点) 4. 将各临界点投到对应的合金成分-温度坐标中,每个临界
材料科学基础-第四章-相图(1)

共 晶 相 图
三
第三节 二元共晶相图及合金凝固
24
第 四 章 相 图
第三节 二元共晶相图及合金凝固
2 合金的平衡结晶及其组织(以Pb-Sn相图为例) (2)2%<Wsn<19%的合金 ① 凝固过程(冷却曲线、相变、组织示意图)。 ② 二次相(次生相)的生成:脱溶转变(二次析出或 二次再结晶)。 ③ 室温组织(α+βⅡ)及其相对量计算。
28
第 四 章 相 图 2 合金的平衡结晶及其组织(以Pb-Sn相图为例) (4)亚共晶合金
第三节 二元共晶相图及合金凝固
第
三
节 共 晶 相 图
(c)2003 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning™ is a trademark used herein under license.
第
三
节 共 晶 相 图
(c)2003 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning™ is a trademark used herein under license.
(c)2003 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning ™ is a trademark used herein under license.
第
三
节 共 晶 相 图
(c)2003 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning™ is a trademark used herein 图
材料科学基础2--第一章-相图4

单相区:L, a, b 两相区: L+a, L+ b,a+b
相变线
TAE及TBE:初生(初晶)a及b析出线 即L→a, L→b
TAM及TBN:初生a及b结晶终了线 MF及NG: a及b溶解度变化线
即a→bII,b→aII MEN: 共晶线,即L→a+b
相变点
TA及TB:纯组元A、B的熔点 M及N:a及b的最大溶解度点 F及G:a及b室温溶解度点 E:共晶点,发生共晶反应的液相成分点
将支点由O移至N,则上式变为:
Wa(xa-xL)=W0(x0-xL) 将W0设为100%,则两相相对量分数为:
Wa
x0 xa
xL xL
100 %
将支点由O移至M,得到两相相对量分数为:
WL
xa xa
x0 xL
100 %
杠杆定律仅适用于平衡结晶条件。
WL 100 % Wa Wa 100 % WL
(1)组织形成过程 以x合金为例。 相组成物:a 组织组成物:
单相等轴a晶粒
(2)成分变化与相平衡
(a) 形核
T=T0时,固态核心成分位于温度水平线与 固相线的交点a0。
只有液相中某局部区域成分为a0时,才符合 结晶的浓度条件。
浓度起伏(成分起伏):
液相局部微区成分波动存在时起时伏、此 起彼伏的现象。
问题:假定合金分别冷却到1,2,3,4温度开始结晶,获得的组织特点有何不同?
(2)晶内偏析共晶
晶内偏析共晶: 端部固溶体合金非平衡结晶时出现共晶组织
的现象。 由于晶内偏析共晶数量较少,往往以离异
共晶形式存在。
两种情况促使离异共晶形成: ►靠近极限溶解度的端部固溶体的非平衡冷却 。 ►靠近极限溶解度的亚共晶合金的平衡冷却。 (3)次生相
材料科学基础三元相图共67页

43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
45、自己的饭量自己知道。——苏联
Байду номын сангаас
材料科学基础三元相图
21、静念园林好,人间良可辞。 22、步步寻往迹,有处特依依。 23、望云惭高鸟,临木愧游鱼。 24、结庐在人境,而无车马喧;问君 何能尔 ?心远 地自偏 。 25、人生归有道,衣食固其端。
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
《材料科学基础教学课件》第一章-相图
在化学工业中的应用
化工过程控制
相图可以用来预测不同成分和温 度下的相态和物性,为化工过程 的控制提供依据,确保生产过程
的稳定性和安全性。
化学反应研究
相图可以用来研究化学反应过程中 物质的状态和性质变化,有助于深 入理解化学反应机理和反应条件的 选择。
分离技术应用
相图可以用来指导分离技术的选择 和应用,例如利用相图的溶解度曲 线进行萃取分离或结晶分离。
04
相图的应用
在材料科学中的应用
合金设计
相图是合金设计的基础,通过相 图可以确定合金的成分范围以及 各相的组成和性质,从而优化合 金的性能。
热处理工艺制定
利用相图可以确定合金在不同温 度下的相变过程,从而制定合理 的热处理工艺,优化材料的显微 组织和力学性能。
新材料研发
相图为新材料研发提供了理论指 导,通过研究不同成分和温度下 的相变规律,可以发现具有优异 性能的新型材料。
实验法是绘制相图最直接和可靠的方 法,但需要耗费大量的时间和资源。
实验法通常需要使用精密的实验仪器 和设备,如热分析仪、X射线衍射仪、 扫描电子显微镜等,以获得精确的数 据。
计算法
计算法是根据物质的分子或原 子模型,通过计算机模拟计算 物质之间的相平衡关系。
计算法可以快速地预测物质的 相平衡关系,但需要建立准确 的分子或原子模型,且对计算 资源的要求较高。
在冶金工业中的应用
钢铁冶金
01
钢铁冶金过程中涉及大量的相变和相分离,相图是指导钢铁冶
金工艺的重要工具,有助于优化炼钢和连铸连轧工艺。
有色金属冶金
02
在有色金属冶金中,相图可以用来确定合金的成分和温度范围,
优化熔炼、浇注和凝固工艺,提高产品的质量和性能。
九相图
结论: 三角形顶点温度最高, 离顶点愈远其 表示 温度愈低。等温线愈密,表示液 相面越 陡 峭。
C 重心规则:用于判断无变量炸的性质
定义:无变量点处于其相应ቧ三角形的重廃位,则为共熔点; 无变量点处于其相应副三角形的交叉位,则为单转憔点;
立体图与平面投影图的关系
(1) 立体图的空间曲面(液相面)
投影为平面上的初晶区 A 、B 、C e1E → E1E/、
平面界线→空间界线 e2E →E2E/ 、 e3E →E3E/;
e1 → E1 平面点→空间点 e2 → E2
e3 → E3 E→E/
(2) 冷却过程温度降低的方向 (3) 等温线: 在空间结构图的液相面上,
A+C
B+C
A+B A化合物存在于某一温度范围内 B
5、应用:
CaO-SiO2及MgO-SiO2系统 相图,在SiO2含量高处都有 一个二液分层区。
3、举例: 2MgO.SiO2和2FeO.SiO2在高温能
以各种比例互溶形成连续固溶体。 举例: 铁钙黄长石(Ca2FeSiAlO7)与镁方 柱石(Ca2MgSi2O7)形成连续固溶体 中间有一交点。
初晶区熔体 > 界线上熔体 > 共熔点处熔体
原因:不同晶体结构之间的相互干扰。
The End
The End
二、三元系统组成中的一些关系
1、等含量规则 在等边三角形中,平行于一条边的直线上的所
有各点均含有相等的对应顶点的组成。
C
O M
N
A
ED
F
B
材料科学基础第六讲-相图
3-4点时,为单相固溶体,不发生变化。 4点以下,将从β相析出次生相αII
§4.4其它类型的二元合金相图
第五节 复杂相图
§5.1 二元合金相图的分析和使用
I 包晶反应:L+α β II 包晶反应:L+ β γ III 包晶反应:L+ ε η IV 共析反应: β α + γ V 共析反应: γ α + δ VI 共析反应: δ α + ε VII 共析反应: ζ δ + ε VIII 包析反应: γ + ε ζ IX 包析反应: γ + ζ δ X 熔晶反应: γ ε + L XI 共晶反应: L η + θ
相律:表示在平衡条件下,系统的自由度数、组元 数和相数之间的关系。它是检验、分析和使用相图 的重要工具。
F=C-P+2
F-平衡系统的自由度数 C-平衡系统的组元数 P-平衡系统的相数
当压力为常数时:F=C-P+1
J. Willard Gibbs
自由度:指平衡系统中可以独立改变的因素(如温度, 美国物理学家 压力,成分)等。纯金属的自由度最多一个,二元系 (1839-1903)
包晶转变区的特征是:反应相是液相和一个固相,其成分点位于水 平线的两端,所形成的固相位于水平线中间的下方。
典型合金的平衡结晶及组织
(一)含银量42.4%的铂银合金
当合金I自液态缓冷到1点时, 开始结晶出α相,与匀晶系 合金的结晶完全相同
当温度降到tD时,合金中 α 相的成分到P点,液相的成 分到C点。
应用相图时要注意的问题
连接线(等温线):两个平衡相成分点之间的连线
第三节 一元系相图
材料科学基础 第五章 5.1-5.4相图
5.2.3 杠杆定律
设成份为 X的合金的总重量为1,液相的相对重量为 QL,其 成份为 X1,固相相对重量为Qα,其成份为X2,则 :
5.2.4 相图的类型和结构 根据组元的多少,可分为单元系、二元系、三元 系 …. 相图。
二元系相图的类型有:
① 液态无限溶解,固态无限溶解 -匀晶相图; ②液态无限溶解,固态有限溶解 -共晶相图和包晶
共晶组织:共晶转变产物。(是两相混合物)
共晶合金的特殊性质: ①比纯组元熔点低,简化了熔化和铸造的操作; ②共晶合金比纯金属有更好的流动性,其在凝固之 中防止了阻碍液体流动的枝晶形成,从而改善铸造 性能; ③恒温转变(无凝固温度范围)减少了铸造缺陷, 例如偏聚和缩孔; ④共晶凝固可获得多种形态的显微组织,尤其是规 则排列的层状或杆状共晶组织可能成为优异性能的 原位复合材料(in-situ composite )。
5.2.2 相律
相律(phase rule)是表示在平衡条件下,系统的自 由度数、组元数和相数之间的关系,是系统的平 衡条件的数学表达式。 相律数学表达式:f = C – P + 2 式中 P—平衡相数 C—体系的组元数 f—体系自由度(degrees of freedom) 数 2-温度和压力 自由度数 f:是指不影响体系平衡状态的独立可 变参数(温度、压力、浓度等)的数目。 在恒压下,相律表达式: f = C – P + 1
相律的应用
① 利用它可以确定系统中可能存在的最多平衡相数 单元系,因f ≥0,故 P≤1-0+1=2,平衡相最大为二个。 注意:这并不是说,单元系中能够出现的相数不能超过二 个,而是说,某一固定 T下,单元系中不同的相只能有两 个同时存在,而其它相则在别的条件下存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.临界核半径:聚集的原子群超过一定尺寸能够稳定存在最小的晶体颗粒径。
2.非稳定扩散:扩散过程中任一点浓度随时间变化。
3.无序扩散:无化学位梯度、浓度梯度无外场推动力由热起伏引起的扩散。
质点的扩散是无序的、随机的。
4.烧结定义:粉体在一定温度作用下发生团结,使气孔率下降,致密度提高,强度增大,晶粒增长的现象5互扩散推动力:化学位梯度。
粘度:单位面积的内磨擦力与速度梯度的比例系数。
6.非均相成核:母液中存在某界面(空位、杂质、位错),成核会优先在界面上进行的成核系统7.粘附:两种物质在界面上产生相互的吸引而粘结在一起的力。
8.表面能:当T,P及组成不变的条件下,增加单位表面积对系统所做的功。
9.多晶体织构:多晶体的晶界形状,分布称为多晶体的织构,即显微结构中的晶界构型。
10弗仑克尔缺陷:晶体内部质点由于热起伏的影响,质点从正常位置位移到晶体内部的间隙位置上,正常位置上出现空位。
肖特基缺陷:质点由热起伏引起位移到表面上,正常位置上出现空位的缺陷。
11.表面张力:气--液表面上,液相内存在一种力图缩小表面积的张力。
12.配位数:某一离子被最临近的异号离子所包围的个数,称为该离子的配位数。
13.吸附:固体和液体表面存在大量不饱和键的原子和离子,它们都能吸引外来的原子,离子,分子14.类质同晶:化学组成不同而性质相近似.且具有相同晶体结构的一类物质15.同质多晶:同种化学成分,在不同热力学条件下结晶成不同晶体的结构现象。
16极化:指正,负离子在电场作用1``下,使正,负电荷重心不重合,并产生偶极距,这一现象称为极化。
17.桥氧离子:指一个氧离子与两个硅离子的连结起来,此氧离子称为桥氧离子。
18.表面能:当T,P及组成不变的条件下,增加单位表面积对系统所做的功。
19.凝聚系统相律:F=C-P+N 凝聚系统N=1(压力影响小,可忽略)F=C-P+120.转熔点:不一致熔融化合物的分解温度。
21.双升点:从点向外看,二个线温度升高。
双降点:从点向外看,二个线温度下降。
22.间隙扩散:质点沿间隙位置扩散。
本征扩散:主要出现肖特基和弗兰克尔点缺陷由此点缺陷引起的扩散23.矿化剂:在固相反应中加入少量非反应物,反应过程中不与反应物起化学反应只起加速反应作用的物质。
6.非均相成核比均相成核易进行的原因:因为:△G#c=△G c。
f(θ)并且:f(θ)=(2+COSθ)(1- COSθ)2/4,当:θ=90度时,f(θ)=(2+COSθ)(1- COSθ)2/4=(2+0)(1- 0)2/4=2/4=1/2,所以:△G#c =△Gc。
f(θ)=1/2。
△Gc,即:非均相成核所需能量是均相成核的一半,杂质存在有利成核。
7.相变过程的推动力:相变推动力为过冷度(过热度)的函数,相平衡理论温度与系统实际温度之差即为相变过程的推动力。
ΔG=ΔH-TΔH/T0=ΔHT0-T/T0=ΔH.ΔT/T0式中:T0--相变平衡温度,ΔH--相变热,T---任意温度。
自发反应时:ΔG<0,即ΔH.ΔT/T0<0 相变放热(凝聚,结晶):ΔH<0 则须:ΔT>0,T0>T ,过冷,即实际温度比理论温度要低,相变才能自发进行。
相变吸热(蒸发,熔融):ΔH>0 ,ΔT<0 , T0<T,过热。
即实际温度比理论温度要高,相变才能自发进行。
8.斯宾那多分解相变和成核-生长相变的主要区别:组成变-不变;相分布和尺寸有规律-无规律;相颗粒高度连续性非球型-连续性差的球型9.马氏体相变及特点:钢淬火时得到的一种高硬度结构的变化过程特点:具有剪切均匀整齐性、不发生原子扩散、相变速度快可达声速、相变有一定范围。
10.影响固相反应的因素:1反应物化学组成与结构的影响2颗粒度和分布影响3反应温度压力气氛影响4.矿化剂的影响。
11.影响烧结的因素1、粉末的粒度。
细颗粒增加了烧结推动力,缩短原子扩散距离,提高颗粒在液相中的溶解度,从而导致烧结过程的加速。
2、外加剂的作用。
在固相烧结中,有少量外加剂可与主晶相形成固溶体,促进缺陷增加,在液相烧结中,外加剂改变液相的性质(如粘度,组成等),促进烧结。
3、烧结温度:晶体中晶格能越大,离子结合也越牢固,离子扩散也越困难,烧结温度越高。
保温时间:高温段以体积扩散为主,以短时间为好,低温段为表面扩散为主,低温时间越长,不仅不引起致密化,反而会因表面扩散,改变了气孔的形状而给制品性能带来损害,要尽可能快地从低温升到高温,以创造体积扩散条件。
4、气氛的影响:氧化,还原,中性。
5、成形压力影响:成型压力越大颗粒间接触越紧密,对烧结越有利。
12.杨德尔方程:Kt=R02[1-(1-G)1/3]2;金斯特林格动力学方程积分式: K k.t=(2DμC0/R02ρn.)t=1-2/3G-(1-G)2/3公式中:R0---反应物等径球颗粒半径;G ---转化率;K k---速度常数;t---时间;D---扩散系数;n---分子数;C0---初始气体浓度;μ---分子量;ρ---产物密度。
由公式可见:速度常数K与R0颗粒半径平方成反比,颗粒越小,反应体系比表面积越大,反应界面和扩散截面也相应增加,因此反应速率增大。
威尔表面学说:颗粒尺寸减小,键强分布曲线变平,弱键比例增加,故而使反应和扩散能力增强。
13.影响扩散的因素:化学键:共价键方向性限制不利间隙扩散,空位扩散为主金属键离子键以空位扩散为主,间隙离子较小时以间隙扩散为主。
缺陷:缺陷部位会成为质点扩散的快速通道,有利扩散。
温度:D=D0exp(-Q/RT)Q不变,温度升高扩散系数增大有利扩散。
Q越大温度变化对扩散系数越敏感。
杂质:杂质与介质形成化合物降低扩散速度;杂质与空位缔合有利扩散;杂质含量大本征扩散和非本征扩散的温度转折点升高。
扩散物质的性质:扩散质点和介质的性质差异大利于扩散扩散介质的结构:结构紧密不利扩散。
14非化学计量化合物:化合物原子数量的比例,不符合定比定律,即非简单的固定比例关系。
15.硫型物质:物质熔融时体积膨胀,压力升高,熔点升高的物质。
16.水型物质:象冰一样熔融时体积收缩的物质。
压力升高,熔点降低。
如:铋、镓、锗、三氯化铁。
17.置换固溶体:杂质质点置换基质质点形成的固溶体。
18.结构松弛:熔体冷却到一定温度时,质点(原子,离子,或分子) 相应进行重排或调整,以达到该温度下的平衡结构,同时放出能量,这个过程称结构松弛。
22.计算Na2O.Al2O3.6SiO2的桥氧数.:Na2O.Al2O3.6SiO2为钠长石:架状结构;无机络盐形式:Na[AlSi3O8]。
钠长石:m=8-2O/Si=8-2*8/(1+3)=423.在萤石晶体中R ca+=0.112nm,R F-=0.131nm,a=0.547nm,求萤石晶体中离子堆积系数答:萤石位面心立方结构Z=4,4个Ca++离子,8个F-离子()24.凝聚系统三元相图中的分界曲线其自由度是多少?哪些可以改变?答:F=3-3+1=1,一个变量可以改变。
25.在石英中加入Na2O能够降低石英的熔点从结构上来说明:高聚物变成低聚物使熔点降低。
26.刃位错、螺旋位错及基本区别:刃位错:在位错线附近原子失去正常有规律排列,并滑移一段距离,由此产生的缺陷即是。
螺旋位错:在位错线附近原子失去正常有规律排列,产生螺旋位移,这种缺陷即是。
基本区别:刃位错:滑移方向与位错线垂直,位错增加了半片原子面。
螺旋位错:滑移方向与位错线平行。
质点以位错线为轴做螺旋状排列。
27.从[SiO4]的结合以及Si-O-Si键角等方面说明:α-方石英、α-鳞石英、α-石英的结构特征α-方石英:以中心对称Si-O-Si键角180度。
α-鳞石英:以过中心的平面为对称面,Si-O-Si键角180度。
α-石英:以中心对称Si-O-Si键角150度。
石英的横向转变缓慢,结构重排困难。
纵向转变容易,结构变化不大。
28.区别高岭石和钠长石的可塑性.(烧失量).(玻璃性)Al2O3.2SiO2.2H2O为高岭石;无机络盐形式:Al2[Si2O5](OH)4。
高岭石:m=8-2O/Si=8-2*5/2=3。
高岭石因为是层状结构遇水形成六角片状结构片片之间有毛细管作用,因此,具有可塑性。
(高岭石煅烧后结构水排除,烧失量较大)(高岭石不能形成玻璃,因为m=3,不能形成玻璃)Na2O.Al2O3.6SiO2为钠长石:架状结构;无机络盐形式:Na[AlSi3O8]。
钠长石:m=8-2O/Si=8-2*8/(1+3)=4。
钠长石和石英均为架状结构。
遇水也不会形成片状结构,因此,无可塑性(钠长石结构内部无结构水煅烧后,烧失量较小)(钠长石能够形成玻璃。
因为m=3.5以上,所以能形成玻璃。
)29.CsCl、NaCl的结构,Na+和Cs+离子在结构中的位置,Cl-离子在什么位置,画图NaCl为面心立方Cl-离子做紧密堆积排列Na+离子充填全部8面体空隙中。
CsCll属于体心立方结构,Cl-离子做紧密堆积排列,Cs+离子在体心位置。
30结构松弛的时间对形成玻璃的影响:熔体内结构调整速率快,粘度小,松弛时间短,则越易形成晶体平衡结构。
反之易形成玻璃。
冷却速度大于结构调整速率则易形成玻璃。
冷却速率q大,Tg高,易形成玻璃。
31.纯物质在任意指定温度下,固、液、气三相可以平衡共存,用相律说明这个结论是否正确请举例说明。
这个结论不正确。
因为,固、液、气三相平衡时,相律为:F=C-P+2,其中,C=1,P=3,则F=0,即自由度为0温度和压力均不可以变化。
这时不能够指定温度。
例如:水在0度时是三相共存,温度一变固、液、气三相就不平衡了。
所以温度不能任意指定温度。
32.最紧密堆积原理.原理:晶体内质点相互结合是以内能最小为原则,即球体堆积密度越大,系统内能越小。
AB型六方最紧密堆积ABC型面心立方最紧密堆积。
空间利用率相同为:74.05%。
空隙率为:25.95%。
球个数与间隙关系:晶胞内球体个数n,四面体个数有2n个,八面体有n个。
33玻璃的通性:各向同性;介稳性;由熔融态向玻璃态转化的过程是可逆的与渐变的,在一定的温度范围内完成,无固定熔点;由熔融态向玻璃态转化时物理、化学性质随温度变化的连续性;物理、化学性质随成分变化的连续性34.石英经煅烧易破碎:利用晶界应力的作用,加热冷却使晶界产生应力,内部结构出现微裂纹而易于粉碎。
35.在真空中和在空气中云母片剥离后再合上的现象道理:真空中无杂质吸附,表面能不降低,剥离后再合上,会很好的粘附在一起。
在空气中吸附杂质,降低表面能,所以剥离后再合上,不会粘附在一起。
36.应用高温玻璃熔体自然形成玻璃球能够形成球形而不形成其他形状:熔体表面张力的作用,球周边有一向心的表面张力的分力,各分力的合力使表面趋于球形。
