最新药品质量公告
国家药监局、国家卫生健康委关于发布《医疗器械临床试验质量管理规范》的公告

国家药监局、国家卫生健康委关于发布《医疗器械临床试验质量管理规范》的公告文章属性•【制定机关】国家药品监督管理局,国家卫生健康委员会•【公布日期】2022.03.24•【文号】国家药监局、国家卫生健康委公告2022年第28号•【施行日期】2022.05.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗质量正文国家药监局国家卫生健康委公告2022年第28号关于发布《医疗器械临床试验质量管理规范》的公告为深化医疗器械审评审批制度改革,加强医疗器械临床试验管理,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与备案管理办法》(市场监管总局令第47号)、《体外诊断试剂注册与备案管理办法》(市场监管总局令第48号),国家药品监督管理局会同国家卫生健康委员会组织修订了《医疗器械临床试验质量管理规范》,现予发布,自2022年5月1日起施行。
特此公告。
附件:医疗器械临床试验质量管理规范国家药监局国家卫生健康委2022年3月24日附件医疗器械临床试验质量管理规范第一章总则第一条为加强对医疗器械临床试验的管理,维护受试者权益和安全,保证医疗器械临床试验过程规范,结果真实、准确、完整和可追溯,根据《医疗器械监督管理条例》,制定本规范。
第二条在中华人民共和国境内,为申请医疗器械(含体外诊断试剂,下同)注册而实施的医疗器械临床试验相关活动,应当遵守本规范。
本规范涵盖医疗器械临床试验全过程,包括医疗器械临床试验的方案设计、实施、监查、稽查、检查以及数据的采集、记录、保存、分析,总结和报告等。
第三条医疗器械临床试验应当遵守《世界医学大会赫尔辛基宣言》的伦理准则和国家涉及人的生物医学研究伦理的相关规范。
参与医疗器械临床试验的各方应当按照试验中各自的职责承担相应的伦理责任。
第四条实施医疗器械临床试验应当有充分的科学依据和明确的试验目的,权衡受试者和社会预期的风险和获益。
只有当预期的获益大于风险时,方可实施或者继续实施临床试验。
国家药品质量公告

药品质量公告(总第67期)国家食品药品监督管理局发布 2006年10月根据2006年全国药品抽验计划,国家食品药品监督管理局组织有关单位在全国范围内对相关品种进行了药品质量抽查检验,在抽验中发现18个批次的药品为假冒药品,涉及1家医疗机构、17家药品经营企业(见附表),现予以公告。
对公告中的假冒药品立即停止销售和使用,涉及经营、使用假冒药品的经营企业和医疗机构所在地的药品监督管理部门要认真追查假药的来源,依法从严查处。
附表:假冒药品名单药品质量公告(总第68期)国家食品药品监督管理局发布 2007年3月根据2006年国家药品抽验计划,国家食品药品监督管理局组织有关单位在全国范围内进行了药品监督抽验,本期公告内容为在流通和使用单位对15个品种的不同剂型进行抽查检验的结果。
具体为:阿司匹林(肠溶片、胶囊、泡腾片、维生素C分散片):41家生产企业的200批次为合格药品,5家生产企业的9个批次为不合格药品;氨咖黄敏(胶囊、颗粒、片):44家生产企业的205批次为合格药品,1家生产企业的1个批次为不合格药品;布洛芬缓释胶囊:34家生产企业的182批次为合格药品,1家生产企业的1个批次为不合格药品;复方氨酚烷胺(片、分散片):149家生产企业的746批次为合格药品,5家生产企业的5个批次为不合格药品;复方对乙酰氨基酚片:52家生产企业的165批次为合格药品,4家生产企业的5个批次为不合格药品;交沙霉素片:13家生产企业的129批次为合格药品,1家生产企业的1个批次为不合格药品;青霉素V钾(片、分散片):36家生产企业的394批次为合格药品,5家生产企业的27个批次为不合格药品;维生素B12片:15家生产企业的314批次为合格药品,1家生产企业的1个批次为不合格药品;维生素E烟酸酯(胶囊、胶丸):19家生产企业的53批次为合格药品,1家生产企业的1个批次为不合格药品;盐酸利多卡因注射液、蚓激酶(胶囊、片)、甲硫氨酸片、胰激肽原酶肠溶片、左旋多巴注射液和对乙酰氨基酚颗粒6个品种抽验结果为符合规定。
国家药品质量公告

80mg
陕西省大正国药有限责任公司西郊分公司
《中国药典》2005年版二部
河南省食品药品检验所
不合格
检查(溶出度)
16
格列齐特片(Ⅱ)
北京海联制药有限公司
20090201
80mg
北京海联制药有限公司
《中国药典》2005年版二部
河南省食品药品检验所
不合格
检查(溶出度)
17
格列齐特片(Ⅱ)
江西省食品药品检验所
不合格
检查(溶出度)
2
盐酸异丙嗪片
北海阳光药业有限公司
080414
12.5mg
吉林省四平市盛泰医药药材有限公司
《中国药典》2005年版二部
江西省食品药品检验所
不合格
检查(溶出度)
3
硝酸甘油片
北京益民药业有限公司
0701010
0.5mg
云南省保山市第二人民医院
《中国药典》2005年版二部
山西省药品检验所
不合格
性状
检查(pH值)
21
强力枇杷露
成都天银制药有限公司
090103
每瓶装100ml
广东思明药业有限公司
国家食品药品监督管理局标准(试行)YBZ00582006
陕西省食品药品检验所
不合格
含量测定
22
强力枇杷露
成都天银制药有限公司
090101
每瓶装100ml
新疆克州万兴药业有限责任公司
0.25g(按C16H17N3O4S计)
北京太洋药业有限公司
《中国药典》2005年版二部
山东省药品检验所
不合格
检查(溶出度)
8
盐酸环丙沙星滴眼液
国家药监局关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告

国家药监局关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告文章属性•【制定机关】国家药品监督管理局•【公布日期】2022.05.27•【文号】国家药监局公告2022年第43号•【施行日期】2022.07.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局公告2022年第43号关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告根据《药品生产质量管理规范(2010年修订)》第三百一十条规定,现发布《临床试验用药品(试行)》附录,作为《药品生产质量管理规范(2010年修订)》配套文件,自2022年7月1日起施行。
特此公告。
附件:临床试验用药品(试行)国家药监局2022年5月27日附件临床试验用药品(试行)第一章范围第一条本附录适用于临床试验用药品(包括试验药物、安慰剂)的制备。
已上市药品作为对照药品或试验药物时,其更改包装、标签等也适用本附录。
第二章原则第二条临床试验用药品的制备和质量控制应当遵循《药品生产质量管理规范》的相关基本原则以及数据可靠性要求,最大限度降低制备环节污染、交叉污染、混淆和差错的风险,确保临床试验用药品质量,保障受试者安全。
第三条临床试验用药品的制备和质量控制具有以下特殊性:(一)在新药早期临床试验阶段,通常尚未形成成熟的制备工艺,尚不具备充分确认和验证的条件;(二)对新药的特性、潜在作用及毒性的了解不够充分,对试验药物关键质量属性的识别,对质量控制指标和方法的研究还需进一步深入;(三)临床试验用药品制备过程可能同时涉及试验药物制备、安慰剂制备、对照药品和试验药物更改包装标签等不同活动,随机和盲法的要求也增加了临床试验用药品制备过程混淆和差错的风险。
应当基于以上的特殊性,以及其不同研发阶段的特点和临床试验设计的要求等,对临床试验用药品进行相应的控制。
第四条在保证受试者安全且不影响临床试验质量的前提下,临床试验用药品的质量风险管理策略可根据研发规律进行相应调整。
国家食品药品监督管理局第61期药品质量公告
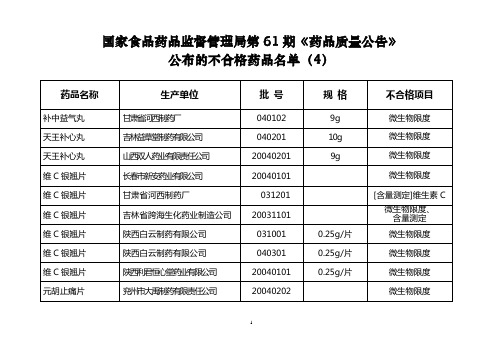
生产单位
批号
规格
不合格项目
护肝片
通化盛和药业股份有限公司
20031101
微生物限度
辽源七厘散
辽源市杏林制药厂
030401
5g
水分、微生物限度、装量差异
辽源七厘散
辽源市杏林制药厂
031201
5g
水分、微生物限度、装量差异
羚羊感冒片
吉林省跨海生化药业制造公司
20031201
0.25g
微生物限度
羚羊感冒片
20030806
微生物限度
云芝肝泰颗粒
黑龙江省格润药业有限责任公司
20040203
每袋装5g
微生物限度
云芝肝泰颗粒
黑龙江省格润药业有限责任公司
20040201
每袋装5g
微生物限度
云芝肝泰颗粒
黑龙江省格润药业有限责任公司
20040201
每袋装5g
微生物限度
云芝肝泰颗粒
吉林金泉药业股份有限公司
20030101
河北安国药业集团有限公司
20020104
每丸重9g
水分
补中益气丸
河北承德药业集团六合制药有限责任公司
030826
9g
鉴别(1)、(2)、(3)
羚羊感冒片
吉林跨海生化药业制造公司
20031001
微生物限度
羚羊感冒片
吉林跨海生化药业制造公司
20030901
微生物限度
国家食品药品监督管理局第61期《药品质量公告》
吉林市圣源药业有限责任公司
20031201
3g
装量差异
桂附地黄丸
甘肃天水歧黄药业有限责任公司
031206
《关于仿制药质量和疗效一致性评价有关事项的公告》政策解读

《关于仿制药质量和疗效一致性评价有关事项的公告》政策解读自20世纪80年代以来,随着人口老龄化、医疗费用不断增长以及药物创新成本的提高,仿制药作为一种廉价替代品逐渐走进人们的生活中。
然而,随之而来的问题是,仿制药的质量和疗效是否能够与原研药保持一致,这一问题备受关注。
在此背景下,2020年4月,国家药品监督管理局发布了《关于仿制药质量和疗效一致性评价有关事项的公告》,对仿制药的质量和疗效一致性评价进行了全面规范,为保障公众用药安全提供了有力保障。
本公告主要包括以下几个方面内容:一、对于已上市的仿制药,应当进行质量和疗效一致性评价,并在规定时间内提交评价报告。
对于未按时提交评价报告的企业,药品注册证书将被注销。
此举旨在确保所有药物企业都能够按照统一的标准进行一致性评价,提高药品质量水平,保障患者用药安全。
二、对于尚未上市的仿制药,应提前进行质量和疗效一致性评价,并在获得注册证书前完成。
评价结果应当作为药品审批的重要依据之一。
此举旨在促进仿制药的研发,提高其疗效,同时在保证安全性的前提下,缩短药品上市的时间。
三、评价结果应当公开透明,供患者、医生和药品监管部门等各方参考。
同时,评价结果也是药品定价的重要依据之一。
通过公开透明的评价结果,可以提高药品的透明度,促进药品定价的公正和合理,保障患者用药权益。
四、对于既有生物类似药,也有生物原研药和生物仿制药的情况,生物类似药的质量和疗效一致性评价具有特殊的复杂性。
因此,应当对其评价标准、评价方法等作出相应修订和规范。
此举旨在保障生物类似药的质量和疗效一致性,促进生物类似药的发展,为患者提供更多选择。
以上规定无疑提高了药品质量和疗效的标准,但也给药品企业带来了新的挑战。
面对相对复杂的评价要求和要求,企业需要顺应市场潮流,占据市场优势。
在这一背景下,企业应加强创新,培养核心竞争力,不断提高药品质量,降低成本,以更好的服务于公众。
总之,仿制药的质量和疗效评价是一个既重要又复杂的事项,关系到社会稳定和公众健康安全。
药品质量公告

药品质量公告
2008年度第1期(总第73期)
国家食品药品监督管理局发布2008年4月
为加强药品监管,保障公众用药安全,国家食品药品监督管理局组织在全国范围内对流感疫苗进行了评价抽验,并对2006年至2007年度抽验的部分生物制品进行了跟踪抽验。
本期公告内容为对2006年至2007年度抽验的部分生物制品跟踪抽验和流感疫苗评价性抽验的药品质量情况。
一、部分生物制品跟踪抽验的质量情况
跟踪抽验涉及8家生物制品生产企业生产的17批制品,经检验,1家生产企业生产的1个品种3批次不合格(见附表1)。
二、流感疫苗评价性抽验的质量情况
被抽验的流感疫苗涉及12家生产企业的77批制品,经检验,均合格(见附表2)。
附表:1.2008年第1期国家药品质量公告部分生物制品跟踪抽验的质量情况
2.2008年第1期国家药品质量公告流感疫苗评价性抽验的质量情况
附表1:
2008年第1期国家药品质量公告部分生物制品跟踪抽验的质量情况
附表2:
2008年第1期国家药品质量公告流感疫苗评价性抽验的质量情况。
福建省药品质量公告

福建省药品质量公告1. 引言本公告旨在向社会公众通报福建省药品质量监管的最新情况,并积极倡导广大市民关注和维护自身用药安全。
福建省药品监管部门将始终坚持以人民健康为中心的理念,严格落实药品质量管理法规,全力保障药品质量安全,切实维护公众用药权益。
2. 药品质量监管措施福建省药品监管部门加强了对药品生产企业的监督检查力度,严格按照《中华人民共和国药品管理法》对药品生产流程进行检查和监管。
我省已建立了覆盖全省范围的药品监管信息系统,实现对药品从生产到销售全程的追溯和监管。
3. 药品质量监管重点福建省药品监管部门对以下方面的药品质量进行重点监管:3.1 药品生产企业的生产环境和设备药品生产企业的生产环境和设备直接关系到药品的质量安全。
福建省药品监管部门将对药品生产企业的生产环境和设备进行定期检查,确保符合国家相关规定,杜绝环境和设备对药品质量的影响。
3.2 药品原材料的采购和使用药品原材料的质量直接影响到药品的疗效和安全性。
福建省药品监管部门将对药品生产企业的原材料采购和使用情况进行严格监管,确保原材料符合国家相关标准,不使用假冒伪劣原材料。
3.3 药品生产过程的监控和控制药品生产过程中的监控和控制是确保药品质量的关键环节。
福建省药品监管部门将对药品生产企业的生产过程进行监控和控制,确保药品生产符合国家相关标准和规定。
3.4 药品销售环节的监督药品销售环节是药品质量监管的最后一道防线。
福建省药品监管部门将加强对药品销售企业的监督,确保药品销售符合国家相关规定,杜绝假冒伪劣药品的流入市场。
4. 药品质量监管成效福建省药品监管部门的努力取得了显著成效:•药品生产企业的合规率显著提高,违法违规行为得到有效遏制;•药品生产企业的质量管理水平大幅提升,药品质量安全风险得到有效控制;•药品销售企业的合规率明显提高,假冒伪劣药品的销售现象得到有效遏制。
5. 公众参与药品质量监管福建省药品监管部门鼓励公众参与药品质量监管工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品质量公告
([2008]第2期,总第23期)
北京市药品监督管理局发布2008年7月
为进一步贯彻执行《中华人民共和国药品管理法》,严厉打击制售假劣药品的违法行为,保障首都人民用药的安全有效,根据北京市药品抽验计划,北京市药品监督管理局组织在全市范围内对药品生产、经营、使用部门进行质量监督抽验,现将结果予以公布。
2008年第二季度,全市按照抽验计划共完成监督性抽验1703批次,其中不合格26批次,不合格率为1.53%(具体品种见附表)。
对公告中的不合格药品,我局将依据《中华人民共和国药品管理法》有关规定进行查处,并根据情况在本辖区内继续进行跟踪抽样检验。
附表:北京市2008年第二季度药品抽验不合格品种汇总表。
