ALK基因重排:多中心试验结果
FoundationOne CDx检测方法的性能验证方法
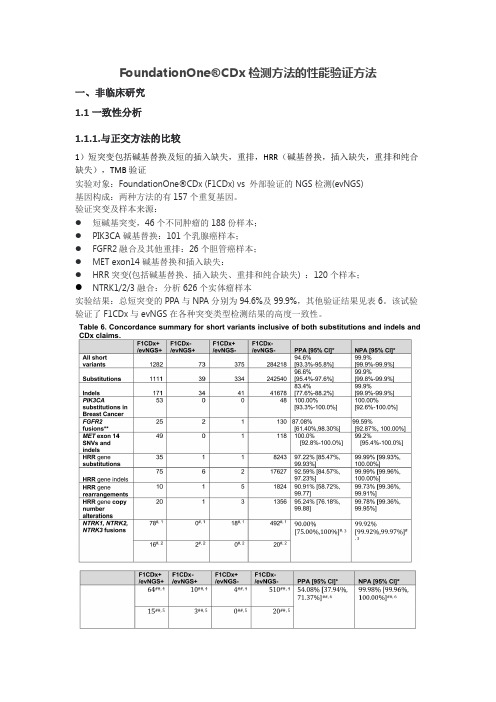
FoundationOne®CDx检测方法的性能验证方法一、非临床研究1.1一致性分析1.1.1.与正交方法的比较1)短突变包括碱基替换及短的插入缺失,重排,HRR(碱基替换,插入缺失,重排和纯合缺失),TMB验证实验对象:FoundationOne®CDx (F1CDx) vs 外部验证的NGS检测(evNGS)基因构成:两种方法的有157个重复基因。
验证突变及样本来源:●短碱基突变,46个不同肿瘤的188份样本;●PIK3CA碱基替换:101个乳腺癌样本;●FGFR2融合及其他重排:26个胆管癌样本;●MET exon14碱基替换和插入缺失:●HRR突变(包括碱基替换、插入缺失、重排和纯合缺失) :120个样本;●NTRK1/2/3融合:分析626个实体瘤样本实验结果:总短突变的PPA与NPA分别为94.6%及99.9%,其他验证结果见表6。
该试验验证了F1CDx与evNGS在各种突变类型检测结果的高度一致性。
2)TMB-H验证实验对象:F1CDx vs CLIA验证的全外显子组测序(WES)验证突变及样本来源:TMB-H:共评估了218个样本,其中89个样本未进行F1CDx预筛查(Set A),129个样本进行了F1CDx预筛查(Set B)。
实验结果:总体PPA为87.28% (95% CI[64.42%,96.17%]),总体NPA为91.56% (95%CI[85.66%,95.64%])。
该试验验证了F1CDx与CLIA验证的全外显子组测序(WES)检测TMB-High(> 10mutations/Mb)结果的一致性。
详细结果见表7。
备注:1PPA和NPA使用TMB-High的患病率(估计为19%)进行校正。
根据结果(Set a和Set b)的加权平均值计算总体PPA和NPA。
1.1.2.与FoundationOne®(F1 LDT)方法的比较实验对象:F1CDx vs F1 LDT验证突变:包括2026个短突变、266个CNV和33个重排。
基于PD-1PD-L1抑制剂的非小细胞肺癌免疫治疗预测标志物的研究进展

基于PD-1/PD-L1抑制剂的非小细胞肺癌免疫治疗预测标志物的研究进展王佳慧,陈公琰Advancesinthestudyofpredictivemarkersofimmunotherapyfornon-smallcelllungcancerbasedonPD-1/PD-L1inhibitorsWANGJiahui,CHENGongyanHarbinMedicalUniversityCancerHospital,HeilongjiangHarbin150000,China.【Abstract】Themorbidityandmortalityoflungcancerarethehighestintheworld.Non-smallcelllungcanceraccountsforabout85%ofalltypesoflungcancer.Theeffectiverateoftraditionalradiotherapyandchemotherapyisverylimited.Drugresistanceintargetedtherapyiswidespread.Withthefurtherstudyofthemechanismoftumorimmuneescape,theimmunotherapyledbyPD-1/PD-L1inhibitorsisexpectedtobringanewdawnforpatients.Butrelatedclinicalstudiessuggestthatonlyabout20%ofthenon-selectedpopulationcanbenefitfromit,soitisurgenttoscreenthedominantpopulation.ThisarticlewillreviewthecurrentresearchprogressofPD-1/PD-L1inhibitorimmunotherapypredictivemarkersinnon-smallcelllungcancer,inordertohelptheclinicalselectionofnon-smallcelllungcancerimmunotherapysuperioritypopulation,andtomaximizethebenefitofpatients.【Keywords】non-smallcelllungcancer,immunotherapy,PD-1/PD-L1inhibitor,biomarkersModernOncology2021,29(10):1822-1825【指示性摘要】肺癌的发病率及死亡率均居世界首位,其中非小细胞肺癌约占所有肺癌类型的85%,传统放化疗的有效率十分有限,靶向治疗的耐药问题广泛存在。
非小细胞肺癌常见的驱动基因突变类型

非小细胞肺癌常见的驱动基因突变类型非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是目前肺癌的主要类型,约占所有肺癌的85%。
驱动基因突变是NSCLC发生和发展的重要原因之一。
本文将介绍非小细胞肺癌中常见的几种驱动基因突变类型。
1. EGFR突变表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)是一种经常发生突变的驱动基因。
EGFR突变包括点突变和插入/缺失突变,常见的突变位点有Exon 19和Exon 21。
EGFR突变可以导致受体激活异常,进而促进细胞增殖和进化,是NSCLC中最为常见的驱动基因突变。
EGFR突变与亚型NSCLC的发生有关,对EGFR酪氨酸激酶抑制剂(EGFR-TKI)有较好的治疗反应。
2. ALK融合基因ALK基因重排是NSCLC中另一种常见的驱动基因突变。
ALK基因重排导致ALK蛋白与其他蛋白(如EML4)融合,形成具有激酶活性的融合蛋白。
这种融合蛋白能够激活多个信号通路,促进肿瘤细胞的增殖和生存。
ALK融合基因在NSCLC中的检出率约为5%,主要见于非吸烟者和年轻患者。
对于ALK阳性的NSCLC患者,ALK 抑制剂是一种有效的治疗选择。
3. ROS1融合基因ROS1基因融合是NSCLC中另一种重要的驱动基因突变。
ROS1融合基因的患者通常是非吸烟者和年轻人。
ROS1融合基因可以激活多个信号通路,促进肿瘤细胞的增殖和生存。
ROS1融合基因在NSCLC中的检出率约为1-2%。
针对ROS1阳性的NSCLC患者,ROS1抑制剂是一种有效的治疗选择。
4. BRAF突变BRAF基因突变是NSCLC中较为罕见但具有重要意义的驱动基因突变。
BRAF突变通常见于不吸烟的患者,尤其是女性。
BRAF突变可以导致信号通路的异常激活,进而促进肿瘤细胞的增殖和生存。
BRAF突变在NSCLC中的检出率约为1-4%。
对于BRAF阳性的NSCLC患者,BRAF抑制剂是一种有效的治疗选择。
肺癌的分子标志物与综合治疗策略

肺癌的分子标志物与综合治疗策略引言:肺癌是全球范围内最常见的致死性肿瘤之一,其高度侵袭性和复杂多变的分子机制使得肺癌的治疗策略面临巨大挑战。
近年来,随着生物技术和基因组学知识的不断发展,人们对于肺癌发生、发展及预后因素有了更深入的认识。
其中,肺癌分子标志物的寻找与综合治疗策略成为了研究的热点。
本文将针对肺癌的分子标志物和相应治疗策略进行探讨。
一、肺癌分子标志物1. 基因突变肺癌基因突变是导致正常细胞异常增殖和转化为恶性肿瘤细胞的重要原因之一。
EGFR、ALK、KRAS等基因突变在非小细胞肺癌中占据重要地位。
a. EGFR(表皮生长因子受体)EGFR突变是EGFR酪氨酸激酶结构域上特定位置的点突变。
这一突变使得EGFR表达异常增强,进而促进细胞分裂和生长。
肺腺癌病例中约有10%至15%携带EGFR突变,对于这些患者,靶向治疗药物如吉非替尼和埃洛替尼可以显著提高治疗效果。
b. ALK(酪氨酸激酶)ALK基因重排是指ALK基因与其他基因发生融合事件,从而产生具有异常活性的融合蛋白。
近年来,针对ALK基因重排的抑制剂如克唑替尼已被成功应用于临床治疗,并取得了较好的疗效。
c. KRASKRAS基因突变是非小细胞肺癌最常见的致癌基因突变之一。
在KRAS 阳性的肺癌患者中,传统化疗相对无效,故需广泛寻找新药物或新靶点以改善治疗效果。
2. 转录因子和信号通路肺癌发生与发展涉及多种信号通路和转录因子的紊乱调控。
EGFR、PI3K/AKT和STAT3等进行信号传导的分子通路在肺癌中起到了重要作用。
a. EGFREGFR通过自身活化或透过其他信号分子进行信号传导,参与了肿瘤细胞的增殖、生存和迁移等过程。
因此,EGFR抑制剂如吉非替尼和埃洛替尼被广泛应用于肺癌的靶向治疗中。
b. PI3K/AKTPI3K/AKT通路可以促进肺癌细胞生长和侵袭,并参与了患者对放化疗的耐药性形成。
针对PI3K/AKT信号通路及其下游靶点的治疗策略正受到越来越多的关注。
肺癌的遗传易感性研究和家族遗传分析

论文题目:肺癌的遗传易感性研究和家族遗传分析1. 引言肺癌是全球最常见的恶性肿瘤之一,其发病率和死亡率在所有癌症中均居前列。
虽然吸烟是肺癌的主要风险因素,但遗传因素在肺癌的发生中也扮演着重要角色。
近年来,随着基因组学和分子生物学研究的进展,人们对肺癌的遗传易感性和家族遗传机制有了更深入的了解。
本文将系统探讨肺癌的遗传易感性研究、家族遗传分析以及相关的分子机制。
2. 肺癌的遗传易感性2.1 遗传易感基因的发现●EGFR基因:EGFR突变在非小细胞肺癌(NSCLC)中常见,特别是亚洲人群。
EGFR突变患者对酪氨酸激酶抑制剂(TKI)治疗反应良好。
●KRAS基因:KRAS突变在吸烟相关的NSCLC中较为常见,预示着较差的预后和对TKI治疗的耐药性。
●ALK基因重排:ALK基因重排在NSCLC患者中约占5%,ALK抑制剂对这类患者有显著疗效。
●TP53基因:TP53突变在多种癌症中普遍存在,突变形式多样,预示着肿瘤的侵袭性和预后差。
2.2 全基因组关联研究(GWAS)全基因组关联研究通过分析大规模人群的基因型与表型数据,识别出多个与肺癌易感性相关的基因位点:●5p15.33位点:包含TERT和CLPTM1L基因,与多种癌症的易感性相关。
●6p21位点:HLA基因簇所在区域,提示免疫反应在肺癌发生中的作用。
●15q25位点:包含CHRNA5-CHRNA3-CHRNB4基因簇,与尼古丁依赖和肺癌风险相关。
3. 家族遗传分析3.1 家族性肺癌的特点●家族聚集性:家族中多名成员患有肺癌,且发病年龄较早。
●非吸烟相关:一些家族性肺癌病例发生在非吸烟者或轻度吸烟者中,提示遗传因素的作用。
3.2 家族性肺癌的遗传模式●常染色体显性遗传:某些家族性肺癌表现为常染色体显性遗传模式,即携带致病基因的个体有50%的概率将基因传递给子女。
●多基因遗传:家族性肺癌可能涉及多个基因的共同作用,这些基因的累积效应增加了患病风险。
3.3 遗传咨询和风险评估●家族史采集:详细记录家族中每位成员的疾病史,识别高风险个体。
alk基因突变融合断裂重排fish检测原理

alk基因突变融合断裂重排fish检测原理
ALK(Anaplastic Lymphoma Kinase)基因突变融合断裂重排FISH(Fluorescence In Situ Hybridization)检测原理是一种用
于检测ALK基因突变融合及其断裂重排的分子生物学方法。
ALK基因突变融合断裂重排是一种常见的癌症基因变异形式,尤其在肺癌中较为常见。
这种突变融合导致ALK基因的活性
增强,从而促进癌细胞生长和增殖。
FISH检测原理利用荧光标记的DNA探针与靶序列进行杂交反应,通过观察荧光信号的存在与否来确定当前位置的目标序列。
对于ALK基因突变融合断裂重排的检测,常用的方法是使用
两个不同颜色的探针,一种用于检测ALK基因的正常状态,
另一种用于检测突变融合断裂重排。
具体操作步骤包括:
1.制备氟化物处理细胞标本,以使细胞核的DNA解离;
2.将荧光标记的DNA探针与解离后的DNA进行杂交反应,以便与目标序列特异性结合;
3.通过荧光显微镜观察探针结合的荧光信号,分析目标序列的
存在情况。
如果ALK基因突变融合断裂重排存在,FISH检测将会观察到针对突变融合断裂重排的荧光信号。
根据荧光信号的颜色和位置,可以确定是否存在ALK基因的突变融合断裂重排。
FISH检测原理通过荧光信号直接观察目标序列的存在与否,
具有高灵敏度和特异性,对于ALK基因的突变融合断裂重排的检测非常有效。
这种方法在肺癌等ALK突变相关癌症的诊断和治疗中起着重要的作用。
原发性肺鳞癌中EGFR和ALK基因突变的临床研究

原发性肺鳞癌中EGFR和ALK基因突变的临床研究钟炜祥;韦晰凤【期刊名称】《现代肿瘤医学》【年(卷),期】2022(30)21【摘要】目的:探讨赣南地区原发性肺鳞癌患者EGFR和ALK基因突变的特点,科学指导此类患者优选靶向用药。
方法:入组73例原发性肺鳞癌病例,采用ARMS-PNA技术检测EGFR基因第18、19、20、21外显子突变,应用不平衡法检测其中60例病例的ALK融合基因,回顾性分析EGFR和ALK基因突变患者的临床病理特征。
结果:EGFR基因突变8例,阳性率为10.96%(8/73),4例为L858R突变,3例为19del突变,1例为G719X突变。
女性患者突变率(66.67%,2/3)明显高于男性患者(8.57%,6/70)(P=0.030),EGFR基因突变在高龄(≥60岁)、进展期(N_(1-3)、Ⅲ+Ⅳ期)患者中相对较高,但差异无统计学意义(P>0.05)。
EGFR基因突变与吸烟史、T分期以及肿瘤分布位置均无相关性(P>0.05);ALK融合基因表达2例,阳性率3.33%(2/60),与患者性别、年龄、吸烟史、TNM分期及肿瘤分布类型等各临床病理特征均无相关性(P>0.05);未发现EGFR和ALK基因共存突变病例。
结论:赣南地区原发性肺鳞癌患者EGFR和ALK基因突变率相对不高,EGFR基因突变以L858R 和19del突变为主,且好发于女性患者,可能是患者病情进展的预测因子之一。
【总页数】5页(P3919-3923)【作者】钟炜祥;韦晰凤【作者单位】赣南医学院第一附属医院胸外科;赣州市妇幼保健院【正文语种】中文【中图分类】R734.2【相关文献】1.肺炎型肺腺癌患者EGFR基因突变和ALK基因重排情况的临床分析2.肺原发性腺样囊性癌的临床病理特征及PD-1、PD-L1、EGFR、ALK基因检测的临床意义3.赣南地区原发性肺腺癌中EGFR基因突变的临床研究4.赣南地区原发性肺腺癌中EGFR基因突变的临床研究5.EGFR基因突变/ALK基因融合阳性肺鳞癌的靶向治疗因版权原因,仅展示原文概要,查看原文内容请购买。
原发灶不明肿瘤治疗的新策略

原发灶不明肿瘤治疗的新策略原发灶不明肿瘤是经充分检查和评估后无法明确原发灶的转移性肿瘤。
原发灶不明肿瘤因起源组织不明,以经验性化疗作为主要治疗方式,中位生存时间<1年。
基于基因表达谱的检测方法较免疫组织化学提高了肿瘤起源组织检出的灵敏度和特异度,但对治疗的指导价值尚存在争议。
免疫检查点抑制剂和泛癌种抗肿瘤药物的获批改善了原发灶不明肿瘤患者的预后,基于分子生物学检测指导下的靶向治疗和免疫治疗是未来研究的主要方向。
因原发灶不明肿瘤高度的异质性和独特的临床病理特征,篮式试验更加适合应用于原发灶不明肿瘤患者的临床试验设计。
【关键词】原发灶不明肿瘤;预后不良亚型;化疗;靶向治疗;免疫治疗;篮式试验原发灶不明肿瘤(carcinoma of unknown primary, CUP)是经组织病理学确诊,但通过标准评估手段和影像学检查无法明确原发灶部位的转移性肿瘤。
CUP属于一种高异质性的肿瘤,约占所有恶性肿瘤的3%~5%,好发于肺、淋巴结、骨骼、肝脏、纵膈、腹腔等部位。
根据临床病理特征和预后情况,CUP可分为预后良好亚型和预后不良亚型。
其中,预后不良亚型尚无标准治疗,以经验性化疗为主,整体预后较差,中位总生存时间(overall survival, OS)<1年。
CUP诊治的难点在于肿瘤原发部位不明、病理组织类型多样和化疗的疗效欠佳。
本文通过对预后不良亚型CUP的治疗新进展进行综述,以便为CUP的临床诊治和开展临床研究提供参考。
一、CUP的治疗现状(一)经验性化疗预后良好亚型约占CUP的20%,包含以下类型:(1)肿瘤单发、较小且可切除;(2)累及颈部(非锁骨上)淋巴结的鳞状细胞癌;(3)累及腹股沟淋巴结的鳞状细胞癌;(4)孤立的腋窝淋巴结转移癌(女性);(5)腹膜浆液性乳头状腺癌(女性);(6)累及腹股沟淋巴结的鳞状细胞癌;(7)累及纵膈或腹膜后的低分化癌;(8)低分化神经内分泌癌;(9)高分化神经内分泌癌;(10)免疫组化或血清前列腺特异性抗原表达的骨转移癌(男性)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GeneDiagnostic, ZytoVision
Anaplastic lymphoma kinase(ALK)gene rearrangement in non-small cell lung cancer(NSCLC):
Results of a multi-centre ALK-testing
V Laffert M,Warth A,Penzel R,et al.
BACKGROUND:The reliable identification of non-small cell lung cancers(NSCLC)with chromosomal breaks in the gene of the anaplastic lymphoma kinase(ALK)is crucial for the induction of therapy with ALK-inhibitors.In order to ensure a reliable detection of ALK-breaks by means of fluorescence in situ hybridization(FISH)testing,round robin tests are essential.In preparation of a nation (German)-wide round robin test we initiated a pre-testing phase involving8experts in FISH-diagnostics to identify NSCLC cases(n= 10)with a pre-tested ALK-status.In addition,ALK immunohistochemistry(IHC)was performed to assess ALK protein expression. MATERIAL AND METHODS:Sections derived from a tissue microarray,each consisting of3cores from10NSCLC cases,were independently tested for ALK protein expression by IHC and genomic ALK-breaks by FISH involving8institutes of pathology.Based on a pre-screening,5cases were identified to be clearly ALK-break negative,whereas the remaining5cases were ALK-break positive including one case with low percentage(20%)of positive cells.The latter had been additionally tested by RT-PCR.
RESULTS:The5unequivocal ALK-break negative NSCLC were almost consistently scored negative by means of FISH and IHC by all8experts.Interestingly,4of the5cases with pre-defined ALK-breaks revealed homogenous FISH results whereas IHC for the detection of ALK protein expression showed heterogeneous results.The remaining case(low number of ALK-break positive cells)was scored negative by3experts and positive by the other5.RT-PCR revealed the expression of an EML4-ALK fusion gene variant1. CONCLUSION:ALK-break negative NSCLC cases revealed concordant homogeneous results by means of FISH and IHC(score0-1) by all8experts.Discordant FISH results were raised in one ALK-break positive case with a low number of affected tumor cells.The remaining4ALK-break positive cases revealed concordant FISH data whereas the ALK-IHC revealed very diverse results.The cases with concordant FISH results provide an excellent basis for round robin ALK-FISH testing.As long as standardized ALK-IHC protocols are missing,ALK protein expression cannot by regarded as the method of choice for identification of patients eligible for treatment with ALK inhibitors.
ALK基因重排:多中心试验结果
背景:
用可靠的手段确认非小细胞肺癌(NSCLC)ALK基因断裂对于选择ALK阻断剂治疗是致关重要的。
为了确认采用FISH手段诊断ALK断裂的可靠性,需要做一系列的验证(round robin test)。
为做全国(德国)范围内的系列验证,我们在此启动了一个预试验,内容是要求8位FISH诊断专家来确认NSCLC病例(n=10)的ALK状态(原先已经做过相应检测)。
此外,ALK IHC用于评估ALK的蛋白表达水平。
材料与方法:
以10例NSCLC病例的组织制作成的每例三芯点组织芯片为样本,由8家病理科分别采用IHC方法检测ALK蛋白表达和采用FISH方法(ZytoVision,德国蔡图微)检测ALK基因断裂。
基于实验前筛选,5例为明确的ALK阴性,5例为ALK阳性,其中1例为以低百分比(20%)阳性细胞数确定的阳性标本,并经RT-PCR进一步确认。
结果:5例ALK断裂阴性的NSCLC标本经8个病理专家采用FISH和IHC方法检测评分的结果几乎一致为阴性。
有意思的是,原选定为ALK阳性的5例样本中,有4例FISH检测结果一致,但是经IHC检测ALK蛋白表达的结果却各不相同。
余下的1例(ALK阳性细胞值较低)有3位专家判定为阴性,其余5为判定为阳性,RT-PCR结果显示引物1EML4-ALK基因融合。
结论:
8位病理专家对ALK阴性的NSCLC样本的FISH和IHC(0-1)结果评判表现出一致性。
4例ALK阳性标本的FISH评判结果一致,另1例ALK阳性样本FISH评判结果不一致,其原因是由于阳性细胞值低造成的;而IHC检测显示出了不同的结果。
这些样本的FISH结果一致性为ALK FISH系列检测提供了良好的基础。
只要ALK IHC操作未规范化,ALK蛋白表达的检测结果就不能作为确定ALK抑制剂治疗的标准。
点评:建议IHC ALK用作筛查,FISH ALK用于确诊;严重病情情况下即使IHC ALK阴性,也可FISH ALK复查,因为IHC 约有4%的假阴性(Savic S et al.2015).。
