专题1 第1单元 第3课时 物质的聚集状态
专题一第一单元第三课时物质的聚集状态课件
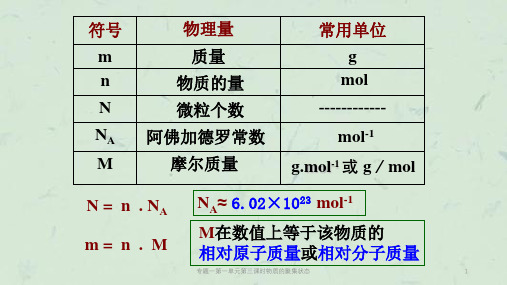
6
二、影响物质体积的因素
温度、压强(气体)、 微粒数目、微粒大小、微粒间距离。
当温度、压强和微粒数目相同时 微粒本身的大小 决定 固体和液体的体积
微粒之间距离的大小 决定 气体的体积
专题一第一单元第三课时物质的聚集状态
7
三、气体摩尔体积 符号:Vm
1、定义:单位物质的量的气体所占的体积。 (1mol气体所占的体积)
V1 = V2
n1 n2
=
N1 N2
专题一第一单元第三课时物质的聚集状态
11
阅读课本12页【例2】
解 : n (H e )M m ((H H e e ))4 0 g .4 m 6 4 o g l 1 0 .1 1 6 m o l
标 况 下 氦 气 的 体 积 V(He)n(He)Vm0.116mol22.4Lmol1 2.60L 答 :
=2mol ×22.4L.mol-1
答:略.
=44.8L
专题一第一单元第三课时物质的聚集状态
14
阅读课本12页【例3】
解:n(Zn)=
m(Zn) M(Zn)
=
13g 65g. mol-1
=0.2mol
Zn + 2HCl = ZnCl2 + H2↑
1mol
1mol ×22.4 L·mol-1
= 22.4L
9
概念辨析:
1、判断下列叙述是否正确
A.标况下,1 mol任何物质的积都约为 22.4 L×
B.l mol气体的体积约为22.4 L ×
C.l mol氖气和l mol氧气体积相同 ×
D.标准状况下,l mol氧气和氮气的混合气体体积
约为22.4 L
√
高中化学 专题一 第一单元 第三课时 物质的聚集状态课件 苏教版必修1
大小只取决于分子数的多少和分子间距离这两个因素。
第四页,共15页。
首 页
一
二
Z 自主预习 K 课堂互动
IZHU YUXI
ETANG HUDONG
S 随堂练习
UITANG LIANXI
三
三、气体的摩尔体积
1.气体的摩尔体积,即:单位物质的量的气体所占的体积,用符号 Vm 表
分子数是减小的,符合要求的是 B;p 前 = p 后,则表明反应前后气体的分子数
是不变的,只有 C。
(2)若反应在压强恒定、容积可变的容器内进行,反应前后 ρ 前>ρ 后和 V
前<V 后 ,在气体总质量不变的前提下,则表明气体的分子数是增大的。由于分
子数的增多,导致了容器体积的增大,从而造成密度的减小。符合题意的是
其物质的量之比,1 = 1 = 1 。
2
2
2
3.在同温、同压下,气体的密度之比等于其摩尔质量之比,1 = 1 。
2
第八页,共15页。
2
首 页
探究(tànjiū)
点一
Z 自主预习 K 课堂互动
IZHU YUXI
ETANG HUDONG
S 随堂练习
UITANG LIANXI
探究(tànjiū)
点二
【例题 2】在 120 ℃时分别进行如下四个反应:
A.2H2S+O2
2S+2H2O
B.2H2S+3O2
2SO2+2H2O
C.C2H4+3O2
2CO2+2H2O
D.C4H8 +6O2
物质的聚集状态

小结: 小结:
质量 m
÷M ×M
物质的量 n
×Vm ÷Vm
×NA ÷NA
粒子数 N
V
(气体 气体) 气体
[例]在标准状况下,8. 5克NH3体积是多少 例 在标准状况下 在标准状况下, 克 体积是多少?
氨的式量是17, 氨的摩尔质量是 17g/mol 。 解: 氨的式量是 n (NH3) =
m(NH3) M (NH3)
气体的体积大小取 决于: 决于:
气体微粒的间距和哪些外界条件有关? 气体微粒的间距和哪些外界条件有关?
①压强越大,体积越小; 压强越大,体积越小
压强对气体体积的 影响
②温度越高,体积越大 温度越高,
当压强增大, 当压强增大,气体分子间 距离变小,气体体积变小。 距离变小,气体体积变小。
温度对气体体积的影响
√ √ √
任何气体的体积在标准状况约为22.4 任何气体的体积在标准状况约为22.4 L 。 物质的量 标准状况下, mol任何气体的体积约为 标准状况下,n mol任何气体的体积约为 22.4n L。
标准状况下, L任何气体约含6.02× 任何气体约含6.02 个分子。 标准状况下,22.4 L任何气体约含6.02×1023个分子。 标准状况下,1mol水的体积约为22.4L。 水的体积约为22.4L 标准状况下,1mol水的体积约为22.4L。 水的状态
• 物质在不同状态时的微观结构特点 固体干冰
分子间距离较小 与分子直径接近
CO2气体
间距较大, 间距较大,约是分子直 径的10 10倍 径的10倍
探究: 探究:粒子大小和粒子间距 对物质体积的影响示意图
总结: 总结:
微粒的数目 固体、 固体、液体的体积大 小取决于: 小取决于 微粒的大小 微粒的数目 微粒的间距
高中化学 专题1 第一单元 第三课时 物质的聚集状态课件 苏教版

第二十二页,共38页。
第二十三页,共38页。
[例1] 下列说法正确的是
()
①标准状况下,6.02×1023个分子所占的体积(tǐjī)约是22.4 L
②0.5 mol H2所占体积(tǐjī)为11.2 L ③标准状况下,1 mol H2O的体
积(tǐjī)为22.4 L ④标准状况下,28 g CO与N2的混合气体的体积
n(CO2)=44 g·1 gmol-1=414 mol,
则n(CH4)∶n(CO2)=11∶4,D正确;
同温同压下ρρ((CCOH24))=MM((CCHO42))=1464=141,A正确;
NN((CCHO42))=nn((CCHO42))··NNAA=141,B错误;
同温同压下VV((CCHO42))=nn((CCHO42))=141,C正确。
微粒间的空隙
几乎不能被压
置上振动
很小
缩
第十二页,共38页。
物质的聚 集状态
微观结构
微粒排列较紧
液态 密,微粒间的
空隙较小
微粒之间的距 气态
离较大
微粒的运 动方式
可以自由移动
可以自由移动
宏观性质
没有固定的形状, 但不易被压缩 没有固定的形状, 容易被压缩
(3)阿伏加德罗定律:在相同温度和压强下,相同体积的任何 (rènhé)气体都具有相同的分子数。
体,当这两个容器内温度和气体密度相等时,下列说法正确的
是
()
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子(fēnzǐ)数目相等
D.两种气体的氧原子数目相等
第二十九页,共38页。
[解析] 解答本题(běntí)应先看清题目中给出的条件,同温、 同体积、同密度,然后根据各种物理量间的换算关系找出正确答 案。根据题意,因等温度、等体积、等密度,则两者等质量,B项 错;等质量的O2和O3物质的量不相等,则压强和分子数不相等, 则A、C两项错,O2和O3都是由氧原子构成的,所以等质量的O2 和O3原子数相等。
高中化学专题1第1单元第3课时物质的聚集状态课件必修1高一必修1化学课件

12/6/2021
第二页,共四十三页。
栏目导航
自主预习 探新知
12/6/2021
第三页,共四十三页。
栏目导航
一、物质的聚集状态 1.对物质从宏观聚集状态、微观组成的角度分类
12/6/2021
第四页,共四十三页。
栏目导航
(1)晶体:具有规则的 几何(jǐ hé)外形 和固定 熔点(ró的ngdi固ǎn) 体,如氯化 钠、纯碱、冰。
(4)两密闭容器,若温度、密度相同(m1>m2),则其压强 (p)G1________G2(填“>”“=”或“<”)。
12/6/2021
第二十六页,共四十三页。
栏目导航
[解析] 标准状况下,m1 g 气体 G1 与 m2 g 气体 G2 的分子数相 同,所以物质的量是相等的,根据公式 m=nM,所以摩尔质量之比 等于质量之比,即为 m1∶m2。(1)根据公式 M=ρVm,同温同压下, 气体的 Vm 是相等的,所以 G1 与 G2 的密度之比等于摩尔质量之比, 即为 m1∶m2;
12/6/2021
第二十三页,共四十三页。
栏目导航
阿伏加德罗定律(dìnglǜ)及其推论
1.阿伏加德罗定律:相同温度相同压强下,相同体积的任何气 体都含有相同数目的粒子(分子)。
12/6/2021
第二十四页,共四十三页。
栏目导航
2.阿伏加德罗定律的基本推论 推论
公式
同温同压下,气体的体积之比等于其物质的量之比
VV12=nn12
同温同体积时,气体的压强之比等于其物质的量之比 pp12=nn12
同温同压下,任何气体的密度之比等于其摩尔质量之比 ρρ12=MM21
12/6/2021
第二十五页,共四十三页。
《物质的聚集状态》课件

等离子态的生成与转化
总结词
等离子态物质的生成通常需要高能条 件,如高温或高压,而其转化则与外 部条件的变化有关。
详细描述
等离子态物质的生成可以通过加热气 体、电弧放电、激光照射等方式实现 。在一定条件下,等离子态物质可以 转化为其他聚集状态,如固态、液态 或气态。
等离子态物质的应用
总结词
等离子态物质在工业、医疗、环保等领域有广泛应用。
特性
软物质具有复杂的微观结构和动态行为,如黏滞流体、液 晶、高分子聚合物等。这些物质的聚集状态会随着温度、 压力等外部条件的变化而变化。
应用
软物质在日常生活中有着广泛的应用,如塑料、橡胶、涂 料等,同时在生物医学、材料科学等领域也有着重要的应 用价值。
量子态物质
01
定义
量子态物质是指那些表现出量子力学特性的物质,即粒子的运动状态和
特性
超固态物质具有极高的硬度和强度,同时又具有很好的弹性和韧性 。这种状态下的物质具有非常独特的物理和化学性质,如高温超导 等。
应用
超固态物质在材料科学、电子学、能源等领域具有广泛的应用前景, 如高温超导材料、超硬材料等。
软物质
定义
软物质是指那些在常温常压下表现出柔软、黏滞、流动性 等特性的物质。与硬物质不同,软物质在受到外力作用时 容易发生形变。
多领域得到应用。
THANKS
感谢观看
位置具有不确定性,同时表现出波粒二象性。
02
特性
量子态物质具有许多奇特的性质,如量子纠缠、量子隧道效应等。这些
性质使得量子态物质在信息处理、量子计算等领域具有巨大的潜力。
03
应用
目前量子态物质的应用主要集中在理论研究和实验室实验阶段,如量子
高一化学《物质的聚集状态》课件
练习:
1.下列说法是否正确? (1)1摩尔氢气的体积约为22.4L (2)标准状况下,1摩尔水的体积约22.4升。 (3)20 oC时, 1摩尔氧气的体积约22.4升。 (4)2×105Pa时,1摩尔氮气的体积小于22.4升。
2.标准状况下: (1)44.8升氢气的物质的量是多少? (2)0.5摩尔氧气的体积是多少? (3)14克CO的体积是多少? (4)33.6升氮气中含多少个氮分子?
V
5.公式: n = —— Vm
思考:1mol气体在任何状况下所占的体积是不
是相等?是不是都约为22 .4L?
1、状态:气体
几点注意:
2、状况:一定温度和压强下,一般指标准状况
3、定量:1mol
4、数值:约22 .4L
5、通常状况: 20 0C、1.01×105Pa
6、气体体积与微粒数目有关,与种类无关。
该物质在标准状况下的体积为22.4L
D.标准状况下,1molH2和O2的混合气 体的体积不一定为22.4L
7、结论:在标准状况下,1mol任何气体所占的体积
都约为22 .4L。
8、有关计算:(标准状况下) V=n×22.4L/mol(n为气体的物质的量)
气体摩尔体积的推广
阿伏加德罗定律 内容:同温同压下,相同体积的任何气体 都具有相同数目的分子数
推论: (1)同温同压,体积与物质的量成正比 (2)同温同体积,压强与物质的量成正比 (3)同温同压,密度与摩尔质量成正比
举一个例子:同学们在做操的时候,一个班在操场上所 占的面积和哪些因素有关:人数、距离、胖瘦
粒子数目
物质的体积 粒子大小
粒子间距
固体物质
液体物质
23 456 78 9
(教师参考)高中化学 1.1.3 物质的聚集状态课件2 苏教版必修1
÷M 质量 (m)
精选ppt
13
6、气体体积与微粒数目有关,与种类无关。
7、结论:在标准状况下,1mol任何气体所占的体积 都约为22 .4L。
8、有关计算:(标准状况下)
V=n×22.4L/mol
精选ppt
7
辨析和应用
Ø1mol任何物质的体积在标准状况下都约为22.4 L。
Ø1mol气体的体积约为22.4 L。
Ø1mol空气的体积在标准状况下约是22.4 L。 Ø任何气体的体积在标准状况约为22.4 L 。
• ①Cl2 ⑤O2
②N2 ③H2
精选ppt
④CO2
11
知识归纳
..
质量
d
M
物质的量
M
d
Vm
Vm
NA
.. NA
微粒数
. .
..
气体体积 (标准状况)
M 摩尔质量
NA 阿伏加德罗常数
Vm 气体摩尔体积 d 气体密度
精选ppt
12
体积 V?m (V)
粒子数 (N)
×NA ÷NA
物质的量 (n)
÷ρ × ρ ×M
1mol气体体积:Vm约22.4L
6.公式: n = —VV—m
思考:1mol气体在任何状 况下所占的体积是不 是相
等?是不是都约为22 .4L?
精选ppt
6
温馨提醒
1、状态:气体
2、状况:一定温度和压强下,一般指标准状况
3、定量:1mol
4、数值:约22 .4L
5、通常状况: 20 0C、1.01×105Pa
专题1 化学家眼中的物质世界
第一单元 丰富多彩的化学物质 第3课时 物质的聚集状态
高中化学必修1学案专题1第一单元第3课时物质的聚集状态
第3课时物质的聚集状态一、物质的聚集状态及其结构和性质1.物质的聚集状态主要有气态、液态和固态三种。
2.不同聚集状态物质的微观结构与性质二、物质体积的影响因素物质体积的大小取决于构成这种物质的粒子数目、粒子大小和粒子之间的距离。
1.固态或液态物质固态或液态物质粒子之间的距离是非常小的,故1 mol固态或液态物质的体积主要取决于粒子的大小,不同的固态或液态物质,粒子的大小是不相同的,因此,1 mol不同的固态或液态物质的体积是不相同的。
2.气态物质对于气体来说,粒子之间的距离远大于粒子本身的直径,所以 1 mol气体的体积主要取决于气体粒子之间的距离。
而在同温同压下,任何气体粒子之间的距离可以看成是相等的,1 mol任何气体都具有相同的体积。
三、气体摩尔体积1.概念:单位物质的量的气体所占的体积。
2.符号及单位:符号为V m,常用单位有L/mol(或L·mol-1)和m3/mol(或m3·mol-1)。
3.气体摩尔体积的数值气体摩尔体积的数值决定于气体所处的温度和压强。
例如标准状况下,气体摩尔体积约为22.4_L·mol-1(较常用);25 ℃和101 kPa的条件下,气体摩尔体积约为24.8 L·mol-1。
4.物质的量(n)、气体体积(V)和气体摩尔体积(V m)的关系为V m=Vn。
四、阿伏加德罗定律内容:同温同压下,相同体积的任何气体都含有相同的分子数。
探究点一气体摩尔体积及相关计算一、标准状况下的气体摩尔体积及有关计算1.标准状况下的气体摩尔体积并不一定只有在标准状况下1 mol气体的体积才是22.4 L,在非标准状况下,1 mol气体也有可能是22.4 L。
2.标准状况下气体体积的计算(1)气体的物质的量n=V 22.4 L/mol(2)气体的摩尔质量M=V m·ρ=ρ×22.4 L/mol(标准状况)(3)气体的分子数N=n·N A=V22.4 L/mol·N A(4)气体的质量m=n·M=V22.4 L/mol·M二、化学方程式中的化学计量数与几个物理量的关系结论:(1)化学方程式中各物质的化学计量数之比等于各物质的分子数之比,等于各物质的物质的量之比,即ν1ν2ν3…=N1N2 N3…=n1n2n3…(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于各气体的体积之比,即ν1ν2ν3…=V1V2V3…1.两种气体体积相同,所含的分子数一定相同吗?提示:不一定。
《物质的聚集状态说》课件
迁移现象是指带电气体分子在电场作用下的定向 迁移现象。迁移率与电场强度和温度有关。
3
扩散和迁移的应用
扩散和迁移在工业生产和科学研究中有着广泛的 应用,如混合气体分离、污染物的扩散等。
气态物质的其他特性
气体的热容
01
气体的热容是指气体在等温过程中吸收或释放热量时其温度的
变化量。气体的热容与温度和压力有关。
晶体的结构与性质
结构
晶体具有整齐、规则的几何外形,内 部原子或分子的排列呈现周期性重复 。
性质
晶体具有固定的熔点,对X射线衍射呈 现出特有的衍射图案。
非晶体的结构与性质
结构
非晶体内部原子或分子的排列呈现无序或近似的无序状态, 没有明显的几何外形。
性质
非晶体没有固定的熔点,对X射线衍射不呈现出明显的衍射图 案。
二氧化碳
用于灭火器、饮料、发酵等领域。
THANKS
感谢观看
《物质的聚集状态说》ppt课件
目录
• 物质的聚集状态概述 • 固态物质 • 液态物质 • 气态物质 • 物质的聚集状态与生活应用
01
物质的聚集状态概述
物质的三种聚集状态
01
02
03
固态
物质分子或原子紧密排列 ,形成固定形状和体积的 聚集状态。
液态
物质分子或原子相对自由 移动,形成连续且具有一 定流动性的聚集状态。
食品
如糖果、巧克力、饼干等,满足人们的口腹之欲。
液态物质的应用
饮料
如水、茶、咖啡、果汁 等,提供人体所需的水 分和营养。
燃料
如石油、天然气、煤油 等,用于提供能源和动 力。
药品
如药水、药膏、注射剂 等,用于治疗疾病和缓 解症状。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三课时物质的聚集状态
—————————————————————————————————————[三级训练·节节过关]
1.相同物质的量的各固体或液体的体积并不相同,其主要原因是()
A.粒子大小不同B.粒子质量不同
C.粒子间距离不同D.粒子的状态不同
2.下列说法正确的是()
A.标准状况下,22.4 L任何气体都约含有6.02×1023个分子
B.含1 mol氦原子的氦气在标准状况下的体积约为11.2 L
C.常温常压下,11.2 L Cl2含有的分子数为0.5N A
D.标准状况下,11.2 L蔗糖含有的分子数为0.5N A
3.下列说法正确的是()
A.常温常压下,22.4 L CO2中含有N A个CO2分子
B.标准状况下,4.48 L CO含有0.2N A个原子
C.22.4 L Cl2中含有N A个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1N A个氧原子
4.在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是________,含原子数最多的是__________,质量最大的是________,体积最小的是________。
1.下列有关气体体积的叙述中,正确的是()
A.一定温度和压强下,各种气态物质的体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质的体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
2.常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是()
3.下列说法正确的是()
A.1 mol CO和1 mol N2所含分子数相等,质量相等,它们所占的体积也相等
B.22.4 L H2和71 g Cl2恰好反应生成2 mol HCl
C.非标准状况下,1 mol任何气体的体积一定不是22.4 L
D.1 mol HCl在标准状况下的体积约是22.4 L
4.下列说法中,正确的是()
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol NaCl所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量为2 mol 5.下列说法正确的是(N A表示阿伏加德罗常数的值)()
A.在常温常压下,11.2 L N2含有的分子数为N A
B.标准状况下,4 g H2所占的体积约是22.4 L
C.32 g O2在标准状况下所占的体积约为22.4 L
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
6.在标准状况下,某气体密度为1.25 g·L-1,则该气体的相对分子质量为()
A.12.5B.14
C.28 D.30
7.同温同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是()
A.密度比为16∶11 B.密度比为11∶16
C.体积比为1∶1 D.体积比为16∶11
8.标准状况下,同质量的气体A和B,已知B的体积大于A,则它们的摩尔质量的关系是()
A.M A=M B B.M A>M B
C.M A<M B D.无法确定
9.某气体由双原子分子构成,它的摩尔质量为M g·mol-1,该气体有m g,阿伏加德罗常数的值用N A表示,则:
(1)该气体的物质的量为________mol;
(2)该气体在标准状况下的体积为________L;
(3)该气体所含原子总数为________个。
10.(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,其分子数之比为________;氧原子数之比为________;相同条件下的体积之比为________。
(2)标准状况下,1.7 g NH3的体积为________L,它与标准状况下________L H2S含有相同数目的H。
(3)某气态氧化物的化学式为RO2。
标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为__________。
1.下列叙述正确的是( )
A .1 mol 任何气体的体积都约为22.4 L
B .1 mol 任何物质在标准状况下所占的体积都约是22.4 L
C .标准状况下,1 mol O 2所占的体积约是22.4 L
D .标准状况下,22.4 L 气体的物质的量不一定是1 mol
2.在标准状况下,下列物质占体积最大的是( )
A .98 g H 2SO 4
B .6.02×1023个N 2分子
C .44.8 L HCl
D .6 g H 2
3.在体积相同的两个密闭容器中分别充满O 2、O 3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A .两种气体的压强相等
B .O 2比O 3的质量小
C .两种气体的分子数目相等
D .两种气体的氧原子数目相等
4.设阿伏加德罗常数的数值为N A ,标准状况下m g O 2和N 2的混合气体含有b 个分子,则n g 该混合气体在相同状况下所占的体积应是( )
A.22.4nb mN A L
B.22.4mb nN A
L C.22.4nN A mb L D.nbN A 22.4m
L 5.同温同压下,具有相同体积的任何气体中含有的分子数相同。
在一定温度和压强下,10体积气体A 2跟30体积气体B 2化合生成20体积某气体C ,则气体C 的化学式为( )
A .AB
B .A 2B
C .AB 3
D .AB 2
6.在同温同压下,某集气瓶充满O 2时为116 g ,充满CO 2时为122 g ,充满气体A 时为114 g ,则A 的相对分子质量为( )
A .44
B .32
C .28
D .17
7.下列关于a g H 2和b g He 的说法正确的是( )
A .同温同压下,H 2和He 的体积比是a ∶2b
B .同温同压下,若a =b ,则H 2与He 的物质的量之比是1∶1
C .体积相同时,He 的质量一定大于H 2的质量
D .同温同压下,若二者的物质的量相等,其体积也相等
8.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强
均相同,且甲的密度大于乙的密度,则下列说法正确的是()
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
9.对一定量气体体积的探究。
(1)已知1 mol不同气体在不同条件下的体积:
(2)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为______。
②1 mol不同的气体,在不同的条件下,体积__________(填“一定”“一定不”或“不一定”)相等。
(3)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(4)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
(3)①气体分子数目相等②相同条件下,气体分子间距离几乎相等
(4)V(O2)=n·V m=m
M·V m=
4 g
32 g·mol×22.4 L·mol
-1=2.8 L。
10.CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则:
(1)混合气体中CO的质量是________g;
(2)混合气体中CO2在标准状况下的体积是________L;
(3)混合气体在标准状况下的密度是________g·L-1。
