【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)
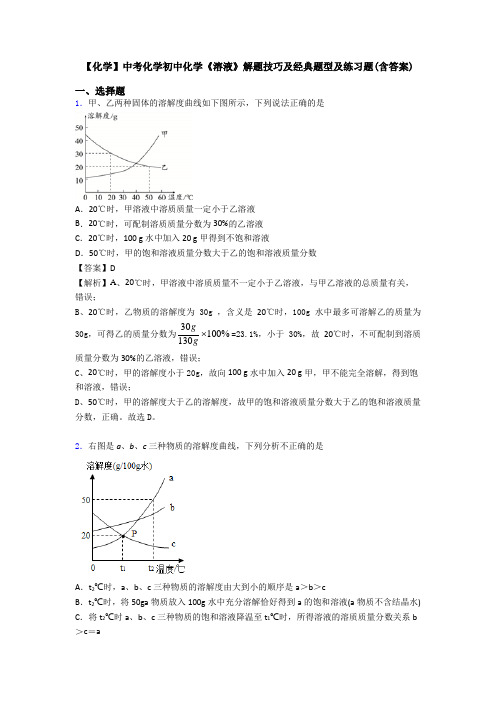
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.甲、乙两种固体的溶解度曲线如下图所示,下列说法正确的是A.20℃时,甲溶液中溶质质量一定小于乙溶液B.20℃时,可配制溶质质量分数为30%的乙溶液C.20℃时,100 g水中加入20 g甲得到不饱和溶液D.50℃时,甲的饱和溶液质量分数大于乙的饱和溶液质量分数【答案】D【解析】A、20℃时,甲溶液中溶质质量不一定小于乙溶液,与甲乙溶液的总质量有关,错误;B、20℃时,乙物质的溶解度为30g ,含义是20℃时,100g水中最多可溶解乙的质量为30g,可得乙的质量分数为30100%130gg=23.1%,小于30%,故20℃时,不可配制到溶质质量分数为30%的乙溶液,错误;C、20℃时,甲的溶解度小于20g,故向100 g水中加入20 g甲,甲不能完全溶解,得到饱和溶液,错误;D、50℃时,甲的溶解度大于乙的溶解度,故甲的饱和溶液质量分数大于乙的饱和溶液质量分数,正确。
故选D。
2.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【答案】C【解析】【详解】A.通过分析溶解度曲线可知,t2℃时,a、b、c三种物质溶解度由大到小的顺序是a>b>c,故A正确;B.t2℃时,a物质的溶解度是50g,所以将50g a物质(不含结晶水)放入100g水中充分溶解得到150ga的饱和溶液,故B正确;C.t1℃时,b物质的溶解度最大,a物质次之,降低温度,a、b物质会析出晶体,c物质降低温度不会析出晶体,应该按照50℃时的溶解度进行计算,所以将50℃时a、b、c三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是b>a>c,故C 错误;D.c物质的溶解度随温度的升高而减小,所以将c的饱和溶液变为不饱和溶液,可采用降低温度的方法,故D正确;故选C。
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
2.盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如下图所示。
下列说法正确的是A.MgSO4的溶解度始终随温度的升高而减小B.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等C.t2℃时,100gMgCl2的饱和溶液中含有agMgCl2D.将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和【答案】D【解析】【分析】【详解】A、由溶解度曲线可知,MgSO4的溶解度不是始终随温度的升高而减小,故A错误;B、t1℃时,氯化钾和硫酸镁的溶解度相等,如果两种溶液是饱和溶液,并且溶液质量相等,则溶质质量一定相等,但题目未告知两溶液质量是否相等,故B错误;C、t2℃时,溶解度的含义是100g水中最多能溶解ag氯化镁,因此100gMgCl2的饱和溶液中含有氯化镁的质量小于ag,故C错误;D、氯化钾的溶解度随着温度的升高而增大,将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和溶液变成不饱和溶液,故D正确。
故选:D。
3.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g D.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。
t1℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2℃时,甲的溶解度为50g,即100g水中最多溶解50g的甲,40g甲加入50g水中,充分溶解后只能溶解25g,所得的溶液质量为75g,错误;D、t2℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是A.乙为NH4Cl B.t3应介于40℃﹣50℃C.55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙 D.等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等【答案】C【解析】A. 据溶解度表可知,NH4Cl的溶解度随温度升高而增大,故乙是NH4Cl,正确;B、40℃时,Na2SO4的溶解度是48.4g,50℃时,溶解度变小,是47.5g,且t3℃时两种物质的溶解度相等,故t3应介于40℃﹣50℃,正确;C、据溶解度表分析可知,55℃时,NH4Cl的溶解度大于Na2SO4的溶解度,故分别将两饱和溶液蒸发等质量的水,得到固体质量乙>甲,错误;D、两种物质的溶解度从t3降温到t1时,溶解度变化相同,故等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等,正确。
故选C。
2.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90gD.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s×100%。
t1℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2℃时,甲的溶解度为50g,即100g水中最多溶解50g的甲,40g甲加入50g水中,充分溶解后只能溶解25g,所得的溶液质量为75g,错误;D、t2℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.配制一定质量分数的氯化钠溶液,下列操作正确的是A.称量固体时,左盘放砝码,右盘放氯化钠B.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签C.量取液体时,手持量筒,视线与液体的凹液面的最低处保持水平D.称量固体时,发现指针向左偏,应该用镊子将游码向右移动直至天平平衡【答案】B【解析】A、称量固体药品的质量时要注意“左物右码”,错误;B、溶于配制好后需要标明溶液的名称和溶质的质量分数,正确;C、量取液体体积时,量筒应放在水平桌面上,错误;D、定量称量固体质量时,指针向左偏,说明左盘重了,应该减少药品的质量直至天平平衡,错误。
故选B。
2.下列关于溶液的说法错误的是()A.固体、液体、气体都可以做溶质B.NH4NO3溶解过程中吸热,溶液温度降低C.欲使100克KNO3溶液的质量分数由5%变成10%,可向其中加入5克KNO3固体D.25℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a 与b的质量不一定相等【答案】C【解析】试题分析:A、溶质可以是固体、液体、气体,故A说法正确;B、NH4NO3溶解过程中吸热,溶液温度降低,故B说法正确;C、溶质质量分数:,故C错;D、如果硝酸钾溶液蒸发溶剂前,是饱和溶液,蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量一定相等,如果硝酸钾溶液蒸发溶剂前,是不饱和溶液,蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量一定不相等,故D说法正确。
故选C。
考点:溶液的概念、组成及其特点;溶解时的吸热或放热现象;晶体和结晶的概念与现象;有关溶质质量分数的简单计算3.NH4C1和Na2SO4的溶解度表及溶解度曲线如下,下列说法正确的是:()A.甲为NH4C1B.t2时,甲溶液的溶质质量分数一定比乙大C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小D.等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等【答案】D【解析】A、通过分析溶解度表中的数据可知,氯化铵的溶解度随温度的升高而增大,所以乙为氯化铵;B、饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,由图可知,t2时,甲乙两物质的溶解度相等,所以两物质的饱和溶液溶质的质量分数相同;不饱和时,浓度大小关系不确定,C、甲物质饱和溶液从t3降温到t2,溶解度变大,溶质的质量不变,溶质的质量分数不变;D、t1℃、t3℃时,两物质的溶解度相等,所以等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等,故D正确.选D点睛:在溶解度曲线图上,溶剂的量都是100g,所以分析溶质的质量分数时,只需要比较溶质的多少即可。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.小龙同学在工具书中查到氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示通过分析他得出以下结论,其中错误的是氢氧化钠碳酸钠20℃40℃20℃40℃水109 g129 g21.8 g49 g酒精17.3 g40 g不溶不溶A.影响物质的溶解度的因素有:温度、溶质性质、溶剂性质B.NaOH易溶于水也易溶于酒精,Na2CO3 易溶于水不溶于酒精中C.20℃时,将CO2通入NaOH的酒精饱和溶液中,会产生白色沉淀D.40℃时,若将50 g NaOH分别投入到100g水和100 g酒精中,均能形成饱和溶液【答案】D【解析】A、通过分析溶解度表可知,影响物质的溶解度的因素有:温度、溶质性质、溶剂性质,正确;B、 20℃时,NaOH在水和酒精的溶解度分别为:109 g和17.3 g,所以易溶于水也易溶于酒精,20℃时,Na2CO3在水和酒精的溶解度分别为:21.8g和不溶,所以Na2CO3 易溶于水不溶于酒精中,正确;C、20℃时,Na2CO3在水和酒精的溶解度为不溶,CO2与氢氧化钠反应生成碳酸钠和水。
20℃时,将CO2通入NaOH的酒精饱和溶液中,会产生白色沉淀,正确;D、40℃时,NaOH在水和酒精的溶解度分别为129g和40g。
40℃时,若将50 g NaOH分别投入到100g水和100 g酒精中,NaOH在水中不能形成饱和溶液,在酒精中能形成饱和溶液,错误。
故选D。
点睛:通常把室温(即20℃)时的溶解度大于或等于10g的物质,叫易溶物质。
2.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90gD.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A 【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.右图是NaCl、MgSO4的溶解度曲线.下列说法正确的是()A.只有在t1℃时,NaCl和MgSO4的溶解度才相等B.t1℃~t3℃,MgSO4的溶解度随温度升高而增大C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出【答案】C【解析】根据两物质的溶解度曲线不难看出,两物质的溶解度曲线有两个交点,即t1℃和t2℃时,两物质的溶解度相等,故A错误;由硫酸镁的溶解度曲线可知,在t1℃~t3℃时,硫酸镁的溶解度先随温度的升高而增大,后随温度的升高而减小,故B错误;在t2℃时,由于硫酸镁的溶解度大于氯化钠的溶解度,所以硫酸镁饱和溶液中溶质的质量分数大,故C正确;由于在t2﹣t3℃,硫酸镁的溶解度随温度的降低而增大,因此把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液会由饱和溶液变成不饱和溶液,而不会有晶体析出,故D错误。
【答案】B【解析】饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。
判断溶液是否饱和的方法是:向溶液中在加入少量同种溶质,搅拌,如能继续溶解,原溶液是不饱和溶液;如不能溶解,原溶液为饱和溶液。
A. 温度不变时,向该溶液中加入少量水,溶质的质量分数都变小;B. 温度不变时,向该溶液中加入少量KNO3晶体,晶体不再溶解,可证明原溶液是饱和溶液;C. 取少量该溶液,升温后无KNO3晶体析出,可能是升温时物质的溶解度变大,使溶液由饱和溶液变成不饱和溶液;D. 取少量该溶液,降温到10℃时,有KNO3晶体析出,是因为降温时,物质的溶解度变小。
选B点睛:证明溶液是否饱和的关键是清楚饱和溶液与不饱和溶液是的区别。
2.线:溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.甲、乙两种物质的溶解度曲线如图所示。
下列叙述正确的是A.甲的溶解度比乙的大B.将t2℃时甲、乙饱和溶液降温到t1℃,析出甲的质量大C.t2℃时,等质量甲和乙的饱和溶液中所含溶剂的质量甲>乙D.将t1℃时甲、乙饱和溶液升温的t2℃,溶液的溶质质量分数相等【答案】D【解析】A、在比较物质的溶解度时,需要指明温度,故错误;B、将甲、乙的饱和溶液的质量不确定,所以从t 2℃降到t1℃,析出晶体的质量也不确定,故错误;C、t2℃时,甲物质的溶解度>乙物质的溶解度,即100g溶剂中甲物质的质量>乙物质的质量,等质量甲和乙的饱和溶液中所含溶剂的质量甲<乙,故错误;D、由于在t1℃时甲、乙两物质的溶解度相同,溶液中溶质的质量分时也相同。
甲、乙的溶解度都温度的升高而增大,所以,将t1℃甲、乙两物质的饱和溶液升温至t2℃,都变成了不饱和溶液,由于溶液中溶质的质量、溶剂的质量都不变,所得甲溶液溶质质量分数=乙溶液溶质质量分数,故正确。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如下图所示。
下列说法正确的是A.MgSO4的溶解度始终随温度的升高而减小B.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等C.t2℃时,100gMgCl2的饱和溶液中含有agMgCl2D.将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和【答案】D【解析】【分析】【详解】A、由溶解度曲线可知,MgSO4的溶解度不是始终随温度的升高而减小,故A错误;B、t1℃时,氯化钾和硫酸镁的溶解度相等,如果两种溶液是饱和溶液,并且溶液质量相等,则溶质质量一定相等,但题目未告知两溶液质量是否相等,故B错误;C、t2℃时,溶解度的含义是100g水中最多能溶解ag氯化镁,因此100gMgCl2的饱和溶液中含有氯化镁的质量小于ag,故C错误;D、氯化钾的溶解度随着温度的升高而增大,将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和溶液变成不饱和溶液,故D正确。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.30℃时,取甲、乙、丙中的两种固体各1g 分别放进盛有10g 水的两支试管中,充分振荡后的溶解情况如图。
下列说法正确的是A .甲物质的溶解度比乙物质的溶解度大B .加入试管1的固体是丙C .向烧杯中加入NH 4NO 3固体后,试管2中一定有晶体析出D .将30℃时甲、乙、丙三种物质的饱和溶液降温至 20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙【答案】B【解析】A .比较物质的溶解度大小须确定温度,故A 错误;B .30℃时三种物质只有丙的溶解度小于10g ,即100g 水中溶解溶质的质量小于10g ,则10g 水中溶解溶质的质量小于1g ,所以30℃时,取其中两种固体各1g 分别放进盛有10g 水的两支试管中,充分振荡后有剩余固体的是丙,即试管1,故B 正确;C .向烧杯中加入NH 4NO 3固体后,温度降低,若降到20℃以下,才有晶体析出,高于此温度,则无晶体析出;所以向烧杯中加入NH 4NO 3固体后,试管2中不一定有晶体析出,故C 错误;D .将30℃时甲、乙、丙三种物质的饱和溶液降温至20℃,甲乙溶解度减小,均析出晶体,溶质的质量减小,溶质的质量分数减小,丙溶解度增大,溶液中溶质、溶剂的质量不变,溶质的质量分数与降温前相等;饱和溶液中溶质质量分数=100g溶解度溶解度×100%,即溶解度越大质量分数也就越大,20℃时乙的溶解度大于甲的溶解度大于30℃时丙的溶解度,故所得溶液中溶质的质量分数的大小关系是乙>甲>丙,故D 错误;故选B 。
2.不含结晶水的甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是A .t 1℃时,甲、乙饱和溶液中含溶质的质量相等B .t 1℃时,甲、乙两种物质各25g 分别加入到50g 水中,充分溶解,得到的溶液质量都是70gC .t 2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数D.t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙【答案】B【解析】A、t1℃时,甲、乙溶解度相等,所以等质量的饱和溶液中含溶质的质量相等,故A错误;B、t1℃时,甲、乙两种物质的溶解度是40g,所以各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70g,故B正确;C、t2℃时,溶液的饱和状态不确定,所以甲溶液的溶质质量分数不一定大于乙溶液的溶质质量分数,故C错误;D、t2℃时甲、乙的饱和溶液的质量不确定,所以降温到t1℃时,析出晶体的质量甲不一定大于乙,故D错误。
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.甲、乙两种物质的溶解度曲线如图所示。
下列叙述正确的是A.甲的溶解度比乙的大B.将t2℃时甲、乙饱和溶液降温到t1℃,析出甲的质量大C.t2℃时,等质量甲和乙的饱和溶液中所含溶剂的质量甲>乙D.将t1℃时甲、乙饱和溶液升温的t2℃,溶液的溶质质量分数相等【答案】D【解析】A、在比较物质的溶解度时,需要指明温度,故错误;B、将甲、乙的饱和溶液的质量不确定,所以从t 2℃降到t1℃,析出晶体的质量也不确定,故错误;C、t2℃时,甲物质的溶解度>乙物质的溶解度,即100g溶剂中甲物质的质量>乙物质的质量,等质量甲和乙的饱和溶液中所含溶剂的质量甲<乙,故错误;D、由于在t1℃时甲、乙两物质的溶解度相同,溶液中溶质的质量分时也相同。
甲、乙的溶解度都温度的升高而增大,所以,将t1℃甲、乙两物质的饱和溶液升温至t2℃,都变成了不饱和溶液,由于溶液中溶质的质量、溶剂的质量都不变,所得甲溶液溶质质量分数=乙溶液溶质质量分数,故正确。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.如图为A、B两种固体的溶解度曲线。
下列说法正确的是:A.t2℃甲物质的溶解度大于t1℃乙物质的溶解度B.t1℃甲、乙两种物质的饱和溶液含溶质质量相等C.t2℃甲物质的不饱和溶液通过降温总能得到甲的饱和溶液D.可通过冷却热饱和溶液的方法得到固体甲【答案】A【解析】A.由溶解度曲线可知,t2℃甲物质的溶解度大于t1℃乙物质的溶解度,故A正确;B.t1℃甲、乙两种物质的溶解度相等,此温度下甲、乙的饱和溶液的质量分数相等,但溶液质量不一定相等,所含溶质也不一定相等,故B错误;C.降温甲的溶解度随温度降低而降低,但因不知道甲在t2℃时溶液的质量分数,则t2℃甲物质的不饱和溶液通过降温不一定得到甲的饱和溶液,故C错误;D.从单一溶质的溶液中获得固体溶质,最好的方法是蒸发结晶,故D错误;答案为A。
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.面:对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。
如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。
2.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
下列说法正确的是A.硝酸钾的溶解度变大B.溶质的质量分数保持不变C.所得溶液是饱和溶液D.所的溶液的质量为120g【答案】C【解析】【分析】【详解】A、硝酸钾的溶解度只受温度一个外界因素的影响,温度不变,溶解度不变,故A不正确;B、硝酸钾部分溶解,溶质的质量分数变大,故B不正确;C、硝酸钾部分溶解,则溶液为饱和溶液,故C正确;D、20g的硝酸钾部分溶解,溶液的质量小于120g,故D不正确。
故选C。
3.如图是两种固体物质的溶解度曲线(不含结晶水,且在同一杯溶液中相互不干扰)。
对此,下列判断正确的是( )A.甲、乙在20℃时,溶液质量分数相等B.30℃时,同一杯甲乙二者饱和溶液,甲溶质质量不一定比乙多C.分别恒温蒸发30℃时两杯溶液,析出的甲比乙多D.30℃时,将60g甲的饱和溶液降温到20℃时,析出5g甲物质【答案】D【解析】A. 甲、乙在20℃时,饱和溶液的溶质质量分数相等,错误;B. 30℃时,同一杯甲乙二者饱和溶液,甲溶质质量一定比乙多,错误;C. 分别恒温蒸发30℃时两杯两种物质的饱和溶液,析出的甲比乙多,错误;D. 30℃时,将60g甲的饱和溶液降温到20℃时,析出5g甲物质,正确。
故选D。
4.如图是三种固体物质a、b、c的溶解度曲线,则以下说法不正确的是A.t1℃时三种物质溶解度的大小为b>a=cB.将t2℃时a的饱和溶液150g降温到t1℃时,析出溶质30gC.要从含有少量c的a溶液中得到较多的a晶体,通常采用降温结晶的方法D.t2℃时,将1ga物质加入到2g水中不断搅拌,能形成3g不饱和深【答案】D【解析】A.由溶解度曲线可知t1℃时三种物质溶解度的大小为b>a=c,故A正确;B.将t2℃时a的溶解度是50g,饱和溶液150g中含溶质50g,当降温到t1℃时,因t1℃时a物质的溶解度为20g,因此会析出溶质30g,故B正确;C.a的溶解度随温度升高增大且影响较大,而c物质的溶解度随温度升高而减小,因此要从含有少量c的a溶液中得到较多的a晶体,通常采用降温结晶的方法,故C正确;D.从图象中可以看出t2℃时,a物质的溶解度为50g,即50g固体a在100g水中溶解达到饱和状态,形成150g溶液,比值为1:2:3,故t2℃时,将1g a物质加入到2g水中不断搅拌,能形成应是3g饱和溶液,故D 不正确;故选D。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.30℃时,取甲、乙、丙中的两种固体各 1g 分别放进盛有 10g 水的两支试管中,充分振 荡后的溶解情况如图。下列说法正确的是
A.甲物质的溶解度比乙物质的溶解度大
B.加入试管 1 的固体是丙
C.向烧杯中加入 NH4NO3 固体后,试管 2 中一定有晶体析出 D.将 30℃时甲、乙、丙三种物质的饱和溶液降温至 20℃,所得溶液中溶质的质量分数的
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案) 一、选择题
1.右图是 NaCl、MgSO4 的溶解度曲线.下列说法正确的是( )
A.只有在 t1℃时,NaCl 和 MgSO4 的溶解度才相等 B.t1℃~t3℃,MgSO4 的溶解度随温度升高而增大 C.在 t2℃时,MgSO4 饱和溶液的溶质质量分数最大 D.把 MgSO4 饱和溶液的温度从 t3℃降至 t2℃时,有晶体析出 【答案】C 【解析】 根据两物质的溶解度曲线不难看出,两物质的溶解度曲线有两个交点,即 t1℃和 t2℃时, 两物质的溶解度相等,故 A 错误;由硫酸镁的溶解度曲线可知,在 t1℃~t3℃时,硫酸镁 的溶解度先随温度的升高而增大,后随温度的升高而减小,故 B 错误;在 t2℃时,由于硫 酸镁的溶解度大于氯化钠的溶解度,所以硫酸镁饱和溶液中溶质的质量分数大,故 C 正 确;由于在 t2﹣t3℃,硫酸镁的溶解度随温度的降低而增大,因此把 MgSO4 饱和溶液的温 度从 t3℃降至 t2℃时,溶液会由饱和溶液变成不饱和溶液,而不会有晶体析出,故 D 错 误。
【解析】A、t2℃时,乙物质的溶解度等于 20g,乙的饱和溶液中溶质的质量分数为 ×100%≈16.7%,错误;B、t1℃时,甲、乙的饱和溶液升温至 t2℃时,甲物质的溶解度增 大,不会析出晶体,乙物质的溶解度减小,会析出固体,错误;C、t2℃时,N 点在溶解度 曲线的下方,所以对应的甲的溶液不饱和溶液,正确;D、甲物质的溶解度随温度的升高 而增大,乙物质的溶解度随温度的升高而减小,所以 t2℃的甲、乙饱和溶液降温至 t1℃ 时,甲物质降温后析出晶体,仍然饱和,质量分数用 t1℃时溶解度计算即可;乙物质降温 后变为不饱和,所以溶质质量分数不变,所以乙物质的质量分数按照 t2℃时乙物质的溶解 度计算,所以只要比较出 t1℃时甲物质溶解度与 t2℃时乙物质的溶解度的大小即可,可知 甲>乙,错误。故选 C。 点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质 的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量 分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸 发结晶的方法达到提纯物质的目的。
s
点睛:一定温度下,饱和溶液溶质的质量分数=
×100%。
100g s
4.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( ) ①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数; ③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。 A.①② B.①③ C.②④ D.③④ 【答案】A 【解析】①称量的氯化钠固体中含有不溶性杂质,导致氯化钠质量偏小,从而导致配制的 氯化钠溶液溶质质量分数偏小,正确;②用量筒量取水时仰视读数,导致读数偏小,而量 筒中水的体积偏大,最终导致配制的氯化钠溶液溶质质量分数偏小,正确;③往烧杯中加 水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,错误;④溶液 具有均一性,将配制好的溶液往试剂瓶中转移时有少量溅出,溶质质量分数不变,错误。 故选 A。
【答案】B 【解析】饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的 饱和溶液,反之为不饱和溶液。判断溶液是否饱和的方法是:向溶液中在加入少量同种溶 质,搅拌,如能继续溶解,原溶液是不饱和溶液;如不能溶解,原溶液为饱和溶液。A. 温 度不变时,向该溶液中加入少量水,溶质的质量分数都变小;B. 温度不变时,向该溶液中 加入少量 KNO3 晶体,晶体不再溶解,可证明原溶液是饱和溶液;C. 取少量该溶液,升温 后无 KNO3 晶体析出,可能是升温时物质的溶解度变大,使溶液由饱和溶液变成不饱和溶 液;D. 取少量该溶液,降温到 10℃时,有 KNO3 晶体析出,是因为降温时,物质的溶解度 变小。选 B
30g ×100%=23.1%,故 C 错误; 130g
D、t3℃时,甲物质的溶解度大于乙物质的溶解度,所以 t2℃时,质量相同的甲、乙饱和溶 液分别升温至 t3℃,为达饱和状态,需加入甲的质量大于乙的质量,故 D 正确。 点睛: 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解 性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的 大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶 的方法达到提纯物质的目的。
7.下表是 NaCl、KNO3 在不同温度时的溶解度:
温度/℃
10
20
30
NaCl 溶解度/g
KNO3
35.8 20.9
36.0 31.6
36.3 45.8
40 36.6 63.9
50 37.0 85.5
60 37.3 110
据此数据,判断下列说法错误的是 ( ) A.KNO3 和 NaCl 的溶解度相等的温度范围在 20℃~30℃ B.在 20℃时,NaCl 和 KNO3 固体各 34g 分别加入两只各盛有 100g 水的烧杯中,均不能形 成饱和溶液 C.在 60℃时,KNO3 的饱和溶液 105g 中含有溶质的质量为 55g D.从含有少量 NaCl 的 KN03 饱和溶液中得到较多的 KNO3 晶体,通常可采用冷却热饱和溶液 的方法 【答案】B 【解析】 分析图表,KNO3 和 NaCl 的溶解度曲线在 20℃~30℃温度范围内相交; B、根据 20℃时 NaCl 和 KNO3 的溶解度及溶解度的定义分析解答; C、依据 60℃时 KNO3 的溶解度是 110g 分析解答; D、根据 NaCl 和 KNO3 的溶解度随温度的变化趋势分析提纯硝酸钾的方法。 解:A、分析图表,KNO3 和 NaCl 的溶解度曲线在 20℃~30℃温度范围内有相同的时候,所 以两种物质的溶解度曲线在此范围内相交,正确; B、在 20℃时,NaCl 的溶解度是 36.0g,KNO3 的溶解度是 31.6g;所以分别将两种物质 34g 加入两只各盛有 100g 水的烧杯中,可形成氯化钠的不饱和溶液,硝酸钾的饱和溶液,故错 误; C、60℃时 KNO3 的溶解度是 110g,相当于 210g 溶液最多溶解硝酸钾 110g;则 105g 饱和溶 液溶液含有硝酸钾 55g,正确; D、根据图表可知:氯化钠的溶解度受温度的变化影响较小,硝酸钾的溶解度随温度的升高 而逐渐增大,且变化较大;所以从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾 晶体,可以采取冷却热饱和溶液的方法,正确。 故选 B。
点睛:重点是抓住溶解度的实质进行分析,结合图表பைடு நூலகம்提供的信息即可解决。
8.甲、乙两种不含结晶水的固体的溶解度曲线如图所示.下列说法中正确的是
A.t3℃时,甲的饱和溶液溶质与溶液的质量比为 1:2 B.t1℃时,甲的溶解度大于乙的溶解度 C.t2℃时,甲、乙溶液的溶质质量分数都为 30% D.t2℃时,质量相同的甲、乙饱和溶液分别升温至 t3℃,为达饱和状态,需加入甲的质量 大于乙的质量 【答案】D 【解析】A、t3℃时,甲物质的溶解度是 50g,所以甲的饱和溶液溶质与溶液的质量比为 1:3,故 A 错误; B、通过分析溶解度曲线可知,t1℃时,甲的溶解度小于乙的溶解度,故 B 错误; C、t2℃时,甲、乙物质的溶解度是 30g,所以甲、乙饱和溶液的溶质质量分数都为
小,丙溶解度增大,溶液中溶质、溶剂的质量不变,溶质的质量分数与降温前相等;饱和
溶解度
溶液中溶质质量分数=
×100%,即溶解度越大质量分数也就越大,20℃时
溶解度 100g
乙的溶解度大于甲的溶解度大于 30℃时丙的溶解度,故所得溶液中溶质的质量分数的大小 关系是乙>甲>丙,故 D 错误;故选 B。
6.面:对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液; 曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如 果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种 方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。
3.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等 B.由 t2℃降温到 t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多 C.t2℃时,将 40g 甲物质加入 50g 水中,充分溶解后溶液的质量为 90g D.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多 【答案】A 【解析】
10.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是
A.t2℃时,乙的饱和溶液中溶质的质量分数为 20% B.把 t1℃时甲、乙的饱和溶液升温至 t2 ℃,均有晶体析出 C.M 点对应的甲溶液,是 t2℃时甲的不饱和溶液 D.把 t2℃时甲、乙的饱和溶液降温至 t1℃,此时溶液中溶质的质量分数相等。 【答案】C
大小关系是乙>甲=丙
【答案】B
【解析】A.比较物质的溶解度大小须确定温度,故 A 错误;B.30℃时三种物质只有丙的
溶解度小于 10g,即 100g 水中溶解溶质的质量小于 10g,则 10g 水中溶解溶质的质量小于
1g,所以 30℃时,取其中两种固体各 1g 分别放进盛有 10g 水的两支试管中,充分振荡后
点睛:证明溶液是否饱和的关键是清楚饱和溶液与不饱和溶液是的区别。
2.配制一定浓度的氯化钠溶液,会导致溶液中溶质质量分数偏大的是 A.用量筒量取水时仰视读数 B.配制溶液的烧杯用少量蒸馏水润洗 C.用托盘天平称量氯化钠时,放砝码的托盘上忘了放纸 D.将水倒入烧杯时,有少量水溅出 【答案】D 【解析】 A. 用量筒量取水时仰视读数,量取实际水的体积偏大,故溶液中溶质的质量分数偏小,错 误; B. 配制溶液的烧杯用少量蒸馏水润洗相当于溶剂水的体积偏大,故溶液中溶质的质量分数 偏小,错误; C. 用托盘天平称量氯化钠时,放砝码的托盘上忘了放纸相当于称量氯化钠的质量偏小,故 配得的溶液中溶质的质量分数偏小,错误; D. 将水倒入烧杯时,有少量水溅出,相当于溶液中水的体积偏小,故溶液中溶质的质量分 数偏大,正确。故选 D。
