胃蛋白酶原检测试剂盒(PGⅠ&PGⅡ)产品介绍
胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(胶乳免疫比浊法)产品技术要求百奥泰康

胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(胶乳免疫比浊法)适用范围:该产品用于体外定量测定人血清或血浆中胃蛋白酶原Ⅰ的浓度。
1.1 产品规格试剂1:60mL×2,试剂2:20mL×2 ;试剂1:60mL×1,试剂2:20mL×1 ;试剂1:45mL×2,试剂2:15mL×2 ;试剂1:45mL×1,试剂2:15mL×1 ;试剂1:30mL×2,试剂2:10mL×2 ;试剂1:30mL×1,试剂2:10mL×1 ;试剂1:60mL×1 ,试剂2:15mL×1 ;试剂1:60mL×2 ,试剂2:12mL×2 ;试剂1:60mL×1,试剂2:12mL×1;试剂1:50mL×1,试剂2:10mL×1 ;试剂1:50mL×2 ,试剂2:10mL×2;试剂1:20mL×1 ,试剂2:4mL×1 ;试剂1:3000mL×1,试剂2:600mL×1 ;试剂1:300mL×1,试剂2:100mL×1 ;试剂1:15mL×1 ,试剂2:5mL×1 ;试剂1:1500mL×1,试剂2:500mL×1 ;20人份(试剂1: 4.8mL×1,试剂2: 1.6mL×1);50人份(试剂1: 12mL×1,试剂2: 4mL×1);100人份(试剂1: 24mL×1,试剂2: 8mL×1);1.2 组成成分1.2.1 试剂组成试剂1:甘氨酸缓冲液 200mmol/L(PH=8.2);试剂2:抗人胃蛋白酶原Ⅰ抗体包被的胶乳悬浊液 <0.5%1.2.2 校准品的组成5个水平的液体校准品,在50mmol/L PH=7.4 的磷酸盐缓冲液中添加胃蛋白酶原Ⅰ/Ⅱ,稳定剂<0.1%;PGⅠ定值范围:(5-15)ng/mL、(20-40)ng/mL、(50-90)ng/mL、(100-150)ng/mL、(160-240)ng/mL;PGⅡ定值范围:(0-10)ng/mL、(10-25)ng/mL、(25-50)ng/mL、(50-75) ng/mL、(75-120) ng/mL。
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
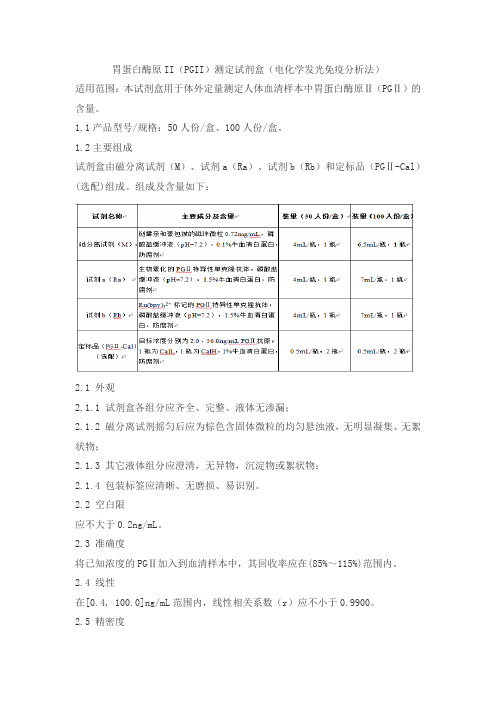
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中胃蛋白酶原Ⅱ(PGⅡ)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(PGⅡ-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.2ng/mL。
2.3 准确度
将已知浓度的PGⅡ加入到血清样本中,其回收率应在(85%~115%)范围内。
2.4 线性
在[0.4, 100.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,测定高低两个水平的的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别检测高低两个水平的的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源至深圳新产业的PGⅡ定标液。
胃蛋白酶原Ⅰ 胃蛋白酶原Ⅱ(PGⅠ PGⅡ)二合一测定试剂盒(荧光免疫层析法)产品技术要求海格德生物

胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(PGⅠ/PGⅡ)二合一测定试剂盒(荧光免疫层析法)
1.性能指标
2.1 外观
2.1.1试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
2.1.2检测卡的外观应符合下列要求:外观平整、色泽均匀、边缘无毛刺,不能有色斑或污渍。
2.2物理检测
试纸条宽度均为4.0±0.5mm。
2.3液体移行速度
应不小于10.0mm/min。
2.4 空白限
PGⅠ空白限应不高于2ng/mL;
PGⅡ空白限应不高于2ng/mL。
2.5准确度
在试剂盒线性区间内,检测两个不同浓度的工作校准品,测定值与标示值的相对偏差应不超过±15%。
2.6线性
PGⅠ:在线性范围(2~150)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1ng/mL,在(10~150)ng/mL区间内测定的线性相对偏差应不超过±15%。
PGⅡ:在线性范围(2~80)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1 ng/mL,在(10~80)ng/mL区间内测定的线性相对偏差应不超过±15%。
2.7 重复性
用同一批号试剂盒测定两个不同浓度的内部参考品,要求变异系数CV≤15%。
2.8批间差
使用3个不同批号的试剂盒测定高、低两个浓度的参考品,要求批间变异系数CV≤15%。
胃蛋白酶原I 胃蛋白酶原II(PGⅠ PGⅡ)检测试剂盒(荧光免疫层析法)产品技术要求宝创

胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(PGⅠ/PGⅡ)检测试剂盒(荧光免疫层析法)性能指标1外观检查试剂盒应外观整洁平整,各组分齐全、完整,包装标签应清晰、准确、牢固。
试纸条表面应平整、无划伤、无开裂、无变形、无异味及污迹,各材料附着牢固、内容齐全。
检测卡外壳应平整,上下盖应均匀合拢,无明显间隙,试纸条在壳内应附着牢固。
质控品复溶前为白色至淡黄色冻干品;复溶后为澄清、透明液体,无沉淀、悬浮物和絮状物。
2物理检查2.1试纸条宽度试纸条宽度应在3.9mm~4.1mm之间。
2.2液体移行速度液体移行速度应≥10mm/min。
3最低检出限3.1PGⅠ≤1ng/ml;3.2PGⅡ≤0.5ng/ml。
4线性范围4.1PGⅠ:在1~200ng/ml范围内,其相关系数r≥0.9900;4.2PGⅡ:在1~100ng/ml浓度范围内,其相关系数(r)≥0.9900。
5准确度5.1PGⅠ:回收率应在85%~115%范围内。
5.2PGⅡ:回收率应在85%~115%范围内。
6精密度6.1批内精密度6.1.1PGⅠ:变异系数CV(%)≤10%;6.1.2PGⅡ:变异系数CV(%)≤10%。
6.2批间精密度6.2.1PGⅠ:变异系数CV(%)≤15%;6.2.2PGⅡ:变异系数CV(%)≤15%。
7特异性7.1PGⅠ:测试高浓度PGⅡ样本,检测结果≤1.0ng/ml;7.2PGⅡ:测试高浓度PGⅠ样本,检测结果≤0.5ng/ml。
8质控品8.1质控品测定值:测定本质控品,测定结果应在该质控品规定的参考范围内。
8.2瓶内均一性:瓶内变异系数(CV)应≤15%。
8.3瓶间均一性:瓶间变异系数(CV)应≤15%。
人胃蛋白酶原A(PG-A)ELISA试剂盒使用步骤

人胃蛋白酶原A(PG—A)ELISA试剂盒使用步骤本试剂盒只能用于科学研究,不得用于医学诊断人胃蛋白酶原A(PGA)ELISA检测试剂盒检测原理试剂盒采用双抗体夹心法酶联免疫吸附试验(ELISA)。
往预先包被人胃蛋白酶原A(PGA)捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并*洗涤。
用底物TMB显色,TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成终的黄色。
颜色的深浅和样品中的人胃蛋白酶原A(PGA)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保管方法1.血清:使用不含热原和内毒素的试管,操作过程中避开任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞快速小心地分别。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保管:假如样本收集后不及时检测,请按一次用量分装,冻存于20℃,避开反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品酶标仪(450nm)高精度加样器及枪头:0.510uL、220uL、20200uL、2001000uL37℃恒温箱操作注意事项试剂盒保管在28℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶*溶解后再使用。
试验中不用的板条应立刻放回自封袋中,密封(低温干燥)保管。
预处理后的样本无需稀释,直接取10μL加样即可。
严格依照说明书中标明的时间、加液量及次序进行温育操作。
全部液体组分使用前充分摇匀。
试剂盒构成名称 96孔配置 48孔配置备注微孔酶标板 12孔×8条 12孔×4条无标准品 0.3mL 0.3mL 无样本稀释液 6mL 3mL 无检测抗体HRP 10mL 5mL 无20×洗涤缓冲液 25mL 15mL 按说明书进行稀释底物A 6mL 3mL 无底物B 6mL 3mL 无停止液 6mL 3mL 无封板膜 2张 2张无说明书 1份 1份无自封袋 1个 1个无注:标准品浓度依次为:160、80、40、20、10、0ng/mL.试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
胃蛋白酶原试剂盒 (PGIPGII)

BSBE
胃癌的筛查方法
以胃镜为基准时胃蛋白酶原法与间接X线法敏感度的比较
临界值(cut off) 基准值(阳性值) PGⅠ≦70同时PGⅠ/Ⅱ≦3.0
胃蛋白酶原法 29/38 76%
间接X线法 15/38 39%
38例用内视镜发现胃癌的病例中,有29例(76%)用胃蛋白酶原法(基 准值)检查呈阳性,而用间接X线法检查有15例(39%)呈阳性。由此可 见胃蛋白酶原法发现胃癌的敏感度是间接X线法的2倍。
PGI/PGII与X线检测比较 -袁媛九五计划结果
分位两组:
•一组为X线钡餐检查, X线钡餐造影2693人,筛出应胃镜检查者2204人,符合胃癌诊断4人, 检出率0.15% 2204人胃镜检查,查出胃癌30例 X线钡餐和胃镜符合率只有12.5% •一组为胃蛋白酶原检查 胃蛋白酶原检查共1745人,使用Cut-off值PGI≤70并PGI/PGII ≤3,筛 出应胃镜检查者399人,符合胃癌诊断17人,检出率4.2% 399人进行胃镜检查,查出胃癌32例 胃蛋白酶原检查和胃镜符合率为53.13%
■ A组 : 健康胃粘膜 / 低危人群 ■ B组 : 应注意消化道溃疡 ■ C组 : 因胃腺萎缩/胃腺瘤/增生性息肉瘤引起的胃癌 /高危人群 ⇒需要定期进行胃镜检查
Байду номын сангаас
胃蛋白酶原I/II 临床应用
幽门螺杆菌根除治疗效果的评价指标 Hp感染与血清PG水平间存在相关性
感染者初期,血清PGI和PGII均高于非感染者(尤其是PGII),PGI/PGII 比值下降 除菌后则显著下降. 除菌组PGI/II比值变化率(治疗前/治疗后)在治疗 结束后即升高,且持续至第12个月;而未除菌组该值在治疗后一个月升 高,此后逐渐下降,至第9个月时已与治疗前无显著差异
胃蛋白酶原(PG)I、II检测试剂盒行业标准

胃蛋白酶原(PG)I/II检测试剂盒(标记免疫分析法)1 范围本标准规定了胃蛋白酶原I/Ⅱ测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输和贮存。
本标准适用于进行胃蛋白酶原I和胃蛋白酶原Ⅱ测定试剂盒(以下简称PGI/Ⅱ试剂盒)。
包括以摩标记、化学发光标记等标记方法免疫分析试剂盒。
本标准不适用于胶体金标记或其他方法标记的半定量测定PG I/Ⅱ试剂(如;试纸条等);用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191—2008包装储运图示标志。
GB/T 29791.2 体外诊断医疗器械制造商提供的信息(标示) 第2部分:专业用体外诊断试剂。
3分类按照标记方法不同可以分为酶标记、(电)化学发光标记、(时间分辨)荧光标记等;根据固相载体不同可以分为微孔板式、管式、磁颗粒、微球珠和塑料珠等;根据操作过程的不同可分为手工操作法和仪器自动操作法。
4要求4.1外观制造商应根据自己产品的包装特点规定适当的外观要求,一般应有试剂盒各组分组成、性状;内外包装、标签清晰等的要求。
4.2 检出限4.2.1PGI试剂盒检测限不高于2.5ng/mL。
4.2.2 PG II试剂盒检测限不高于1.4ng/mL。
4.3线性在制造商给定的线性区间内(PG I下限不高于 3 ng/mL,上限不低于200 ng/mL;PG II下限不高于1.5 ng/mL,上限不低于100 ng/mL),相关系数(r)应不低于0.9900。
4.4准确度准确度应符合如下要求之一:a)在试剂金规定的线性区间内,检测胃蛋白酶原I/Ⅱ国家(或国际)标准品,测定结果的相对偏差应在士15.0%范围内b) 回收率应在85.0%~115.0%范围内。
4.5准确度4.5.1 批内精密度在试剂盒的剂量-反应曲线范围内,设置2个~3个不同浓度的质控品,手工操作试剂盒测定结果的变异系数(CV)应不高于10.0%,全自动操作试剂盒测定结果的变异系数(CV)应不高于8.0%。
胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(磁微粒化学发光法)产品技术要求利德曼生化

胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(磁微粒化学发光法)
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应无沉淀或絮状物;
2.1.4包装标签应清晰,易识别。
2.2线性
在[1.00,500.00]ng/mL的测量范围内,试剂盒的相关系数(r)应≥0.9900。
2.3检出限
应不高于1.00ng/mL。
2.4准确度
回收率应在85.0%-115.0%范围内。
2.5批内精密度
批内变异系数(CV)应不大于8.0%。
2.6批间精密度
批间变异系数(CV)应不大于15.0%。
2.7质控品的赋值有效性
质控品的测量值应在质控范围内。
2.8特异性
测定浓度为200.00ng/mL的胃蛋白酶原Ⅱ样本,测定结果≤1.00ng/mL。
2.9校准品和质控品的批内瓶间差
2.9.1 校准品的批内瓶间差
校准品B~校准品F的批内瓶间差CV≤8.0%。
2.9.2 质控品的批内瓶间差
质控品批内瓶间差CV≤8.0%。
2.10 稳定性
在2℃~8℃条件下储存,有效期为12个月,在有效期满后检测试剂盒的线性、检出限、准确度、批内精密度、质控品的赋值有效性,应符合2.2、2.3、2.4、2.5、2.7的要求。
2.11 溯源性
根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,胃蛋白酶原Ⅰ校准品溯源至企业校准品,企业校准品与已上市产品比对赋值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胃蛋白酶原(PGⅠ&PGⅡ)定量检测
试剂盒(化学发光法)
项目推荐书
胃蛋白酶原检测试剂盒(PGⅠ&PGⅡ)产品介绍我司全国首家自主研发生产的特色产品胃蛋白酶原(PG1/PG2),在个性化治疗领域中起到重点筛查、早期发现的作用,仅需抽取2毫升血液,便能够非介入、精确定量、快速便捷全面地监测胃部疾病,病人痛苦小,费用低,是胃镜、钡餐、碳呼吸等传统胃病检测方法所无法比拟的。
下图是美凯试剂盒、配套仪器:
胃蛋白酶原Ⅰ/Ⅱ定量检测试剂盒(化学发光法):
①最高检出率能达到97%;
②检测方法简单,一台仪器就可以进行检测;
③只需要2毫升血液就可以进行检测;
④低廉的花费就可以判断胃部疾病的进展情况;
⑤可实现对胃癌早发现,早预防,早诊断,早治疗;
⑥非侵入、无痛苦、无不良反应,适用于任何人群。
检验操作流程:。
