离子互换反应2-离子方程式练习
高一化学第二章离子反应方程式知识点及练习题(含答案)
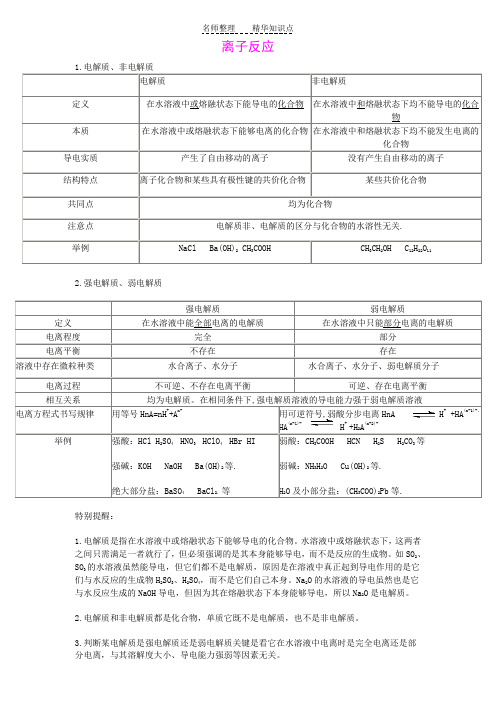
离子反应2.强电解质、弱电解质特别提醒:1.电解质是指在水溶液中或熔融状态下能够导电的化合物。
水溶液中或熔融状态下,这两者之间只需满足一者就行了,但必须强调的是其本身能够导电,而不是反应的生成物。
如SO2、SO3的水溶液虽然能导电,但它们都不是电解质,原因是在溶液中真正起到导电作用的是它们与水反应的生成物H2SO3、H2SO4,而不是它们自己本身。
Na2O的水溶液的导电虽然也是它与水反应生成的NaOH导电,但因为其在熔融状态下本身能够导电,所以Na2O是电解质。
2.电解质和非电解质都是化合物,单质它既不是电解质,也不是非电解质。
3.判断某电解质是强电解质还是弱电解质关键是看它在水溶液中电离时是完全电离还是部分电离,与其溶解度大小、导电能力强弱等因素无关。
离子方程式的书写1.离子反应:指在溶液中(或熔化状态下)有离子参加或离子生成的反应。
2.离子方程式:用实际参加反应的离子符号表示化学反应的式子。
3.离子方程式的书写: (1)书写规则:①单质、氧化物、不溶物、难电离的物质(弱酸、弱碱及水等)不能拆开来写。
如Cl 2、Na 2O等不可以拆开写成Cl -、Na +、O 2-;BaSO 4不可以拆开写成Ba 2+、SO 42-形式。
②易溶于水,易电离的物质的离子符号的改写同电离方程式中的离子形式。
如NaHCO 3改写Na +、HCO 3-;NaHSO 4应改写Na +,H +,SO 42-③微溶物,若出现在反应物中一般改写成离子符号(悬浊液除外);若出现在生成物中一般不改写。
④固体与固体物质反应不写离子方程式。
如实验室制取NH 3的离子方程式为: 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O⑤浓H 2SO 4、浓H 3PO 4一般不拆开写成离子形式;HCl 、HNO 3无论浓稀,均应改写成离子符号。
如Cu 片与浓H 2SO 4反应的离子方程式为:Cu+2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O(2)书写步骤(以CuSO 4溶液与BaCl 2 溶液反应为) ①写出反应的化学方程式:CuSO 4+BaCl 2==CuCl 2+BaSO 4↓ ②把易溶于水、易电离的物质拆开写成离子形式,难溶的物质或难电离的物质以及气体等仍用化学式来表示。
中学化学 离子反应 练习题(含答案)

1.了解氧化还原反应的本质,了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
2.能正确书写化学方程式和离子方程式,并能进行有关计算。
3.了解离子反应的概念、离子反应发生的条件。
掌握常见离子的检验方法。
1.(2019·全国卷Ⅲ)离子交换法净化水过程如图所示。
下列说法中错误的是()A.经过阳离子交换树脂后,水中阳离子的总数不变B.水中的NO-3、SO2-4、Cl-通过阴离子树脂后被除去C.通过净化处理后,水的导电性降低D.阴离子树脂填充段存在反应H++OH-===H2O2.(2019·全国卷Ⅱ,节选)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。
回答下列问题:(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。
灼烧立德粉样品时,钡的焰色为________(填标号)。
A.黄色B.红色C.紫色D.绿色(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为_________________________________________。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为___________________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为_____________________________________________________________________________。
3.(2018·全国卷Ⅰ,节选)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。
该反应的氧化产物是一种气体,其分子式为________。
【人教版】2018-2019高中化学必修一第二章第二节离子反应第二课时离子反应及其发生的条件同步练习含答案

第二节离子反应第二课时离子反应及其发生的条件[A篇知识对点训练]知识点1 离子反应1.下列物质混合发生化学反应,且属于离子反应的是 ( )A.NaOH溶液和K2SO4溶液混合B.锌片投入稀硫酸中C.KClO3和MnO2固体混合物加热制O2D.H2和O2反应生成水答案 B解析A项不具备复分解反应发生的条件;B项离子反应是Zn+2H+===Zn2++H2↑;C项不是在溶液中进行的反应;D项不是离子反应。
2.关于离子方程式Cu2++2OH-===Cu(OH)2↓的说法正确的是( )A.可表示CuSO 4溶液和Ba(OH)2溶液的反应B.可表示某一个具体的反应,也可以表示一类反应C.离子方程式中的OH-可代表弱碱或强碱D.该反应可看到Cu(OH)2白色沉淀答案 B解析A项中还有SO2-4+Ba2+===BaSO4↓;C项离子方程式中的OH-只能代表强碱;D项Cu(OH)2为蓝色沉淀。
3.下列化学反应的离子方程式错误的是( )A.BaCl2溶液与K2SO4溶液的反应:Ba2++SO2-4===BaSO4↓B.NaOH溶液与硝酸的反应:OH-+H+===H2OC.Na2CO3溶液与硫酸的反应:CO2-3+2H+===CO2↑+H2OD.碳酸钙与盐酸的反应:CO2-3+2H+===CO2↑+H2O答案 D解析D项中因碳酸钙为不溶于水的固体,应写化学式,正确的离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O。
4.不能用离子方程式CO2-3+2H+===CO2↑+H2O表示的反应是 ( )A.Na2CO3+2HCl===CO2↑+H2O+2NaClB.NaHCO3+HCl===NaCl+CO2↑+H2OC.K2CO3+H2SO4===K2SO4+CO2↑+H2OD.K2CO3+2HNO3===2KNO3+CO2↑+H2O答案 B解析NaHCO3在水溶液中只能电离出Na+和HCO-3,而不是CO2-3,所以离子方程式为HCO-3+H+===H2O+CO2↑。
离子反应方程式练习题

离子反应方程式练习题离子反应方程式是化学反应中描述离子间相互作用的方程式。
它是化学反应的核心,有助于我们理解反应物与生成物之间的离子交换过程。
为了巩固对离子反应方程式的理解,以下是一些练习题,帮助你熟悉离子反应方程式的写法。
题目一:用化学符号和离子的方式写出以下反应方程式,并指出其中的氧化剂和还原剂:1. 铜箔与盐酸反应。
2. 铁粉与硫酸反应。
3. 锌与硝酸反应。
4. 氯化钠与硝酸银反应。
思考提示:1. 了解盐酸的化学式和铜的化学式,了解氧化剂和还原剂的特征。
2. 大多数金属与酸反应会产生什么产物?3. 了解硝酸和硝酸银的化学式,了解氧化剂和还原剂的特征。
参考答案:1. Cu + 2HCl → CuCl2 + H2;盐酸是氧化剂,铜是还原剂。
2. Fe + H2SO4 → FeSO4 + H2;硫酸是氧化剂,铁是还原剂。
3. Zn + 2HNO3 → Zn(NO3)2 + H2;硝酸是氧化剂,锌是还原剂。
4. NaCl + AgNO3 → AgCl + NaNO3;硝酸银是氧化剂,氯化钠是还原剂。
题目二:根据以下方程式写出离子方程式,并指出反应中形成了哪些沉淀物:1. 钠碳酸与铜(II)硫酸反应。
2. 钙氢氧化物与硫酸反应。
3. 铵氯与银亚胺反应。
4. 氯化锌与硫酸铝反应。
思考提示:1. 化合物的化学式可以通过元素的原子数和价态来确定。
2. 在有些反应中,不溶于溶液中的物质会形成沉淀物。
参考答案:1. Na2CO3 + CuSO4 → CuCO3 + Na2SO4;沉淀物为碳酸铜。
2. Ca(OH)2 + H2SO4 → CaSO4 + 2H2O;沉淀物为硫酸钙。
3. NH4Cl + AgNO2 → AgCl + NH4NO2;沉淀物为氯化银。
4. ZnCl2 + Al2(SO4)3 → AlCl3 + ZnSO4;没有沉淀物生成。
题目三:根据以下方程式写出离子方程式,并指出反应中发生了哪些氧化还原反应:1. 硫酸与氢氧化钠反应。
离子反应方程式练习(经典)

Cu + 2OH = 向CuSO4溶液中 蓝色沉淀 Cu(OH) ) 加入NaOH溶液 (1)生成难溶物(↓) 加入 溶液 )生成难溶物( 2↓ 向盛有稀NaOH溶 向盛有稀 溶 复分解型离 溶液红色 液和几滴酚酞溶 (2)生成难电离物H+ =2O等) )生成难电离物(H H2O 等 OH- + ( 子反应发生 逐渐褪去 液的试管中逐滴 滴加稀盐酸 的条件 (3)生成挥发性物质(↑) )生成挥发性物质( ) 向Na2CO3溶液中 加入足量盐酸 有无色气 泡冒出 CO32- + 2H+= H2O + CO2↑
4. 碳酸氢钠溶液与盐酸反应: 来自酸氢钠溶液与盐酸反应:CO32- + 2H+ =CO2↑+H2O
5. 碳酸钙溶于醋酸: 碳酸钙溶于醋酸:
CaCO3+2H + =Ca+H2O+CO2↑
6. 硫酸铁溶液跟氢氧化钠溶液混和: 硫酸铁溶液跟氢氧化钠溶液混和:
-=2Fe(OH) ↓+3SO 2Fe2(SO4)3+6OH 4 3
练习一、判断下列离子方程式书写是否正确, 若不正确,请改正。 1 碳酸钙和盐酸反应: 碳酸钙和盐酸反应: CO32- +2H+=CO2↑+H2O 2 稀硫酸与氢氧化钡溶液反应: 稀硫酸与氢氧化钡溶液反应: Ba2+ + OH+ H+ + SO42- = BaSO4↓+ H2O 3 铁和稀硫酸反应: 铁和稀硫酸反应: 2Fe+6H + =2Fe 3+ +3H2↑
2、氨水作为反应物写成NH3·H2O;作 、氨水作为反应物写成 ; 为生成物若有加热条件或浓度很大时 可写成NH 标 可写成 3(标↑号 )
离子反应习题及答案

离子反应习题及答案离子反应习题及答案离子反应是化学中重要的概念之一,它描述了离子之间的相互作用和转化过程。
在学习离子反应时,习题是非常重要的辅助工具,通过解答习题可以加深对离子反应的理解和应用。
本文将提供一些常见的离子反应习题及其答案,希望对读者有所帮助。
1. 铁离子与氯离子反应生成什么产物?答案:铁离子与氯离子反应生成氯化铁。
反应方程式为:Fe^2+ + 2Cl^- → FeCl22. 钙离子与氧离子反应生成什么产物?答案:钙离子与氧离子反应生成氧化钙。
反应方程式为:Ca^2+ + O^2- → CaO3. 铜离子与硫离子反应生成什么产物?答案:铜离子与硫离子反应生成硫化铜。
反应方程式为:Cu^2+ + S^2- → CuS4. 铝离子与氟离子反应生成什么产物?答案:铝离子与氟离子反应生成氟化铝。
反应方程式为:Al^3+ + 3F^- → AlF35. 银离子与氯离子反应生成什么产物?答案:银离子与氯离子反应生成氯化银。
反应方程式为:Ag^+ + Cl^- → AgCl6. 铜离子与铁离子反应生成什么产物?答案:铜离子与铁离子反应生成铁离子和铜固体。
反应方程式为:Cu^2+ + Fe^2+ → Cu + Fe^2+7. 铵离子与氯离子反应生成什么产物?答案:铵离子与氯离子反应生成氯化铵。
反应方程式为:NH4^+ + Cl^- → NH4Cl8. 钠离子与氯离子反应生成什么产物?答案:钠离子与氯离子反应生成氯化钠。
反应方程式为:Na^+ + Cl^- → NaCl9. 铜离子与银离子反应生成什么产物?答案:铜离子与银离子反应生成银固体和铜离子。
反应方程式为:Cu^2+ + 2Ag^+ → Cu + 2Ag^+10. 钠离子与氧离子反应生成什么产物?答案:钠离子与氧离子反应生成氧化钠。
反应方程式为:2Na^+ + O^2- → Na2O以上是一些常见的离子反应习题及其答案。
通过解答这些习题,可以加深对离子反应的理解,并且掌握离子之间的相互作用和转化过程。
离子反应方程式
1 离子反应一、离子反应有自由移动的离子参加或有自由移动的离子生成的化学反应,都属于离子反应(多数在水溶液中进行,少数在熔融状态下进行)二、离子反应的本质反应物中离子浓度的减少或生成物中离子浓度的增加三、离子反应的类型1、离子互换型(离子交换型复分解型)如:CuSO4 +BaCl2 ===== BaSO4↓+CuCl2 Ba2++SO42-===== BaSO4↓2、氧化还原型(包括在溶液中的置换反应)如:Zn +Cu2+===== Zn2++Cu 2I-+Cl2 ===== 2Cl-+I23、其它离子反应如:络合、水解、双水解等AgOH +2NH3 ===== 〔Ag(NH3 )2〕++OH-(银氨溶液络合)Al3++3H2O ===== Al(OH)3 +H+(水解)2Al3+ +3S2—+6H2O ===== 3H2S↑+3Al(OH)3 ↓(双水解)四、离子反应发生的条件1、有难溶物(沉淀)的生成或难溶物(沉淀)的溶解(要求熟记酸、碱、盐溶解性表)如:Ca2++CO32+===== CaCO3 ↓CaCO3 +CO2 +H2O===== Ca2++2HCO3-2、有难电离的物质(弱电解质如:弱酸、弱碱、水等)生成如:NH4++OH-===== NH3•H2O CH3COO-+H+===== CH3COOH3、有气体生成或气体被吸收如:CO32-+2H+===== H2O +CO2↑NH3 +H+===== NH4+4、发生氧化还原反应如:2Fe3++Cu ===== 2Fe2++Cu2+5、发生络合、水解、或双水解反应如:Fe3++3SCN-===== Fe(SCN)3 S2-+H2O ===== HS-+OH-2Al3+ +3CO32—+3H2O===== 3CO2↑+3Al(OH)3↓(双水解)五、离子方程式1、概念用实际参加反应的离子符号或实际生成的离子的符号表示化学反应的式子叫离子方程式。
离子方程式练习题
离子方程式练习题1. 写出下列化学反应的离子方程式:- (a) 碳酸氢钠与盐酸反应- (b) 氢氧化钠与硫酸反应- (c) 氯化铁与氢氧化钠溶液反应- (d) 硫酸铜与氢氧化钡溶液反应2. 完成以下离子反应的平衡方程式:- (a) 氢氧化钾与硫酸铜溶液反应- (b) 氯化铵与氢氧化钠溶液反应- (c) 碳酸钠与盐酸反应- (d) 硫酸与氢氧化钠溶液反应3. 将下列化学方程式转换为离子方程式:- (a) Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O- (b) Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O- (c) Fe2O3 + 6HCl → 2FeCl3 + 3H2O- (d) Mg(OH)2 + 2HCl → MgCl2 + 2H2O4. 根据题目所给的反应物和生成物,写出离子方程式: - (a) 硫酸铵与氢氧化钠溶液反应- (b) 硫酸与碳酸钠溶液反应- (c) 硫酸铜溶液与氢氧化钠溶液反应- (d) 氯化铁溶液与氢氧化钾溶液反应5. 写出下列反应的离子方程式,并标明沉淀符号:- (a) 氯化钙与碳酸钠溶液反应- (b) 硫酸镁与氢氧化钠溶液反应- (d) 硫酸铁与氢氧化钾溶液反应6. 完成下列离子方程式的书写:- (a) 硫酸氢钠与氢氧化钾溶液反应- (b) 氯化铵与氢氧化钙溶液反应- (c) 硫酸亚铁与氢氧化钠溶液反应- (d) 氯化铜与氢氧化钠溶液反应7. 根据题目所给的反应物和生成物,写出离子方程式,并标明气体符号:- (a) 碳酸氢铵与盐酸反应- (b) 碳酸钙与盐酸反应- (c) 碳酸氢钾与硫酸反应- (d) 碳酸钠与硫酸反应8. 写出下列反应的离子方程式,并标明氧化还原反应的电子转移: - (a) 铁与稀硫酸反应- (b) 铜与稀硝酸反应- (c) 锌与稀硫酸反应- (d) 铁与稀硝酸反应9. 完成下列离子方程式的书写,并标明氧化还原反应的电子转移: - (a) 铜与稀硫酸反应- (b) 铁与稀盐酸反应- (c) 锌与稀硝酸反应- (d) 铜与稀硝酸反应10. 根据题目所给的反应物和生成物,写出离子方程式,并标明沉淀符号和气体符号:- (a) 硫酸铝与氢氧化钠溶液反应- (c) 碳酸氢铵与氢氧化钠溶液反应 - (d) 硫酸镁与氢氧化钠溶液反应。
离子反应离子方程式整理
离子反应离子方程式整理1.有水参加的离子反应⑴Na2O2投入水中Na2O2+H2O=4Na++4OH-+O2↑⑵Na投入水中2Na+2H2O=2Na++2OH-+H2↑⑶氯气通入水中Cl2+H2O=(可逆)H++Cl-+HClO⑷FeCl3溶液滴入沸水中Fe3++3H2O=(△可逆)Fe(OH)3(胶体)+3H+⑸AlCl3溶液与NaAlO2、NaCO3、NaHCO3的双水解反应①Al3++3AlO2-+6H2O=4Al(OH)3↓②2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑③Al3++3HCO32-=Al(OH)3↓+3CO2↑⑹氯碱工业2Cl-+2H2O=(通电)Cl2↑+H2↑+2OH-2、有碱参加的离子反应⑴稀NH4Cl溶液中滴入NaOH溶液①混合NH4++OH-=NH3·H2O②共热NH4++OH-=(△)NH3↑+H2O⑵Al投入NaOH溶液中2Al+2OH-+6H2O=2AlO2-+3H2↑⑶用NaOH溶液吸收氯气Cl2+2OH-=Cl-+ClO-+H2O⑷AlCl3溶液滴入NaOH溶液中①少量Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+H2O②后续3AlO2-+Al3++6H2O=4Al(OH)3↓⑸澄清石灰水中通入CO2①少量Ca++2OH-+CO2=CaCO3↓+H2O②过量OH-+CO2=HCO3-⑹NaHSO4溶液中滴入Ba(OH)2溶液2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O⑺向Ca(HCO3)2溶液中滴入NaOH溶液①少量HCO3-+Ca2++OH-=CaCO3↓+H2O②过量2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O⑻向NH4HCO3溶液中滴入过量NaOH溶液NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O3.有酸参加的离子反应⑴MnO2与浓盐酸共热制氯气MnO2+2Cl-+4H+=(△)Mn2++Cl2↑+2H2O⑵稀硝酸与Fe反应①少量Fe+4H++NO3-=Fe3++NO↑+2H2O②过量3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O⑶H2S气体通入FeCl3溶液中2Fe3++H2S=2Fe2++S↓+H2O⑷Fe2O3与HI反应+I2+3H2O⑸Ca(ClO)2溶液中通入CO2、SO2 ①少量-Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO过量ClO-+CO2+H2O=2HClO+HCO3-②Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+⑹饱和NaCO3溶液中通入CO22Na++CO32-+CO2+H2O=2NaHCO3⑺NaAlO2溶液中通入CO2①少量2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-②过量AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-4.其它盐溶液的离子反应⑴FeBr2溶液中通入Cl2①少量②过量2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-⑵FeCl3溶液腐蚀铜2Fe3++Cu=2Fe2++Cu2+⑶NaAlO溶液与NaHCO3溶液混合AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-。
最新化学离子反应练习全集
最新化学离子反应练习全集一、高中化学离子反应1.下列各反应对应的离子方程式正确的是()A.向Ca(OH)2溶液中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O B.向100mL0.12mol·L-1的Ba(OH)2溶液中通入0.02molCO2:Ba2++3OH-+2CO2=HCO3-+BaCO3↓+H2OC.硫酸氢钠与氢氧化钡溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2OD.向含0.1molNaOH和0.1molNa2CO3的溶液中加入1L0.4mol·L-1稀盐酸:OH-+CO32-+3H+=CO2↑+2H2O【答案】D【解析】【分析】【详解】A.根据定少为一的原则,将NaHCO3的系数定为1,则向Ca(OH)2溶液中加入少量的NaHCO3溶液,离子反应方程式应为:Ca2++OH-+HCO3-=CaCO3↓+H2O,A选项错误;B.先算出Ba(OH)2的物质的量为0.012mol,而CO2的物质的量为0.02mol,二者的物质的量为3:5,按照3:5的化学计量比来写方程式:3Ba2++6OH-+5CO2=4HCO3-+BaCO3↓+H2O,B 选项错误;C.硫酸氢钠与氢氧化钡溶液反应后pH恰好为7,因此二者按2:1的系数来反应:2H++SO42-+Ba2++OH-=BaSO4↓+2H2O,C选项错误;D.首先三者的物质的量之比为1:1:4,稀盐酸先和烧碱中和,过量的稀盐酸再和纯碱反应,据此离子反应方程式为:OH-+CO32-+3H+=CO2↑+2H2O,D选项正确;答案选D。
【点睛】本题考查了离子方程式的书写,侧重考查反应物用量不同发生反应不同的离子反应,题目难度较大,注意反应的顺序,尤其是某一种反应物过量时的后续反应。
2.下列离子方程式书写及评价合理的是( )C将少量的34Fe O溶解在过量的稀3HNO中23342Fe O8H Fe2Fe4H O++++=++正确,34Fe O化学式可改写为23FeO Fe O⋅,2Fe+与3Fe+,物质的量之比为1:2D将2FeCl溶液加入到足量的NaClO溶液中222Fe2C1O2H O Fe(OH)2HC1O+-++=↓+错误,2Fe+与C1O-发生氧化还原反应:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A.Mg(HCO3)2溶液中加入足量NaOH溶液,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3−+4OH−═Mg(OH)2↓+2CO32−+2H2O,故A错误;B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO2−+5H+═Al3++Al(OH)3↓+H2O,故B正确;C.Fe3O4与过量的稀HNO3反应,生成的亚铁离子被稀硝酸氧化成了铁离子,正确的离子方程式为:3Fe3O4+NO3−+28H+═9Fe3++14H2O+NO↑,故C错误;D.NaClO溶液与FeCl2溶液混合,二者发生氧化还原反应,正确的离子反应为:2Fe2++5ClO−+5H2O═2Fe(OH)3↓+Cl−+4HClO,故D错误;答案选B。
