实验一绝对乙醇的制备
药物合成要点
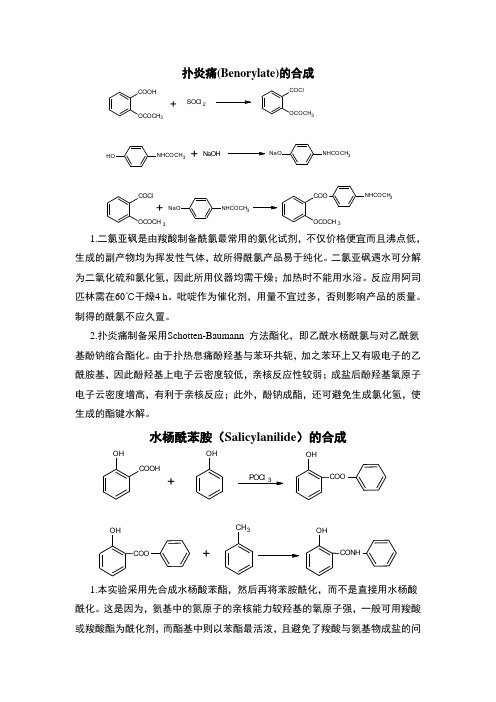
扑炎痛(Benorylate)的合成COOHOCOCH 3+SOCl 2CO ClOCOCH 3NHCO CH 3OH +NaOH NHCO CH 3NaOCOCl OCOCH 3+NHCO CH 3NaOOCOCH 3COO NHCO CH 31.二氯亚砜是由羧酸制备酰氯最常用的氯化试剂,不仅价格便宜而且沸点低,生成的副产物均为挥发性气体,故所得酰氯产品易于纯化。
二氯亚砜遇水可分解为二氧化硫和氯化氢,因此所用仪器均需干燥;加热时不能用水浴。
反应用阿司匹林需在60℃干燥4 h 。
吡啶作为催化剂,用量不宜过多,否则影响产品的质量。
制得的酰氯不应久置。
2.扑炎痛制备采用Schotten-Baumann 方法酯化,即乙酰水杨酰氯与对乙酰氨基酚钠缩合酯化。
由于扑热息痛酚羟基与苯环共轭,加之苯环上又有吸电子的乙酰胺基,因此酚羟基上电子云密度较低,亲核反应性较弱;成盐后酚羟基氧原子电子云密度增高,有利于亲核反应;此外,酚钠成酯,还可避免生成氯化氢,使生成的酯键水解。
水杨酰苯胺(Salicylanilide )的合成OHCOOHOH+OHCOOPOCl 3OHCOOCH 3+OHCONH1.本实验采用先合成水杨酸苯酯,然后再将苯胺酰化,而不是直接用水杨酸酰化。
这是因为,氨基中的氮原子的亲核能力较羟基的氧原子强,一般可用羧酸或羧酸酯为酰化剂,而酯基中则以苯酯最活泼,且避免了羧酸与氨基物成盐的问题,因此羧酸酯类作为酰化剂常被应用。
2.产品精制需加少量EDTA ,因为酚羟基易受金属离子催化氧化,使产品带有颜色。
加入EDTA 的目的是络合掉金属离子,防止产品氧化着色。
巴比妥(Barbital )的合成CH 2COOCH 2CH 3COOCH 2CH 3+CH 3CH 232CCOOCH 2CH 3COOCH 2CH 3H 3CH 2CH 3CH 2C 32H 2NCONH 2CCOOCH 2CH 3COOCH 2CH 3H 3CH 2CH 3CH 2CN HNHOONaC H 3CH 3NHOH 3H 31.本实验中所用仪器均需彻底干燥。
乙醇

乙醇一、简介(1)按生产使用的原料可分为淀粉质原料发酵酒精(一般有薯类、谷类和野生植物等含淀粉质的原料,在微生物作用下将淀粉水解为葡萄糖,再进一步由酵母发酵生成酒精);糖蜜原料发酵酒精(直接利用糖蜜中的糖分,经过稀释杀菌并添加部分营养盐,借酵母的作用发酵生成酒精);和亚硫酸盐纸浆废液发酵生产酒精(利用造纸废液中含有的六碳糖,在酵母作用下发酵成酒精,主要产品为工业用酒精。
也有用木屑稀酸水解制作的酒精)。
(2)按生产的方法来分,可分为发酵法酒精和合成法酒精两大类。
(3)按产品质量或性质来分,又分为高纯度酒精、无水酒精、普通酒精和变性酒精。
(4)按产品系列(BG384-81)分为优级、一级、二级、三级和四级。
其中一、二级相当于高纯度酒精及普通精馏酒精。
三级相当于医药酒精,四级相当于工业酒精。
新增二级标准是为了满足不同用户和生产的需要,减少生产与使用上的浪费,促进提高产品质量而制订的。
二、名称1、化学名称乙醇2、商品名称酒精、酒精;乙醇(发醇法);无水酒精;无水乙醇;无水乙醇(药用);绝对酒精;95%乙醇;酒精95%;食用酒精;食用乙醇;变性乙醇;调香级食用酒精三、系统编号CAS编号:64-17-5EINECS号:200-578-6InChI编码:InChI=1/C2H6O/c1-2-3/h3H,2H2,1H3危规编号:32061危险品运输编号:UN 1170/1986/1987四、物质颜色性状1、颜色在常温、常压下,易燃无色透明液体,2、性状3、相态液体4、臭味性有特殊香味,略带刺激性,5、挥发性易挥发五、化学结构1、化学组成乙醇分子是由是由C、H、O 三种原子构成(乙基和羟基两部分组成),可以看成是乙烷分子中的一个氢原子被羟基取代的产物,也可以看成是水分子中的一个氢原子被乙基取代的产物。
乙醇分子中的羰键(碳氧键)和羟键(氢氧键)比较容易断裂。
C、O原子均以sp3杂化轨道成键、极性分子。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
浙江省富阳中学2024-2025学年高三上学期高考化学模拟试题(含答案)

富阳中学2024-2025学年高三上学期高考化学模拟试题注意事项:1.答题前,考生务必将自己的姓名、班级、学校在答题卡上填写清楚。
2.每小题选出答案后,用2B 铅笔把答题卡上对应的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
在试卷上作答无效。
3.考试结束后,请将答题卡、试卷、草稿纸交回。
满分100分,考试用时75分钟。
相对原子质量: H-1 B-11 C-12 N-14 O-16 Mg-24Al-27 S-32 Fe-56 Cu-64 Sn-119 W-184一、单项选择题(共13个小题,每小题3分,共39分,每小题只有一个选项符合题目要求)1.化学与社会、生活密切相关。
对下列现象或事实的描述正确的是A.游泳场馆常用硫酸铜做泳池消毒剂,因为铜盐水解生成的胶状物质可吸附细菌B.在聚氯乙烯高分子链中加入邻苯二甲酸二丁酯是为了起润滑作用,利于高分子链运动C.铜的合金在生活中运用广泛,其中白铜是铜镍合金,黄铜是铜锌合金,紫铜是铜铬合金,青铜是铜锡合金D.“冬日灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“薪柴之灰”,与铵态氮肥一同使用效果更佳2.下列说法正确的是A.顺-2-丁烯与反-2-丁烯互为同素异形体B.基态Fe 3+的核外电子有26种不同的运动状态C.O 2、O 3均有非极性共价键D.富勒烯与碳纳米管组成元素相同3.下列化学用语或图示表示正确的是A.氮原子的电子排布图:B.Si O 2的电子式:C.4-甲氧基苯胺:D.中子数为10的氧原子:818O4.下列过程对应的反应方程式正确的是A. 将SnC l 4放入水中:SnC l 4+(x+2)H 2O Sn O 2 · x H 2O ↓+4HClB. 将过量S O 2通入次氯酸钙溶液:Ca 2++SO 2+H 2O +3ClO −CaS O 4↓+Cl −+2HClOC. 乙醚的制备:2C 2H 5OH 140℃(C 2H 5)2O +H 2OD. 制备84消毒液:Cl 2+2NaOH ≜NaCl +NaClO +H 2O5.如右图所示的化合物是制备某些食品添加剂的中间体,其中X 、Y 、Z 、P 、Q 、R 、M 为原子序数依次增大的短周期元素,下列说法正确的是A.简单氢化物的沸点:Z <QB.M 的最高价含氧酸与Y 反应体现氧化性和酸性C.Q的第一电离能是同周期元素中最大的D.P分别与X、Q形成的化合物空间结构一定相同6.处理废弃的锂电池正极材料Li CoO2以回收Li、Co等金属的部分工艺路线如下,已知气体1无毒无害,烧渣中Co仅有一种价态,下列说法错误的是A.500℃焙烧生成的烧渣成分有LiCl、SiO2、CoCl2B.滤饼2转化为Co3O4的反应中氧化剂∶还原剂=1∶6C.若500℃焙烧后直接水浸可能会产生大量烟雾,腐蚀设备D.流程中仅有滤液3和气体1可直接在该工艺路线中再利用7.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是选项陈述Ⅰ陈述ⅡA用pH计分别测量等浓度的HCl、HBr、HI溶液,pH值:HCl<HBr<HI非金属性:Cl>Br>IB取F e3O4加稀硫酸至全部溶解,滴加少量KMn O4后紫色褪去F e3O4中含有Fe(Ⅱ)C向熔融氯化钾中加入钠单质,有钾单质蒸汽放出,同时生成氯化钠高温下活泼性Na>KD将打磨后的铝箔直接在酒精灯上加热,铝箔融化滴落熔点:A l2O3<Al8.一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。
用乙醇做实验报告(3篇)

第1篇实验名称:乙醇的性质及制备一、实验目的1. 了解乙醇的性质及制备方法。
2. 掌握乙醇的实验室制备方法。
3. 熟悉实验操作技能,提高实验操作能力。
二、实验原理乙醇(C2H5OH)是一种无色、透明、易挥发的有机溶剂,具有刺激性气味。
乙醇的制备方法有直接法和间接法。
直接法是通过乙烯与水加成反应制备,间接法是通过乙醛与水加成反应制备。
三、实验仪器与试剂1. 仪器:蒸馏烧瓶、冷凝管、锥形瓶、酒精灯、烧杯、玻璃棒、量筒、滴定管等。
2. 试剂:乙醇、乙烯、乙醛、浓硫酸、水、NaOH溶液、NaCl溶液、溴水等。
四、实验步骤1. 乙醇的制备(间接法)(1)将乙醛与NaOH溶液混合,加入蒸馏烧瓶中。
(2)将混合液加热至沸腾,使乙醛与水发生加成反应,生成乙醇。
(3)将反应后的混合液冷却,过滤掉固体杂质。
(4)将滤液加入锥形瓶中,加入适量的NaCl溶液,使乙醇盐析。
(5)用玻璃棒搅拌,待乙醇结晶后,过滤得到乙醇。
2. 乙醇的性质实验(1)乙醇的燃烧实验将乙醇滴入酒精灯火焰中,观察火焰颜色和燃烧现象。
(2)乙醇与水混合实验将乙醇与水按一定比例混合,观察混合液的外观和气味。
(3)乙醇与NaOH溶液反应实验将乙醇与NaOH溶液混合,观察反应现象。
(4)乙醇与溴水反应实验将乙醇与溴水混合,观察反应现象。
五、实验结果与分析1. 乙醇的制备通过实验,成功制备出乙醇,其纯度较高。
2. 乙醇的性质(1)乙醇燃烧时,火焰呈蓝色,燃烧充分。
(2)乙醇与水混合后,无色透明,具有刺激性气味。
(3)乙醇与NaOH溶液混合,无明显现象。
(4)乙醇与溴水混合,溶液颜色变深。
六、实验结论1. 成功制备出乙醇,纯度较高。
2. 通过实验,掌握了乙醇的性质及制备方法。
3. 提高了实验操作技能,为今后实验奠定了基础。
七、实验注意事项1. 实验过程中,注意安全,防止火灾和爆炸。
2. 操作时要小心谨慎,避免溶液溅出。
3. 实验结束后,及时清洗实验器材,保持实验室卫生。
实验1 固体酒精的制备

实验1 固体酒精的制备酒精的学名是乙醇,燃烧时无烟无味,安全卫生,但由于是液体,较易挥发携带不便,如制成固体酒精,降低了挥发性且易于包装和携带,使用更加安全。
一、实验目的掌握固体酒精的配制原理和实验方法。
二、实验原理硬脂酸钠受热软化,冷却后又重新固化,将液态酒精与硬脂酸钠搅拌共热,冷却后硬脂酸钠将酒精包含其中,成为固状产品。
方法二中加入虫胶,石腊作为粘结剂,可得到质地更加结实的固体酒精。
同时可以助燃,使其燃烧得更加持久,并释放更多的热量。
三、实验仪器与试剂1、实验仪器电炉子(0—1000W可调),水浴锅(500ml),球形冷凝管,250ml三口烧瓶(24),温度计(1-100度),秒表1块,燃烧盆,烧杯(100ml13个),模具(贺柱形,V—200ml)2.实验试剂工业酒精(酒精含量>等于95%硬脂酸钠AR虫胶片(工业级)固体石蜡AR氢氧化钠AR沸石四、实验步骤方法一:1,称取0.8g(0.02mol)氢氧化钠,迅速研碎成小颗粒,加入250ml的烧瓶中,再加入1g虫胶片,80ml酒精和数粒小沸石,装置回流冷凝管,水浴加热回流至回体全部溶解为止,2,在100ml烧杯中加入5g(约0.02mol)硬脂酸和20ml酒精,在水浴上温热硬脂酸全部溶解,然后从冷凝管上端将烧杯中的物料加入含有氢氧化钠,虫胶片和酒精的三口烧瓶中,摇动使其混合均匀,回流不同时间后一去水浴,反应混合物自然冷却,待降温到50度时倒入模具中,加盖以避免酒精挥发,冷至室温后完全固化,从模具中取出即得到成品,3,切不同回流时间的产品进行燃烧实验,并进行比较。
方法二:1,向250ml三口烧瓶中加入9g(约0。
035mol)硬脂酸,2g石蜡,50ml酒精和数粒小沸石,装置回流冷凝管,摇匀,在水浴上加热约60度并保温至固体全部溶解为止。
2,将1.5g (约0。
037mol)氢氧化钠和13.5g 水加入100gl烧杯中,搅拌溶解后再加入25ml酒精,搅匀。
无水乙醇理化性质

名称中文名称:无水乙醇中文别名:无水酒精,绝对酒精英文别名:DehydratedAlcohol,Ethanoldenatured,Ethanol,Spiritofwine,Alcoholanhydrous,Ethylalcohol,Grainalcohol, Anhydrousalcohol,Dehydratedalcohol,Ethylhydrate化学式结构简式:C2H5OH分子式:C2H6O相对分子质量46.07性状无色澄清液体。
有愉快的气味和灼烧味。
易流动。
极易从空气中吸收水分,能与水和氯仿、乙醚等多种有机溶剂混溶。
能与水形成共沸混合物(含水4.43%),共沸点78.15℃。
相对密度(d204)0.789。
熔点-114.1℃。
沸点78.5℃。
折光率(n20D)1.361。
闪点(闭杯)13℃。
易燃。
蒸气与空气能形成爆炸性混合物,爆炸极限3.5%~18.0%(体积)储存密封阴凉干燥保存。
用途溶剂。
分析镍、钾、镁及脂肪的酸价。
萃取剂。
脱水剂。
清洗剂。
安全措施贮于低温通风处,远离火种、热源。
与酸类、胺类分储。
误食,饮温水,催吐。
灭火:抗溶性泡沫、二氧化碳、干粉、砂土。
灭火方法燃烧性:易燃闪点(℃):12爆炸下限(%):3.3爆炸上限(%):19.0引燃温度(℃):363最大爆炸压力(MPa):0.735灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。
喷水保持容器冷却,至灭火结束。
紧急处理吸入:迅速脱离现场至新鲜空气处。
就医。
误食:饮足量温水,催吐,就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
编辑本段理化常数英文名:absolute alcohol;anhydrous ethanolCAS:64-17-5分子式:C2H6O结构简式:CH3CH2OH或C2H5OH官能团:—OH(羟基)主要成分:纯品外观与性能:无色液体,有醇香制取:实验室制备无水酒精时,在95.57%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏,这样可得99.5%的无水酒精。
药物化学实验讲义

药物化学实验讲义药物化学合成实验实验⼀阿司匹林(Aspirin )的合成⼀、⽬的要求1. 掌握酯化反应和重结晶的原理及基本操作。
2. 熟悉搅拌机的安装及使⽤⽅法。
⼆、实验原理阿司匹林为解镇痛药,⽤于治疗伤风、感冒、头痛、发烧、神经痛、关节痛及风湿病等。
近年来,⼜证明它具有抑制⾎⼩板凝聚的作⽤,其治疗范围⼜进⼀步扩⼤到预防⾎栓形成,治疗⼼⾎管疾患。
阿司匹林化学名为2-⼄酰氧基苯甲酸,化学结构式为:OCOCH 3COOH阿司匹林为⽩⾊针状或板状结晶,mp.135~140℃,易溶⼄醇,可溶于氯仿、⼄醚,微溶于⽔。
合成路线如下: OCOCH 3COOH OHCOOH (CH 3CO)2O H 2SO 4CH 3COOH++三、实验⽅法(⼀)酯化在装有搅拌棒及球形冷凝器的100 mL 三颈瓶中,依次加⼊⽔杨酸10 g ,醋酐14 mL ,浓硫酸5滴。
开动搅拌机,置油浴加热,待浴温升⾄70℃时,维持在此温度反应30 min 。
停⽌搅拌,稍冷,将反应液倾⼊150 mL 冷⽔中,继续搅拌,⾄阿司匹林全部析出。
抽滤,⽤少量稀⼄醇洗涤,压⼲,得粗品。
(⼆)精制将所得粗品置于附有球形冷凝器的100 mL 圆底烧瓶中,加⼊30 mL ⼄醇,于⽔浴上加热⾄阿司匹林全部溶解,稍冷,加⼊活性碳回流脱⾊10 min ,趁热抽滤。
将滤液慢慢倾⼊75mL热⽔中,⾃然冷却⾄室温,析出⽩⾊结晶。
待结晶析出完全后,抽滤,⽤少量稀⼄醇洗涤,压⼲,置红外灯下⼲燥(⼲燥时温度不超过60℃为宜),测熔点,计算收率。
(三)⽔杨酸限量检查取阿司匹林0.1 g,加1 mL⼄醇溶解后,加冷⽔定适量,制成50 mL溶液。
⽴即加⼊1mL新配制的稀硫酸铁铵溶液,摇匀;30秒内显⾊,与对于照液⽐较,不得更深(0.1%)。
对照液的制备:精密称取⽔杨酸0.1 g,加少量⽔溶解后,加⼊1 mL冰醋酸,摇匀;加冷⽔定适量,制成1000 mL溶液,摇匀。
精密吸取1 mL,加⼊1 mL⼄醇,48 mL⽔,及1 mL新配制的稀硫酸铁铵溶液,摇匀。
无水酒精的制备

分子筛吸附具 有低能耗、 易 操作、 易批量 生产等优点,已 经大量应用于 无水酒精的规 模化生产, 其发 展前景主要为 进一步优化工 艺参数和提高 吸附剂性能。
生物质吸附 作为继分子筛吸 附之后的新兴技 术, 尚处于小型 验阶段,因为继承 了分子筛吸附的 优点,并具有绿色 吸附剂的独特优 势, 使其有望成 为分子筛吸附的 保替代工艺。
Thank You!
核心技术就是脱去酒 精与水共沸混合物中 的水含量, 的水含量,使酒精净 含量达到99.5%(质 含量达到 ( 量分数)以上。 量分数)以上。
主要方法
吸水剂脱水法 特殊的精馏方式 膜分离 真空脱水 超临界流体萃取法
吸水剂脱水法
以固体吸水剂(如生石灰、分子筛)或液态吸水剂(如甘油、汽油)脱水。 生物质吸附(如纤维素、玉米粉、 麦秆、 蔗渣、 淀粉、 半纤维素、 木屑、 其他谷物、 农产品残渣等) 现在用的比较多 用离子交换树脂脱水(聚苯乙烯钾型强酸性树脂)
无水酒精的制备方法介绍
无水酒精
酒精学名乙醇,它以玉米、 酒精学名乙醇,它以玉米、小麦、 糖蜜等为原料, 薯类、糖蜜等为原料,经发酵精馏 而制成。 而制成。常压下酒精水溶液质量浓 度为95.57%(质量分数)时, 酒精 度为 (质量分数) 和水形成共沸物。 和水形成共沸物。 无水酒精,又称绝对酒精, 无水酒精,又称绝对酒精,是由 95.57%(质量分数)的酒精经脱水 (质量分数) 精制而成的含水量较少的酒精。 精制而成的含水量较少的酒精。 无水酒精的应用方向主要有两个:一 无水酒精的应用方向主要有两个 一 是研究用纯净的无水酒精,其社会需 是研究用纯净的无水酒精 其社会需 求量少;二是燃料用无水酒精 二是燃料用无水酒精,这方 求量少 二是燃料用无水酒精 这方 面社会需求量巨大,已成为各国能源 面社会需求量巨大 已成为各国能源 的主要补充。 的主要补充。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验一 绝对乙醇的制备
一、实验目的
1、学习隔绝空气中湿气的回流反应装置使用。
2、掌握无水乙醇、绝对乙醇的制备方法。
二、实验原理
市售的无水乙醇一般只能达到%的纯度,在许多反应中需用纯度更高的绝对乙醇,经常需自己制备。
通常工业用的%的乙醇不能直接用蒸馏法制取无水乙醇,因%乙醇和%的水形成恒沸点混合物。
要把水除去,第一步是加入氧化钙(生石灰)煮沸回流,使乙醇中的水与生石灰作用生成氢氧化钙,然后再将无水乙醇蒸出。
这样得到无水乙醇,纯度最高约%。
纯度更高的无水乙醇可用金属镁或金属钠进行处理。
三、药品和仪器
药品:95%乙醇 生石灰 氯化钙 镁条 金属钠 碘粒 邻苯二甲酸二乙酯
仪器: 圆底烧瓶 冷凝管 干燥管 烧杯
四、实验步骤
1、无水乙醇(含量%)的制备
在100 mL 圆底烧瓶[1]中,放置50 mL 95 %乙醇和12 g 生石灰[2],用木塞塞紧瓶口,放置至下次实验[3]。
下次实验时,拔去木塞,装上回流冷凝管,其上端接一氯化钙干燥管,在水浴上回流加热 h ,稍冷后取下冷凝管,改成蒸馏装置。
蒸去前馏分后,用干燥的吸滤瓶或蒸馏瓶作接受器,其支管接一氯化钙干燥管,使与大气相通。
用水浴加热,蒸馏至几乎无液滴流出为止。
称量无水乙醇的质量或量其体积,计算回收率。
2、绝对乙醇(含量 %)的制备
①用金属镁制取 在250 mL 的圆底烧瓶中,放置 g 干燥纯净的镁条,10 mL %乙醇,装上回流冷凝管,并在冷凝管上端附加一只无水氯化钙干燥管。
在沸水浴上或用火直接加热使达微沸,移去热源,立刻加入几粒碘片(此时注意不要振荡),顷刻即在碘粒附近发生作用,最后可以达到相当剧烈的程度。
有时作用太慢则需加热,如果在加碘之后,作用仍不开始,则可再加入数粒碘(一般讲,乙醇与镁的作用是缓慢的,如所用乙醇含水量超过 %则作用尤其困难)。
待全部镁已经作用完毕后,加入100 mL %乙醇和几粒沸石。
回流1 h ,蒸馏,产物收集于玻璃瓶中,用一橡皮塞或磨口塞塞住。
②用金属钠制取 装置和操作同①,在250 mL 圆底烧瓶中,放置2 g 金属钠[4]
和100 mL 纯度至少为99 %的乙醇,加入几粒沸石。
加热回流30 min 后,加入4 g 邻苯二甲酸二乙酯[5]
,再回流10 min 。
取下冷凝管,改成蒸馏装置,按收集无水乙醇的要求进行蒸馏。
产品储于带有磨口塞或橡皮塞的容器中。
五、注意事项
1、本实验中所用仪器均需彻底干燥。
由于无水乙醇具有很强的吸水性,故操作过程中和存放时必须防止水分侵入。
2、一般用干燥剂干燥有机溶剂时,在蒸馏前应先过滤除去。
但氧化钙与乙醇中的水反应生成的氢氧化钙,因在加热时不分解,故可留在瓶中一起蒸馏。
3、若不放置,可适当延长回流时间。
4、金属钠遇水即燃烧、爆炸,故使用时应严格防止与水接触。
在称量和切片过程中应当迅速,以免空气中水气侵蚀或被氧化。
5、加入邻苯二甲酸二乙酯的目的,是利用它和氢氧化钠进行如下反应: 2C 2H 5OH + Mg (C 2H 5O)2Mg + H
(C 2H 5O)2Mg + 2H 22C 2H 5OH + Mg(OH)2
C 2H 5OH + Na C 2H 5ONa + H 12
C 2H 5ONa + H 2O
C 2H 5OH + NaOH
或COO COO C 2H 5C 2H 5
Na Na +2C 2H 5OH
+
因此消除了乙醇和氢氧化钠生成乙醇钠与水的作用,这样制得的乙醇可达到极高的纯度。
六、乙醇的纯度和密度对照表
七、思考题
为什么工业酒精不能直接用蒸馏法制取无水乙醇。
