铜锌族元素补充习题
化学初三下人教新资料12.2(化学元素与人体健康)补充习题4及解析

化学初三下人教新资料 12.2( 化学元素与人体健康 ) 增补习题 4 及分析1、在人体含量最多的化学元素是〔〕A、碳B、氢C、氧D、钙2、人体中缺乏或过多都会惹起甲状腺疾病的元素是〔〕A、钠B、氯C、铁D、碘3、有一种病叫做缺铁性贫血症,这里缺铁指的是缺〔〕A、铁单质B、铁元素C、三氧化二铁D、四氧化三铁4、相关人体的构成元素的说法中错误的选项是〔〕A、构成人体自己的元素约有50 多种B、人体内的碳、氢、氧、氮四种元素主要以水、糖类、油脂、蛋白质和维生素形式存在C、人体内含量许多的元素有11 种D、因为微量元素的含量特别少,所以,对人体健康的影响也很小5、人们每日经过摄入食品不停增补所需要的各样元素,但有时也会摄入某些有害的元素,对以下矿物元素进行分类。
①镉②钾③铁④钙⑤汞⑥碘⑦铅⑧镁⑨硒⑩锌(1)人体中必要的微量元素 ______________________(2)对人体有害的微量元素 ______________________6、请你将人体缺乏的元素与由此而引起的疾病用直线连起来:7、学好化学有益于提升生活质量,合理饮食是身体健康的保证。
请指出与以下各样病症产生相关的营养素:肥胖症 ____________ ;贫血 ____________ ;夜盲症 __________;坏血病 ____________ ;佝偻病 ____________;大脖子病 __________ 。
吃低质奶粉致使的“大头婴儿”___________。
答案:1C2D3B4D5(1) ③⑥⑨⑩ (2) ①⑤⑦6.缺乏维生素 A→夜盲症缺乏维生素 C→坏血病缺钙→佝偻病或骨质松散缺碘→甲状腺肿大缺氟→蛀牙缺铁→贫血7、脂肪〔或糖〕;铁元素;维生素A;维生素C;钙元素;碘元素;蛋白质。
化学补充题

10
10
10
剩余固体的质量 (g) 18.375
16.750
15.125
13.500
13.500
2021/8/6
3
• (1)、求铜锌合金中锌的质量分数; • (2)、从图可知,当所用合金与稀盐酸的质
量比为——时,表明锌恰好完全溶解。
• (3)、计算稀盐酸中溶质的质量分数。
2021/8/6
4
• 5、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,
则该口服液中葡萄糖酸锌的质量是——mg.
• 2、2006年6月9日~7月9日,世界杯足球赛在德国举行,当运动员肌
肉受伤时,队医随即对准球员的受伤部位喷射氯乙烷(化学式为 C错2H误5C的l,是沸(点为)12.3℃)进行局部麻醉处理。下列有关氯乙烷的说法
• A、氯乙烷是由碳、氢、氯三元素组成的
• B、氯乙烷是由2个碳原子、5个氢原子和1个氯原子构成的求样Fra bibliotek中碳酸钙的质量分数
2021/8/6
5
• C、氯乙烷中碳、氢、氯三种元素的质量比为48:10:71
• D、氯乙烷用于冷冻麻醉与其沸点较低、易挥发吸热有关
2021/8/6
1
补充题
• 3、某化合物完全燃烧,需4.8克O2,同时生成4.4克CO2和
2.7克H2O。则该化合物中()
• A、只含碳、氢、氧三种元素
• B、只含碳、氧两种元素
• C、只含碳、氢两种元素
补充题
• 1、锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会
引起多种疾病,因此缺锌可能通过服用葡萄糖酸锌等保健品来补锌。 已回答知:葡萄糖酸锌的化学式为C12H22O14Zn(相对分子质量为455),试
知识总结——铜族元素和锌族元素
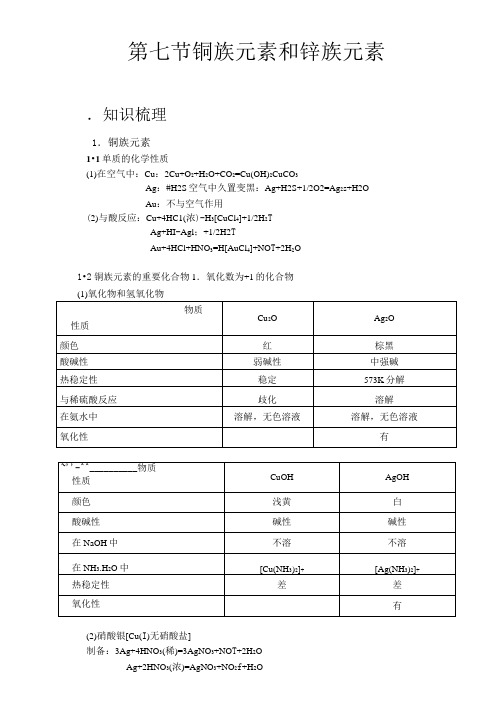
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
元素周期表测试及答案

学案1. 下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )A .2、4、6B .19、20、21C .1、3、5D .8、16、18【答案】C学案2. 已知a 为ⅡA 族元素,b 为ⅢA 族元素,它们的原子序数分别为m 和n ,且a 、b 为同一周期元素,下列关系不可能的是 ( ) A .n =m +1 B .n =m +11 C .n =m +25 D .n =m +10【答案】D学案3. 已知X 、Y 、Z 三种主族元素在元素周期表中的相对位置如图所示,设X 的原子序数为a ,则下列说法中不正确的是 ( ) A .Y 与Z 的原子序数之和可能为2a B .Y 的原子序数可能为a -19 C .Z 的原子序数可能为a +33 D .X 、Y 、Z 一定都是短周期元素【答案】D学案4. 下列各组给定原子序数的元素,不能..形成原子数之比为1:1稳定化合物的是( ) A .3和17 B .1和8C .7和8D .7和12【答案】D学案5. 向溴化钠、碘化钠的混合溶液中通入足量氯气之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是( )A .NaClB .NaCl 、NaBr 、NaIC .NaBr 、NaID .NaCl 、I 2【答案】A学案6. 下列各组微粒中,核外电子总数相等的是( )A .Na +和Li +B .CO 和CO 2C .H 2O 和Al 3+D .NO 和CO【答案】C学案7. 我国“嫦娥一号”顺利进入绕月轨道,实现绕月探测。
据科学家预测,月球的土壤中吸附着数百万吨的32He ,而在地球上氦元素主要以42He 的形式存在。
关于32He 和42He 的叙述中正确的是( ) A .32He 和42He 互为同位素 B .42He 比32He 多一个质子C .42He 原子核内有4个中子D .32He 和42He 是同一核素【答案】A学案8. 短周期元素A 、B 、C 、D,0.5 mol A 的离子得到6.02×1023个电子后被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol/L 的盐酸完全反应,A 元素原子核内质子数与中子数相等;B元素原子核外电子数比A 元素原子核外电子数多1;C -核外电子层数比A 元素的离子核外电子层数多1;D 元素原子最外层电子数是次外层的2倍。
奥赛无机元素化学习题_第十七章__铜_锌_分_族

【高中化学奥林匹克竞赛辅导】无机元素化学练习第十七章铜锌分族1. 完成并配平下列各反应方程式:(1) Cu + NaCN + H2O ?? (4) AuCl3 + H2O2 + KOH ??(2) Ag2S +HNO3(浓) ?? (5) CuS+HNO3(稀) ??(3) Ag(S2O3)23? + H2S ?? (6) Cu + I-+ H+ ??2. 为什么Cu2+(aq)比Cu+(aq)稳定?而固态时Cu(I)比Cu(II)稳定?3. 往硫酸铜溶液中加入Na2CO3溶液能否得到碳酸铜沉淀?为什么?写出相应的反应方程式。
4. 试说明:AuCl在水中能自动分解成为Au和AuCl3,而Au3+和I?作用则得到AuI。
5. 为把银线上的灰暗色Ag2S除去,可以把这灰暗色的银线放入盛有热的Na2CO3溶液的铝器皿中。
试解释这是为什么?(已知E ?Ag2S/Ag = -0.70V,E ?Ag+/Ag = 0.80V)6. CuSO4水溶液加入I?或CN?时,会得到Cu(I)化合物的沉淀,但是Cu2SO4一遇水就会变成CuSO4和Cu,这是为什么?7. 为什么在水中CuF2存在而CuF不存在;CuI存在而CuI2不存在。
8. 解释下列各现象:(1) CuCl2的稀溶液是兰色,加入浓HCl后呈绿色。
(2) CuCl不溶于水和稀HCl中,但溶于浓HCl中。
(3) 把KCN加入Cu2+离子溶液中,溶液的兰色显着减少,再向此溶液中通入H2S气体,不产生CuS沉淀。
(4) AgCl的盐酸中的溶解度一开始减少,然后随着盐酸浓度的增加而增加。
(5) 氯化银在氨溶液中溶解,但碘化银不溶于氨溶液。
9. 将CuCl2?2H2O加热,能否制得无水CuCl2?10. 不用H2S或硫化物,如何分离Ag+、Cu2+、Ba2+、Al3+离子?11. 化合物A溶于水,加入NaOH后得兰色沉淀B。
B溶于盐酸,也溶于氨水,生成兰色溶液C。
人教版九年级化学下册第八单元补充题型.doc

第八单元金属和金属材料金属化学性质补充习题一、 判断和验证金属活动性顺序1、某化学兴趣小组为了验证铁、镁、铜的活动性顺序,选取了下列各组试剂,其中较易操作且正确的一组是( )A 、镁、铁、氯化铜溶液B 、铁、铜、硫酸镁溶液C 、铁、氯化镁溶液、硫酸铜溶液D 、铜、硫酸镁溶液、氯化亚铁溶液2、某学生为了验证锌、银、铜三种金属的活动性顺序,设计了五个实验:①将Zn 、Cu 分别放入稀盐酸中; ②将Ag 放入Cu(NO 3)2溶液中;③将Cu 放入AgNO 3溶液中;④将Cu 放入ZnSO 4溶液中;⑤将Zn 放入AgNO 3溶液中。
下列实验组合不能验证锌、银、铜三种金属活动性顺序的是( ) A .①② B .①③ C .②④ D .①⑤3、某化学兴趣小组为测定Fe 、Cu 、Ag 三种金属的活动性顺序设计了四种方案,每种方案所用的试剂如下,其中你认为不可行的是( )A 、Fe 、Ag 、CuSO 4溶液B 、Fe 、Cu 、AgNO 3溶液、稀盐酸C 、Cu 、FeCl 2溶液、AgNO 3溶液D 、Cu 、Ag 、Fe 、稀盐酸 二、图像问题1、将质量相等的A 、B 两种金属,同时分别放入两份质量分数相同且足量的稀盐酸中,反应生成H 2的质量与反应时间的关系如图所示。
根据图中所提供的信息,写出能从中得到的正确结论。
(已知:A 、B 的生成物中均为+2价) (1)生成H 2的质量:A B (2)相对原子质量:A B (3)反应速率:A B(4)在金属活动性顺序里,A 、B 均排在 。
2、等质量的A 、B 、C 三种金属跟足量的稀硫酸完全反应后都生成+2价的硫酸盐,生成氢气的质量(m )与反应时间(t )的关系如图所示,则下列说法中正确的是( )A 、三种金属的活动性是A >B >C B 、三种金属的相对原子质量是A <B <C C 、反应消耗硫酸的质量相同D 、反应速度最慢的是C ,最快是A3、将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如右图。
第18章-铜族元素锌族元素习题
第18章铜族元素锌族元素习题1.选择题18-1 在酸度较大的水溶液中也不溶解的盐是………………………………. ( ) (A) Ag2SO4(B) Ag3PO4 (C) Ag2CO3(D) Ag2S18-2 在CuSO4溶液中加入过量的碳酸钠溶液,常形成的产物是…………() (A) Cu(HCO3)2(B) CuCO3 (C) Cu2(OH)2CO3(D) Cu(OH)218-3 下述有关银的性质的正确论述是………………………………………( ) (A) 从稀盐酸中置换出氢(B) 从浓盐酸中置换出氢(C) 从氢碘酸中置换出氢(D) 从稀硫酸中置换出氢18-4 能共存于溶液中的一对离子是…………………………………………..() (A) Fe3+和I-(B) Pb2+和Sn2+(C) Ag+和PO43-(D) Fe3+和SCN-18-5 欲除去CuSO4酸性溶液中少量Fe3+,加入下列试剂效果最好的是( ) (A) 氨水(B) NaOH (C) H2S水(D) Cu2(OH)2CO318-6 Cu2O 和稀H2SO4反应,最后能生成……………………………….() (A)Cu2SO4+ H2O (B) CuSO4+ H2O(C) CuSO4+ Cu + H2O (D) CuS18-7 五水硫酸铜可溶于浓盐酸,关于所得溶液的下列说法中,正确的是( )(A) 所得溶液呈蓝色;(B) 将溶液煮沸时释放出氯气,留下一种Cu(+I) 的配合物溶液;(C) 这种溶液与过量的氢氧化钠溶液反应,不生成沉淀;(D) 此溶液与金属铜一起加热,可被还原为一种Cu(+I)的氯配合物。
18-8 下列描述银的性质中,正确的是……………………………………….()(A) 能与浓HCl作用放出氢(B) 能与氢碘酸作用放出氢(C) 能与稀硫酸作用放出氢(D) 能与沸水作用放出氢18-9 能区别Zn2+和Al3+的下列试剂是………………………………………...() (A)NaOH (B)HCl (C)NH3.H2O (D)Na2CO318-10 已知:K sp(AgSCN ) = 1.1×10-12,K sp(AgI) = 1.5×10-16,K sp(Ag2CrO4) = 1.0×10-11则上述难溶盐与其金属组成的电对的值大小顺序为……………..() (A) AgSCN >AgI >Ag2CrO4 (B) AgI >AgSCN >Ag2CrO4(C) Ag2CrO4>AgSCN >AgI (D) Ag2CrO4>AgI >AgSCN18-11 在反应:AgCl(s) + 2 S2O32-(aq) →Ag(S2O3)23-(aq) + Cl-(aq)中起Lewis 酸和Lewis 碱作用的是…………………………………………………………() (A)AgCl和Ag(S2O3)23-(B)AgCl和S2O32-(C)Ag+和Cl-(D)Ag+和S2O32-18-12 Hg22+中汞原子之间的化学键为………………………………………() (A) 离子键(B) σ键(C) π键(D) 配位键18-13 加NH3·H2O水于Hg2Cl2上,容易生成的是……………………..() (A) Hg(OH)2(B) [Hg(NH3)4]2+(C) [Hg(NH3)2]+(D) HgNH2Cl+Hg18-14 在工业上欲除去ZnSO4溶液中的Fe3+杂质,需加入最合适的试剂是( ) (A) NaOH (B) Na2CO3 (C) ZnCO3(D) Zn18-15 下列的阳离子中,能与Cl-离子在溶液中生成白色沉淀,加氨水时又将转成黑色的是……………………………………………………………………….( ) (A) 铅(II) (B) 银(I) (C) 汞(I) (D) 锡(II)18-16 下列金属单质可以被HNO3氧化成最高价态的是…………………()(A) Hg (B) Ti (D) Pb (D) Bi18-17 已知:Cd2++ CN-[Cd(CN)]+K1 = 105.48[Cd(CN)]++ CN-[Cd(CN)2] K2 = 105.12[Cd(CN)2] + CN-[Cd(CN)3]- K3 = 104.63Cd2++ 4CN-[Cd(CN)4]2-K稳= 1018.80则[Cd(CN)3]-+ CN-[Cd(CN)4]2-的K4等于…………………………….. ( ) (A) K4 = 103.57 (B) K4 = 1015.23 (C) K4 = 1013.32(D) K4 = 1013.6818-18 下列化合物中,既能溶于浓碱,又能溶于酸的是………………….. () (A) Ag2O (B) Cu(OH)2(C) HgO (D) Cd(OH)218-19 在含有0.1 mol·L-1的Pb2+,Cd2+,Mn2+和Cu2+的0.3 mol·L-1HCl 溶液中通入H2S,全部沉淀的一组离子是…………………………………..()(A) Mn2+,Cd2+,Cu2+(B) Cd2+,Mn2+(C) Pb2+,Mn2+,Cu2+(D) Cd2+,Cu2+,Pb2+18-20 能共存于酸性溶液中的一组离子是………………………………….() (A) K+,I-,SO42-,MnO4-(B) Na+,Zn2+,SO42-,NO3-(C) Ag+,AsO43-,S2-,SO32-(D) K+,S2-,SO42-,Cr2O72-18-21 从Ag+,Hg2+,Hg22+,Pb2+的混合液中分离出Ag+,可加入的试剂为( ) (A) H2S (B) SnCl2(C) NaOH (D) NH3·H2O18-22 在下列反应中:①Cu2++ I-②Cu2++ CN-③Cu2++ S2O32-+ H2O④Hg22++ I-(适量)⑤Hg22++ NH3·H2O金属离子氧化态发生变化的是……………………………………………..() (A) ①②③④(B) ①②③⑤(C) ①②④⑤(D) ②③④⑤18-23 已知下列五组物质性质差异为:Mg(OH)2>Cd(OH)2;H2SiF6>HF ;H2PbCl6>PbCl4;AgF >CaF2;Au+>Hg22+,它们依次表示的性质是……………………………………………..()(A) 碱性,酸性,稳定性,溶解度,易歧化;(B) 碱性,酸性,水解度,溶解度,氧化性;(C) 碱性,酸性,稳定性,溶解度,水解度;(D) 碱性,酸性,稳定性,溶解度,配位能力(与NH3)。
高一化学补充练习
1.2 补充练习班级:学号:姓名:相对原子质量:N~14 O~16 S~32 Zn~651. 关于146C 的叙述错误的是()A . 质子数为6 B. 电子数为6 C . 中子数为6 D. 质量数为142. 摩尔是()A .物质的数量单位B .表示物质的质量单位C .表示物质的量的单位D .既是物质的数量单位又是物质的质量单位3. 不同元素的原子()A .质子数一定不相等B .中子数一定不相等C .质量数一定不相等D .核外电子数可能相等4. 下列各组微粒中,互为同位素的是()A 、金刚石和石墨B 、X 4019和X 4020C 、D 2O 和H 2O D 、Y 12652和Y 128525. 下列关于阿伏加德罗常数的说法正确的是()A .阿伏加德罗常数是12g 碳中所含的碳原子数B .阿伏加德罗常数是1mol 物质所含的原子数C .阿伏加德罗常数是6.02×1023 mol -1D .阿伏加德罗常数的符号为N A ,近似为6.02×1023 mol -16. 如果1g 水中含有n 个氢原子,则阿伏加德罗常数是()A .1/n mol 1B .9n mol 1C .2nmol 1D .nmol 17. 下列叙述中错误的是()A .H 2SO 4的摩尔质量是98B .2mol NO 和2mol CO 2含分子数相同C .等质量的O 2和O 3中所含氧原子个数相同D .等物质的量的CO 和CO 2中所含碳原子数相等8. 相同质量的SO 2和SO 3它们之间的关系是()A .所含硫原子的物质的量之比为1:1B .氧原子的物质的量之比为3:2C .氧元素的质量比为5:4D .硫元素的质量比为5:49. 某元素1个原子的质量为a kg ,1 个12C 原子质量为b kg ,则该元素的这种原子的相对原子质量是()A .ba 12 B .a 12b C .A N a D .a·N A10.对1mol H2O的说法正确的是()A.含有6.02×1023个氢分子B.含有6.02×2×1023个氢元素C.含有6.02×8×1023个电子D.含有6.02×1024个质子11.跟2.8g N2含有相同分子数的下列物质是()(A)16g氧气(B)0.2mol甲烷分子(C)1.8g水(D)3.01×1022个磷酸分子12.氢的三种同位素是、、,它们的名称分别为氕、氘、氚,通常用H、D、T分别表示。
化学补充习题答案上教版
化学补充习题答案上教版化学是一门充满魅力的科学,它揭示了物质的本质和变化规律。
在学习化学的过程中,习题是不可或缺的一部分。
通过解答习题,我们可以巩固知识,提高思维能力,并且更好地理解化学的原理和应用。
然而,有时候我们可能会遇到一些难题,需要寻求答案来帮助我们解决困惑。
下面是一些化学补充习题的答案,希望对大家有所帮助。
1. 铝是一种常见的金属元素,它的原子序数是13。
请问铝的原子结构是怎样的?答案:铝的原子结构可以通过查阅元素周期表得到。
铝的原子序数为13,意味着它的原子核中有13个质子。
根据原子的电中性原则,铝的原子中也应该有13个电子。
铝的电子结构可以用1s² 2s² 2p⁶ 3s² 3p¹来表示。
其中,1s²表示第一能级上有2个电子,2s² 2p⁶表示第二能级上有8个电子,3s² 3p¹表示第三能级上有3个电子。
2. 硫酸是一种常用的化学品,化学式为H₂SO₄。
请问硫酸中氢离子和硫酸根离子的比例是多少?答案:硫酸的化学式为H₂SO₄,其中有2个氢离子(H⁺)和1个硫酸根离子(SO₄²⁻)。
因此,氢离子和硫酸根离子的比例是2:1。
3. 燃烧是一种常见的化学反应,它涉及到氧气和燃料之间的反应。
请问甲烷(CH₄)在完全燃烧的情况下生成的产物是什么?答案:甲烷在完全燃烧的情况下生成二氧化碳(CO₂)和水(H₂O)。
化学方程式可以表示为:CH₄ + 2O₂ → CO₂ + 2H₂O。
4. pH是用来表示溶液酸碱性的指标。
请问pH值为7的溶液是酸性、中性还是碱性?答案:pH值为7的溶液是中性溶液。
在酸碱指示剂的pH量表中,pH值为7表示溶液的酸碱平衡,即酸性和碱性的浓度相等。
5. 氧化还原反应是一种重要的化学反应类型,涉及到电子的转移。
请问在以下反应中,哪种物质被氧化,哪种物质被还原?Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag答案:在这个反应中,铜(Cu)被氧化,银离子(Ag⁺)被还原。
3.3.2元素符号 元素周期表同步练习(含答案)
答卷时应注意事项1、拿到试卷,要认真仔细的先填好自己的考生信息。
2、拿到试卷不要提笔就写,先大致的浏览一遍,有多少大题,每个大题里有几个小题,有什么题型,哪些容易,哪些难,做到心里有底;3、审题,每个题目都要多读几遍,不仅要读大题,还要读小题,不放过每一个字,遇到暂时弄不懂题意的题目,手指点读,多读几遍题目,就能理解题意了;容易混乱的地方也应该多读几遍,比如从小到大,从左到右这样的题;4、每个题目做完了以后,把自己的手从试卷上完全移开,好好的看看有没有被自己的手臂挡住而遗漏的题;试卷第1页和第2页上下衔接的地方一定要注意,仔细看看有没有遗漏的小题;5、中途遇到真的解决不了的难题,注意安排好时间,先把后面会做的做完,再来重新读题,结合平时课堂上所学的知识,解答难题;一定要镇定,不能因此慌了手脚,影响下面的答题;6、卷面要清洁,字迹要清工整,非常重要;7、做完的试卷要检查,这样可以发现刚才可能留下的错误或是可以检查是否有漏题,检查的时候,用手指点读题目,不要管自己的答案,重新分析题意,所有计算题重新计算,判断题重新判断,填空题重新填空,之后把检查的结果与先前做的结果进行对比分析。
亲爱的小朋友,你们好!经过两个月的学习,你们一定有不小的收获吧,用你的自信和智慧,认真答题,相信你一定会闯关成功。
相信你是最棒的!课题3 元素第2课时 元素符号 元素周期表1.下列元素名称与对应的元素符号均正确的是( )A. 氯cl B.氢h C.镁Mg D.铜CU2.下列科学家中,发现了元素周期律并编制出元素周期表的是( )A. 拉瓦锡B.门捷列夫C.道尔顿D.阿伏加德罗3.元素周期表是学习和研究化学的重要工具,它的内容非常丰富。
你认为从元素周期表中不能直接获得的信息是( )A. 元素在自然界中的分布B.元素性质的变化规律C.元素符号D.元素的原子序数4.图摘自元素周期表,部分信息略去。
据此判断相关叙述正确的是( )A. 磷原子(P)质量是30.97B.Cl表示1个氟原子C.三种元素都是非金属元素D.三种元素在周期表中属于同一族5.元素周期表是学习化学的重要工具,图是元素周期表中的一格,下列说法正确的是( )A. 铬的相对原子质量为52 gB.铬属于非金属元素C.铬元素在地壳中的含量为52.00%D.铬原子的核外有24个电子6.中华文化,博大精深。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第20章 铜锌族元素补充习题一.选择题1. 101AA03 为除去钢粉中的少量氧化铜杂质,采用下列那种方法合适( ) A, 用热水洗 B.用浓盐酸洗 C. 用氨水洗 D. 用盐酸洗2. 101AA04 与铜在加热条件下反应能 生成氢气的是( ) A. 浓硝酸 B. 浓硫酸 C. 浓盐酸 D. 稀硫酸3. 101AA05 "沾起"撒落的细小汞滴的金属片为( ) A. 铜片 B. 铁片 C. 铝片 D. Sn 片4. 101BA02 关于ⅠB 族性质叙述不正确的是( )A. (n-1)d 与ns 轨道能级相近,d 电子可部分参与成键,所以多变价B. ⅠB 族的E ØM/M 为正值,所以ⅠB 族金属不能与水反应C. 次外层为18电子构型,具有强烈的极化作用与明显的变形性D. ⅠB 族在水溶液中的化学活泼性从Cu----Au 降低,是因为I 1Cu----Au 增大5. 101BA03 汞能用于制造温度计是因为( )A. 膨胀系数均匀.不润湿玻璃B. 室温时蒸气压低C. 能溶解金属D. 常温时不活泼6. 102AA01 下列各电子对中,电对的代数值最小的是( ) A. E ØCuS/Cu B. E ØCu(NH 3)2+4/CuC. E ØCu 2+/CuD. E ØCu(OH)2/Cu7. 102AA02 下列化合物不存在的是( ) A. CuF 2 B. CuCl 2 C. CuBr 2 D. CuI 2 8. 102AA03 Cu 2+能氧化( )A. I -B. S 2-C. Cl -D. Cu9. 102AA05 关于Cu(Ⅱ)与Cu(Ⅰ)的稳定性与相互转化,下列说法不正确 的是( )A. 高温 干态时一价铜稳定B. 二价铜的水合能大,在水溶液中二价铜稳定C. 若要使反应Cu 2++Cu 2Cu +顺利进行,必须加入沉淀剂或配合剂D. 任何情况下一价铜在水溶液中都不能稳定存在10. 102BA07 在碱性物质中硫酸铜溶液与C 6H 12O 6反应生成( ) A. CuO+Cu B. Cu 2O C. Cu(OH)2+Cu D. Cu 2O+Cu+CuO11. 102BA08 氧化亚铜在下列( )溶液中发生歧化反应A. 稀硝酸B. 稀硫酸C. FeCl3溶液 D. 浓盐酸12.102BB10 硫酸铜溶液与下列( )物质反应生成白色沉淀物A. NaCl+SO2 B. KI C. KI+Na2SO3D. K4[Fe(CN)6] E. Na2S2O313.103BA01 在Hg2(NO3)2溶液中,加入下列试剂不能生成黑色分散细珠汞的为( )A. 强碱溶液 B, 通入硫化氢 C, 稀盐酸 D. 氨水14.103BA06+0.854┏━━━━━━━━━━━┓根据电势图Hg2+________Hg22+________Hg回答问题:+0.920 +0.789 歧化反应Hg22+Hg2++Hg的平衡常数是( )A. 163 C. 6.13×103 D. 0.85415.103BA08 氯化汞溶液与下列( )反应能生成黑色沉淀物A. H2O2+NaOH B. NH3·H2OC. Na2C2O4D. NaOH16.103BA10 氯化亚汞白色沉淀物与下列( )反应不生成灰色沉淀物A. SnCl2 B. NH3.H2O C. NaCl D. KI+I217.104AA02 最难溶于浓氨水的是( )A. AgIB. AgBrC. AgClD. AgF18.104AA04 硝酸银溶液显( )性A. 近中性B. 强酸性C. 酸性D. 碱性19.104BA01 下列配离子中无色的是( )A. [Cu(NH3)2]+ B. [CuCl4}2- C. [Cu(NH3)4]2+D. [Cu(H2O)4]2+20.104BA04 下列反应不正确的是( )A. Ag2O+2HF == 2AgF+H2OB. AgCl+2NH3 == 〔Ag(NH3)2〕++Cl-C. Ag++F- == AgF↓D. AgBr == Ag+Br (光子)21.104BA06 用于吸收合成氨原料气中一氧化碳的物质是( )A. Cu2O B. [Cu(NH3)4](OH)2C. [Cu(NH3)4]Ac D. CuO22.104BB11 下列哪组配和剂能使相应的沉淀完全溶解AgCl AgBr AgI Ag2SA. NH3.H2O S2O32- CN- CN-B. CN- S2O32- NH3.H2O CN-C. NH3.H2O CN- CN- S2O32-D. NH3.H2O CN- S2O32- CN-23.104BA12 下列化合物中遇皮肤能产生黑色斑点的物质是( )A. NaCl B. Cu(NO3)2C. AgNO3D. ZnCl224.104BB13 关于反应2Cu2++4I-2CuI↓+I2不正确的说法是( )A. 本反应可用于制备CuIB. 本反应进行的很完全是因为I-是还原剂又是沉淀剂C. 本反应能有效的防止一价铜歧化是由于生成了难溶的CuID. 本反应不可用于碘量法测定Cu2+含量E. 反应进行时有大量副产物CuI225.104BB17 下列关于AgX的叙述不正确的是( )A. AgX离子间极化作用由AgF到AgI依此增大B. 键型从AgF到AgI由离滓型过度到共价型C. 溶解度由AgF到AgI依此增大D. 除AgF外,AgX都会感光分解E. AgX都能潮解26.104BB18 关于Cu2O和Ag2O的性质不正确的是( )A. Cu2O是离子化合物 B. Ag2O是共价化合物C. Cu2O弱酸性化合物 D. 潮湿的Ag2O 是中强碱E. Ag2O比Cu2O易分解27.105AA01 下列化合物中,不溶于水的白色沉淀是( )A, PbS B. ZnS C. Ag2S D. As2S328.105AA02 向汞盐溶液中加入过量的浓氨水后生成( )A. Hg(OH)42- B. Hg(NH3)42+ C. HgNH2ClD. Hg+HgNH2Cl29.105AA05 俗称升汞的物质( )A. Hg2Cl2B. HgCl2C. 两者均是D. 两者均否30.105BA06 ZnSO4溶液中加入Na2CO3溶液产物是( )A. ZnCO3 B. ZnCO3·Zn(OH)2C. ZnOD. Zn(OH)231.105BA07 ZnSO4溶液与下列( )溶液反应能制得立德粉A. Na2S B. MgSO4C, BaS D. CdS32.105BA08 ZnSO4中加入NaHCO3溶液产物是( )A. ZnCO3·Zn(OH)2B. ZnCO3C. Zn(OH)2D. ZnO33.105BB11 下列反应式中有错误的是( )A. 2ZnS+3O2 == 2ZnO+2SO2↑B. HgS+O2 == Hg↑+SO2↑(加热)C. HgS+Fe == Hg↑+FeS (加热)D. HgS+2Na2S == Na4〔HgS3〕E. HgCl2+2KI(过量) == HgI2↓+2KCl34.106AA07 某两种单质在空气中生成M2O,M2O2或MO2者为( )A. ⅠAB. ⅡBC.两者均是D. 两者均否35.107CB08 用硫化氢试剂鉴别Cd2+和Hg2+离子时产生 _____ 色沉淀是Cd2+,产生 _____色沉淀是Hg2+A. 白色沉淀B. 黑色沉淀C. 黄色沉淀D. 橙红色沉淀E. 蓝色沉淀36.107CB09 用过量KI试剂鉴别Hg22+和Hg2+离子时产生( )的为Hg22+而产生( )的为Hg2+A. 砖红色沉淀B. 无色溶液C. 黄色沉淀或绿色溶液D. 橙红色溶液37.107CB10 利用氨水鉴别Hg2+和Hg22+离子时产生( )者为Hg2+,产生( )者为Hg22+A. 黑色B. 灰黑色C. 白D. 黄色38.107CA11 往一弱酸性无色溶液中加入0.1mol·L-1K2CrO4溶液产生砖红色沉淀.说明此无色溶液中含有下列( )离子A. Ba2+B. Pb2+C. Ag+D. Cu2+39.107CA12 往一白色固体中加氨水变为无色液体,再加硝酸酸化白色固体出现.证明此白色固体为( )A. PbCl2 B. AgCl C. Hg2Cl2D. ZnCl240.107CA13 往一白色固体中加入氨水后变为黑色固体.说明此白色固体为( )A. HgCl2 B. AgCl C. Hg2Cl2D. ZnCl241.208AB01 在下列溶液中分别加入NaOH溶液,能产生氧化物沉淀的是( )A. Cu2+B. Ag+C. Zn2+D. Cd2+E. Hg2+42.209AB01 A. CuS B. Ag2S C. ZnS D. CdS E. HgS 分别试验上述沉淀物在盐酸.硝酸,王水中的溶解性,其中只溶于硝酸和王水的是( )43.209AA02 下列只溶于王水的是( )A. CuSB. Ag2S C. CdS D. HgS44.209AA03 下列硫化物可溶于非氧化性浓酸的是( )A. CuSB. CdSC. Ag2S D. HgS45.209AB08 下列硫化物可溶于非氧化性酸浓酸的是( )A.CuSB. Ag2S C. ZnS D. CdS E. HgS46.310AA05 元素电势图0.905 0.7986Hg2+________Hg22+______Hg-0.080 -0.358Cu(OH)2______Cu 2O______Cu+OH - 0.538 0.137 Cu 2++Cl -_____CuCl_______Cu+Cl - -0.01 -0.12Cu(NH 3)42+______Cu(NH 3)2+______Cu+2NH 3 判断下列可歧化的是( ) A. Hg 22+ B. Cu(NH 3)2+ C. Cu 2O D. 均不可歧化 二.填空题1. 101BC01 Zn 和Al 不同, _____ 可以从氨水中置换出氢气,而____ 则不能发生这样的反应2. 101BC07 铜与稀硝酸反应有 _____ 气体生成,呈 _____ 色.3. 101BC08 Ag 与HI 溶液反应生成_________ 和 __________4. 101BC09 锌不与水反应,因为生成了 __________ 溶于水的________5. 101BC10 锌能溶于氢氧化钠溶液,生成 __________ 和_____________ .6. 102BC06 CuCl 为 _______ 色沉淀,溶于氨水有Cu(NH 3)2+离子生成呈_______ 色.7. 103AC01 向甘汞溶液中加入稀氨水,得到的不是Hg(OH)2HgO 或 [Hg(NH 3)4]2+,而是 _____色的沉淀物,其是 ________8. 103AC02 在亚汞盐溶液中,加入过量氯化钠溶液析出 ________色的沉淀, 其是______9. 103AC04 在HgCl 2溶液中通入适量二氧化硫生成 _____ 色沉淀物, 其为 ___________10. 104AC01 氢氧化铜呈微弱的_____,它能溶于过量的强碱溶液,生成___. 11. 105AC03 Zn(OH)2受热会分解生成______, 能溶于碱生成__________ 12. 105AC04 在Hg(NO 3)2溶液中逐滴加入KI 溶液,开始有____色____生成. 13. 105CC01 在HgCl 2溶液中滴加某无色试剂______,先产生白色沉淀,后产生黑色沉淀______.14. 105CC06 在含有氯化锌和氯化汞的混合液中,加入过量稀氨水产生白色沉淀物_____.生成_____离子仍存在于溶液中.15. 105CC08 在含有Zn(NO 3)2和Hg 2(NO 3)2的混合液中加入过量稀氨水产生灰色沉淀____,生成___离子仍存在于溶液中.16. 106AC01 所有金属中导电导热性最好的是____ ,居第二位的是________. 17. 107BC07 在一蓝色溶液A 中滴加醋酸酸化,然后滴入K 4[Fe(CN)6 溶液产生红棕色沉淀为 ___________,A 为_________18. 208AC03 ⅠB 和ⅡB 族元素从上到下活泼性依次_________.只有____________ 能与盐酸反应产生氢气.19. 208AC04 ⅡB 族金属与稀盐酸和稀硫酸反应缓慢的是 ________,而完全不反应的是_________20. 208AC06 ⅠB 族三种金属中,在有空气存在时能缓慢溶于稀酸的是_______ , 而只能溶于王水的是 ______21. 208AC07 在常温下,将同一NaOH 溶液滴入CdSO 4和 HgSO 4溶液中,分别得到 ______,_______. 三.问答题1. 101BD04 用银和硝酸反应制取AgNO 3,为了充分利用硝酸,问采用浓硝酸还是稀硝酸好2. 102BD01 当含有二价铜离子的溶液与含有CN -离子的溶液相混合时将发生什么变化?若CN -离子过量时,又出现什么现象?为什么?写出有关方程式3. 102BD04 已知: 2CuO(S) == Cu 2O(S)+1/2O 2(g)的热力学数据如下: △H Ø298 == 143.7kJ ·mol -1 △G Ø298 == 108kJ ·mol -1 △S Ø298 == 0.119kJ ·mol -1·K -1试说明常温下氧化铜稳定而在高温下(如1273K)Cu 2O 则稳定 4. 103BD04 以Hg(NO 3)2作为原料制备: 氯化亚汞 和氯化汞5. 103BD05 什么条件下可使二价汞和一价汞互相转化,试各举三个反应方程式加以说明之6. 104BD07 分离硫酸铜和硫酸锌7. 104BD08 解释:加热分解CuCl 2.2H 2O 时得不到无水CuCl 28. 104BD09 为什么当硝酸与[Ag(NH 3)2]Cl 反应时,会析出沉淀,说明发生反应的本质9. 104CD03 说明下列反应现象,并写出方程式,加热稀HNO 3和CuS 的混合物,氯化银沉淀和氨水作用,CuSO 4和KI 溶液作用,AgNO 3和KI 溶液作用。
