全国高中化学竞赛教练员习题答案 第二部分有机化学高中化学
人教版高中化学必修二有机化合物知识点与练习题(附答案)

人教版高中化学必修二有机化合物知识点与练习题(附答案)大多数化合物都含有碳元素,但只有含有碳和氢元素的化合物才称为有机化合物,简称有机物。
CO、CO2碳酸、碳酸盐、金属碳化物等化合物则属于无机化合物。
烃是一类仅含碳和氢两种元素的有机物,也称为碳氢化合物。
甲烷、乙烯和苯是烃的代表物,它们的结构特点和用途不同。
甲烷是一种饱和烷烃,稳定性较高,不与酸、碱和氧气等反应,也不会使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
它是一种无色气体,密度比空气轻,主要用于石化工业原料、植物生长调节剂和催熟剂。
乙烯是一种不饱和烯烃,含有双键和链状结构,六原子共平面。
它是一种无色气体,比空气稍轻,难溶于水,主要用于石化工业原料、植物生长调节剂和催熟剂。
苯是一种介于单键和双键之间的独特键的环状烃,平面结构为正六边形。
它是一种无色有特殊气味的液体,密度比水小,难溶于水,主要用作有机溶剂和化工原料。
烃类有机物的化学性质包括燃烧、取代反应和高温分解。
燃烧产生CO2和H2O,取代反应可以生成多种有机取代产物,而高温分解可以将甲烷分解成C和H2在取代反应中,甲烷与氯气在光照下发生反应,产生多种有机取代产物,其中HCl气体产量最多。
烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。
需要注意的是,烃类有机物的性质和用途各不相同,需要根据具体情况进行分析和应用。
乙烯是一种烯烃,具有不饱和性。
它可以发生多种反应。
氧化反应:乙烯可以燃烧,生成二氧化碳和水。
在酸性高锰酸钾溶液中,乙烯可以被氧化为二氧化碳,同时使溶液褪色。
加聚反应是乙烯分子发生加成反应,形成聚乙烯。
加成反应:乙烯可以和溴水或溴的四氯化碳溶液发生加成反应,生成1,2-二溴乙烷。
乙烯还可以和氢气、氯气、氢氯酸和水发生加成反应。
取代反应:苯是一种芳香烃,具有稳定的化学性质。
它可以通过萃取作用使溴水颜色变浅,液体分层,上层呈橙红色。
苯可以发生取代反应,生成溴苯和硝基苯。
溴苯可以通过液溴和铁单质催化剂反应得到。
全国高中化学竞赛教练员习题答案 七 化学热力学 高中化学

七、化学热力学(A )1. ∆U = -87.2 kJ·mol -1∆H = ∆U + ∆pV = ∆U + ∆nRT∴∆H = -87.2 + (2-4) × 8.314 × 298 × 10-3 = -92.2 kJ·mol -12. ∆H 298= –393.13 – (–395.0) = 1.87 kJ·mol -13. ∆r H m =12∆1H m –∆2H m –∆3H m = (–27.59)/2 – (–58.52)/6 – (+38.04)/3 = -16.72 kJ·mol -14. ∆r H m = 3∆2H m – 2∆1H m =3 × (–483.7) – 2 × (–92.4) = –1266.3 kJ·mol -1 在此温度下,正反应是放热的。
5.(1)熵增 (2)熵减 (3)熵增(4)熵减(5)熵增(6)熵增6. ∆r G m =12∆1G m +52∆2G m =12×(–142.0)+52×(–113.6) = –355 kJ·mol -1 7. ∆r H m =∆f H m,CO 2+ 2∆f H m,H 2O(l )–∆f H m,CH 4= (–392.9) + 2×(–285.5) – (–74.82) = –889.08 kJ·mol -1∆r S m =S m,CO 2+ 2S m,H 2O(l )–S m,CH 4– 2S m,O 2= 213.6 + 2 × 16.75 – 186.01 – 2 ×205.0 = –348.91 J·mol –1·K –1∆r G m =∆r H m –T ×∆r S m = – 889.08 – 298.15 × (–348.91)×10–3 = –785.05kJ·mol -18. Fe 2O 3(s) + 3C (s)2Fe (s) + 3CO (g)∆f H m,CO = –110.5 kJ·mol -1∆f H m,Fe 2O 3= –820 kJ·mol -1∴∆r H m = 3∆f H m,CO –∆f H m,Fe 2O 3= 3×(–110.5)–(–820) = –488.5 kJ·mol -1∆r S m =3S m,CO + 2S m,Fe –3S m,C – S m, Fe 2O 3=3×198+2×27–3×5.5–180= 451.5 J·mol –1·K –1假设在298K —T 区间,∆r H m 、∆r S m 基本保持不变,令∆r G m,T =0 则: T = ∆r H m /∆r S m = 488.5×103/451.5 = 1082 K故在1 atm 下,当T >1082K 时,Fe 2O 3能用碳来还原。
中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷及答案

中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷(2012年9月2日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
允许使用非编程计算器以及直尺等文具第1题(7分)1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。
简述实验现象并写出两步主要反应的离子方程式。
无色溶液产生白色沉淀,后逐渐溶解(1分,如只写白色沉淀溶解不扣分,未表明白色,扣0.5分)(1)Zn2++2NH3+2H2O=Zn(OH)2↓+2NH4+(1分)写成如下形式均给分:Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+[Zn(H2O)6]2++2NH3·H2O=Zn(OH)2↓+2NH4+ +6H2O[Zn(H2O)6]2++2NH3=Zn(OH)2↓+2NH4+ +2H2O (2)Zn(OH)2 + 2NH4+ +2NH3 = [Zn(NH3)4]2+ +2H2O如写成Zn(OH)2+4NH3= [Zn(NH3)4]2++2OH—也对,如产物写成[Zn(NH3)6]2+扣0.5分,因主要产物是[Zn(NH3)4]2+1-2 化合物[Cu(Pydc)(amp)] ·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。
第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。
Pydc 和amp是含有芳环的有机配体。
通过计算回答:(1)第一步失重失去的组分。
高中化学第二册第一节_认识有机化合物练习题含答案

高中化学第二册第一节认识有机化合物练习题含答案学校:__________ 班级:__________ 姓名:__________ 考号:__________1. 下列结构式从成键情况看不合理的是()A. B. C. D.2. 某芳香族化合物的分子式为C7H6O3,该有机物分子中含有两个−OH和—个−CHO,则符合条件的该有机物共有(不考虑立体异构)()A.5种B.6种C.7种D.8种3.下列有机化合物的分类不正确的是()CA.AB.BC.CD.D4. 下列分子中,中心原子的杂化轨道类型相同的是()A.CO2和SO2B.CH4与NH3C.H2O2与C2H4D.C2H4与N2H45. 在常温和光照条件下,可与甲烷发生反应的是()A.氧气B.氯气C.高锰酸钾酸性溶液D.浓硫酸6. 如图是四种常见有机物的比例模型示意图.有关下列说法正确的是()A.能使酸性KM n O4溶液褪色B.可与溴水发生取代反应而使溴水褪色C.与浓硫酸、浓硝酸的混合液共热发生取代反应D.可发生取代、氧化、消去、水解等反应7. 对CH4与Cl2的反应(如图所示)叙述不正确的是()A.该反应属于取代反应B.该反应的条件是光照C.该反应的生成物有四种D.该反应的现象是量筒内气体颜色变浅,器壁上有油状液滴,量筒内液面上升并产生白雾8. 受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是()A.DEHP是芳香族化合物B.DEHP是醚类物质C.DEHP分子中共有2个双键D.DEHP分子中至少有8个碳原子在同一平面9. 天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应前者大。
下列叙述:①天然气与煤、石油相比是较洁净的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一;④甲⑥甲烷易完全燃烧,故燃烧甲烷可用于制造合成氨的原料气;⑤用甲烷可生成CCl4;烷时不必保持空气流通。
高中化学奥林匹克竞赛(有机化学)高二检测题(附答案)
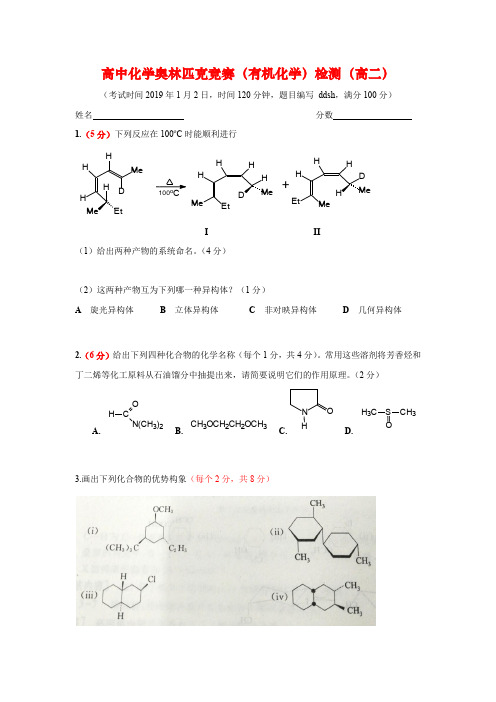
高中化学奥林匹克竞赛(有机化学)检测(高二)(考试时间2019年1月2日,时间120分钟,题目编写 ddsh ,满分100分) 姓名 分数 1.(5分)下列反应在100o C 时能顺利进行I II(1)给出两种产物的系统命名。
(4分)(2)这两种产物互为下列哪一种异构体?(1分)A 旋光异构体B 立体异构体C 非对映异构体D 几何异构体2.(6分)给出下列四种化合物的化学名称(每个1分,共4分)。
常用这些溶剂将芳香烃和丁二烯等化工原料从石油馏分中抽提出来,请简要说明它们的作用原理。
(2分)A. B.C.D.3.画出下列化合物的优势构象(每个2分,共8分)+H CO N(CH 3)2CH 3OCH 2CH 2OCH 3N OHH 3C S OCH 34.判断下列分子是否具有光学活性(共10分)5.下列各组化合物都能够发生分子内的SN2反应。
对各组反应的难易程度进行排序(6分)6.(每式1分,每个命名1分,共9分)2004年是俄国化学家马科尼可夫(V . V . Markovnikov ,1838-1904)逝世100周年。
马科尼可夫因提出C =C 双键的加成规则(Markovnikov Rule )而著称于世。
本题就涉及该规则。
给出下列有机反应序列中的A 、B 、C 、D 、E 、F 和G 的结构式,并给出D 和G 的系统命名。
7.(13分)写出下列反应的每步反应的主产物(A 、B 、C )的结构式;若涉及立体化学,请用Z 、E 、R 、S 等符号具体标明。
(B 是两种几何异构体的混合物)8.(13分)以氯苯为起始原料,用最佳方法合成1-溴-3-氯苯(限用具有高产率的各反应,标明合成的各个步骤)。
CH 2COOH CH 2COOHACH CHO(等摩尔)BHBrC9.(10分)用苯、不超过四个碳的有机化合物和合适的无机试剂为原料合成以下产物:10.(20分)写出下列转化的反应流程高中化学奥林匹克竞赛(有机化学)检测(高二)(答案和评分)(满分100分,时间120分钟)考试时间2019年1月2日 试题编制 dds姓名 分数 1. (5分) 下列反应在100o C 时能顺利进行:I II(1)给出两种产物的系统命名。
高中有机化学综合练习题(附答案)

高中有机化学综合练习题一、单选题1.朋友圈中一个叫“福(氟)禄(氯)双全(醛)”的物质(结构简式如图)火了起来。
该物质属于( )A.有机物B.无机物C.单质D.氧化物2.下列化学用语正确的是( )A.羟基的电子式:B.甲醇的球棍模型:C.是3﹣甲基﹣1,3﹣丁二烯的键线式D.聚丙烯的结构简式:3.下列物质不含官能团的是( )A.CH3CHO B.CH3CH2OH C.CH3CH2Br D.4.下列有机反应类型中,不正确的是( )A.取代反应B.CH3CH3+Cl2CH3CH2Cl+HCl置换反应C.CH2=CH2+H2O CH3CH2OH加成反应D.2CH3CHO+O22CH3COOH氧化反应5.下列有关说法正确的是( )A.红磷和白磷互为同位素B.丁烯和丙烯互为同素异形体C.CH3CH2CH2CH3与CH(CH3)3互为同分异构体D.16O和18O互为同系物6.提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法不对的是( )7.下列实验装置能达到实验目的是(夹持仪器未画出)( )A.用于制备乙酸乙酯B.用于石油的分馏C.用于实验室制硝基苯D.可证明酸性:盐酸>碳酸>苯酚8.下列有关石油的炼制工艺中,属于获得汽油的主要途径的是( )A.裂化B.裂解C.常压分馏D.减压分馏9.下列化学用语或有关物质性质的描述正确的是( )A.2-甲基戊烷也称异戊烷B.X、Y、Z的一氯代物均有4种C.乙烯在一定条件下能发生加成反应、加聚反应,还能被酸性高锰酸钾溶液氧化D.治疗疟疾的青蒿素的结构简式为,分子式是C H Ol520510.某气态烃 20mL完全燃烧时消耗同温同压下的氧气100mL。
则该烃是( )A.C2H4B. C3H8C. C4H8D. C5H1011.已知异丙苯的结构简式如图,下列说法错误的是( )A. 异丙苯可以使酸性高锰酸钾溶液褪色B. 异丙苯的沸点比苯高C. 异丙苯中所有碳原子不可能都处于同一平面D. 异丙苯和苯乙烯互为同系物12.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入直馏汽油、苯、酒精、NaBr溶液,振荡后静置,现象正确的是( )A. Ⅰ中溶液分层,下层呈紫红色B. Ⅱ中溶液分层,上层呈紫红色C. Ⅲ中溶液分层,下层呈黄褐色D. Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色13.维生素P的结构如图所示,其中R为烷烃基。
2021年高中化学必修二第七章《有机化合物》复习题(答案解析)(2)

一、选择题1.下列说法正确的是()A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为C n H2n B.一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积C.某气态烃C x H y与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4D.相同质量的烃,完全燃烧,消耗O2越多,烃中含氢元素的质量分数就越高2.下列各组有机物以任意比混合,若总物质的量一定,完全燃烧时生成水的质量和消耗氧气的质量不变的是A.C3H8、C4H6B.C3H6、C4H6O2C.C2H2、C6H6D.CH4O、C4H4O5 3.下列操作能达到相应实验目的的是()A.A B.B C.C D.D4.通过测定血液或尿液中某物质的含量可诊断糖尿病患者的病情,该物质为()A.蛋白质B.葡萄糖C.淀粉D.油脂5.下列食物属于酸性食物的是A.柠檬B.苹果C.生菜D.火腿肠6.下列实验方案能达到目的的是A.用浓硫酸干燥NH3B.用焰色反应鉴别KCl和K2SO4C.用NaOH溶液除去Cl2中的HCl D.用灼烧闻气味的方法鉴别棉线和羊毛线7.室温下,下列各组微粒在指定溶液中能大量共存的是()A.pH=1的无色溶液中:CH3CH2OH、Cr2O2-7、K+、SO2-4B.c(Ca2+)=0.1mol·L-1的溶液中:NH+4、SO2-3、Cl-、Br-C.含大量HCO-3的溶液中:C6H5O-、CO2-3、Br-、K+D.能使甲基橙变为橙色的溶液:Na+、NH+4、CO2-3、Cl-8.下列反应中前者属于取代反应,后者属于加成反应的是A.乙醇与金属Na反应;乙烯使酸性高锰酸钾溶液的褪色B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷C.苯滴入浓硝酸和浓硫酸的混合液中,有油状液体生成;乙烯与水生成乙醇的反应D.在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应9.下列说法不正确...的是A.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质B.在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质C.因铝制品表面有致密的氧化膜保护层,故可长时间盛放咸菜等腌制食品D.工业上,二氧化硫可用于漂白纸浆以及草帽等编织物10.下列说法正确的是A.乙烯、聚氯乙烯和苯分子中均含有碳碳双键B.淀粉、纤维素、蛋白质、花生油都是天然有机高分子化合物C.只用一种试剂就可以鉴别甲苯、乙醇和四氯化碳D.淀粉和纤维素互为同分异构体二、填空题11.我国的酿酒历史源远流长,唐朝大诗人李白在诗句“遥看汉水鸭头绿,恰似葡萄初酦醅”中,将碧绿的汉水比作初酿的葡萄酒。
2000年全国高中学生化学竞赛(浙江赛区)初赛试题与答案

C、m1 一定等于 m2
D、m1 可能大于 m2
23、第 IIIA 族的 Al、Ga 均为两性元素,Al(OH)3 与 Ga(OH)3 相比,后者酸性强与前者。当
CO2 通入 NaAlO2 和 NaGaO2 的溶液中,首先沉淀出来的氢氧化物是
A、Al(OH)3
B、Ga(OH)3
C、同时沉淀出来
D、无法判断
A、焦炭
B、甲烷
C、一氧化碳
D、C12H26
21、将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如果把
含 H2S 的空气通入 CuSO4 溶液,导电性稍有变化但溶液吸收 H2S 的容量大;若用溴水,则 吸收容量不大而导电性变化很大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵
物质的平衡会发生较大影响。如:
CaAl2Si2O8+ Mg2SiO4 = CaMg2Al2Si3O12 (钙长石) (镁橄榄石) (钙镁)石榴子石
摩尔质量(g/mol) 278
密度(g/cm3)
2.70
140.6 3.22
413.6 3.50
在地壳区域变质的高压条件下,有利于
A、钙长石生成
B、镁橄榄石生成
能是
A、H2XO3
B、X(OH)2
C、H2XO4
D、H6XO6
13、将 H2、Cl2 等体积混合于密封容器中,用强紫外线照射时,则容器内的压力
A、增大下列操作中,原溶液不能保持澄清的是
A、往饱和 CaCl2 溶液中通入 CO2
B、往 CuSO4 溶液中加入少量氨水
错选的不给分;有 2 个答案,只选一个且选对的给 1 分)
11、将 0.2mol NO2、0.1mol CO2、0.5mol HCl 气体分别依次通入含 0.4mol NaOH 溶液中,最
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二部分 有机化学 一、系统命名 1. (1) 2,2,4,4四甲基戊烷 (2) 2,5,6三甲基辛烷 (3) 2,3,5,5四甲基庚烷 (4) 3甲基4乙基己烷 (5) 2,6,8三甲基5异丁基癸烷 2. (1) 1,1二甲基3异丙基环戊烷 (2) 2甲基3环丙基庚烷 (3) 1甲基3环丁基环戊烷 (4) 螺[3,4]辛烷 (5) 二环[2,2,1]庚烷 (6) 二环[4,2,0]辛烷 (7) 二环[3,3,1]庚烷 (8) 4–甲基螺[2,4]庚烷 (9) 3,6二甲基二环[3,2,0]庚烷 (10) 1,3,8三甲基二环[4,4,0]癸烷 3. (1) (1R,3R)1甲基3异丙基环己烷 (2) (5S)5氯螺[2,5]辛烷 (3) (1R,2R,4R)1,2二甲基4氯环己烷 (4) 顺1甲基4(R仲丁基)环己烷 (5) (1S,2R,4S)1,2,4–三甲基环己烷 4. (1) 2甲基2氯丁烷 (2) 2甲基3氯丁烷 (3) (2R)1,1二甲基2氯甲基环戊烷 (4) 2–乙基–4–氯–1–丁烯 (5) 3氯甲基2溴己烷 (6) 反1溴4碘环己烷 (7) (1R,2S,3S)1甲基3氟2氯环己烷 (8) (2S,3S,4R)2,3,4三氯己烷 5. (1) 7甲基3仲丁基4氯1,5辛二烯 (2) 2,3,4三甲基2戊烯 (3) 3乙烯基1,5庚二烯 (4) 1甲基5乙基1,3环己二烯 (5) 3,5二甲基4异丙基1,3己二烯 (6) 3亚甲基环戊烯 (7) (E)2,3二甲基1溴2戊烯 (8) 1烯丙基2丙烯基1,3环己二烯 (9) (E,S)4甲基2己烯 (10) (3S,4R)4甲基3氯环戊烯 (11) (E,R)2,7二甲基5溴4壬烯 6. (1) (E)3戊烯1炔 (2) (S)3甲基1戊烯4炔 (3) 5氯2戊炔 (4) (1R,2S)1甲基2丙炔基环己烷 (5) (1R,2S)1甲基2乙炔基环丙烷 (6) (Z)5庚烯1,3二炔 (7) 5炔丙基1,3环己二烯 (8) 顺1,2二甲基反3乙炔基环丙烷 7. (1) 1甲基1,4环己二烯 (2) 2甲基1,3环己二烯 (3) (E)3亚乙基环己烯 (4) (2E,4Z)2,4庚二烯 (5) (Z)4亚乙基环己烯 (6) 1,5乙二烯3炔 (7) 1,3庚二烯6炔 (8) 二(1环己烯基)乙炔 (9) (2Z,4R)4甲基2庚烯5炔 8. (1) 4叔丁基乙苯 (2) 2,4二氯甲苯 (3) 3溴苯乙烯 (4) 3环己基甲苯 (5) 4溴苄基氯 (6) 2氯2′溴联苯 (7) 4甲氧基苯甲醛 (8) 二苯甲烷 (9) 1氯2(2氯丙基)苯 (10) (E)3,4二(4羟基苯基)3己烯 9. (1) 4,4–二甲基–1–溴–3–戊醇 (2) 3–丁烯–2–醇 (3) 4–苯基–1–丁醇 (4) 1–环戊烯基甲醇 (5) 3–环己烯–1–醇 (6) (1S,2S)–2–甲基–1–环戊醇 (7) 4,4–二甲基–2–环己烯–1–醇 (8) (2R,3S)–2–甲基–3–氯–1–醇 (9) 反–4–乙基–1–环己醇 10. (1) 甲基–β–氯乙基醚 (2) 丙基环己基醚 (3) 4–硝基苯乙醚 (4) 乙烯基苄基醚 (5) 1,3–二乙氧基苯 (6) 5–甲氧基–2–戊醇 (7) 2,4–二氯–3′–硝基二苯醚 (8) 乙二醇二甲醚或1,2–二甲氧基乙烷 (9) 1,2–环氧丁烷 (10) 顺–2,3–环氧丁烷 (11) (5S,2S)–5–乙基–2–氯氧杂环庚烷 (12) 2–甲基–1,3–环氧戊烷 (13) 苯并–15–冠–5 (14) 18–冠–6 11. (1) (E)–2–丁烯醛(反巴豆醛) (2) (E)–3–苯基丙烯醛(反肉桂醛) (3) 1,4–戊二烯–3–酮(二乙烯基酮) (4) 5–己烯–3–酮(乙基烯丙基酮) (5) 3–甲基–2–丁酮(甲基异丙基酮) (6) 1,1–二氯丙酮(α,α–二氯丙酮) (7) 1,3–二苯基丙酮(二苄基酮) 12. (1) 3–羟基丁酮 (2) 5–溴己醛 (3) (E)–4–甲基–4–己烯–1–炔–3–酮 (4) (E)–4–甲基–5–苯基–4–己烯–3–酮 (5) 5–甲基–3–氧代–1–己醇 (6) (Z)–3–己烯二醛 (7) 2–环己烯–1–酮 13. (1) 2–丁烯酸 (2) 2,2–二甲基丙酸 (3) 4–溴丁酸 (4) 3–氧代戊酸 (5) 4–羟基–2–氟丁酸 (6) 4–(2–萘基)丁酸 (7) 2–羟基–3–氧代戊酸 (8) 4–乙酰基苯甲酸 (9) 3–苯基丙酸 (10) (E)–3–庚烯酸 (11) 3–乙烯基–4–己炔酸 (12) 3–甲酰基苯甲酸 (13) 2–羟基–1,2,3–丙三酸 (14) 1,3–苯二甲酸 (15) (9Z,12Z,15Z)–9,12,15–十八三烯酸 (16) 4–甲基–5–戊内酯
二、烷、烯、炔 1. 2–甲基丁烷为 , 分子中有9种不同化学环境的氢,所以其中一氯
代物共有四种,分别为 CHCH2CH3CH3CH2Cl CH
3CH2CH3CH3ClC
(a) 2–甲基–1–氯丁烷 (b) 2–甲基–2–氯丁烷 CH3CHH3CCH3ClCH CH3CH3ClCHCH2CH
2
(c) 2–甲基–3–氯丁烷 (d) 3–甲基–1–氯丁烷
CH3CHCH2CH3CH3相对比为a:b:c:d=(6×1):(1×5):(3.8×2):(3×1)=6:5:7.6:3 相对百分比为
a: 6628%657.6321.6 b: 523%21.6
c: 7.635%21.6 d: 314%21.6
2. 丙烷中具有两种不同化学环境的氢,一溴化后分别得到 (a) 1–溴丙烷 CH3CH2CH2Br
(b) 2–溴丙烷 CH3CH3BrCH
相对百分比a:b= (6×1) : (2×82) = 6:164 = 3:82 百分比为a: 3/(82+3) = 3.5%;b: 82/85 = 96.5% 选择性溴化比氯化要高。 3. 2,3–二甲基–丁烷 4. (1)1,2,4–三甲基二环[4,4,0]癸烷 (2)三环[4,2,2,01,6]癸烷 (3)顺,顺–1,2,4–三甲基环己烷(或r–1,顺–2,顺–4–三甲基环己烷) (4)顺,反–1,2,4–三甲基环己烷(或r–1,顺–2,反–4–三甲基环己烷) 5.
(a) CH2Br 溴甲基环己烷
(b) BrCH3 1–甲基–1–溴环己烷
(c) Br
CH3 顺–1–甲基–2–溴环己烷及
反–1–甲基–2–溴环己烷
(d) Br
CH3 顺–1–甲基–3–溴环己烷及
反–1–甲基–3–溴环己烷
(e) BrCH
3
顺–1–甲基–4–溴环己烷及
反–1–甲基–4–溴环己烷 烷烃卤化反应中,氢的活性3°>2o >1o,所以溴化主要产物为(b)1–甲基–1–溴环己烷
6. BrBr
7. (1) CF3CH2CH2Br (2) CH3CHBrBr (3) CH3CHCH2BrCHO 重排
醇
8. 顺–2–丁烯反应产物 CCOHHHOHCH3CH3+
CC
OH
H
HOH
CH3CH
3
反–2–丁烯反应产物 CCOHHHOHCH3CH3 9.
10. HCH3
CC
CH2H+CH2CH2CH
2OH
HCl(A)CH
3CH2CH2OCH2CH2CH
11. CCH3CH3CH3CH3CHCH2+ HICCH3CH3CH
3CH
I_
CH3CCH3CH3CH3CHI(A)
CH3CCH3CH3CH3CHI_CH3CCH3CH3CH3CH
I
(B)
CH3CCH3CH3CH3CHICCH3CH3CH3CHCH2
KOHA.
顺–2–丁烯反应产物 CC
OH
HHOH
CH3
CH
3
反–2–丁烯反应产物 CC
OHHHOHCH3CH3CCOHHH
OHCH3
CH3
+
