阿齐沙坦
阿齐沙坦主要原辅料及工艺说明
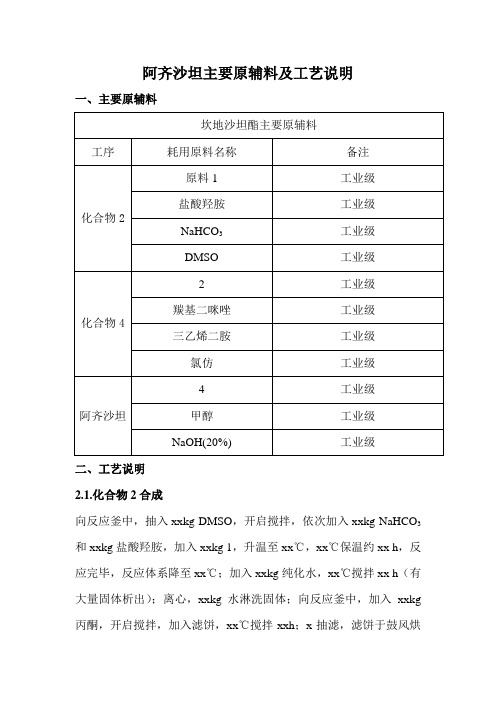
阿齐沙坦主要原辅料及工艺说明
一、主要原辅料
二、工艺说明
2.1.化合物2合成
向反应釜中,抽入xxkg DMSO,开启搅拌,依次加入xxkg NaHCO3和xxkg盐酸羟胺,加入xxkg 1,升温至xx℃,xx℃保温约xx h,反应完毕,反应体系降至xx℃;加入xxkg纯化水,xx℃搅拌xx h(有大量固体析出);离心,xxkg水淋洗固体;向反应釜中,加入xxkg 丙酮,开启搅拌,加入滤饼,xx℃搅拌xxh;x抽滤,滤饼于鼓风烘
箱,xx℃干燥;加入xxkg乙酸乙酯与xxkg氯仿,开启搅拌,加入上述固体,升温至回流,回流打浆xxh,降温xx℃;抽滤;xx℃鼓风干燥xxh,得xxkg类白色固体。
2.2.化合物4合成
向反应釜中,抽入xxkg氯仿,加入xxkg 2和羰基二咪唑xxkg;xxkg 三乙烯二胺和xxkg氯仿的溶液;回流反应xx h,反应完毕,降至xx℃,加入盐酸水溶液xxkg,静置分层;分出有机层,有机层中加入无水硫酸钠xxkg,抽滤;浓缩滤液有大量固体析出;抽滤,干燥得到xxkg 白色固体。
2.3.阿齐沙坦合成
向反应釜中,加入xxkg甲醇,开启搅拌,加入xxkg 4和xxkg NaOH 溶液,反应完毕,用盐酸溶液调节PH=3(有大量固体析出);离心;干燥,得xxkg白色粗品。
试析阿齐沙坦胃漂浮缓释片的制备及体外释放

试析阿齐沙坦胃漂浮缓释片的制备及体外释放阿齐沙坦是新一代选择性AT1亚型血管紧张素II受体拮抗剂ARBs类抗高血压药。
它与血管紧张素转化酶抑制剂ACEI类降压药物相比,具有平稳降压、不会引起干咳的优点。
尽管已上市的有多个ARBs,但对于许多患者,仅抑制肾素-醛固酮系统RAS活性并不足以控制血压和降低心血管疾病及糖尿病的风险。
研究显示,阿齐沙坦作为新一代双重功能ARBs,不仅拮抗血管紧张素II的1型受体AT1受体,还可能通过多种机制降低心血管疾病及糖尿病的风险[1,2]。
2021年4月28日,日本武田制药公司Takeda完成了该药物三期临床试验。
临床试验证明,本品具有较好疗效,且不良反应发生率较低,依从性较好的特点。
胃漂浮滞留型缓释片[3]是一种特殊缓释制剂,口服后能漂浮于胃液之上,同时缓慢释药,从而延长了药物在胃内的滞留时间,使药物在胃及小肠上端的吸收率提高。
目前尚未见阿齐沙坦胃漂浮缓释片的相关报道。
本实验采用湿法制粒制备了阿齐沙坦胃漂浮缓释片, 并对其体外溶出度等制剂质量进行了初步评价。
1 材料1.1 仪器TDP型单冲压片机上海天凡药机制造厂;PYC-A型片剂硬度仪上海黄海药检仪器厂;2RS-8G智能溶出试验仪天津海益达科技有限公司;UV-2450紫外分光光度计日本岛津公司1.2 试药阿齐沙坦浙江台州保隆化工有限公司;羟丙甲纤维素HPMC,MethocelK4M、K15M、K100M,上海卡乐康包衣技术有限公司;低取代羟丙基纤维素L-HPC,安徽山河药用辅料有限公司;硬脂酸镁湖南尔康制药股份有限公司;碳酸氢钠湖北兴银河化学有限公司。
2 方法和结果2.1 制备工艺将原料、HPMC、L-HPC及碳酸氢钠分别过100目筛,按等量递加法混匀,以80%乙醇溶液为粘合剂,采用30目筛制粒,60℃干燥4 h,整粒,加入及硬脂酸镁,混合均匀,压片,硬度控制在10-12 kg。
2.2 质量评价测定波长的选择精密称取原药适量,加0.1 mol·ml-1盐酸,以0.1 mol·ml-1盐酸为空白,于200-400 nm波长范围内扫描,在240 nm处有最大吸收峰,且辅料无干扰,故选择240 nm为紫外检测波长。
阿齐沙坦研究计划

阿齐沙坦片研究计划一、原料药信息英文名:Azilsartan化学名:2-乙氧基-1-[[2'-(4,5-二氢-5-氧代-1,2,4-恶二唑-3-基)联苯-4-基]甲基]苯并咪唑-7-羧酸分子式:C25H20N4O5分子量:456.45CAS号:147403-03-0结构式:溶解性:为白色或微黄色的结晶或结晶性粉末,易溶于N,N-二甲基乙酰胺,难溶在甲醇中,微溶于乙醇(99.5),几乎不溶于水。
二、制剂信息目前阿齐沙坦片剂于2012年5月28日在日本上市,公司名称为武田药品工业株式会社,规格为20mg(微赤色)和40mg(黄色),主要用于高血压的治疗。
非活性成分:乳糖一水合物(lactose)、玉米淀粉(Starch)、微晶纤维素(MCC)、羟丙基纤维素(HPC)、低取代羟丙基纤维素(L-HPC)、聚乙二醇6000(PEG6000)、硬脂酸镁、羟丙甲纤维素(HPMC)、二氧化钛、三氧化二铁。
分析:填充剂:乳糖一水合物、玉米淀粉、微晶纤维素粘合剂:羟丙基纤维素(HPC在国内用于粘合剂较少,拟采用HPMC E5)崩解剂:低取代羟丙基纤维素润滑剂:聚乙二醇6000、硬脂酸镁包衣剂:羟丙甲纤维素、二氧化钛、三氧化二铁、聚乙二醇6000注:聚乙二醇6000可能存在一定稳定剂作用,制剂研究过程中加以确认;采用湿法制粒工艺制备。
依据原研片剂形状尺寸推测,原研片剂片重在100~150mg之间,暂定为150mg研究。
时间具体研究内容2012年9月、10月完成辅料的采购,制剂相关文献的调研,开展辅料相容性研究,及处方筛选,协助市售、自制品溶出度测定。
2012.11月针对市售品溶出度,进行小试处方优化,对填充剂、崩解剂、PEG用量进行考察,确定20mg素片溶出及稳定性主要影响因素。
2012.12月针对市售品溶出度,进行小试处方优化,及包衣因素对溶出度影响,进行处方调整及优化,完成20mg处方研究,开展40mg规格研究。
阿齐沙坦片体外溶出方法

阿齐沙坦片体外溶出方法阿齐沙坦是一种血管紧张素Ⅱ受体拮抗剂,主要用于降低高血压和心衰患者的血压。
在药效学研究中,研究药物的体外溶出是非常重要的一步。
本文将介绍阿齐沙坦片的体外溶出方法。
1.实验设备和试剂仪器:电子天平、旋转式溶出仪;试剂:阿齐沙坦标准品、磷酸二氢钾、氯化钠、氢氧化钠、橙黄法尼粉、去离子水。
2.实验方法2.1 预处理样品(1)取5个阿齐沙坦片,除去包衣,将药片平均粉碎,挑取约20mg药粉称量,加入预先称量好的50ml去离子水中,超声处理10min。
(2)采用橙黄法尼粉标记,(2.1)称取适量的橙黄法尼粉,加入到试样液中,搅拌均匀。
(2.2)移出适量的标样液(标准品中加橙黄法尼粉),加入适量的橙黄法尼粉,搅拌均匀,则制备好了标准品。
2.2 磷酸缓冲液的配制磷酸缓冲液配制:用25%磷酸溶液和1M氢氧化钠调节,调至pH7.4。
2.3 体外溶出实验旋转式溶出仪中加入900ml磷酸缓冲液(pH7.4)作为溶液,溶液温度调节至37℃±0.5℃,溶液搅拌速率调节至100r/min。
在旋转式溶出仪的6个篮子中分别加入预处理好的药粉50mg,加入1ml橙黄法尼粉标记液作为标准品,放入篮子中后,立即开始溶出实验。
定时取出10ml溶液,离心5分钟,用超高效液相色谱法检测阿齐沙坦的含量。
3.结果分析3.1 阿齐沙坦的体外溶出曲线体外溶出曲线是药物溶出度和溶出时间的曲线。
根据实验结果绘制药物体外溶出曲线,可知阿齐沙坦在磷酸缓冲液中溶出程度。
3.2 质量控制方法(1)标准品与试样中阿齐沙坦的峰面积进行比较,可得到试样中阿齐沙坦的含量。
(2)比较管内标准品和标准曲线,评估测试结果。
阿齐沙坦片体外溶出方法

阿齐沙坦片体外溶出方法阿齐沙坦片是一种常用的降压药物,其主要成分为阿齐沙坦。
为了确保阿齐沙坦片能够发挥稳定有效的治疗作用,需要对其进行体外溶出测试。
下面将详细介绍阿齐沙坦片体外溶出方法。
一、实验原理体外溶出测试是指将阿齐沙坦片置于一定温度的胃肠道模拟溶出液中,并以一定速率搅拌,使药品逐渐溶解并释放出来。
通过测定溶出液中阿齐沙坦的浓度变化,确定其在胃肠道中的溶出速率,从而评估阿齐沙坦片的溶出特性。
二、仪器与试剂1.体外溶出仪器。
2.电子天平。
3.离心机。
4.试管。
5.微孔头滤纸。
6.模拟胃肠道模拟液。
7.磷酸二氢钠缓冲液。
8.无水乙醇。
9.去离子水。
三、实验步骤1.准备溶出介质。
将磷酸二氢钠缓冲液(pH 6.8)和无水乙醇按5:5的比例混合,得到模拟胃肠道模拟液。
2.称量样品。
将阿齐沙坦片称量2.5mg,放入一个直径为25mm的试管中。
3.添加介质。
将20ml的模拟胃肠道模拟液加入试管中,使药品完全浸没在液体中。
将试管放入离心机中进行离心,速度为100r/min,时间为5分钟。
离心的目的是使液体更加均匀地分布在试管中。
5.设定试验条件。
将试管放入体外溶出仪中,设定温度为37℃,转速为100r/min。
6.取样分析。
在预定时间内(例如5min、10min、15min、30min、45min、60min、120min等),分别取出0.5ml溶出液,并用微孔头滤纸过滤。
然后采用高效液相层析法(HPLC)测定阿齐沙坦的浓度。
7.记录数据。
将每个时间点的阿齐沙坦溶出率(%)记录在表格中。
四、实验注意事项1.阿齐沙坦片的质量应该足够准确,尽量避免误差。
2.体外溶出仪应该保持平稳,以确保转速和温度的准确性。
3.在取样之前,要记得使用微孔头滤纸过滤液体,以去除杂质和颗粒。
4.在换液过程中,要注意不要损坏试管和样品。
5.在记录数据的过程中,要注意准确记录时间和阿齐沙坦溶出率。
以上就是阿齐沙坦片体外溶出测试的具体步骤和注意事项。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿齐沙坦价格:265.00元/千克起订量:1 千克可售数量:50 千克联系人:汪峰先生 (销售经理)山东创新药物研发有限公司以化药3类为主要研究方,自主研发“阿齐沙坦(azilsartan)" 化药3+3类,用于抗高血压。
【药品名称】阿齐沙坦(azilsartan)【CAS】147403-03-0【注册分类】化学药品3.1【剂型及规格】片剂,20mg、40mg。
【适...1.一种阿齐沙坦的制备方法,包括:(1)按摩尔比1:1~1:3将2,3-二氨基苯甲酸甲酯和原碳酸四乙酯溶解到醋酸中,于20~30℃加入四丁基氟化铵,加热回流反应10~16小时后冷却至室温,然后蒸去醋酸,将得到的粗产品用水打浆过滤,最后用乙醇重结晶、干燥,得到乙氧基苯并咪唑-7-羧酸甲酯;(2)将2-氰基-4′-甲基联苯溶于二氯甲烷中,分批加入N-溴代琥珀酰亚胺,室温下搅拌4-8小时,反应结束后,经水洗、蒸馏、石油醚打浆,然后过滤、干燥,得到2-氰基-4′-溴甲基联苯;(3)按摩尔比1:1~1:2将上述乙氧基苯并咪唑-7-羧酸甲酯和2-氰基-4′-溴甲基联苯溶解到乙醇中,加入碳酸钾,加热回流8~16小时,然后蒸掉乙醇、加水打浆,再过滤、用乙醇重结晶得到1-[(2′-氰基联苯-4-基)甲基]-2-乙氧基苯并咪唑-7-羧酸甲酯;(4)将上述1-[(2′-氰基联苯-4-基)甲基]-2-乙氧基苯并咪唑-7-羧酸甲酯悬浮于水中,加入盐酸羟胺、氢氧化钠和四丁基氟化铵,加热回流10~16小时后冷却,然后加入氢氧化钠,再于20~30℃加入氯甲酸乙酯,加热回流8~16小时后冷却析出固体,最后过滤、水洗、干燥得到阿奇沙坦甲酯;(5)将上述阿奇沙坦甲酯悬浮于水中,加入氢氧化锂水溶液,室温搅拌12-16小时,于冰水浴下调节pH值为2-4后过滤,最后用乙醇重结晶,得到阿齐沙坦。
上海市浦东新区张江高科技产业东区瑞庆路526号1幢4层403室上海凯谱林医药开发有限公司阿齐沙坦是新一代选择性AT1亚型血管紧张素II受体拮抗剂(AR Bs)类抗高血压药。
它与血管紧张素转化酶抑制剂(ACEI)类降压药物相比,具有平稳降压、不会引起干咳的优点。
尽管已上市的有多个ARBs,但对于许多患者,仅抑制肾素-醛固酮系统(RAS)活性并不足以控制血压和降低心血管疾病及糖尿病的风险。
研究显示,阿齐沙坦作为新一代双重功能ARBs,不仅拮抗血管紧张素II的1型受体(A T1受体),还可能通过多种机制降低心血管疾病及糖尿病的风险[1,2]。
2010年4月28日,日本武田制药公司(Takeda)完成了该药物三期临床试验。
临床试验证明,本品具有较好疗效,且不良反应发生率较低,依从性较好的特点。
目前国内尚未见阿齐沙坦片的相关报道。
本实验采用湿法制粒制备了阿齐沙坦片, 并对其体外溶出度等制剂质量进行了初步评价。
1 材料1.1 仪器TDP型单冲压片机(上海天凡药机制造厂);2RS-8G智能溶出试验仪(天津海益达科技有限公司);UV-2450紫外分光光度计(日本岛津公司)1.2 试药阿齐沙坦(浙江台州保隆化工有限公司);微晶纤维素(Avicel PH101,上海昌为医药辅料技术有限公司);一水乳糖(上海昌为医药辅料技术有限公司);淀粉(安徽山河药用辅料有限公司);羟丙甲纤维素(METHOCEL™ E5,广州市天润药业有限公司);低取代羟丙基纤维素(安徽山河药用辅料有限公司);硬脂酸镁(湖南尔康制药股份有限公司)。
2 试验方法及结果2.1 制备工艺将原料、乳糖、部分微晶纤维素、淀粉及低取代羟丙基纤维素按等量递加法混匀,以羟丙甲基纤维素水溶液为粘合剂,采用30目筛制粒,60℃干燥1h,整粒,加入微晶纤维素及硬脂酸镁,混合均匀,压片(片重约135mg),包衣(增重2.5~3.0%)。
2.2 微晶纤维素用量的选择在原辅料相容溶性试验及对溶出度的影响的基础上,本品选择微晶纤维素为填充剂,用量为30%压片后的成型较好。
本实验采用微晶纤维素具有海绵状多孔管状结构,遇水后.水分子易进入片剂内部,破坏微晶之间的氢键起到崩解剂的作用,有利于药物的溶出。
2.3 处方处方优化在预试验基础上考察发现,影响片剂质量的主要因素为乳糖用量(A)、微晶纤维素内外加的比例(B)、低取代羟丙基纤维素的用量(C)及羟丙甲基纤维素水溶液浓度(D),因此采用正交设计法按L9(34)正交表设计成四因素三水平的正交试验,以崩解时间为考察指标。
其实验结果见表1、2。
表1 因素水平表Tab 1 Levels of factors水平因素A B C D1 30% 1:1 1% 0.5%2 20% 1:2 3% 1.0%3 10% 1:3 5% 1.5%表2 试验处方设计Tab 2 Results of orthogonal tests试验号 A B C D 崩解时间/s1 1 1 1 1 70.42 1 2 2 2 86.73 1 3 3 3 97.64 2 1 2 3 78.45 2 2 3 1 95.66 2 3 1 2 76.37 3 1 3 2 92.78 3 2 1 3 73.19 3 3 2 1 86.2均值1 84.90 80.50 73.27 84.07均值2 83.43 85.13 83.77 85.23均值3 84.00 86.70 95.30 83.03极差 1.47 6.20 22.03 2.20结果表明,辅料用量对分散片崩解时间的影响为C>B>D>A,通过正交试验得到较优处方为A1B3C3D2, 考虑到压片时片剂较好的可压性,选择处方为A3B3C3D2。
3 质量评价照上述制备工艺及优化的处方A3B3C3D2,重新制备三批样品,对其进行了体外溶出度及影响因素的考察。
3.1 溶出度测定标准曲线:精密称取阿齐沙坦对照品10.51mg,精密称定,置100ml量瓶中,用pH6.8磷酸盐缓冲液(含0.5%十二烷基硫酸钠)溶解并稀释至刻度,摇匀,作为溶液I。
精密量取溶液I 2ml、4ml、5ml、6ml、7ml,置100ml量瓶中,用pH6.8磷酸盐缓冲液稀释至刻度,摇匀,作为供试品溶液,照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA),在240nm的波长处测定吸收度。
以浓度C(µg/ml)为横坐标,以吸收度A为纵坐标,进行线性回归。
试验结果见表3。
回收率:对照品溶液:精密称取阿齐沙坦对照品10.53mg置100ml量瓶中,加pH6.8磷酸盐缓冲液(含0.5%十二烷基硫酸钠)适量,振摇使阿齐沙坦溶解,加pH6.8磷酸盐缓冲液稀释至刻度,摇匀,精密量取续滤液5ml,置100ml量瓶中,用pH6.8磷酸盐缓冲液稀释至刻度,摇匀,作为对照品溶液。
供试品溶液:分别按处方量的80%、100%、120%,精密称取阿齐沙坦对照品约8.0mg、10.0mg、12.0mg,每个浓度3份,共9份,分别置100ml量瓶中,按处方加入辅料,加pH6.8磷酸盐缓冲液(含0.5%十二烷基硫酸钠)适量,振摇使阿齐沙坦溶解,加pH6.8磷酸盐缓冲液稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置100ml量瓶中,用0.1mol/L盐酸溶液稀释至刻度,摇匀,作为供试品溶液。
分别取上述对照品溶液与供试品溶液,照分光光度法(中国药典2010年版二部附录ⅣA)在240nm的波长处测定吸收度。
计算回收率。
试验结果见表3。
精密度:取线性关系试验项下浓度为10.51μg/ml的溶液,作为供试品溶液,照分光光度法(中国药典2010年版二部附录ⅣA)在240nm的波长处连续测定吸收度6次并记录,试验结果见表3。
溶液稳定性:取溶出度测定项下的溶液,分别于0、1、2、4、6小时按溶出度方法测定,考查溶液稳定性,结果见表3。
表3 溶出度方法学验证结果Tab 3 Results of the validated dissolution method项目验证结果线性阿齐沙坦在2.102~7.357µg/ml的浓度范围内浓度与其吸收度A呈良好的线性关系,相关系数为0.9991。
回收率平均回收率为99.2%,RSD为1.13%。
精密度 RSD为0.96%。
溶液稳定性溶液于0、1、2、4、6 h的RSD为1.12%,溶液较稳定。
结果表明,本法线性、精密度、回收率及溶液稳定性均良好。
测定方法取本品,照溶出度测定法(中国药典2010年版二部附录ⅩC第二法),转速50 r•min-1,以pH6.8磷酸盐缓冲液(含0.5%十二烷基硫酸钠)900 mL为出介质,温度37℃。
依法操作,经45分钟时,取溶液滤过,精密量取续滤液5ml,置50ml量瓶中,用溶出介质稀释至刻度,摇匀作为供试品溶液;另精密称取阿齐沙坦对照品适量,用pH6.8磷酸盐缓冲液定量稀释制成每1ml中约含4μg的溶液。
取上述两种溶液,照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA),在240nm波长处分别测定吸光度,计算每片的溶出量。
3.2 体外溶出度试验照2.1项下制备方法,分别对制备三批样品, 照3.1项下方法进行了体外溶出度试验,结果见图1。
图1 三批样品的溶出曲线Fig.1 Diagram of dissolutoin curves in three batches由图可知,采用该处方工艺制备的三批样品溶出度基本一致,其平均溶出度为96.8%。
3.3 影响因素试验采用铝塑复合膜包装,将自制样品片直接放置于下述条件下:60 ℃(高温);相对湿度92.5%(高湿);照度4500 lx(强光)。
分别于0、5、10 d取样,试验结果间表4。
表4 影响因素考察实验结果(n=3)Tab4 Results of stability experiments of sample条件时间/d 外观溶出度/% 有关物质/% 含量/%0 除去包衣,白色片 95.4 0.21 100.1%光照 5 除去包衣,白色片 96.8 0.24 99.54%10 除去包衣,白色片 97.2 0.24 98.25%高温 5 除去包衣,白色片 96.3 0.31 99.21%10 除去包衣,类白色片 96.4 0.35 99.01%高湿 5 除去包衣,白色片 95.1 0.24 99.67%10 除去包衣,白色片 97.3 0.28 99.58%光照、高温(60℃)及高湿(92.5%)试验结果表明,高温(60℃)及高湿(92.5%)5天、10天外观、溶出度、含量基本没有变化,高温10天有关物质略有升高,光照试验各考察指标均无明显变化。
因此为保证本品稳定性,采用双面铝塑复合膜包装。
4 讨论本实验中湿法制粒压片,处方中使用微晶纤维具有海绵状多孔管状结构,遇水后,而且水溶性的乳糖可以更利于水分子进入片剂内部,破坏微晶之间的氢键起到崩解剂的作用。
