阿维巴坦的合成研究进展综述报告
头孢他啶-阿维巴坦对抗碳青霉烯类肠杆菌属细菌的体外敏感性分析

512020年10月第27卷第20期头孢他啶-阿维巴坦对抗碳青霉烯类肠杆菌属细菌的体外敏感性分析许晓波随细菌耐药性的增强,临床应用抗生素越发困难,需要新的且不易耐药的抗生素的出现。
由森林实验室和阿斯利康制药公司联合开发的头孢他啶-阿维巴坦注射剂已于2015年被美国食品药品监督管理局快速批准,用于治疗成人复杂性腹腔内感染、尿路感染,以及医院获得性细菌性肺炎和呼吸机相关细菌性肺炎[1]。
头孢他啶-阿维巴坦对A、C、D类β内酰胺酶具有一定抑菌活性,对B类需要金属离子发挥催化作用的金属碳青霉烯酶无抑菌作用[2],故在体外进行头孢他啶-阿维巴坦的药敏试验及抗碳青霉烯酶表型试验对临床抗生素的应用具有积极作用。
1 材料与方法1.1 一般资料 收集我院2019年1—12月抗碳青霉烯类肠杆菌属(CRE)菌株117株,其中肺炎克雷伯菌85株(72.6%),黏质沙雷菌11株(9.4%),大肠埃希菌10株(8.5%),奇异变形杆菌3株(0.3%),产气克雷伯菌、雷极普罗维登斯菌、弗氏柠檬酸杆菌、摩氏摩根菌各2株(各0.2%)。
标本来源:痰液32株(27.4%),中段尿23株(19.7%),肺泡灌洗液21株(17.9%),创面分泌物17株(14.5%),穿刺液(胆汁、胸腹水等)、其他部位各10株(各8.5%),血液4株(3.4%)。
科室来源:ICU 31株(26.5%),老年病区30株(25.6%),呼吸内科20株(17.1%),神经外科、普外科各9株(各7.7%),消化内科8株(6.8%),心胸肺外科6株(5.1%),其他科室4株(3.4%)。
1.2 结果判断 根据临床和实验室标准协会M100(2019版)中的药敏判断标准,CRE菌株为肠杆菌属细菌对厄他培南最低抑菌浓度(MIC)≥2μg /mL,对亚胺培南及美罗培南MIC≥4μg /mL的菌株。
所有耐药菌菌株均通过纸片扩散法(K-B法)进行验证,亚胺培南及美罗培南抑菌圈直径≤19mm。
新药Aprocitentan(阿普昔腾坦)合成检索总结报告
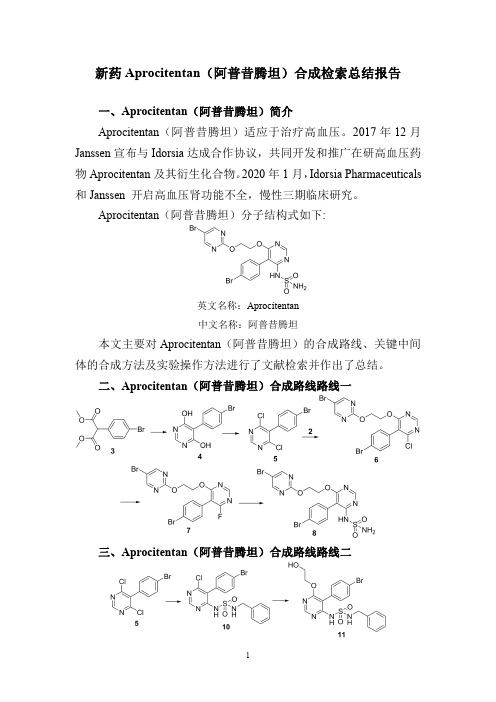
新药Aprocitentan(阿普昔腾坦)合成检索总结报告一、Aprocitentan(阿普昔腾坦)简介Aprocitentan(阿普昔腾坦)适应于治疗高血压。
2017年12月Janssen宣布与Idorsia达成合作协议,共同开发和推广在研高血压药物Aprocitentan及其衍生化合物。
2020年1月,Idorsia Pharmaceuticals 和Janssen开启高血压肾功能不全,慢性三期临床研究。
Aprocitentan(阿普昔腾坦)分子结构式如下:英文名称:Aprocitentan中文名称:阿普昔腾坦本文主要对Aprocitentan(阿普昔腾坦)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、Aprocitentan(阿普昔腾坦)合成路线路线一三、Aprocitentan(阿普昔腾坦)合成路线路线二四、Aprocitentan (阿普昔腾坦)合成路线一检索总结报告(一)Aprocitentan (阿普昔腾坦)中间体2的合成(路线一)合成方法实验步骤参考文献操作方法一A mixtureof 5-bromo-2-chloro-pyrimidine 1(100g,0.51mol),THF (1.5L),and K 2CO 3(286g,24mol)was heated to 45o C,then ethylene glycol (43ml,0.7mol)was added to thereaction mixture and maintained at 45o C for 8h.The reaction mixture was cooled to room temperature,filtered,and the residue was washed with THF (400ml).The solvent of The filtratewas replaced with ethyl acetate using Dean-Stark apparatus,and the solution was refluxed for 1h,then cooled to 15o C,filtered and washed with ethyl acetate (200ml)and dried in theoven at 60o C for 6h to obtain 110g (98%)of 2as a white solid,mp 68o C-70o anic Preparations and Procedures International ;vol.49;nb.3;(2017);p.258-264.(二)Aprocitentan (阿普昔腾坦)中间体4的合成(路线一)合成方法实验步骤参考文献操作方法To a stirred solution of 100g dimethyl(4-bromophenyl)-malonate 3(10,0.348mol)in 400cm 3methanol,30g formamide (0.66mol)and 30g sodium methoxide (0.555mol)were added at 20-25o C.The reaction mass was heated to 70o C and maintained until completion of reaction (monitored by HPLC).After completion of the reaction,methanol was distilled off from the reaction mass under reduced pressure at 70o C to obtain the syrup.The syrup was cooled to 25-30o C and diluted with 2dm 3water.The pH of the solution was adjusted to 2-2.5using conc.hydrochloricMonatshefte fur Chemie ;vol.149;nb.3;(2018);p.一acid and maintained for 45min.The obtained solid was filtered and washed with water until the pH of the filtrate became 7-7.5.The product was suck dried and dried under reduced pressure at 100C to obtain crude 4.The crude solid was dissolved in 500cm3methanol at 60-65o C and maintained for 1h.The reaction mass was cooled to 25-30o C and maintained for 30min.The obtained solid was filtered,washed with methanol,anddried at 50-55o C under reduced pressure to offer 4.Yield:70g (75.25%);purity by HPLC:99.5%;m.p.:176-180C 653-661.操作方法二To the mixture containing the intermediate 3,100g of formazan hydrochloride was added,and the mixture was stirred and heated to 25°C for 16h.Adding water to the reaction solution,stir at 25°C until clarified,stand still,take the water phase,adjust the pH of the aqueous phase to 5with hydrochloric acid solution and stir for 1h.After suction filtration,the obtained filter cake was washed with a methanol aqueous solution having a mass fraction of 80%.Drying gave 270.2g of intermediate 4,The yield was 92.6%.CN108997223;(2018);(A)Chinese 操作方法三A solution of intermediate 3(11.73g)in MeOH (100mL)was added at 0o C to a solution of sodium (2.83g)in MeOH (100mL).The mixture was stirred for 18h at rt before formamidine hydrochloride (4.10g)was added.The suspension was stirred at rt for 4h.The solvent was removed and the residue was suspended in 10%aq.citric acid (100mL)and stirred for 10min.The white precipitate was collected,washed with 10%aq.citric acid,water,evaporated three times from cyclohexane and dried under HV at 40o C to give 5-(4-bromophenyl)-pyrimidine-4,6-diol 4.WO2009/24906;(2009);(A1)English;WO2006/51502;(2006);(A2)English;US2012/142716;(2012);(A1)English(三)Aprocitentan (阿普昔腾坦)中间体5的合成(路线一)合成方法实验步骤参考文献操作方法200g of the intermediate 4was taken in a 3L three-necked flask.Add 300g of toluene and 180g of N,N-dimethylaniline,mechanically stirred,230g of phosphorus oxychloride was added dropwise at 30°C,and the temperature was raised to 55°C after the addition.After the solid is completely dissolved,the temperature is raised to 100°C,the reaction is carried out for 4h,and then cooled to 25°C for use.450g of water was mixed with 500g of toluene,and cooled to 25°C CN108997223;(2018);(A)。
阿维菌素生物合成及其代谢途径研究进展

突破性进展 , 阿维菌素的生物合成途径 已基本阐明, 有关生物合成基 因簇 已被克隆 , 多数基 因的功能已经明 确 J 5 。尤其近年 H Iea .kd 等完成了阿维链霉菌全基因组 的测序工作 , J这些不仅有利于人们 了解这一重 要抗生素和类似抗生素的合成机制 , 利用基 因工程产生杂合抗生素 , 更利于从全局对菌种进行改 良, 利于工 业生产 。基于上述研究基础 , S ae et i 有 目的的进行遗传操作( 日 对 .vr cn s m iu 在 本发现的 S ae et i 至今 .vr cn s m iu 仍 为产 生阿维 菌 素 的唯一 菌种 ) 使 阿维菌 素产 量提 高 , , 工艺 简 化 , 生新 的 有 活性 的抗 生素 具有 重 大意 义 。 产 本文结合 自己的研究课题 , 主要对阿维菌素近年来的研究进展进行综述 , 旨在为阿维菌素和类似抗生素产生 菌 的改造 和应 用提 供思 路 、 策略 。
V0 . . 】21 No 4
A r ,0 7 p.20
阿维 菌素 生物 合成 及 其 代 谢 途 径 研 究 进 展
梁剑 光 , 黄 鹏 徐正 军 ,
(. 1 常熟理工学院 生物与食品工程系 , 江苏 常熟 2 50 ; 150 2 华 东理 工大学 生物 反应 器工 程 国家重点 实验 室 , . 上海 2 0 3 ; 0 2 7
常熟理 工学 院 学报 ( 自然科 学版 )
20 0 7正
1 阿维菌素的菌种选育与分子研究
1 1 阿维菌素 菌种 选育 .
阿维菌 素 (vr ci) aemet 产生 菌 17 在 日本 发现 后 , 日本 北里 ( ist) n 9 8年 以 Kt ao 大学 和北 里研 究 所 以及 美 国 a Mec 司为 主的研 究小组 分别 对它 进行 了深人 的研 究 , 对 阿维 菌素产 生 菌进 行 了大 量 的改 造 , rk公 并 为阿 维菌 素工业 生产 奠定 了 良好 的基 础 。最初分 离 到 的阿 维菌 素 产生 菌 的产量 很 低 , 原始 菌 株 MA一48 60的发 酵单 位只有 9 m 。通过 多 年的 菌种选育 , 量得 到 了大 幅 度 的提 高 , l 产 目前最 高 产量 每 毫升 已达 上万 单 位 。 目 前 对多 种链霉 菌 的研究表 明 , 多调 控 因子参 与 了复杂 的调控 网络 , 响链 霉 菌 的表 型分 化 和次级代 谢产 物 许 影 的产量 。宋渊 等 利 用高 频 电子流 和亚硝 基弧对 阿维 链霉 菌 诱 变 , 得诱 变后 选 育 的菌 株 的发 酵单 位 高达 使 30 40 t/ l产量 提高 了 2倍 。任超 等 J05年 了解 了阿维 菌素产 生茵生 长特性 , 高产 生茵 B组 份 50— 0 0 gm , x 20 提 的产量 , 采用紫外 线 ( V)诱变 荆氯化 锂 ( iI , u 、 LC ) 亚硝基 胍 ( T 并 结合 甲硫 氨 酸 ( t诱 导 等手段 对 出发 N G) Me) 菌株 S ae tiH 05进行 诱 变处理 , 果筛选 获 得 总效 价 达 到 42 . i / l .vr is 06 mil 结 54 3x m 的高 产阿 维 茵突 变 株 N g 3— 13 其 中 B组分 含量显 著提 高且 高达 8 .% , 1 3, 53 B a也显 著提 高达 到 23 . 得 阿维茵 素总效 价及 B 组 分显 著提 高 的菌株 。20 1 0 6年 。又通过 离 子 注入诱 变 、 紫外 线 与 氯化 锂 复合 诱变 法处理 阿维链 霉菌 出发 菌株 N 59 筛选 获得 A emet s 22 , vr ci 高效 突变菌 株 A 32 , n 20 6 总效价 达 到 6 8 .t / l 9 82x m , g B a含量达 到 7 .% , 出发 菌株 N 59的 B a组提 高 4 . % 。攸 德伟 等 ¨ l 94 较 22 1 63 。经 过 紫外 线 和亚 硝 基胍 对 初 始菌 株 的孢 子 的诱 变及 对其 原生质 体 的诱变 再生 , 并且 经过 异亮 氨酸 和链霉 素 的定 向筛 选 , 得到 的高 产菌
头孢他啶-阿维巴坦耐药性及其机制研究进展

头孢他啶-阿维巴坦耐药性及其机制研究进展
傅倩雯;徐杰;赵卫峰
【期刊名称】《中国感染与化疗杂志》
【年(卷),期】2022(22)4
【摘要】近年来,随着广谱抗生素的广泛使用及细菌耐药基因的出现,耐碳青霉烯类革兰阴性菌在世界范围内的播散已逐渐成为世界一大重要公共卫生问题[1]。
其中主要包括耐碳青霉烯类肠杆菌目细菌(CRE),耐碳青霉烯类铜绿假单胞菌(CRPA)和耐碳青霉烯类鲍曼不动杆菌(CRAB),其中CRE及CRAB往往携带碳青霉烯酶,可以使绝大多数β内酰胺类抗生素失活,并且这些细菌还携带可以水平转移的耐药质粒,进一步加剧碳青霉烯类耐药性传播[2]。
【总页数】6页(P509-514)
【作者】傅倩雯;徐杰;赵卫峰
【作者单位】苏州大学附属第一医院感染病科
【正文语种】中文
【中图分类】R978.11
【相关文献】
1.新型抗菌药物头孢他啶/阿维巴坦的研究进展
2.产KP C型碳青霉烯类耐药肠杆菌对头孢他啶-阿维巴坦的体外敏感性变化的机制分析
3.肺炎克雷伯菌对头孢他啶/阿维巴坦的耐药性分析
4.头孢他啶-阿维巴坦在耐药菌感染中的临床应用研究进展
5.碳青霉烯类耐药肠杆菌目细菌对头孢他啶/阿维巴坦的耐药率及耐药机制研究
因版权原因,仅展示原文概要,查看原文内容请购买。
阿拉伯糖苷类药物的合成研究进展

阿拉伯糖苷类药物的合成研究进展杜峰;李永曙【摘要】阿拉伯糖苷类药物是一类非常重要的糖苷类抗肿瘤抗病毒药物.本文根据该类药物的化学结构特点,归纳了不同的合成策略,并对其合成方法进行了综述.【期刊名称】《浙江化工》【年(卷),期】2015(046)003【总页数】6页(P17-22)【关键词】阿拉伯糖苷;合成方法;综述【作者】杜峰;李永曙【作者单位】浙江工业大学药学院,浙江杭州310032;浙江工业大学药学院,浙江杭州310032【正文语种】中文糖苷类抗肿瘤抗病毒药物的作用机制主要是阻止或抑制肿瘤细胞或被病毒侵染的宿主细胞中脱氧核糖核酸(DNA)、核糖核酸(RNA)或蛋白质的合成,从而抑制肿瘤细胞的分裂增殖,干扰病毒复制[1]。
阿拉伯糖苷类药物属于一类重要的糖苷类抗肿瘤抗病毒药物,在一些疾病的治疗上与核苷类药物相比较有更好的疗效。
阿糖苷类药物与核苷类药物相比,化学结构上的主要差异在于糖基部分2'位羟基的空间构型不同,阿糖2'位为S构型,核糖2'位为R构型。
如图1所示。
阿糖苷与核苷一样,存在α和β两种构型[2](见图1)。
天然核苷均是β构型的,因此β构型糖苷具有较好的生物活性。
由于阿糖苷类化合物的化学结构特点,导致其在合成策略上与核苷类化合物的合成有着不同的方法。
核苷化合物合成常用的方法是以四乙酰核糖和碱基为原料,反应机理[3]如图2所示。
四乙酰核糖在催化剂作用下,脱去异头碳上的乙酰氧基,形成一种环酰氧钅翁离子中间体,再与碱基发生SN2反应,生成核苷。
由于核糖2'位羟基是在糖环平面下,所以形成的1,2-酰氧钅翁离子中间体也是在糖环平面下,碱基则从糖环平面上方(β位)进攻异头碳,从而生成β构型的核苷。
如果用乙酰化阿糖代替核糖与碱基直接反应,则得到的应该是α构型阿糖苷。
因为阿拉伯糖2'位羟基是在糖环平面上的,形成的1,2-酰氧钅翁离子中间体则在糖环平面之上,碱基将会从糖环平面下方(α位)进攻异头碳,生成的必定是α构型的阿糖苷。
多黏菌素类与替加环素及头孢他啶阿维巴坦药敏方法和报告【专家共识】

多黏菌素类与替加环素及头孢他啶/阿维巴坦药敏方法和报告【专家共识】摘要多黏菌素类、替加环素和头孢他啶/阿维巴坦是目前多重耐药和泛耐药革兰阴性菌等感染的治疗选择,业界对其敏感性检测方法操作的标准化、折点和结果的判读、报告等有困惑。
中国医疗保健国际交流促进会临床微生物与感染分会、中华医学会检验医学分会临床微生物学组、中华医学会微生物学与免疫学分会临床微生物学组组织专家对上述问题进行了讨论并撰写了专家共识,对一些关键问题给出了推荐意见和处理方法,希望能为临床处置、实验室工作提供合理、实用的帮助。
近年来,多重耐药特别是碳青霉烯类耐药革兰阴性菌感染率逐渐增加,而可供选择的药物有限。
一些新抗菌药物陆续在国内外上市,准确可靠的药物敏感性检测和报告对临床合理用药至关重要。
目前,检测人员对这些抗菌药物敏感性检测操作的标准化、折点的选择、结果判读以及药敏报告屡有困惑。
本共识汇集了国内临床微生物学、呼吸病学、感染病学、重症医学、血液病学和临床药学等专家的专业意见和建议,结合国内外文献、国内耐药状况和国内药敏方法的可及性,对目前上市的最后防线类药物——多黏菌素类、替加环素和头孢他啶/阿维巴坦的药敏检测方法和折点选择等问题提出了推荐建议。
一、多黏菌素类(一)药物特点和国内上市情况多黏菌素类是一类聚阳离子多肽。
主要杀菌机制是药物所带的正电荷与细菌细胞膜上的负电荷脂多糖结合,进而破坏细胞膜发挥杀菌作用[1]。
多黏菌素类抗菌谱窄,主要对肠杆菌目、气单胞菌属和一些非发酵菌(如铜绿假单胞菌、鲍曼不动杆菌等)具有体外活性,而革兰阳性菌、厌氧菌、支原体、衣原体、变形杆菌属、摩根菌属、沙雷菌属等对其天然耐药[2, 3]。
获得性耐药机制主要包括染色体介导phoPQ、pmrAB、mgrB等突变和质粒介导的可移动黏菌素耐药基因mcr 导致。
用于临床抗感染治疗的药物主要有多黏菌素B和多黏菌素E(即黏菌素)两类。
注射用硫酸多黏菌素B、硫酸黏菌素分别于2017年9月和2018年3月在我国大陆地区上市。
新型抗菌药物头孢地尔的基本特性及临床应用的研究进展

新型抗菌药物头孢地尔的基本特性及临床应用的研究进展摘要随着多重耐药革兰阴性菌的检出率逐渐增加,患者死亡率显著增加,已成为全球公共卫生难题。
头孢地尔作为新型铁载体头孢菌素,具有广泛的抗菌活性,因其“特洛伊木马”策略,通过铁转运体进入细胞周质,并克服了革兰阴性菌常见的膜孔蛋白丢失、外排泵高表达、产碳青霉烯酶等耐药特性,成为多重耐药革兰阴性菌治疗的新选择。
该文综述了头孢地尔的作用机制、抗菌谱及体外活性、药动学/药效学特性、临床应用、安全性及其耐药性,以期为临床应用提供参考。
关键词头孢地尔;铁载体头孢菌素;多重耐药革兰阴性菌;作用机制;体外活性目前,革兰阴性菌(Gram-negative bacteria,GNB)因其对碳青霉烯的耐药性、高发病率和死亡率已成为全球健康问题的重要“威胁”之一,美国疾病控制与预防中心已将碳青霉烯耐药肠杆菌(carbapenem-resistant Enterobacteriaceae ,CRE)和碳青霉烯耐药不动杆菌(carbapenem-resistant Acinetobacter baumannii,CRAB)列为“紧急威胁”[1-2]。
美国每年大约有19.7万例患者感染产超广谱β-内酰胺酶(extended-spectrum β-Lactamase,ESB Ls)的病原菌、3.2万例多重耐药菌铜绿假单胞菌(multidrug- resistant P.Aeruginosa,M DR-PA)、1.3万例CRE、0.8万例CRAB引起的感染[2]。
针对上述多重耐药菌的治疗药物选择有限,主要为氨基糖苷类、多黏菌素、替加环素、头孢他啶/阿维巴坦等,但因药物毒性、临床疗效、药动学特性和耐药性等因素,其临床应用受到限制[3]。
头孢地尔(cefiderocol,CFDC)是一种新型铁载体头孢菌素,对GNB具有广泛的抗菌活性,于2019年被美国FDA批准用于成人复杂尿路感染(complicated urinary tract infec tions,cUTIs)、GNB导致的医院获得性肺炎(hospital-acquired pneumonia,HAP)和呼吸机相关细菌性肺炎(ventilatorassociated bacterial pneumonia,VABP)的治疗[4],并在2020年被欧洲药品管理局批准用于治疗方案有限的成人患者因需氧GNB导致的感染[5]。
阿维菌素的生物合成研究进展与展望

阿维菌素的生物合成研究进展与展望
陈芝;宋渊;文莹;李季伦
【期刊名称】《自然科学进展》
【年(卷),期】2007(17)3
【摘 要】阿维链霉菌(Streptomyces avermitilis)由于可以产生杀虫抗生素--阿维
菌素而备受研究者的青睐.多年来该菌得到了全面系统的研究,其基因组序列也已测
定.文中综述了阿维链霉菌中阿维菌素生物合成代谢途径方面的研究,并对后续研究
进行展望.
【总页数】7页(P290-296)
【作 者】陈芝;宋渊;文莹;李季伦
【作者单位】中国农业大学生物学院微生物系,北京,100094;中国农业大学生物学
院微生物系,北京,100094;中国农业大学生物学院微生物系,北京,100094;中国农业
大学生物学院微生物系,北京,100094
【正文语种】中 文
【中图分类】TQ45
【相关文献】
1.阿维菌素B1a衍生物合成研究2.甲氨基阿维菌素苯甲酸盐与阿维菌素生物活性
比较3.换热网络最优合成研究的进展与展望4.阿维菌素B2衍生物有机合成研究进
展5.含酰肼结构阿维菌素衍生物的合成及生物活性
因版权原因,仅展示原文概要,查看原文内容请购买
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿维巴坦的合成研究进展
1.本课题相关领域的历史、现状和前沿发展情况
阿维巴坦是一类可以与酶可逆性共价结合的新型β-内酰胺酶抑制剂,阿维巴坦属于二氮杂二双辛烷(DBOs)类化合物,阿维巴坦钠的化学名称为:(2S,
5R)-1,6-二氮杂二环[3.2.1]辛烷-2-甲酰胺-7-氧代-6-磺酸基-单钠盐。
2004年,Novexel公司开始研究DBOs类化合物,但DBOs类化合物的合成工艺复杂,研究进展缓慢。
2015年2月新型复方抗生素药Avycaz头孢他啶-阿维巴坦钠在美国上市,阿维巴坦钠与其他抗生素联用复方制剂仍处在临床研究阶段。
2.前人的研究成果
有文献对阿维巴坦及阿维巴坦钠的合成报道主要有三种。
按照起始原料大致可分为以L-焦谷氨酸衍生物、手性的哌啶环衍生物及烯烃衍生物等。
以(S)-1-(苄氧羰基)-5-氧代吡咯烷-2-羧酸为起始原料研究报道较多且不存在光学选择性和拆分问题,得到的目标产物光学活性较高;以N-Boc-L-焦谷氨酸乙酯(或苄酯)为起始原料,存在部分反应步骤条件苛刻、原料价格较贵、收率低,同时反应中生成的副产物毒性较大等因素也限制了大规模生产。
3.进一步研究方向
阿维巴坦及类似物的合成路线虽已有数条,但大多具有一定的局限性,真正可实现工业化生产的路线仍很少。
以手性的哌啶环衍生物为原料不易得,合成难度较大;以 L- 焦谷氨酸衍生物为原料的路线,工艺较稳定,收率较高,但从实验室到工业化生产也有一段较长的路要走。
