【述评】严重脓毒症免疫调节治疗:从免疫抑制走向 免疫增强
脓毒症脓毒性休克ppt课件

案例二:腹腔感染导致脓毒性休克
患者情况
一位42岁男性,因急性阑尾炎穿孔 导致腹腔感染,出现脓毒性休克症状 。
治疗方案
立即手术清除感染病灶,术后给予抗 生素治疗、液体复苏等综合治疗措施 。
治疗效果
经过积极治疗,患者病情逐渐好转, 最终康复出院。
案干预和综合治疗对于改善预 后至关重要。
脓毒症脓毒性休克ppt课件
汇报人:可编辑 2024-01-11
• 脓毒症和脓毒性休克概述 • 脓毒症脓毒性休克的治疗原则 • 脓毒症脓毒性休克的预防措施
• 脓毒症脓毒性休克的临床案例分 析
• 脓毒症脓毒性休克的护理与康复
01 脓毒症和脓毒性休克概述
定义与分类
定义
脓毒症是指由感染引起的全身性炎症反应综合征,常伴随器官功能不全。脓毒 性休克则是指脓毒症引发低血压和组织灌注不足,导致多器官功能不全的综合 症。
临床表现与诊断标准
临床表现
发热、寒战、呼吸急促、心率加快、白细胞计数升高等全身 性炎症反应综合征表现;低血压、意识障碍、少尿等器官功 能不全表现。
诊断标准
根据2016年国际脓毒症和脓毒性休克指南,诊断需满足以下 条件:存在感染;SIRS表现;器官功能不全(如低血压、少 尿等);血培养或组织样本培养阳性。
05 脓毒症脓毒性休克的护理与康复
护理要点
密切监测生命体征
包括体温、心率、呼吸、血压等,以及意识状态 和尿量等指标,及时发现病情变化。
维持有效循环血容量
根据病情需要,遵医嘱给予补充血容量,维持正 常血压和组织灌注。
ABCD
保持呼吸道通畅
及时清理呼吸道分泌物,保持患者平卧位,头偏 向一侧,防止误吸。
根据患者的血气分析结果 ,使用适当的药物纠正酸 碱平衡失调。
脓毒症诊断与治疗规范2023版解读ppt课件

在补液过程中,应合理使用晶体液和胶体液。晶体液包括生理盐水、平衡盐液等,胶体液 包括白蛋白、血浆等。
监测指标
在补液过程中,应密切监测患者的中心静脉压、血压、心率等指标,以指导液体治疗。
血管活性药物
01
使用时机
血管活性药物应在脓毒症患者出现严重低血压、休克或器官功能障碍
时使用。
02
选择合适的药物
包括年龄、性别、基础疾病、免疫状态、遗传特征等。
病原因素
包括病原微生物的类型、毒力、数量和感染途径等。
治疗因素
包括早期诊断和治疗的及时性、抗生素的使用、机械通气和血液净化等。
预后评估
病情评估
实验室检查
根据患者的症状和体征,评估病情的严重程 度和进展趋势。
通过血液、尿液和其他体液检查,了解患者 的生理和生化指标。
鉴别诊断
1 2
与其他感染性疾病的鉴别
如肺炎、泌尿系统感染等,需通过临床表现和 辅助检查进行鉴别。
与非感染性发热的鉴别
如风湿热、肿瘤等,需通过病史和相关检查进 行鉴别。
3
与脓毒症休克鉴别
如低血容量性休克、心源性休克等,需根据患 者的临床表现和辅助检查进行鉴别。
04
脓毒症的治疗原则
抗生素治疗
早期使用抗生素
特点
脓毒症患者通常存在高代谢状态、免疫功能紊乱、微血管病 变和凝血功能障碍等。
脓毒症的分类
根据感染部位分类
社区获得性脓毒症:由社区感 染引起,包括肺炎、泌尿系统 感染等。
医院获得性脓毒症:由医院内 感染引起,如手术部位感染、 导管相关感染等。
特殊类型脓毒症:如坏死性筋 膜炎、骨与关节感染等。
脓毒症的诊断标准
复发
参附注射液对严重脓毒症患者临床疗效及免疫功能的影响

参附注射液对严重脓毒症患者临床疗效及免疫功能的影响徐俊龙;张宁;朱红俊;张剑;邱泽亮;何许伟;楼天正【摘要】目的:观察参附注射液对严重脓毒症患者的临床疗效及对T淋巴细胞亚群(CD3+、CD4+、CD8+)、NK细胞、单核细胞人白细胞DR抗原(HLA- DR)表达率的影响。
方法将68例严重脓毒症患者随机分为西医常规治疗基础上加用参附注射液治疗组(参附组,36例)和单纯西医常规治疗组(对照组,32例)。
观察治疗前及治疗后第3、7天患者临床疗效及T淋巴细胞亚群、NK细胞、单核细胞HLA- DR表达率的变化。
结果两组患者治疗前APACHE II、Marshal 评分、IL-6和IL-10水平的差异均无统计学意义(均P>0.05);与健康对照组比较,严重脓毒症患者血清IL-6、IL-10和CRP水平明显升高,CD3+、CD4+、CD8+T淋巴细胞和单核细胞HLA- DR表达降低(均P<0.05)。
与对照组同期比较,治疗后第7天参附组APACHEII、Marshal 评分及IL-6和CRP水平均下降,而CD3+、CD4+、CD8+T淋巴细胞、NK细胞及单核细胞HLA- DR表达均升高,差异均有统计学意义(均P<0.05)。
结论严重脓毒症患者全身炎症反应和免疫抑制同时存在;参附注射液具有维持促炎/抗炎平衡,双向调节严重脓毒症免疫紊乱作用,从而改善临床疗效。
%Objective To assess the efficacy of Shengfu injection (SFI) in treatment of severe sepsis and its effect on im-mune function of patients. Methods Sixty- eight patients with severe sepsis were randomly divided into two groups, 36 patients were treated with Shengfu (SFI group) and conventional therapy and 32 patients received conventional therapy only (control group). The acute physiology and chronic health evaluation II (APACHE II) score and Marshal score were evaluated. The serum levels of interleukins (IL- 6, IL- 10), C- reactiveprotein, NK cell, CD3+, CD4+, CD8+ T celland monocyte human leukocyte anti-gen- DR (HLA- DR) before and 3, 7 d after treatment were measured. Results There were no significant differences in APACHE II and Marshal scores, serum IL- 6 and IL- 10 levels between two groups before treatment (P>0.05). Before treatment serum IL- 6, IL- 10 and CRP in both groups were significantly higher, and the CD3+, CD4+, CD8+ T cells, NK cells and HLA- DR level were all significantly lower than those of healthy controls (alP<0.05). Compared with the control group, the APACHE II and Mar-shall scores and serum IL- 6, CRP levels in the SFI group were significantly decreased at d7 after treatment, while the CD3 +, CD4+, CD8 +T cells were significantly increased (P<0.05). Conclusion Shengfu injection can improve the therapeutic efficacy of severe sepsis, which may be associated with its effect on regulation of immune function in patients.【期刊名称】《浙江医学》【年(卷),期】2014(000)006【总页数】4页(P471-474)【关键词】严重脓毒症;参附注射液;T淋巴细胞亚群;单核细胞人白细胞DR抗原【作者】徐俊龙;张宁;朱红俊;张剑;邱泽亮;何许伟;楼天正【作者单位】323000 丽水市人民医院ICU;323000 丽水市人民医院ICU;323000 丽水市人民医院ICU;323000 丽水市人民医院ICU;323000 丽水市人民医院ICU;323000 丽水市人民医院ICU;323000 丽水市人民医院ICU【正文语种】中文脓毒症的发病率高、病死率高,是重症监护病房最常见的死亡原因之一,病死率高达60%[1-2]。
脓毒症心得体会(五篇材料)

脓毒症心得体会(五篇材料)第一篇:脓毒症心得体会脓毒症即是由感染所致的全身炎症反应综合征(SIRS),脓毒性休克是指在严重脓毒症基础上给予足量液体复苏后仍无法纠正的持续低血压状态,即微循环功能障碍未能纠正,伴或不伴组织灌注不良的表现,如酸中毒,意识障碍等,它是严重脓毒症的一种特殊类型。
脓毒性休克属于分布性休克,微循环功能障碍和心脏功能受抑制是循环系统损害的重要组成部分1.血管内皮损伤时毛细血管通透性增高,血管内液体分布到血管外间隙,造成有效循环量下降2.血管内皮损伤部位血小板,炎性细胞聚集及有效循环血容量下降后血液浓缩,血液淤滞造成微循环内血栓形成3.血管内皮损伤时内皮素与输血管因子两者间平衡失调造成血管张力改变4.脓毒性休克时心脏功能均受到抑制,脓毒性休克分为高排低阻与低排高阻两个阶段,首先休克发生时,循环血量迅速下降,引起代偿性微动脉收缩,心脏代偿性做功增加以提高心输出量,此时微动脉对舒血管物质,收缩血管物质及内皮介导的收缩反应降低,即是高排低阻阶段;微循环功能障碍时酸性物质堆积,造成代谢性酸中毒以及氧气在血液和组织细胞间的弥散距离增加,效率降低,造成组织缺氧,心肌细胞缺氧,酸中毒与心肌细胞缺氧可造成心肌收缩力下降,心脏功能受抑制,随着病程发展,心脏收缩功能进入失代偿期,心脏收缩功能进一步下降,心排量减少,并且微循环内血栓形成,即进入低排高阻阶段。
其中血管内皮损伤后内皮细胞活化异常是脓毒性休克时循环功能障碍的重要因素。
血管内皮损伤时血管通透性增加内皮细胞(EC)屏障功能丧失是脓毒性休克时微循环的核心特征,此时内皮细胞活化异常,循环内皮细胞(ECs)增加,此外大量炎症介质释放是EC屏障功能丧失的重要因素,其中肿瘤坏死因子增加EC的通透性。
炎症介质与内皮细胞相互作用可诱导机体呈促凝血的特征,造成微循环血栓形成。
大量炎症介质释放,如肿瘤坏死因子,氧自由基等可诱导内皮细胞凋亡,内皮细胞通过产生舒血管因子一氧化氮(NO),前列环素(PGI2),收缩血管因子血栓素A2,内皮素(ET)和血小板活化因子(PAF)调节小动脉张力并调控血压。
中国严重脓毒症脓毒性休克治疗指南

中国严重脓毒症脓毒性休克治疗指南中国严重脓毒症/脓毒性休克治疗指南脓毒症(sepsis)是由感染引起的全身炎症反应综合征(SIRS),可发展为严重脓毒症(severesepsis)和脓毒性休克(septicshock)。
严重脓毒症和脓毒性休克是重症医学面临的重要临床问题,随着人口的老龄化、肿瘤发病率上升以及侵入性医疗手段的增加,脓毒症的发病率在不断上升,每年全球新增数百万脓毒症患者,其中超过1/4的患者死亡。
中华医学会重症医学分会2007年组织编写了《成人严重脓毒症与脓毒性休克血流动力学监测与支持?指南》,为脓毒症的诊治提供了规范和指导,但是随着近年来国内外该领域研究的不断深入,为了更好地指导我国重症医学工作者对严重脓毒症和脓毒性休克的治疗,中华医学会重症医学分会组织专家应用循证医学的方法制定了本指南。
1?定?义脓毒症是指明确或可疑的感染引起的SIRS。
严重脓毒症是指脓毒症伴由其导致的器官功能障碍和/或组织灌注不足。
脓毒性休克是指脓毒症伴由其所致的低血压,虽经液体治疗后仍无法逆转。
2?诊断标准脓毒症、严重脓毒症、脓毒性休克诊断标准见?表1~2。
3?检索方法(略)4?推荐等级(略)初始复苏推荐意见1:推荐对脓毒症导致组织低灌注(经过最初的液体冲击后持续低血压或血乳酸≥?4mmol/L)的患者采取早期目标导向的液体复苏。
在进行初始复苏的最初6h内,下述复苏目标可以作为规范化治疗的一部分:(1)中心静脉压8~?12mmHg;(2)平均动脉压(MAP)≥65mmHg;(3)尿量≥0.5mL·kg-1·h-1;(4)上腔静脉血氧饱和度或混合静脉血氧饱和度≥0.70或0.65。
(1B)Rivers等研究发现,早期定量液体复苏可提高急诊科脓毒性休克患者的存活率。
最初6h达到以上推荐中的生理标准,可使患者28d?病死率降低15.9%,此治疗策略称为早期目标导向治疗(earlygoal-directedtherapy,EGDT)。
最新日达仙在严重感染患者中的应用主题讲座课件
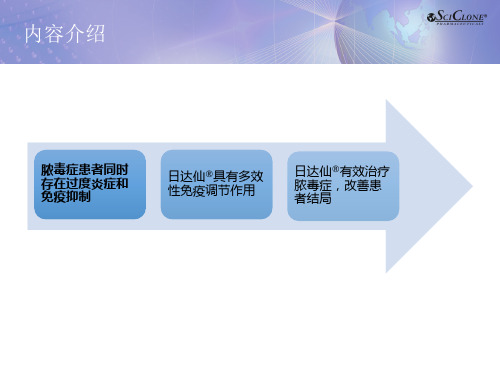
脓毒症患者同时 存在过度炎症和 免疫抑制
日达仙®具有多效 性免疫调节作用
日达仙®有效治疗 脓毒症,改善患 者结局
严重脓毒症
严重脓毒症(Severe Sepsis):由感染引起的全身炎症反应综合征,伴随器 官功能障碍,并威胁生命。
严重脓毒症是ICU患者最常 见的死亡原因
严重脓毒症是宿主免疫系 统和病原体的激烈对抗
促炎与抗炎机制之间的平 衡决定患者结局
Hotchkiss RS, et al. Nat Rev Immunol. 2013;13(12):862-74. .
脓毒症患者同时存在过度炎症和免疫抑制
患者早期死亡多由于无法控制的炎症反应;后期死亡则因持续性的免疫功 能抑制,无法清除病原体,以及继发感染的发生。
免疫治疗改善脓毒症患者生存
脓毒症起始 代偿机制 免 疫 功 能 ( 任 意 单 位 )
恢复=存活 未恢复=死亡/院内感染/病毒重新激活
免疫恢复 灰色区域 免疫衰竭
• 免疫功能状态直接关系 到脓毒症患者的生存。
• 生物标志物指导下的免 疫治疗改善患者免疫功 能。
时间(天)
免疫调节治疗
1. Hotchkiss RS, et al. Lancet Infect Dis. 2013;13(3):260-8. 2. Hotchkiss RS, et al. Nat Rev Immunol. 2013;13(12):862-74.
增加自然杀伤细胞(NK)活性
增强巨噬细胞活性
促进DCs 的活化
调节辅助T细胞各亚群的平衡
增加细胞毒性T细胞(CTL/CD8+)的
水平
通过NK细胞、CD4+Th1细 胞和CD8+细胞毒T细胞的共 同作用来杀伤病毒感染细胞、 肿瘤细胞
脓毒症免疫功能紊乱

免疫功能紊乱加重 脓毒症:免疫功能
2 紊乱导致机体对病 原体的清除能力下 降,加重脓毒症的 病情。
治疗策略:针对脓 毒症与免疫功能紊
4 乱的相互作用,采 取综合性治疗策略, 包括抗感染、免疫 调节等措施。
4
脓毒症免疫功能紊乱的治疗
抗感染治疗
01
抗生素:选择敏感抗生素, 控制感染
02
抗病毒药物:针对病毒感染, 使用抗病毒药物
04
器官功能支持治疗:针对受 损器官进行支持治疗,如呼 吸支持、肾脏替代治疗等
06
心理支持治疗:提供心理支 持,帮助患者缓解焦虑、恐 惧等负面情绪
谢谢
03
抗真菌药物:针对真菌感染, 使用抗真菌药物
04
免疫调节药物:使用免疫调 节药物,调节免疫功能紊乱
免疫调节治疗
1
免疫球蛋白:通过静脉注射 免疫球蛋白,提高机体免疫
力
2
细胞因子:使用细胞因子, 如干扰素、白细胞介素等,
调节免疫功能
3
免疫抑制剂:使用免疫抑制 剂,如糖皮质激素、环孢素
等,抑制过度免疫反应
4
免疫细胞疗法:通过输注免 疫细胞,如T细胞、NK细胞
等,增强免疫功能
综合治疗策略
01
抗生素治疗:针对病原菌进 行抗生素治疗,控制感染
03
营养支持治疗:提供充足的 营养支持,帮助患者恢复免 疫功能
05
预防并发症:预防脓毒症并 发症,如血栓、器官衰竭等
02
免疫调节治疗:使用免疫调 节药物,如糖皮质激素、免 疫球蛋白等,调节免疫功能
心率加快:心率增加,可能伴有 心悸
意识障碍:可能出现意识模糊、 昏迷等症状
消化系统症状:可能出现恶心、 呕吐、腹泻等症状
《基于MIMIC-Ⅲ的脓毒症患者临床特点与预后相关性分析》

《基于MIMIC-Ⅲ的脓毒症患者临床特点与预后相关性分析》一、引言脓毒症是一种由感染引起的全身性炎症反应综合征,其发病率和死亡率均较高。
近年来,随着医疗技术的进步和大数据的应用,对脓毒症患者的临床特点和预后相关性的研究逐渐增多。
MIMIC-Ⅲ(麻省理工学院麻醉数据库)是一个公开的、大型的医学数据库,包含丰富的患者信息和医疗记录,为研究脓毒症提供了良好的数据支持。
本文旨在基于MIMIC-Ⅲ数据,分析脓毒症患者的临床特点及其与预后的相关性。
二、方法本研究从MIMIC-Ⅲ数据库中提取了脓毒症患者的相关信息。
通过统计学方法和数据挖掘技术,对患者的临床特点进行描述和分析。
主要的研究变量包括患者的年龄、性别、感染部位、实验室检查指标、治疗方案等。
通过比较不同组患者的预后情况,分析临床特点与预后之间的相关性。
三、脓毒症患者的临床特点1. 人口学特征:在MIMIC-Ⅲ数据库中,脓毒症患者以中老年人为主,男性患者比例较高。
这可能与男性在社交和职业等方面的活动较多,更容易发生感染有关。
2. 感染部位:脓毒症患者的感染部位多种多样,常见的包括肺部、腹腔、泌尿系统等。
不同部位的感染对患者的临床特点和预后均有影响。
3. 实验室检查指标:实验室检查是诊断和治疗脓毒症的重要依据。
在MIMIC-Ⅲ数据库中,我们发现脓毒症患者的血常规、生化指标等均有明显的异常。
四、临床特点与预后的相关性分析1. 年龄:年龄是影响脓毒症患者预后的重要因素。
随着年龄的增长,患者的生理功能逐渐衰退,对感染的抵抗力减弱,预后较差。
2. 感染部位:不同部位的感染对患者的预后有不同的影响。
例如,肺部感染的患者往往伴有呼吸功能衰竭等并发症,预后较差。
3. 实验室检查指标:实验室检查指标可以反映患者的病情严重程度和治疗效果。
例如,白细胞计数、C反应蛋白等指标的升高提示患者病情严重,需要积极治疗。
同时,这些指标的变化也可以作为评估治疗效果和预后的参考依据。
五、结论基于MIMIC-Ⅲ的数据分析,我们发现脓毒症患者的临床特点与预后之间存在密切的相关性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【述评】严重脓毒症免疫调节治疗:从免疫抑制走向 免疫增强 脓毒症(sepsis) 是危重病患者死亡的首要原因,在所有引起居民死亡的病因中脓毒症排在第10位[1]。早期对脓毒症发病机制的研究认为,失控的、持续放大的全身性炎症反应(SIRS) 是引起脓毒症患者死亡的主要原因[2]。但随着支持治疗手段的提高,绝大部分患者能够度过严重的全身炎症反应阶段即免疫亢进期,进入更加复杂的免疫抑制(麻痹)期。近年来对死亡的脓毒症患者进行尸检发现,脓毒症后期表现为严重的免疫麻痹,且持续数天甚至数周。免疫麻痹导致后期出现继发性感染,大部分感染的病原体是多种耐药的细菌或真菌,无法控制的感染最终导致患者死亡。尽管早期液体复苏、感染灶的及时清除、抗生素的早期使用及器官功能支持的“集束化治疗” 是脓毒症治疗的基石,但脓毒症的病死率仍居高不下。因此,不断探讨和研究新的治疗方法和理念迫在眉睫。近年来已经认识到免疫麻痹是严重脓毒症患者死亡的主要原因,近期有多项研究证实免疫增强(刺激)治疗能够改善脓毒症患者的病情和提高生存率。本文将总结脓毒症免疫功能紊乱研究的最新认识,探讨脓毒症免疫增强治疗的可能性。 1 脓毒症免疫功能紊乱的传统认识 当病原微生物突破皮肤、黏膜等入侵到人体后,机体快速启动非特异性(固有) 免疫系统识别和清除致病微生物。固有免疫反应不仅是机体抵御外界微生物感染的第一道防线,其在诱导和激活获得性免疫中也发挥着重要作用。宿主细胞通过表达几类病原模式识别受体(PRRs) 来识别病原体的保守结构即病原相关分子模式(PAMPs)。常见的PAMPs包括脂多糖、肽聚糖、鞭毛蛋白及微生物的核酸分子等。PRRs主要包括定位于炎症细胞膜和内体膜上的ToII样受体(TLRs) 和C型凝集素受体(CLRs)、胞浆内的NOD样受体(NLRs)、视黄酸诱导基因I解旋酶(RIG-I)样受体(RLRs)和HIN200蛋白等。除识别PAMPs外,这些受体同时也可以识别由于组织损伤和细胞死亡而释放的内源性物质如热休克蛋白、DNA和RNA片段等内源性的危险信号。PAMPs被PRRs识别后启动下游的NF-KB信号通路,引起炎症介质的生成并介导炎症反应。适度的炎症反应有利于病原体的清除;但如果NF-KB信号通路持续激活,则引起炎症介质“瀑布样”的释放,过度的炎症反应对机体造成不利的影响,导致组织和器官功能的损伤。 过去的研究认为炎症介质的过量生成是脓毒症发病的主要病理过程[3]。动物实验和临床研究均证实炎症介质TNF-α和IL-1β等在脓毒症的发病过程中发挥了重要的作用。而且有较多的动物实验也证实抗炎症治疗、拮抗内毒素的治疗能够改善脓毒症小鼠的预后。但随后以“免疫亢进” 为理论基础的,一系列(约25项) 炎症介质(TNF-α和IL-1β等)单克隆抗体的临床实验,均发现“免疫抑制” 治疗不能改善脓毒症患者的预后[4]。近期被寄予厚望的阻断LPS与MD2-TLR4受体结合的拮抗剂(Eritoran,NCT00334828)治疗脓毒症的临床研究也以失败而告终[5]。所有这些临床研究的失败促使我们要重新认识免疫亢进对脓毒症患者死亡的影响以及脓毒症患者的免疫状态。 2 脓毒症免疫功能紊乱的再认识 近年来临床研究和脓毒症患者的尸检发现免疫麻痹是脓毒症患者死亡的主要原因。随着支持治疗手段的提高,绝大部分患者能够度过免疫亢进期,进入更加复杂的免疫麻痹期[6-7]。Ertel等[8]发现用LPS刺激脓毒症和非脓毒症患者的静脉血后,与非脓毒症患者相比脓毒症患者分泌的炎症介质TNF-α、IL-1β和IL-6量减少10% ~20%。Sinistro等也发现与其他患者相比,脓毒症患者外周血仅有5%的单核细胞功能正常[9]。这些研究结果告诉我们机体在受到严重的感染后炎症反应和抗炎症反应均参与了脓毒症的发病,脓毒症后期抗炎症反应占明显的优势、炎症细胞功能失调,机体处于免疫麻痹状态。另外,有研究发现自身免疫性疾病的患者使用TNF-α拮抗剂治疗后脓毒症的发病率和病死率明显增加[10]。 2011年Boomer等[11]在Lancet杂志发表了脓毒症患者的尸检报告,发现脓毒症死亡的患者均表现为严重的免疫抑制。与ICU非脓毒症患者相比,严重脓毒症死亡患者的脾细胞在受到抗CD3和CD28刺激5h后,炎症因子TNF-α(5361pg/mL vs.41pg/mL)、INF-γ (1374 pg/mL vs.37.5pg/mL)、IL-6(3691pg/mL vs.365pg/mL)和IL-10(633pg/mL vs.58pg/mL)的分泌量明显减少,不到对照组的10%。与非脓毒症死亡组相比,脓毒症死亡组的患者脾细胞和肺上皮细胞表面CD4、CD8、协同刺激分子受体CD28和HLA-DR的表达明显减少甚至缺乏,而CD28超家族成员中免疫共抑制分子细胞程序性死亡受体-1(programmed celldeath-1,PD-1)和细胞毒性T淋巴细胞相关抗原4(CTLA-4)的表达明显增加。新生儿和儿童脓毒症患者的尸检也发现淋巴细胞凋亡、数量减少和功能失调介导的免疫麻痹是引起患者死亡的主要原因[12]。持续的免疫麻痹导致患者对原发性致病微生物不能有效的清除,而且随着住院时间的延长和各种有创操作的增多,患者合并院内机会性病原菌的感染。2009年Torgersen等对235例死亡的脓毒症患者进行了尸检,发现尽管所有的患者均使用了广谱的抗生素和进行了感染灶的清除,但仍有76.6%的患者在死亡时感染没有得到有效的控制、感染灶仍存在;且大部分患者出现了新发部位和致病菌的院内感染,42.5%的患者出现2个以上的部位感染;其主要原因是患者的免疫功能受到了严重的抑制[13]。另外,多项临床研究发现大部分脓毒症患者后期出现了院内获得性的二重感染,金黄色葡萄球菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌和白色念珠菌等条件致病菌是引起患者死亡的主要致病病原体[14]。Luyt等和Limaye等发现部分脓毒症患者后期出现了单纯疱疹病毒和巨细胞病毒等潜伏病毒的感染[15-16]。这些临床研究告诉我们脓毒症患者随着病程的延长而出现了免疫麻痹,从而继发了机会性致病菌的感染,最终导致了患者死亡。 3 免疫增强治疗脓毒症的基础和临床研究 随着对脓毒症尤其是病程后期免疫麻痹认识的深入,近年来对脓毒症免疫调节的治疗也发生了变化,动物试验和临床研究均显示免疫增强治疗能够改善患者的免疫状态,清除致病微生物,减少获得性感染的发生率,降低病死率。目前研究较多的免疫增强药物有:粒-巨噬细胞集落刺激因子(GM-CSF)、干扰素-γ(IFN-γ)、胸腺肽(Tα1)、白介素-17(IL-17)和PD-1拮抗剂等。 GM-CSF是一种多效性细胞因子,它与GM-CSF受体结合后促进多种造血细胞的存活、增殖和分化,并通过提高中性粒细胞/单核细胞、树突状细胞等的数量而发挥免疫调节作用。动物研究证实GM-CSF能够增加脓毒症大鼠循环中免疫细胞mHLA-DR的表达和炎症介质的生成[17]。近年来临床研究发现GM-CSF对脓毒症患者具有一定的治疗作用。2011年Bo等利用Meta分析对12项RCT研究、共纳入2380例脓毒症患者进行了系统的分析,发现GM-CSF明显增加了脓毒症患者感染灶的清除,但对28d的存活率无明显的改善,这可能与入组患者脓毒症发病时间不一、免疫状态不同相关[18]。有研究发现如果选择免疫麻痹的患者进行GM-CSF刺激治疗,则能取得较好的疗效。Hall等[19]利用LPS刺激脓毒症患者外周血提取的单核细胞,对刺激后TNF-α分泌少于200pg/mL的患者,诊断为免疫抑制;给予这部分患者GM-CSF治疗后TNF-α的分泌增加,院内获得性继发感染的可能性明显减少。2009年,Meisel等[20]采用以mHLA-DR标志物为指导,对严重脓毒症患者进行GM-CSF免疫增强治疗取得了成功。研究者对严重脓毒症合并免疫麻痹状态的患者(mHLA-DR<8000mAb/细胞,连续2d)分别用GM-CSF和生理盐水作为对照治疗。发现两组患者在治疗前mHLA-DR水平差异无统计学意义SF治疗组24h后所有的患mHLA-DR水平均明显上升,而对照组仅有15.8%的患者上升;治疗组免疫反应增强,呼吸机使用时间减少,APACHEⅡ评分显著下降,住院时间和ICU入住时间明显缩短。 IFN-γ由活化的Th细胞和NK细胞产生,其主要的生物学功能是通过诱导多种抗原提呈细胞表达MHC-Ⅰ/Ⅱ分子,活化单核和巨噬细胞并增强其溶菌活性、分泌IL-1、IL-6、IL-8和TNF-α等炎症介质发挥免疫增强作用。IFN-γ还能活化中性粒细胞、NK细胞,刺激血管内皮细胞和白细胞合成黏附分子,促进Th1细胞发育和抑制Th2细胞活化与增殖,刺激B细胞产生的抗体类型向调理素方向转变。目前小样本的临床研究发现IFN-γ治疗脓毒症是有效的。Docke等[21]发现IFN-γ治疗单核细胞表达HLA-DR和TNF-α分泌减少的脓毒症患者,增加单核细胞HLA-DR的表达、CD4T细胞生成IL-17增加, 脓毒症患者的存活率提高。Nalos等[22]发现IFN-γ能够有效的治疗持续性金黄色葡萄球菌感染的患者,IFN-γ治疗后患者的免疫抑制等到有效的改善,致病病原体被清除。另外有研究发现,给予健康成年人,反复多次注射内毒素模拟脓毒症诱导的免疫麻痹的模型。研究发现在第2次注射内毒素前给予IFN-γ注射不但能够增加mHLA-DR的表达,而且也能够恢复炎症介质TNF-α的泌,抗炎症介质IL-10的分泌也明显减少[23]。 Tα1是正常人体内分泌和合成的物质,能够刺激淋巴细胞的增殖、分化,激活树突状细胞,从而具有增强人体细胞免疫功能的作用。管向东教授课题组通过多中心、随机对照研究发现Tα1能够降低严重脓毒症患者的病死率,治疗组和对照组患者的病死率分别为26.0%和35.0% (P=0.049)。Tα1治疗能够改善患者的免疫抑制状态,治疗组患者第3天和第7天外周血单核细胞mHLA-DR的表达明显高于对照组[24]。 IL-7是一种多效应的细胞因子,能够诱导幼稚的记忆性T细胞增殖。美国肿瘤研究所的临床研究发现IL-7治疗后循环中CD4和CD8T细胞的数量增加2倍,脾脏和外周的淋巴结中的T细胞增加了50%。HIV感染、CD4T细胞持续低下的患者,IL-7治疗后CD4和CD8T细胞生成细胞因子的能力增加了2~3倍。脓毒症时IL-7通过各种途径发挥作用,使T细胞激活、恢复低反应性或者耗竭的T细胞的功能,增加细胞黏附分子的表达,这些黏附分子能够增强T细胞到感染灶的聚集和黏附,增加T细胞受体的分化,导致免疫功能的增强,抵抗入侵的病原微生物[25-26]。 负性共刺激因子PD-1存在于T细胞上,通过PD-1通路能够抑制细胞的增殖、细胞因子的生成、细胞毒性功能。慢性持续性的感染如HIV和肝炎病毒的感染等PD-1的过量生成和T细胞耗尽。目前已有3项研究证实阻断PD-1通路能够提高慢性细菌和病毒感染的存活率。有研究发现脓毒症患者循环中T细胞表面的PD-1明显增加,动物研究发现阻断PD-1的信号传导能够提高脓毒症的存活率,提高脓毒症大鼠对致病微生物的清除率[27-28]。
