高中化学基础知识网络结构图(完整版)

高中化学知识结构图汇总
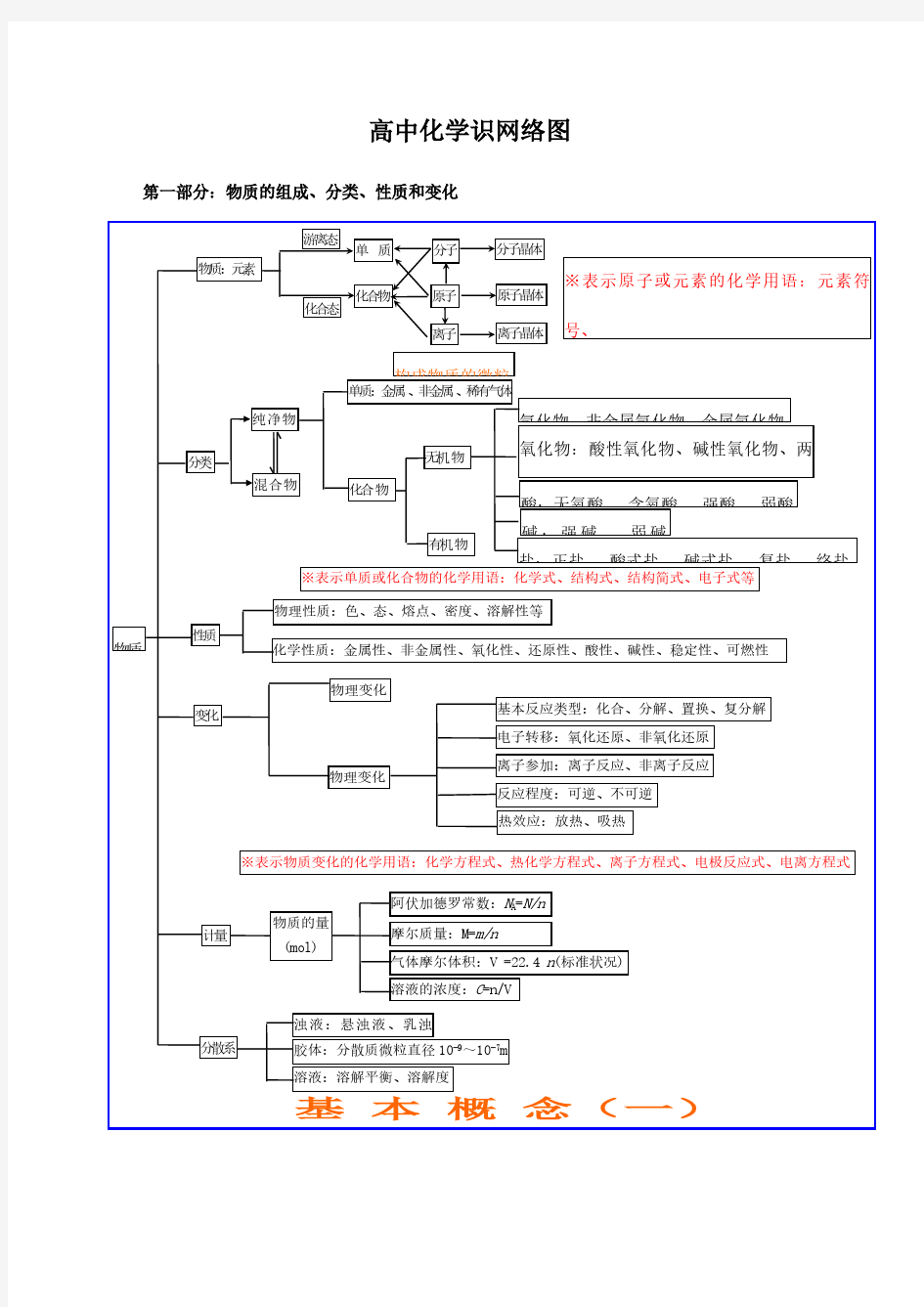
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化 大纲要求(1)了解分子、原子、离子等概念的含义。了解原子团的定义。 (2)理解物理变化与化学变化的区别与联系。 (3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。 (4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求 物质结构和元素周期律 (1)了解元素、核素和同位素的含义。 (2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 (3)了解原子核外电子排布。 (4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 (5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 (6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 (7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。 (8)了解化学键的定义。了解离子键、共价键的形成。 化学反应与能量 (1)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 (2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。 (3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 (4)了解热化学方程式的含义。 (5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 (6)了解焓变与反应热的含义。了解△H=H(反应产物)—H(反应物)表达式的含义。 (7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。 (8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。 (9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 化学反应速率和化学平衡 (1)了解化学反应速率的概念、反应速率的定量表示方法。 (2)了解催化剂在生产、生活和科学研究领域中的重大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。 (5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质溶液 (1)了解电解质的概念。了解强电解质和弱电解质的概念。 (2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。
小学语文各年级知识结构图
小学语文各年级知识结构图 一年级 一、拼音 1. 声母 2. 韵母 (1)。单韵母 (2)复韵母 (3)前鼻音韵母 (4)后鼻音韵母 (5)特殊韵母 3. 整体认读音节 4. 大小字母 5 声调 二、字 1.笔顺 2.识字 a.形近字 b.会意字 c.形声字 d.多音字 e.多义字 3.生字组词
1.反义词 2.量词 3.叠词(AABB 式) 三、句 1.看拼音写句子 2.关联词 .. 因为.... 所以…..、....... 一边 ... 一边3 造句 …….像……、……..从……、……来……. 3. 疑问句 四段 1. 认识自然段. 2.在自然段前面加序号 五、口语交际 1 看图 2.按顺序说 a从上到下 b.从左到右 c.从中间到两边 d.从景到人
1. 古诗 2. 对子 3. 儿童诗歌 4. 谚语 二年级一字 1.识字 a.形近字 b.会意字 c.形声字 d.多音字 e.多义字 2.熟练识字方法 3.生字组词二词 1. 写 a 看拼音写词语 b 多音字组词 2词语搭配 3积累词语 a. 四字词语 b. 成语 三句 1认识句子a比喻句 b 拟人句
c. 反问句 3. 写句子 a.运用标点符号写句子(逗号、句号、问号、感叹号。) b.联系上下文写句子 四段 1. 背诵片段 2. 理解段落内容 五口语交际 1 制定计划 2.听别人讲 3. 学会转述 六习作 1.培养写作兴趣 2.学写 把看到的,听到的,想到的记录下来 3.拓展 学写日记 七积累 1. 儿歌 2. 谚语 3. 古典诗词 4. 名言警句
三年 一、字 1. 学写钢笔字 a.练字必须有正确的姿势 b.练字必须有正确的执笔和运笔方法 c.注意钢笔字的笔法 2.识字 a.形近字b.多音字 3.生字组词二词1写 a看拼音写词语 b 生字组词 c 多音字组词 d近义词反义词 2.积累词语 a. 成语 b. ABB 式词语 c.“又”字结构词语 d.“不”字结构词语 e.表示时间快的词语 3.了解词语 a. 褒贬及中性词 b. 定状补词三句 1. 认识句子
高中化学选修3 物质结构与性质 全册知识点总结
高中化学选修3知识点总结 主要知识要点: 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。 (3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E (5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。 3、电子云与原子轨道 (1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核外电子运动状态的形象化描述。
小学语文一年级上册知识结构图
教学内容教学目标教学建议 1、教给学生看图识字、猜字;使学生对汉字表义的特点形成初步的认识。 2、教给学生听读识字。听读识字是一种分散识1、识字至少334字、随文识字的方法,它的核心是将汉字的字形与字个,上不封顶,允许学音对应起来。教学时,先通过儿童听力强、记忆力强生识字量有差异。学习的特点,带学生反复朗读课文,直至背下来;然后缩20个最常见的偏旁 (部首)。 2、让学生学习并 掌握听读识字和看拼3、看拼音识字和听读识字互相配合。遇到不认小语境,摘出词、语、短句认读,再把单字从这些词、语、短句中摘离出来,把字音与字形对应起来,单独识记。最后再把汉字放回课文中认读。 认字 音识字两种方法。培养识的字,有拼音就看拼音,没有拼音就想办法问别人。 学生主动识字的习惯,课堂上,教师应以听读为主要的识字教学方法;自读鼓励学生学习教材规时,要充分利用拼音认字;老师教,以带读生字为主定必学的字的同时,主要方法;学生自学,要充分利用拼音认字。教学儿歌,动在生活中识字。主要通过听、读、背认字;教学韵文和散文,要引导学生看拼音串读渗透性地识字。 4、开放单元要让孩子走出校门,走出家门,到大语文环境中去认字。 1、学习正确的握 1、在课堂上指导写字,在课堂上监控写字,以笔姿势、书写姿势,养 及时发现问题,特别是督促学生养成良好的写字习成良好的书写习惯,写 惯。
字至少138个。 2、分散难点,以提高写字效率,使学生能熟练写字2、学习掌握基本 地使用写字用具,从小就“不怵”写。不要把一个单笔画和笔顺规则,并能 元、一本书的生字集中到一起写。 按笔顺规则在田字格 正确书写。3、教学时,“写对”和“写好”两个阶段的要求应有不同。先使学生“会写”,在“会”的基础上,3、培养学生认真 再引导学生观察、比较,揣摩怎么写才好看。 写字和爱惜写字用具 的习惯。使学生养成认4、注意培养学生良好的写字习惯。坐姿、拿笔真细心的学习态度和的姿势、如何使用橡皮、用具怎样摆放等,都需要养良好的意志品质。成良好的习惯。 1、拼音教学要与识字教学、阅读教学相结合,以汉字带学拼音,在学习拼音时学习汉字。前期以识字为主,稍稍带一点拼音;中期以熟字带拼音,学拼音带识字;后期运用拼音识字,巩固拼音。 拼音学习汉语拼音, 能看拼音读出字音。2、教学过程中注意用歌谣、游戏、活动等方式激发学生的学习兴趣;借助插图、儿歌帮学生记忆字母的音和形;采取多种形式的读来巩固识记拼音。 3、教师可以适当补充一些音节,提高学生的拼读能力。 1、始终把激发兴趣放在阅读教学的首位。在阅读教学中,我们可以利用低年级孩子的年龄特点,开展形式多样的阅读活动,扩大阅读量,激发学生阅读1、通过阅读课文的兴趣。 和开展各种学习活动,
高中化学选修4知识网络架构
化学选修化学反应原理 第一章 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0☆常见的放热反应:①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大
多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应 ④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101 kPa
②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1 mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。 2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为: H+(aq) +OH-(aq) =H2O(l) ΔH=-mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于mol。 4.中和热的测定实验 五、盖斯定律 1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。
高中化学必修一各章知识点网络图
混合物的分离与提纯 必修一 第一章《从实验学化学》知识网络归纳 一、混合物的分离与提纯 ①依据:状态不同 过滤 ②从液体中分离出不溶的固体物质 ③举例:出去食盐中的泥沙 ①依据:挥发性不同 蒸发 ②从溶液中分离出溶质 ③举例:从NaCl 溶液中分离出NaCl ①依据:溶解度随温度变化 结晶 ②把两种可溶性固体从溶液中分开 ③举例:NaCl 和KNO 3的分离 物理方法 ①依据:沸点不同 蒸馏 ②把两种互溶的液体分开 ③举例:石油分离为汽油、煤油、柴油等。 ①依据:二者互补相容 分液 ②把两种互不相容的液体分开 ③举例:分离四氯化碳和水 ①依据:溶质在不同溶剂中溶解度的不同 萃取 ②把溶质从溶剂中提取到另一种另一种溶剂中 ③举例:用四氯化碳提取碘水中的碘 原则:不增、不减、易分、复原 化学方法 沉淀法:如除去:SO 42-、Ca 2+、Mg 2+、等 方法 气化法:如除去CO 32+等 一、高考中常考的离子检验 ① 从外观观察其颜色、状态 步骤 ②配成溶液,观察溶液颜色、有无沉淀或气体生成 ③用化学试剂检验 ①稀盐酸、BaCl 2溶液 SO 42- ②生成白色沉淀 化学 ③BaCl 2+Na 2SO 4=BaSO 4↓+2NaCl 方法 ①稀HNO 3、AgNO 3溶液 Cl - ②生成不溶于稀HNO 3的白色沉淀 ③ AgNO 3+ NaCl=AgCl↓+NaNO 3
二、物质的量及物质的量浓度 × M ×1000ρ ×溶质摩尔质量
第二章《化学物质及其分类》知识网络归纳 一、物质的分类。金属:Na、Mg、Al 单质 非金属:S、O、N 酸性氧化物:SO3、SO2、P2O5等 氧化物碱性氧化物:Na2O、CaO、Fe2O3 氧化物:Al2O3等 纯盐氧化物:CO、NO等 净含氧酸:HNO3、H2SO4等 物按酸根分 无氧酸:HCl 强酸:HNO3、H2SO4、HCl 酸按强弱分 弱酸:H2CO3、HClO、CH3COOH 化一元酸:HCl、HNO3 合按电离出的H+数分二元酸:H2SO4、H2SO3 物多元酸:H3PO4 强碱:NaOH、Ba(OH)2 物按强弱分 质弱碱:NH3·H2O、Fe(OH)3 碱 一元碱:NaOH、 按电离出的HO-数分二元碱:Ba(OH)2 多元碱:Fe(OH)3 正盐:Na2CO3 盐酸式盐:NaHCO3 碱式盐:Cu2(OH)2CO3 溶液:NaCl溶液、稀H2SO4等 混悬浊液:泥水混合物等 合乳浊液:油水混合物 物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等
小学语文知识宝典
小学语文知识宝典 一、拼音 1、字母(26个) 大写: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z 小写:ɑ b c d e f ɡ h i j k l m n o p q r s t u v w x y z 2、声母(23个) b p m f d t n l ɡ k h j q x zh ch sh r z c s y w 3、韵母(24个) 单韵母:ɑ o e i u ü 复韵母:ɑi ei ui ɑo ou iu ie üe er 前鼻韵母:ɑn en in un ün 后鼻韵母:ɑnɡ enɡ inɡ on ɡ 4、整体认读音节 zhi chi shi ri zi ci si yi wu yu ye yue yuɑn yin yun yinɡ 5、声调 分为四声(ˉˊˇˋ)。标调歌:“有ɑ不放过,无ɑ找o、e ,i、u 并列标在后” 6、音节 音节是声母、韵母和声调的组合。 当韵母“u”和声母“j、q、x、y”相拼时,去掉“u”头上的两点,如“ju”。 7、隔音符号 当a、o、e 开头的音节连接在其他音节后面,读音易发生混淆时,应在第一个音节后面加上隔音符号,用“’”表示,帮助分清两个音节。如“pinɡ’an(平安)”、“qi’e(企鹅)”。 二、汉字 1、笔画与笔顺规则“先横后竖(十),先撇后捺(八),从上到下(景),从左到右(树),从外到内(同),从内到外(函),先里面后封口(国),先中间后两边(水)。” 2、偏旁部首和间架结构(7种结构)独体字(中)、左右结构(秋)、左中右结构(做)、上下结构(恩)、上中下结构(翼)、全包围和半包围结构(园、区)、品字形结构(晶) 3、无声的老师——字典(3种查字方法)(1)“音序查字法”的步骤:认准字音;定字母、翻索引;查音节、找汉字。(2)“部首查字法”的步骤:定部首、翻索引;数余画;查汉字。(3)“数笔画查字法”的步骤:数准笔画数;翻索引、查‘难检字索引’;找汉字。 4、形近字 5、多音字 6、同音字 三、词语 1、词性划分 实词:名词(木)、动词(跑)、形容词(美丽)、数词(一)、量词(位)、代词(你、我、他们)虚词:副词(特别、不)、介词(在、关于)、连词(和)、助词(着、的、啊)、象声词(叮咚)2、近义词和反义词 3、词语归类 例如:按照植物、动物、水果和蔬菜等等分类。 4、词语结构 AA:“一群群” AABB:“重重叠叠”、“干干净净” ABAB:“研究研究” 5、成语和谚语。诀窍“ 三多”:多读、多想、多记。 四、语句 1、单句:由主语和谓语组成。 根据应用分为四种:陈述句(叙述说明);疑问句(询问、提问);祈使句(要求、希望或命令别人做什么);感叹句:表达某种强烈感情) 2、复句:(1)并列关系:……也……,……又……,一边……一边……,有时……有时……,不是……而是… (2)递进关系:不但……而且……,……还……,……甚至……,……也…… (3)选择关系:……或者……,是……还是……,不是……就是……,要么……要么…,与其……不如… (4)转折关系:虽然……但是,……可是……,……然而……,尽管……还是,……却……(5)假设关系:如果……就……,即使……也……,要是……才…… (6)条件关系:只有……才……,只要……就……,除非……才……,无论……都……,任凭……(7)因果关系:因为……所以……,……因此……,之所以……是因为……,既然……就…… 3、理解句意的方法 (1)抓住重点词语理解(2)联系上下文理解 4、扩句、缩句和合并句 (1)扩句:加上恰当的词语修饰和限定语。扩句的原则:(1)不改变原句的主要成分(2)扩充的附加成分必须合理(3)如有例句按照例句扩充。扩句的方法:(1)找句子的主干成分(2)
高中化学知识的结构体系
高中化学知识的结构体系 ★在高考考试大纲中,对高考化学科考试范围分为“必考内容”与“选考内容”两部分。 总计51个知识点,167个考点。 1、必考内容:涵盖必修模块“化学1”、“化学2”与选修模块“化学反应原理”的内容。 2、选考内容:涵盖选修模块“化学与生活”、“化学与技术”、“物质结构与性质”、“有机化学基础”的内容,在高考中考生从 中任选一个模块考试。 必考内容,必修一:19个知识点,56个考点。 必考内容,必修二:10个知识点,32个考点。 必考内容,选修四:5个知识点,21个考点。 选考内容,选修一二三:10个知识点,33个考点。
选考内容,选修五六:7个知识点,25个考点。 (必考)必修1——人教版高一上学期 第一章从实验学化学 ?本章特点内容比较简单,但就是从第二节物质的量开始很多学生学不明白。 ?本章就是高一学生开始化学退步的开始,甚至就是高三理科生的死结。 ?应对办法:真正的理解知识,配合少量的习题。 ?高考命题:计算题或者阿伏伽德罗常数的选择题,属于高考热点。 第二章化学物质及其变化 ?本章内容主要就是氧化还原与离子反应。 ?本章很多同学存在的困难就是氧化还原配平。 ?应对办法:学习配平技巧。 ?高考命题:离子共存、离子方程正误的选择题,属于高考热点、常考点。氧化还原易出计算类选择或者计算题,也可能出判断类选择。 第三章金属及其化合物 ?本章重点内容就是金属钠、过氧化钠、金属铁的两种变价、铝的两性。就是会考重点。 ?本章方程式增多,学生困惑在方程式的记忆。但本章学生自己感觉难度不大。 ?应对办法:学习归纳法的技巧,系统学习。 ?高考命题:推断题,实验题,选择题。 第四章非金属及其化合物 ?本章重点内容就是氨气、氯气、碳与硅。就是会考重点。尤其就是氯气与氨气的制取就是会考必考点。 ?本章方程式增多,学生困惑在方程式的记忆。但本章学生自己感觉难度不大。 ?应对办法:学些归纳法之类的技巧,系统学习。 ?高考命题:推断题。 (必考)必修2——人教版高一下学期
最新高中化学物质结构知识点总结
分子结构与性质 共价键:原子间通过共用电子对形成的化学键。 极性键:正电中心和负电中心不重合; 非极性键:正电中心和负电中心重合; 分子极性与非极性判别: 极性:中心原子最外层电子未全部成键; 非极性:中心原子最外层电子全部成键; 氢键:氢键是由已经与电负性很强的原子(如N、F、O)形成共价键的氢原子与另一个分子中或同一分子中电负性很强的原子之间的作用力。 氢键对物质性质的影响 (1)当形成氢键时,物质的熔、沸点将升高。 (2)氢键不属于化学键; σ键、π键判别规律: 1.共价单键全部都是σ键; 2.共价双键中一个是σ键,一个是π键; 3.共价三键中一个是σ键,两个是π键; 价层电子对互斥理论: 价层电子对数目=(中心原子的价电子数+配位原子提供的电子数)/2 a、如果是离子团,离子的价电子对数应考虑离子所带的电荷: (1)负离子的价电子数=中心原子的价电子数+所带的负电子数; (2)正离子的价电子数=中心原子的价电子数-所带的正电荷数; b、如果成键原子是配位原子,与中心原子之间的化学键是单键时,配位原子提供的价电子数是1,如H、卤素原子;双键时,配位原子提供的价电子数为0,如氧原子,三键时,配位原子提供的原子为-1,如乙炔。双键、三键都当做一个配位原子。 c、σ键电子对数:由分子式确定。如H2O、NH3、CH4分子中的中心原子O、N、C分别含有 2、3、4对σ键电子对。 d、中心原子上的孤对电子数:为,式中a为中心原子的价电子数(主族元素的价电子数就是最外层电子数);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子等于“8-该原子的价电子数”)
小学语文知识点总结集锦
小学语文知识点总结集锦 一、拼音 1、基础知识回顾:23个声母、24个韵母、16个整体认读音节。 2、声调:分为四声。标调歌:“有a 不放过,无a 找o、e ,i、u 并列标在后” 3、音节:音节是声母、韵母和声调的组合。 (1)当韵母“u”和声母“j、q、x、y”相拼时,去掉“u”头上的两点,如“ju”。 (2)人或事物等专用名词的拼音,第一个字母大写,如“北京Beijing” 4、隔音符号:当a、o、e 开头的音节连接在其他音节后面,读音易发生混淆时,应在第一个音节后面加上隔音符号,用“’”表示,帮助分清两个音节。如“ping’an(平安)”、“qi’e(企鹅)”。 二、汉字 1、笔画与笔顺规则“先横后竖(十),先撇后捺(八),从上到下(景),从左到右(树),从外到内(同),从内到外(函),先里面后封口(国),先中间后两边(水)。” 2、偏旁部首和间架结构(7种结构) 独体字(中)、左右结构(秋)、左中右结构(做)、上下结构(恩)、上中下结构(翼)、全包围和半包围结构(园、区)、品字形结构(晶) 3、无声的老师——字典(3种查字方法) (1)“音序查字法”的步骤:认准字音;定字母、翻索引;查音节、找汉字。 (2)“部首查字法”的步骤:定部首、翻索引;数余画;查汉字。部首查字法的规则:上下都有,取上不去下; 左右都有,取左不取右; 内外都有,取外不取内。独体字一般将字的第一画作为其部首。 (3)“数笔画查字法”的步骤:数准笔画数;翻索引、查‘难检字索引’;找汉字。 4、形近字(8种表现形式)——理解记忆法、口诀记忆法 (1)笔画相同而位置不同“由”和“甲” (2)字形相似但笔形不同“外”和“处” (3)字形相似但偏旁不同“晴”和“睛” (4)字形相似但笔画数量不同“今”
小学语文知识框架图
小学语文知识框架图 年级内容课时选课 小学语文知识(四-六年级课文知识 点归纳、 重难点点 拨、同步 练习 四年级上册 1.引导学生独立识字知道学生对多音字、易混字的识 记 2.对新出现的词语进行识记、检测、运用 3.通过造句、仿句或仿写等手段,强化易语言运用能 力 4.在看图训练、口语交际、情景对话中提高学生的表 达能力 5.引导学生体会课文中的情感,逐步培养学生的美好 情感 10 四年级下册10 五年级上册10 五年级下册10 六年级上册10 六年级下册10 小学知识 点的专题 练习 字词识记与运用对多音字、易混字的辨别 5 常见词语的理解与运用 5 常见句式的变化 句式人称变换(第一、第二、第三人称) 3 句式的相互转换(陈述句、祈使句、反问句、疑问句)8 句子的压缩与扩展的方法和技巧 5 部分修辞格的了解及初步运用(比喻、拟人、排比) 2 标点符号的正确使 用 常见标点符号的作用(逗号、顿号、分号) 2 对标点符号运用的常见错误的辨析 3 古诗文的知识与内 容的理解 作者生平、诗文大意、思想内容等的梳理与延伸8 文章的感知与理解 文章的整体内容及作者的思想感情的了解(对文章结 构、思路的把握) 8 文章的写作手法等了解及运用(悬念、抑扬、背景等) 5 听说读写练的综合 能力的提高 看图说话、写作训练 5 情景对话、片段作文 5 归纳、分析能力的培养 3 课外延伸对课文知识点进行相关链接和知识面的扩展等 5 合计(小时):
作文高分冲刺、强化训练体系列表 编号内容课时选课1 考试作文走势分 析 思想倾向、体型变化、热点追踪等10 2 文体写作相关知 识储备及写作技 巧、分类训练 记叙文 记事类行文技巧、结构的巧 妙安排,言语风格等 12 写人类 写景状物类 议论文 立论立意,论证方法的选 择,素材取舍等 15 驳论 说明文 事物说明说明顺序、说明方法 的运用等 6 事理说明 应用文 书信体 各种体式范例及写 作驾驭,语言要求等 8 新闻 调查报告 个人网页设计 体例 演讲文稿等 散文叙事散文情节的安排,散文行 文技巧等 10 抒情散文 3 最新作文题型全 解 片段作文 相关题型题材对象范围的准确把握,立 意的突破,文体选择,行文要点等内化 突破,意识提升,整体安排等 5 命题半命题 作文 8 新材料作文10 看图作文 5 话题作文8 4 专项训练 审题、拟提、立意、文体、选材等技巧提升8 想象力、创造能力、抑扬处理、比喻论证、对比论证, 情理结合,以新取胜,优秀体式内化,语体把握等强化 训练 15 5 专场作文抢分技 巧 六大注意,七大避免 审题、情感倾向、立意与构思、 结构安排、中心不明,思维定势、 文体不当、时间安排失误等 10 抢分巧拟题目,开头与结尾,行文的 变幻规则,层次的巧妙安排等10 6 时事热点材料解析与运用
高中化学物质结构与性质期末复习资料(知识点总结)
第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化:
高中化学必背知识点归纳与总结史上最全)
目录高中化学学习方法………………………………………( 2 ) 高中化学必背知识点……………………………………( 3 ) 高中化学重点……………………………………………( 16 ) 化学计算………………………………………………( 2 1 ) 解题技巧…………………………………………………( 2 5 ) 完整的知识网络构建,让复习备考变得轻轻简单! 高中化学学习方法 经过初中的学习,学生对化学这一学科有了基础的了解。但针对高中有化学学习,在部分学生还 茫然无措。现在就结合高中化学元素的特点,谈谈我对高中 化学的认识和学方法的总结 初中化学来说,知识量更加庞大,内容更加繁杂。但经 过细细的摸索和分析,它仍有规律可循。只要把握好这些规律,高中化学的学习将会变得比较简单。
首先,牢牢地把握好元素周期律这些规律,就为我们 学习元素打下了艰实的基础,然后结合具体元素的特殊性,加以补充,这样对元素这部分的学习就显得相当容易。 其次,紧紧抓住“结构决定性质,性质决定用途”这 条原则,切实掌握物质的结构和性质,并与应用结合起来,这样就能够从识记的水平提高到运用的水平。这也 是高考考查的能力之一。 还要学会活学活用,通过类比的方法,掌握一系列元素的性质,一类化学反应的实质。这样就在很大程度上解决了记忆量大,内容繁多的问题。 下面我谈谈高中化学的课堂学习方法: 考虑到高中学生的素质,切实做好预习是不可能的,但这并不等于放弃课前预习。要对老师的问题有些了解,为听课做好准备。 课堂上务必要认真听课,跟着老师的点拨思路走,通过老老师的引导,最终解决问题。在课堂上一定要慎防发做笔记代替听课,这样会大大降低听课质量。笔记可以在课后根据自己的记忆和理解补记。课堂上一定要勤,勤问,勤思,勤动手。做到以上这些,就会使课堂学习变得充实而有效。 课后复习也是非常重要的一个环节。要对老师讲过的知识加以总结,再思考,最后成为自己的东西。 希望同学们根据以上学习方法,结合自身学习状况,形
人教版小学语文一年级上册第六单元知识结构图
人教版小学语文一年级上册第六单元知识结构图 【单元教材分析】 《比一比》教材由五部分组成。第一部分图画,再现农家小院的景象,为第二部分词语、第三部分韵文提供直观形象的画面。第三部分韵文由四小节组成,主要通过对农家小院里具体事物的比较,展现农家生活的一个侧面。韵文押韵上口,节奏感强,很适合儿童朗读。 《自选商场》一课,通过插图和文字创设了一个真实的生活情景,反映时代生活,拉近识字与生活的距离,引导学生在生活中主动识字,在主动探究中识字,感受识字的乐趣,并了解社会生活。《菜园里》是人教版义务教育课程实验教科书《语文》一年级上册中一篇识字课文。本课有九个词和一首儿歌,词语是菜园里各种蔬菜的名称,儿歌描述了一些蔬菜的特点,儿歌语言生动形象,琅琅上口。 《日月明》是一篇识字韵文,它通过韵文的形式提示了一些会意字的构字特点。几个句意的理解完全可以通过会意字的特点进行分析。韵文的词串压韵,读起来琅琅上口,便于诵读记忆。 【单元教学目标】 1、正确、流利、有感情地朗读课文。 2、识字写字,认识53个生字以及认识笔画“竖钩、卧钩”和4个偏旁“提土旁、女字旁、竹字头、风字框”。会写“牛、羊、小、少、巾、牙、尺、毛、卜、又、心、风、力、手、水”15个字。 3、知道“多-少、大-小“两组意思相反的词,在情境中了解量词”群、颗、堆“的意思,学习正确使用量词。 4、引导学生建立学习与生活的联系,培养学生在生活中主动学习语文的兴趣。 5、观察了解自选商场的购物方式,体会它给人们带来的便利。认识一些蔬菜,了解它们的特点。 6、初步了解会意字的构字特点,激发学生对祖国语言文字的喜爱之情。 【单元教学重、难点】 1、学习生字,背诵课文,积累语言以及量词的积累、运用。 2、培养学生在生活中主动识字。 3、认识表示商品名称的汉字,了解自选商场的购物方式,能正确、流利地朗读课文。 4、放在字音及会意字构字特点上,理解字意。知道会意字的构字规律。 【单元课时安排】 《比一比》: 2 课时 《自选商场》: 2 课时 《菜园里》: 2 课时 《日月明》: 2 课时 《语文园地四》: 3 课时
小学语文知识点汇总知识讲解
小学语文各年级学习要点 一年级:【要求掌握拼音的运用,难点把字母表背熟,重点字母的运用】 二年级:【要求认识简单的字,学习阅读文章,重点多音字的运用,还有字的认识,难点区别多音字】 三年级:【要求认识多字,学习作文,难点联系上下文,解决课后问题,重点回答问题】 四年级:【要求学习作文,写作文,难点把课文理解,重点作文,阅读的掌握】 五年级:【要求掌握许多多音字,字词,会写好作文难点作文,重点阅读与作文】 六年级:【要求认识很多字,区别很多读音,字词,写好作文,难点阅读,重点作文与阅读,通常占整张试卷的60分】 第一部分小学语文1-6年级基本知识点 一、汉语拼音 1、掌握23个声母:b p m f d t n l g k h j q x z c s zh ch sh r y w 2、掌握24个韵母: 1) 单韵母:a o e i u ü 2) 复韵母8个:ai ei ui ao ou iu ie üe 3) 鼻韵母分为前鼻音和后鼻音。前鼻音为:an en in un ün 后鼻音为:ang eng ing ong 3、特殊韵母:er 它不能和声母相拼,只单独作为字音。 4、整体认读音节16个:zi ci si zhi chi shi ri yi yu wu ye yue yin yun yuan ying 5、标调:a o e i u ü,标调时按顺序,iu并列标在后,i上标调去掉点;ü与j q x y相拼 时去两点,如ju qu xu yu 。 6、字母表: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z a b c d e f g h i j k l m n o p q r s t u v w x y z 7、隔音符号:以a o e 开头的音节紧跟在其它音节后面时,音节的界限容易发生混淆,因此音节间要用隔音符号(')隔开。如海鸥hǎi 'ōu 二、查字典的方法 1、音序查字法。如:鼎dǐn,先在“拼音音节索引”中找出音序(D),再查找音节(dǐn)及所对应的页码。 2、部首查字法。如查“挥”字,先在“部首目录”中找到(扌),再找到部首所对应的“检字表”页码,在“检字表”相应部首下及剩余笔画数(6画)下找到要查的字及正文页码。 3、数笔画查字法。在阅读中遇到不知读音,又很难确定部首的字,就只能用数笔画的方法来查了。首先,在“难检字索引”中的相应笔画数下找到该字,再打开所对应的正文页码就可查到这个字。如查“乙”,在“难检字索引”中查(1)画。
马骋小学语文四年级知识结构图
小学语文四年级上册复习资料 第一单元知识点总结 1.《老师,您好!》这是一首现代抒情诗,赞美了教师事业的崇高和美好,抒发了孩子们对老师感激、热爱的思想感情。 2、诗中“哪个人的成长不浸透着教师的心血!”和“哪一项创造不蕴含着教师的辛劳!”这两句诗最能体现老师工作的崇高。诗歌把老师比作春蚕,我想把老师比作园丁、蜡烛、铺路石。 3.《老师,您好!》中,老师用真理和智慧把人才塑造,让春晖和朝霞在心灵闪耀。读了这首诗,我想对老师说:“老师,你真伟大!。” 4.“昨天”“今天”“理想”这是两个比喻句中的词语,诗句中“昨天”指过去的历史。“今天”指现在;“理想”指未来。诗人用这句话形象地说明了教师不仅要让学生知道历史,现状和未来,还要帮助学生树立远大的理想,走向幸福的明天。 5.“春晖”:比喻教师的关心和爱护;“朝霞”:比喻教师的教学像早晨的霞光,给学生带来光明、美好的一天;“春蚕”:比喻辛勤的老师;“理想的丝线”:比喻教师心情劳动的工作成果;“甘露”:比喻教师付出的心血;“茁壮的新苗”“幸福开放的鲜花”:比喻幸福成长的学生。 6.《但愿人长久》的题目中:“但”的意思是只。“愿”是希望、祝愿的意思。“长久”的意思是长久地活着,心怀美好的情感。题目的意思是:但愿大家都能健康生活,美好的情感常留心间。课文中表现苏轼情感变化的词语是先“心绪不宁”,接着“埋怨”,后来“宽慰”。 7.“人有悲欢离合,月有阴晴圆缺,此事古难全。”可以用课文中的“世上本来就是有悲也有欢、有离也有合的,就像天上的月儿有隐也有现、有圆也有缺一样,哪里会十全十美呢!”来解释; 8、“但愿人长久,千里共婵娟!”可以用课文中的“但愿美好的感情长留人们心间,虽然远隔千里,也能共同拥有这一轮明月!”来解释。词中的“此事”指的是“人有悲欢离合,月有阴晴圆缺”;“婵娟”原指美好的样子,词中指美好的月色。这些词句表达了词人热爱生活、积极奋发的宽大胸怀。 9.《望洞庭》是唐代诗人刘禹锡写的,作者借助丰富的想象和形象的比喻,描绘了秋月映照下的洞庭湖的美景,表达了诗人热爱大自然的美好感情。 10、《望洞庭》意思是:秋夜,洞庭湖水清澈透明,与明月的清光交相辉映,显得十分宁静、和谐;湖上无风,迷迷蒙蒙的湖面就像未经磨拭的铜镜一样。在明月银辉下,青翠的君山,清澈的湖水,浑然一体,远望如同银盘里放了一颗小巧玲珑的青螺,十分惹人喜爱。 11、《望洞庭》运用了比喻的修辞手法,分别把洞庭湖水面比作未磨的铜镜;后两句把洞庭湖比作了白银盘,把君山比作了青螺。
小学语文结构图
拼音 1、基础知识回顾:23个声母、24个韵母、16个整体认读音节。 2、声调:分为四声。标调歌:“有a 不放过,无a 找o、e ,i、u 并列标在后” 3、音节:音节是声母、韵母和声调的组合。 (1)当韵母“ 用名词的拼音,第一个字母大写,如“北京 Beijing” 4、隔音符号:当a、o、e 开头的音节连接在其他音节后面,读音易发生混淆时,应在第一个音节后面加上隔音符号,用“’”表示,协助分清两个音节。如“ping’an(平安)”、“qi’e(企鹅)”。二、汉字 1、笔画与笔顺规则“先横后竖(十),先撇后捺(八),从上到下(景),从左到右(树),从外到内(同),从内到外(函),先里面后封口(国),先中间后两边(水)。” 2、偏旁部首和间架结构(7种结构)独体字(中)、左右结构(秋)、左中右结构(做)、上下结构(恩)、上中下结构(翼)、全包围和半包围结构(园、区)、品字形结构(晶) 3、无声的老师——字典(3种查字方法)(1)“音序查字法”的步骤:认准字音;定字母、翻索引;查音节、找汉字。(2)“部首查字法”的步骤:定部首、翻索引;数余画;查汉字。部首查字法的规则:上下都有,取上不去下;左右都有,取左不取右;内外都有,取外不取内。独体字一般将字的第一画作为其部首。(3)“数笔画查字法”的步骤:数准笔画数;翻索引、查‘难检字索引’;找汉字。 4、形近字(8种表现形式)——理解记忆法、口诀记忆法(1)笔画相同而位置不同“由”和“甲” (2)字形相似但笔形不同“外”和“处”(3)字形相似但偏旁不同“晴”和“睛”(4)字形相似但笔画数量不同“今”和“令”(5)结构单位相同但位置不同“陪”和“部”(6)形近音相同“很”和“狠”(7)形近音相近“清”和“情”(8)形近音不同“贫”和“贪” 5、多音字:字形相同,读音不同。如“塞”、“露”、“咽”。同音字:音同形不同。如“燥”和“躁”。 6、多义字:有两种或两种以上意思的字。如:“张” (1)展开(2)看、望(3)陈设(4)姓三、词语实词:名词(木)、动词(跑)、形容词(美丽)、数词(一)、量词(位)、代词(你、我、他们) 1、词性划分虚词:副词(特别、不)、介词(在、关于)、连词(和)、助词(着、的、啊)、象声词(叮咚) 2、近义词和反义词(1 )意思相同的词:“爸爸——父亲”、“互相——相互” 小学各年级课件教案习题汇总 一年级二年级三年级四年级五年级 (2 )意思相近的词:词义的轻重不同:“愉快”→“高兴”→“快活” 词的意义上辨析词义的范围不同:“战斗”和“战役”词义的感情色彩不同:“果断”和“武断”词的搭配关系不同:“严厉”和“严格” 绝对反义词:“生”→“死”;“富”→“穷”辨析角度:意义和感情色彩相对反义词:“前”→“后”;“高”→“低” 3、词语归类——分类记忆法例如:按照植物、动物、水果和蔬菜等等分类。 4、词语结构一AA:“一群群” AABB:“重重叠叠”、“干干净净” ABAB:“研究研究” 5、成语和谚语。诀窍“三多”:多读、多想、多记。四、语句 1、单句:由主语和谓语组成。根据应用分为四种:陈述句(叙述说明);疑问句(询问、提问);祈使句(要求、希望或命令别人做什么);感叹句:表达某种强烈感情) 2、复句:(1)并列关系:……也……,……又……,一边……一边……,有时……有时……,不是……而是…(2)递进关系:不但……而且……,……还……,……甚至……,……也……(3)选择关系:……或者……,是……还是……,不是……就是……,要么……要么…,与其……不如…(4)转折关系:虽然……但是,……不过……,……不过……,即使……还是,……却……(5)假设关系:如果……就……,即使……也……,要是……才……(6)条
高考化学知识点总结(超级详细)
4 4 3 2- 2- 2- - - - + 一、阿伏加德罗定律 高考化学 Ⅰ、基本概念与基础理论: 1.内容:在同温同压下,同体积的气体含有相同的分子数。即“三同”定“一同”。 2.推论 (1)同温同压下,V 1/V 2=n 1/n 2 同温同压下,M 1/M 2=ρ1/ρ 2 注意:①阿伏加德罗定律也适用于不反应的混合气体。②使用气态方程PV=nRT 有助于理解上述推论。 3、阿伏加德罗常这类题的解法: ①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa 、25℃时等。 ②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如 H 2O 、SO 3、已烷、辛烷、 CHCl 3 等。 ③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He 、Ne 等为单原子组成和胶体粒子,Cl 2、N 2、O 2、H 2 为双原子分子等。晶体结构:P 4、金刚石、石墨、二氧化硅等结构。 二、离子共存 1.由于发生复分解反应,离子不能大量共存。 (1)有气体产生。如 CO 3 、SO 3 、S 、HCO 3 、HSO 3 、HS 等易挥发的弱酸的酸根与 H 不能大量共存。 (2)有沉淀生成。如 Ba 2+、Ca 2+、Mg 2+、Ag +等不能与 SO 2-、CO 2-等大量共存;Mg 2+、Fe 2+、Ag +、Al 3+、Zn 2+、Cu 2+ 、 Fe 3+ 等不能与OH -大量共存;Fe 2+ 与S 2-、Ca 2+ 与 PO 3-、Ag + 与 I - 不能大量共存。 (3)有弱电解质生成。如 OH -、CH 3COO -、PO 43-、HPO 42-、H 2PO 4-、F -、ClO -、AlO 2-、SiO 32-、CN -、C 17H 35COO - 、 等与 H + 不能大量共存;一些酸式弱酸根如 HCO 3-、HPO 4 2-、HS - 、H 2PO 4-、HSO 3 -不能与OH - 大量共存;NH 4 + 与OH - 不能大量共存。 (4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO 2-、S 2-、CO 32-、C 6H 5O - 等必须在碱性条件下才能在溶液中存在;如 Fe 3+ 、Al 3+ 等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如 3AlO 2-+Al 3+ +6H 2O=4Al(OH)3↓等。 2.由于发生氧化还原反应,离子不能大量共存。 (1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S 2-、HS -、SO 32-、I -和 Fe 3+ 不能大量共存。 (2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如 MnO 4-、Cr 2O 7-、NO 3-、ClO -与 S 2-、HS -、 SO 32- 、HSO 3- 、I - 、Fe 2+ 等不能大量共存; SO 32- 和 S 2- 在碱性条件下可以共存, 但在酸性条件下则由于发生 2S 2-+SO 32-+6H + =3S ↓+3H 2O 反应不能共在。H + 与 S 2O 32-不能大量共存。 3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。 例:Al 3+ 和 HCO 3-、CO 32-、HS -、S 2-、AlO 2-、ClO -等;Fe 3+ 与 CO 32-、HCO 3-、AlO 2-、ClO -等不能大量共存。 4.溶液中能发生络合反应的离子不能大量共存。
