核外电子分层排布的原子结构模型
卢瑟福原子结构模型
电子层
第2层 原子核 第1层
原子核
+18
Ar
原子核带正电
该电子层 上的电子
+18
K层
2
8
8
核电荷数
Ar
L层 核电荷数 该电子层上的电子数
M层
教材P29
稀有气体元素原子电子层排布
各电子层的电子数
K 1 L 2 M 3 N 4 O 5 P 6 最外层电子数
元素 名称
元素 符号
氦
氖
He
Ne
2
2 8
1.金属单质Na、Mg能分别与非金属单质O2、Cl2 发生反应生成氧化物和氯化物,请写出化学式.
Na2O 、MgO 、 NaCl、MgCl2
教材P30
2.根据Na 、Mg、O、Cl原子在反应过程中失去 或者得到电子的数目和该原子的最外层电子数目, 推断其氧化物和氯化物中元素化合价.
元素 化合价 +1 +2 -2 原子最外层 电子数目 1 失去(或得到) 电子数目 失1e失2e得2e-
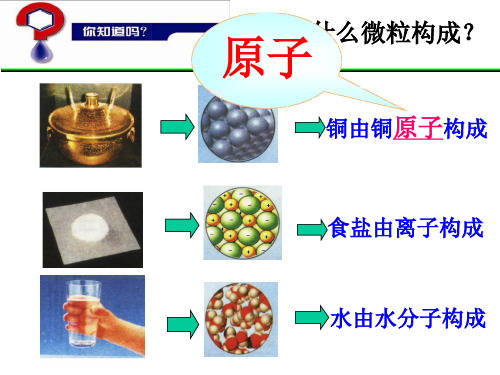
二、原子核外电子排布
原子核
+2
电子层
+10
+18
He Ne
核电荷数
Ar
该电子层 上的电子
+1
+8
+12
H
O
Mg
1、原子核外电子的分层排布
电子层序数(n) 符号 1 2 3 4 5 6 7
K
L
M
N
O
P
Q
+12
Mg
原子结构示意图 为了形象、简单的表示原子的结构,人们就创 造了“原子结构示意图”这种特殊的图形。
第2课时 核外电子排布

提示:不一定。原子失去电子的能力既与最外层电子数有关, 也与电子层数有关,如果原子具有相同的电子层数,则最外层 电子数少的原子失电子能力强。
3.失去电子难的原子得电子一定容易吗?
提示:不一定。若为稀有气体的原子,得失电子都很难。
4.电子在核外排布时,总是先排满一层再排下一层吗?若不 是,请举例说明。 提示:前18号元素原子的电子排布,总是先排满一层再排下一
为次外层,则可排18个,就比L层多10个电子。
8.(双选)X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、
dR m-四种离子的核外电子排布相同,且m>n,则下列关系正确的
是(
) B.b-d=m+n D.a>b>c>d
A.a-c=m-n C.a>b>d>c
【解析】选B、D。四种离子的“核外电子排布相同”,说明四
)
A.两种微粒,若核外电子排布完全相同,则其化学性质一定 相同 B.凡单原子形成的离子,一定具有稀有气体元素原子的核外 电子排布 C.两原子如果核外电子排布相同,则一定属于同种元素 D.两原子如果核外电子排布相同,则一定属于同种原子
【解析】选C。Na+和Mg2+核外电子排布相同,但化学性质不同, A不正确;单原子形成的离子,不一定具有稀有气体元素原子 的核外电子排布,如氢离子,B不正确;两原子如果核外电子 排布相同,则一定属于同种元素,因为两原子的质子数相等, 但中子数可能不等,可能属于不同原子,如11H、21H、31H就是
文物的年代,工业上采用液态空气分馏的方法来生产 Y的单质,
而Z不能形成双原子分子。根据以上叙述,下列说法中正确的 是( )
2020届高考化学高分突破选择题专练(偏难)-人类对原子结构的认识历史

2020届高考化学高分突破选择题专练(偏难)-人类对原子结构的认识历史1.化学在生产、科研和日常生活中有着密切()A. 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈B. 用于文物年代鉴定的放射性 14C和作为原子量标准的 12C,化学性质不同C. 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜D. NO2和SO2都是酸性氧化物,都是大气污染物2.下列说法中正确的是A. 电解质在固态时均为离子晶体B. CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构C. 用道尔顿的原子结构理论无法解释同位素现象D. 晶体类型相同,则晶体中化学键也完全相同3.下列说法不正确的是()A. iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够B. 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识C. H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快D. 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品4.下列知识梳理总结不合理的是()A. 卢瑟福发现原子中存在原子核,提出了“带核”的原子结构模型B. 用一束光照射氢氧化铁胶体,可观察到丁达尔现象C. 地球上99%以上的溴元素存在海洋中,所以溴被称为“海洋元素”D. 蔗糖中加入浓硫酸,变成“黑面包”,只体现了浓硫酸的脱水性5.下列说法不正确的是()A. 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者B. 乙酸乙醋在碱性条件下水解,属于皂化反应C. 使用含有氯化钠的融雪剂会加快桥梁的腐蚀D. 道尔顿首次提出原子学说、汤姆生发现电子、卢瑟福确定原子核的存在,都为原子结构理论的发展作出了巨大贡献6.下列说法错误的是()A. 所有的原子都含有质子、中子和电子三种基本构成微粒B. 宇宙大爆炸产生了氢、氦、锂元素C. 左图的原子模型是玻尔提出的D. 左图模型中的小黑点表示电子在原子核外出现的概率密度的形象描述7.下列说法正确的是()A. 原子结构模型演变历史可以表示为:B. 14C与 14N互为同位素C. 迄今为止人们发现了118种元素,即有118种核素D. 元素性质的周期性变化取决于元素原子核外电子排布的周期性变化8.化学家及其突出贡献为:①波义耳(化学元素概念);②道尔顿(原子学说);③门捷列夫(元素周期律);④玻尔(玻尔原子模型)。
人类对原子结构的认识

原 子:
核电荷数=核内质子数=核外电子数
动脑时间
阳离子: 核电荷数=核内质子数 > 核外电子数 核电荷数=核内质子数 < 核外电子数 阴离子:
质量数
原子核内所有的质子和中子的相对质量取近 似整数值加起来所得数值,叫做质量数。 质量数(A)=质子数(Z)+ 中子数(N)
原子组成的表示方法:
质量数— A
1.求中性原子的中子数:N=
2.求阴离子的中子数,AXn-共有x个电子, 则N= 3.求阳离子的中子数,AXn+共有x个电子, 则N= 4. 求 中 性 分 子 或 原 子 团 的 中 子 数 , 1H 16O分子中,N= 2
复 习
1. 元素如何定义?
具有相同核电荷数(质子数)的同一类 原子叫元素。
1)阴离子:_________ 2)阳离子:_________ 3)原子:___________
+X 2
8
课堂练习2:
在原子序数1~18号元素范围内,按要求 回答下列问题: ①最外层电子数为1的原子有_____ ②最外层电子数是次外层电子数2倍的原 子是______ ③最外层电子数是次外层电子数3倍的原 子是______ ④最外层电子数是次外层电子数4倍的原 子是______
(核电荷数)
质子 Z 个 原子核
质子数— Z
X
— 元 素 符 号
中子 N=(A-Z)个
核外电子 Z个
实例理解
化 合 价
质量数
16
质子数
8
O
-2
离子电荷
22
原子个数
四,知识拓展: A +d c+ --
e Z A、Z、c、d、e各代表什么?
高二化学选修课7 核外电子运动状态

高二化学选修课7 核外电子运动状态【知识目标】学习内容 学习水平 具体知识要点核外电子排布 的表示方法理解1、电子式的含义及书写2、原子结构示意图的含义及书写(1-18号元素)3、电子排布式、轨道表示式的含义及书写(1-18号元素)考点1、原子结构示意图知识梳理原子核外电子 的分层排布电子层序数1 2 3 4 …… 电子层符号 KL MN ……电子离核距离 由 近 远 电子能量由 低高核外电子排布的规律① 能量最低原理:即排满了K 层才排L 层,排满了L 层才排M 层。
② 最多容纳原理:每个电子层最多容纳 2n 2个电子。
③ 不能超过原理:最外层电子数不能超过 8 个电子(K 层为最外层时,不能超过2个电子);次外层电子数不超过 18 个电子(K 层为次外层不能超过2个电子)。
原子结构 示意图知识应用 【例1】某短周期元素原子的次外层电子数为最外层电子数的2倍,则该元素原子核内质子数为A .3B .6C .14D .16 【例2】某离子的结构示意图为,该离子所带的电荷数可能为A .8-nB .n-8C .10-nD .n-10【知识巩固】1.下列关于多电子原子核外电子的运动规律的叙述正确的是A .核外电子是分区域运动的B .所有电子在同一区域里运动C .能量高的电子在离核近的区域运动D .能量低的电子在离核近的区域绕核运动 2.判断某多电子原子中电子能量大小的依据是A .元素原子的核电荷数B .原子核外电子的多少C .电子离原子核的远近D .原子核外电子的大小+n 28K L电子层 层内电子数原子核核电荷数N粒子符号+7253.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是A.电子数B.最外层电子数C.电子层数D.次外层电子数4.某元素原子的最外层电子数是次外层电子数的n倍(n为大于1的自然数),则该元素原子核内的质子数是A.2n B.n+2 C.2n+10 D.2n+25.短周期三种元素X、Y和Z。
原子核外电子的分层排布

阳离子:Na+、Mg2+、Al3+、NH4+、H3O+
阴离子:N3-、O2-、F-、OH-、NH23. 核外有18个电子的粒子
分子或原子:Ar、HCl、H2S、PH3、SiH4、
H2O2、F2 阳离子:K+、Ca2+ 阴离子:P3-、S2-、HS-、Cl-
六、原子核外电子排布相同的粒子间规律
四、相对稳定结构
相对稳定结构即最外层电子数为8(若K层 为最外层为2) 没有达到稳定结构的原子都有达到稳定结构 的趋势 当最外层电子数<4时,易失电子,电子数 越少越易失 当最外层电子数>4时,易得电子,电子数 越多越易得
五、常见粒子总结
2. 核外有10个电子的粒子 分子或原子:Ne、HF、H2O、NH3、CH4
6 P
7 Q
电子层(n) 符号 离核远近 能量高低
1 2 3 4 5 6 7
K L M N O P Q
近 低
远 高
三、核外电子排布的规律
能量最低原理(先排内层,排满后再排外层) 原子核外各电子层最多容纳2n2个电子 原子最外层电子数目不能超过8个(K层为最外 层时不超过2个) 次外层电子数目不能超过18个(K层为次外层时 不超过2个),倒数第三层不能超过32个 注意:主族排布完全符合上述规律,副族次外 层可以不排满
元素周期律
第一课时 原子核外电子的排布
一、电子层
在含多个电子的原子里,电子分别在能量不同 的区域内运动。我们把不同区域简化为不连续 的壳层,也称作电子层。 2. 分别用n=1、2、3、4、5、6、7来表示从内到外 的电子层。(或用K、L、M、N、O、P、Q表示)
原子结构和核外电子排布
考纲解读1.认识原子核的结构,懂得质量数和的含义,掌握构成原子的微粒间的关系,了解元素、核素、同位素的涵义。
2.认识原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.3.了解多电子原子中核外电子分层排布遵循的原理,掌握1~36号元素的电子排布(原子结构示意图、电子排布式)。
4.了解原子结构模型的发展历史了解原子“基态”、“激发态”的概念。
知识再现一.原子的构成1.原子的构成原子中微粒的作用2.原子中有关量的关系:电性关系质子数= 核电荷数= 核外电子数= 原子序数质量关系质量数(A)= 质子数(Z) + 中子数(N)二.同位素1.概念2.同位素的特点同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
3.与同素异形体、同分异构体、同系物的比较例题1、据报道,月球上有大量3He存在,以下关于3He的说法正确的是A、是4He的同分异构体B、比4He多一个中子C、是4He的同位素D、比4He少一个质子2、已知自然界氢的同位素16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有 A、3种 B、6种 C、9种 D、12种3、1999年曾报道合成和分离子含高能量的正离子N5+的化合物N5AsF6,下列叙述中错误的是A、N5+共有34个核外电子B、N5+中氮一氮原子间以共有电子对结合C、化合物中N5AsF6中As化合价为-1D、化合物N5A S F6中F化合价为-1三、核外电子的运动1.核外电子的运动特征核外电子质量,运动速率,运动的空间,确定的轨道。
2.电子云能级(原子轨道)电子云的轮廓图称之为原子轨道.四.核外电子的排布1.核外电子的排布能层(电子层)n 符号K L M N O P Q能级(原子轨道)每一能层的电子的能量也可能不同,又将能层分成相应的能级。
第n能层中,就有个能级,分别为ns 但不一定每一个能级中都有电子。
能级数=序数。
2020-2021学年高中化学新鲁科版必修第二册 第1章第1节原子结构与元素性质第2课时课件
关键能力·合作学习
知识点一 核外电子排布规律 1.核外电子排布规律解读 (1)“一低” 电子首先排布在能量最低的电子层里。排满能量低的电子层,再排能量高的电 子层。 (2)“两不超” 各电子层电子不超过2n2个;最外层电子不超过8个(第一层为最外层时不超过2 个)。
2.核外电子排布的表示方法 (1)原子结构示意图:为了形象表示原子核外电子分层排布的情况而采用的直观 图示。如氯原子结构示意图为
【母题追问】(1)X元素的原子最外层电子数是次外层电子数的2倍,则该元素的 原子核内质子数是多少? 提示:K层为次外层时,X元素的原子最外层电子数为2×2=4<8;L层为次外层时,X元 素的原子最外层电子数为8×2=16>8,不可能,故X元素的原子核外电子数为2+4=6, 即质子数为6。
(2)当第n电子层作为原子的最外层时,其最多容纳的电子数与(n-1)层相同;当第 n电子层作为原子的次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数 多10个。则n层是K层~N层中的哪一层? 提示:根据核外电子排布规律可知,当n为最外层时,最多可容纳8个电子,则第(n1)层最多也可容纳8个电子,故(n-1)层为次外层时,n层应为M层;当n层为次外层 时,其最多可容纳的电子数比(n-1)层多10个,则证明n层最多可容纳18个电子,也 应为M层。
原子类别 稀有气体
金属元素 原子
非金属 元素原子
与元素性质的关系 最外层电子数为8(He为2), 结构稳定,性质不活泼
最外层电子数一般小于4, 较易失去电子
最外层电子数一般大于或 等于4,较易获得电子,形成 8电子稳定结构
与元素化合价的关系
原子结构为稳定结构,常见 化合价为零
易失去最外层电子,达到 稳定结构,其最高正价为 +m(m为最外层电子数)
【高中化学】原子结构第1课时(能层能级、构造原理与电子排布式课件 高二化学人教版2019选择性必修2
填入电子数
核外电子在能级中的排布顺序:
1s→2s → 2p→ 3s → 3p
原子的核外电子排布
【巩固・评价】 根据构造原理分析19K核外电子在能级中的排布。
×
√
KL
MN
1s 2s 2p 3s 3p 3d 4s
KL
M
N
1s 2s 2p 3s 3p 3d 4s
核外电子在能级中的排布顺序: 1s→2s → 2p→ 3s → 3p → 4s → 3d
核外电子运动的特点
① 电子的体积和质量都很小 ② 电子运动空间相对很大(绝对空间小) ③ 电子绕核作高速运动 (接近光速,约为108m/s) ④ 电子是做无规则的运动,没有确定的轨迹。
原子的核外电子排布
1.能层
电子层: 人们把电子运动的区域简化为不连续的壳层,称作“电子层”。
(1)能层:根据核外电子的能量不同,将核外电子所处的不同区域分成 不同的能层。
原子的核外电子排布
想一想
电子排布式也可以用于表示离子的核外电子排布,试写出Na+、Cl-和 Fe2+的电子排布式。
写出原子 的电子排 布式
判断原子 得失电子 的数目
①(价层电子)失电子的顺 序由外向里 ②得电子时,得到的电子填 充在最外层的某个能级上
(“行星系式”原子模型)
(核式模型)
一、关于原子(“ατομ” atom)
话题2 原子结构模型的演变 (必修1 P88科学史话)
4.玻尔原子模型(1913年)❖ 又称分层模型:当原子只有一个电子时,电子沿特定
球形轨道(线型轨道)运转;当原子有多个电子时, 它们将分布在多个球壳中绕核运动。 ❖ 不同的电子运转轨道是具有一定级差的稳定轨道。
核外电子排布 原子结构与元素原子得失电子能力
宏观辨识与微观探析
当堂检测
1、下列叙述正确的是( B ) A.电子的能量越低,运动区域离核越远 B.核外电子的分层排布即是核外电子的分层运动 C.稀有气体元素原子的最外层都排有8个电子 D.当M层是最外层时,最多可排布18个电子
2、下列对氯、硫两种元素及其单质性质的说法错误的是( B ) A.Cl2能与H2S反应生成S,说明氧化性:Cl2>S B.硫原子得电子能力比氯原子强 C.Cl原子最外层有7个电子,S原子最外层有6个电子 D.Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
敬请各位专家、老师批评指正!
祝同学们学习进步,梦想成真!
谢谢大家!
既不易_得__电子, 也不易_失__电子
一般不与其他 物质反应
(2)元素的化合价与原子最外层电子数的关系
金属元素
非金属元素
稀有气体元素
除了零价,只显 正价且一般等于最
外层电子数, 如N1a 、M2g
除了零价,一般既有 正价又有负价。
原子结构为稳定 结构,常见化合价 为零。
元素的性质,特别是化学性质,与原子的最外层电子数关系密切!
原子结构 决定 元素性质
宏观辨识与微观探析
二、原子结构与元素原子得失电子能力 小组讨论
1、影响原子得失电子能力的关键是什么? 2、原子结构的要素主要包括核电荷数、中子数、核外 电子数、电子层数、最外层电子数等,其中哪些会影 响原子得失电子能力?为什么?请结合实例进行论证。
活动·探究
1、预测钠、镁两种元素失电子能力的强弱,并从原子结构的角 度说明理由。 2、预测钠、钾两种元素失电子能力的强弱,并从原子结构的角 度说明理由。
阅读:
P7方法导引
实验步骤:
