(完整版)溶解度曲线解题方法归纳
初三化学氯化钙,氢氧化钾溶解度曲线解题技巧

初三化学氯化钙,氢氧化钾溶解度曲线解题技巧技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B的质量分数为。
(3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。
此时溶液C中氯化钾的质量分数为。
其溶液为(填“饱和”或“不饱和”)。
(4)在40℃时,向100g水中加入100g氯化钾,充分搅拌后形成溶液D,此时溶液D中氯化钾的质量分数为,溶液为(填“饱和”或“不饱和”)。
(5)在溶解度曲线中绘制表示四各溶液A,B,C,D规律:(1)点A,B,C,D与曲线的位置关系(线上,线上方,线下方)来判断溶液的状态。
(2)线上面的点C,D与线上的点B表示的溶液在该温度下的质量分数相等。
(线上面的点C,D表示的溶液的质量分数可以用B点来代替)。
(word完整版)2015年初三化学溶解度曲线知识点及习题,推荐文档
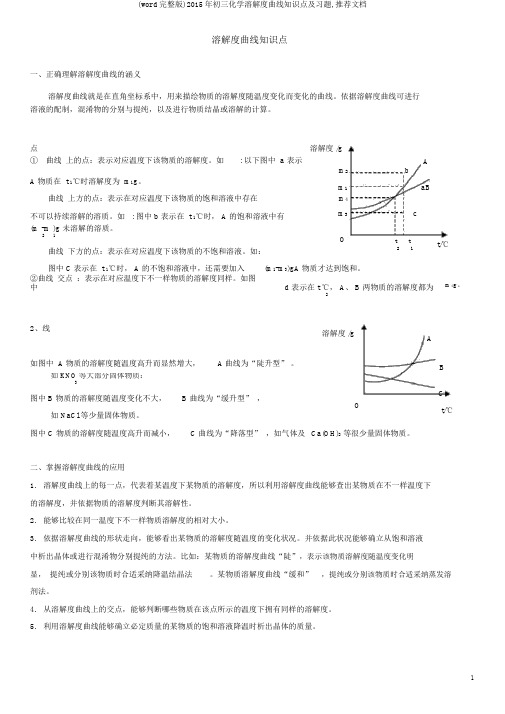
溶解度曲线知识点一、正确理解溶解度曲线的涵义溶解度曲线就是在直角坐标系中,用来描绘物质的溶解度随温度变化而变化的曲线。
依据溶解度曲线可进行溶液的配制,混淆物的分别与提纯,以及进行物质结晶或溶解的计算。
点溶解度 /g① 曲线上的点:表示对应温度下该物质的溶解度。
如: 以下图中 a 表示b Am2A 物质在 t 1℃时溶解度为 m1g。
m1 aB 曲线上方的点:表示在对应温度下该物质的饱和溶液中存在m4不可以持续溶解的溶质。
如 : 图中 b 表示在 t 1℃时, A 的饱和溶液中有m3 c (m -m )g 未溶解的溶质。
2 1 O t t曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如: 2 1 图中 C表示在 t 1℃时, A 的不饱和溶液中,还需要加入(m1-m3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不一样物质的溶解度同样。
如图中 d 表示在 t ℃, A、 B 两物质的溶解度都为2 t/℃m4g。
2、线溶解度 /gA如图中 A 物质的溶解度随温度高升而显然增大,A曲线为“陡升型”。
B 如 KNO等大部分固体物质:3图中 B 物质的溶解度随温度变化不大, B 曲线为“缓升型” ,C O如 NaCl 等少量固体物质。
t/℃图中 C 物质的溶解度随温度高升而减小, C 曲线为“降落型” ,如气体及Ca(OH)2等很少量固体物质。
二、掌握溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,所以利用溶解度曲线能够查出某物质在不一样温度下的溶解度,并依据物质的溶解度判断其溶解性。
2.能够比较在同一温度下不一样物质溶解度的相对大小。
3.依据溶解度曲线的形状走向,能够看出某物质的溶解度随温度的变化状况。
并依据此状况能够确立从饱和溶液中析出晶体或进行混淆物分别提纯的方法。
比如:某物质的溶解度曲线“陡”,表示该物质溶解度随温度变化明显,提纯或分别该物质时合适采纳降温结晶法。
专题07 溶解度及溶解度曲线-中考化学毕业班二轮热点题型归纳与变式演练(全国通用)(解析版)

专题07溶解度及溶解度曲线目录【题型一】溶解度曲线上点、上下方的点、交点的意义 (1)【题型二】溶解度大小的判断 (3)【题型三】溶解度随温度的变化趋势 (3)【题型四】根据溶解度曲线判断物质结晶的方法 (4)【题型五】改变温度时溶液中相关量的变化 (6)【题型一】溶解度曲线上点、上下方的点、交点的意义【典例分析】KNO3、NaCl两种物质的溶解度曲线如图所示。
下列说法正确的是A.NaCl的溶解度受温度的影响比较大B.50℃时,Q点表示的是KNO3的不饱和溶液C.20℃时,两种物质的溶解度相比:KNO3>NaC1D.20℃时,M点NaC1溶液的溶质质量分数是36%【答案】B【解析】A.由图可知,NaC1的溶解度受温度的影响比较小,A错误。
B.50℃时,Q点位于硝酸钾溶解度曲线下方表示的是KNO3的不饱和溶液,B正确。
C.20℃时,两种物质的溶解度相比:NaC1>KNO3,C错误。
D.20℃时,M点NaC1溶液的溶质质量分数是36g100%36g+100g <36%,D错误。
故选:B。
【提分秘籍】(1)曲线越陡峭表明该物质的溶解度受温度的影响越大。
(2)曲线上的点A:表示溶质在该温度下的溶解度。
此时的溶液为饱和溶液(3)曲线上方的点B:表示加入溶质后形成饱和溶液,并有固体剩余。
(4)曲线下方的点C:表示加入溶质后,全部溶解形成不饱和溶液。
【变式演练】下图为甲、乙、丙三种固体物质(不形成结晶水合物)在水中随温度变化的溶解度曲线,按要求填空。
(1)在______℃时,甲和丙的溶解度相等。
(2)t1℃时,将乙溶液的状态由M点变为N点,方法是______。
(3)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为______。
(4)t3℃时,将125g丙的饱和溶液降温至t1℃,应再加入______g丙才能恰好达到饱和状态。
【答案】t2增加溶剂80g15【解析】(1)由图可知,在t2℃时,甲、丙的溶解度曲线相交于一点,该温度下,甲和丙的溶解度相等;(2)t1℃时,M点为乙的饱和溶液,N点为乙的不饱和溶液,该温度下,将乙溶液的状态由M点变为N点的方法是:增加溶剂;(3)t3℃时,甲的溶解度为60g,该温度下,将40g甲放入50g水中,只能溶解30g,形成溶液的质量为50g+30g=80g;(4)t3℃时,125g丙的饱和溶液中溶质质量为25g125g100%25g25g100g⨯⨯=+,溶剂质量为100g,降温至t1℃,该温度下,丙的溶解度为40g,要想达到饱和,还应加入40g-25g=15g 丙。
中考化学第一轮复习专题41 溶解度曲线

☆母题呈现☆【母题来源】2013年抚顺中考化学试题19【母题原题】.(5分)()甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.(1)丙物质的溶解度随温度的升高而(填“增大”或“减小”).(2)若要从乙物质的饱和溶液中得到乙固体,可用结晶方法.(3)t1℃时,将甲物质的饱和溶液升温到t3℃所得溶液中溶质的质量分数(填“变大”、“变小”或“不变”).(4)t3℃将100g水加入到盛有30g甲物质的烧杯中,充分溶解后得到不饱和溶液,若想使溶液恰好饱和,可采用的方法是:①加入甲物质g;②降温到℃.☆母题揭秘☆【考点】溶解度曲线图【题型】溶解度曲线图的意义【解题方法】(1)据溶解度曲线可知物质的溶解度随温度变化情况;(2)溶解度随温度变化不大的物质,要从其溶液中获得晶体常采取蒸发溶剂的方法;(3)据甲的溶解度随温度的变化情况及溶质的质量分数计算方法分析解答;(4)据甲在t3℃、t2℃的溶解度分析解答.☆母题解析☆☆知识链接☆溶解度曲线:用纵坐标表示物质的溶解度,横坐标表示温度,把物质在不同温度时的溶解度标在图上,画出物质溶解度随温度变化的曲线,这种曲线叫溶解度曲线。
1、溶解度曲线表示的意义: (1)曲线上的点,表示某物质在某一温度下的溶解度。
(2)曲线的走向表示某物质的溶解度随温度的变化情况。
(3)两条溶解度曲线的交点表示两种溶质在某一温度下有相同的溶解度。
2、变化规律大多数固体物质的溶解度随温度的升高而增大,如KNO3;少数固体物质的溶解度受温度的影响很小,如NaCl;极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
3、应用(1)查找某一温度下某物质的溶解度。
(2)比较某一温度下两种物质溶解度的大小。
(3)选择使某种物质从溶液中结晶的方法。
☆方法点拨☆1、掌握好溶解度曲线上的点和线的意义意义、作用,善于从溶解度曲线中获取有价值的信息。
2、归纳、整合好溶液的相关知识,并能结合溶解度曲线及设置的问题情景来解决有关的实际问题。
沪教版初三(上)期末一模复习专题《溶解度曲线》知识点归纳及巩固练习
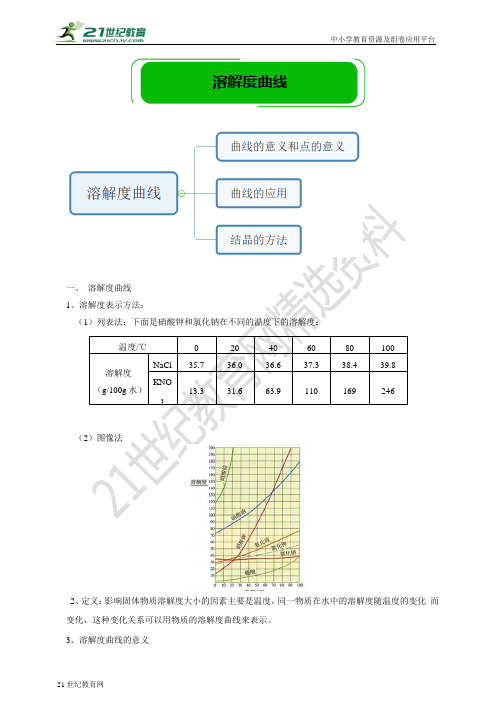
一、 溶解度曲线 1、溶解度表示方法:(1)列表法:下面是硝酸钾和氯化钠在不同的温度下的溶解度:(2)图像法2、定义:影响固体物质溶解度大小的因素主要是温度,同一物质在水中的溶解度随温度的变化 而变化,这种变化关系可以用物质的溶解度曲线来表示。
3、溶解度曲线的意义温度/℃ 0 20 40 60 80 100 溶解度 (g/100g 水)NaCl 35.7 36.0 36.6 37.3 38.4 39.8 KNO313.331.663.9110169246溶解度曲线加溶质 减溶剂 升温降温加溶剂减溶质温度溶解度①溶解度曲线表示: 。
②溶解度曲线上的每一个点....表示: 。
③两条曲线的交叉点...表示: 。
在该温度下,这两种物质的饱和溶液中溶质的质量分数 。
④在溶解度曲线的下方..的点,表示该温度下的溶液是该物质的 (饱和溶液,不饱和溶液)。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的 (饱和溶液,不饱和溶液),也就是说,在溶液中存在未溶解的溶质。
4、溶解度曲线变化的规律 变化趋势:①大多数固体物质的溶解度随温度升高而_ 升高 _,如硝酸钾等; ②少数固体物质的溶解 度受温度影响 不大 ,如氯化钠等; ③极少数固体物质的溶解度随温度升高而 降低 ,如氢氧化钙等。
移动变化:①加溶质或__________________:上移 ②_____________或____________:下移 ③降温:左移④_________________:右移⑤若温度改变前后,溶液都是饱和状态:__________(溶 解度变)5、溶解度曲线的应用(1)查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
(2)比较相同温度时(或一定温度范围内)不同物质溶解度的大小。
(3)比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
(4)确定溶液的状态,饱和溶液与不饱和溶液的转化方法。
【中考化学】“9个要点”攻下溶解度曲线

【中考化学】“9个要点”攻下溶解度曲线溶解度曲线是全国中考的重点内容,也是同学们学习的难点,但各地考查情况各不相同。
现在我们就来挑战一下噢!“七嘴八舌”说考情■ 陕西中考说:必考。
多以溶解度曲线结合实物操作图或者表格形式命题,每年考查的形式均不相同。
近4 年均在18题题位考查。
■山西中考说:仅2019年未考。
除2019年(溶解度表)、2019年(1条曲线+实物操作图)外,其余均是考查2种未知物质的溶解度曲线。
仅2019年在实验探究题中考查,其余均在填空题中考查。
■河南中考说:必考。
除2019年(溶解度表)、2019年(一种未知物质的溶解度曲线),其余均是考查两种未知物质的溶解度曲线。
■河北中考说:仅2019年未考。
常在选择题中以溶解度曲线的形式进行考查,偶尔也会以文字描述或溶解度表格的形式进行考查。
■云南中考说:必考。
在选择题、填空与简答中均有涉及。
多以三条或两条曲线的形式考查,但是偶尔也会以一条曲线的形式考查相关知识。
■安徽中考说:必考。
考查形式多样,考查一条曲线时,曲线走势有“只上升和先升后降”型;考查两条曲线时,曲线走势有“2升”、“1升1降”和“2降”型。
■江西中考说:必考。
曲线的形式包括“1 升 1 降”、“2升”、“2升1降”等。
也会以曲线结合表格形式,或单独以操作图的形式考查。
说来说去还得练1. (推荐云南、安徽、江西、河北)甲、乙两固体物质的溶解度曲线如图所示,下列说法错误的是()A.甲、乙两物质的溶解度均随温度的升高而增大B.t1℃时,甲物质的溶解度和乙物质的溶解度相等C.t1℃时,甲物质和乙物质的饱和溶液的溶质质量分数均为30%D.t2℃时,乙物质的饱和溶液降温后会有晶体析出2. (推荐河南、河北)a、b两物质在不同温度时的溶解度如表所示,根据表中信息,判断下列说法不正确的是()A.20℃时,向100 g水中加入25 g固体a,所得溶液质量是125 gB.b物质的溶解度随温度的升高而减小C.50℃时,100 g b物质的饱和溶液中有18.7 g b物质D.将30℃时,a、b两物质的饱和溶液同时降温至20℃,所得溶液的溶质质量分数的大小关系是>b3. (推荐云南、安徽)如图是一种固体物质(不含结晶水)的溶解度曲线。
初三化学溶解度曲线知识点

初三化学溶解度曲线知识点天高鸟飞,海阔鱼跃;考试这舞台,秀出你特殊的杰出;一宿好的睡眠,精神能百倍;一颗淡定的平常心,冷静应对,努力备考,考入理想院校!下面是作者给大家带来的初三化学溶解度曲线知识点,欢迎大家浏览参考,我们一起来看看吧!初三化学溶解度曲线知识点一、溶解度曲线图上的点1、溶解度曲线上的点:表示在该点所示温度下某物质的溶解度。
如A点表示当温度为t2时,物质R的溶解度为ag。
2、两条曲线的交点:表示在该点所示温度下,两种物质的溶解度相同。
如B点表示当温度为t1时,物质R和N的溶解度相等,都为bg。
二、溶解度曲线图上的线每一条曲线都表示这种物质的溶解度随温度变化而变化的总趋势,主要有:1、陡升型:绝大多数固体物质的溶解度随温度的升高而增大,曲线峻峭。
如曲线R,代表物质有KNO3、NH4NO3等。
2、缓升型:少数固体物质的溶解度受温度的影响较小。
如曲线M,代表物质有NaCl。
3、降落型:极少数固体物质的溶解度随温度的升高而减小。
如曲线N,代表物质有Ca(OH)2。
三、溶解度曲线图上的面1、在溶解度曲线上方平面上的任何点:表示在该点所示温度下形成了含有部分固体溶质的饱和溶液,即依照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是饱和溶液,且还有未溶解完的溶质存在。
如C点。
2、在溶解度曲线下方平面上的任何点:表示在该点所示温度下形成了不饱和溶液,即依照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是不饱和溶液。
如D点。
四、溶解度曲线图的综合运用1、溶解度曲线上的每一点都代表着对应温度下该物质的溶解度,所以利用溶解度曲线可以查找出某种物质在不同温度时的溶解度。
2、根据溶解度曲线的走向,可以判定或比较各物质的溶解度随温度变化的趋势。
3、可以比较在同一温度下不同物质的溶解度大小。
如在t3时,R、M、N三种物质的溶解度由小到大的顺序为N M R。
初三化学,溶解度曲线解题技能溶解度曲线题型可从点、线、面和交点四个方面进行解答:1.溶解度曲线上的点:溶解度曲线上的每一个点都是表示的是某温度下某种物质的溶解度。
2024年中考化学复习方案滚动小专题溶解度曲线

(山西专版)2024年中考化学复习方案滚动小专题(一)溶解度曲线嘿,同学们,备考2024年中考化学,溶解度曲线可是个重点内容。
今天,咱们就一起来攻克这个难题,让溶解度曲线不再成为你的心头大患。
一、溶解度曲线的基本概念咱们得弄明白什么是溶解度曲线。
溶解度曲线,顾名思义,就是描述在一定温度下,某种溶质在溶剂中的溶解度随温度变化的曲线。
这条曲线可是咱们解决溶解问题的关键。
二、溶解度曲线的五大关键点1.溶解度的定义:在一定温度下,100g溶剂中最多能溶解的溶质的质量,称为该温度下的溶解度。
2.溶解度曲线的形状:一般来说,溶解度曲线呈上升趋势,但也有例外。
比如,硫酸钡的溶解度随温度升高而减小。
3.溶解度曲线的交点:两条溶解度曲线的交点表示在某一温度下,两种溶质的溶解度相同。
4.溶解度曲线的斜率:斜率越大,说明该溶质的溶解度随温度变化越敏感。
5.溶解度曲线的应用:通过溶解度曲线,我们可以判断溶液是否饱和、结晶方法、比较不同溶质的溶解度等。
三、溶解度曲线的实战演练1.题目一:已知某温度下,氯化钠的溶解度为35g。
求该温度下,100g水中最多能溶解多少克氯化钠?解析:根据溶解度的定义,35g氯化钠是100g水在该温度下最多能溶解的质量。
所以,答案为35g。
2.题目二:已知某温度下,硫酸铜的溶解度随温度升高而增大。
若将该温度下的硫酸铜溶液加热,溶液的饱和度会发生什么变化?解析:由于硫酸铜的溶解度随温度升高而增大,所以加热后,溶液的饱和度会减小,溶液变为不饱和溶液。
3.题目三:有A、B两种溶质,它们的溶解度曲线如下:(1)在某一温度下,A、B两种溶质的溶解度是否相同?(2)在某一温度下,若要使A、B两种溶质的溶液同时饱和,应如何操作?解析:(1)通过观察溶解度曲线,可以发现A、B两种溶质在某温度下的溶解度曲线交点处,溶解度相同。
(2)要使A、B两种溶质的溶液同时饱和,可以通过降低温度或增加溶质的方法。
1.学会利用溶解度曲线解决实际问题,如结晶方法、溶液饱和度的判断等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巧用溶解度曲线在九年级化学第九单元第 2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。
利用溶解度曲线可以解决很多的问题技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
×100%,溶解度S越大质量分数越大。
(质量分数最大的2、某温度下某饱和溶液的质量分数=S100g+S是该温度下的饱和溶液)特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效法)×100%3、线上的点及线下的点表示的溶液的质量分数=S纵S纵+100g技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B的质量分数为。
(3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。
此时溶液C中氯化钾的质量分数为。
其溶液为(填“饱和”或“不饱和”)。
(4)在40℃时,向100g水中加入100g氯化钾,充分搅拌后形成溶液D,此时溶液D中氯化钾的质量分数为,溶液为(填“饱和”或“不饱和”)。
(5)在溶解度曲线中绘制表示四各溶液A,B,C,D规律:(1)点A,B,C,D与曲线的位置关系(线上,线上方,线下方)来判断溶液的状态。
(2)线上面的点C,D与线上的点B表示的溶液在该温度下的质量分数相等。
(线上面的点C,D表示的溶液的质量分数可以用B点来代替)技巧应用:1、某化学兴趣小组的同学在20℃时进行了如下图1所示实验,已知图2是根据右图KNO 3 的溶解度曲线,结合实验回答相关问题: (1)50℃时,100 g 水最多可溶解硝酸钾的质量为 g 。
(2)充分搅拌后。
可观察到:A 中无剩余固体,B 中 。
(3)A—E 的溶液中,属于不饱和溶液的是(填字母,下同)溶质质量分数相等的是 。
(填字母)解析:(1)描点ABCDE (如图)(2)判断点与曲线的位置关系,来判断溶液的状态 (3)将线上面的点(BE )用线上的点(G )来代替,比较点的位置的高低。
D >C> B= E> A2、请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/CM 3)请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/cm 3)(1)③中溶液的质量为______g ;一定属于不饱和溶液的是______(填序号,下同);溶质的质量分数一定相等的是______.(2)析出晶体的质量为______.A.25g B .(w+25)g C .(w+50)g . 解析:(1)将溶液①②③④⑤在曲线上描点。
(如图) (2)比较点曲线的位置关系来判断溶液的状态。
(线下点①,线上点②线上方的点③⑤。
特殊的点④在射线上AB 上表示可能为饱和溶液)(3)通过点的位置高低来比较溶液的质量分数的大小。
④>③=⑤=②>① 3、如右图是A 、B 两种物质的溶解度曲线,请回答:(1)t3℃时,把46g 固体A 放入100g 水中,充分溶解后可得到A 的 溶液(填“饱和”或“不饱和”)。
(2)t 1℃时,A 、B 两种物质溶解度的大小关系为A B(填“>”、“<”或“=”,下同)。
(3)在其他条件不变的情况下,若把t l ℃时A 、B 的饱和溶液分别升温至t 2℃,此时两种溶液中溶质的质量分数的大小关系为A B :若把t 3℃时A 、B 的饱和溶液分别降温至t 2℃,此时两种溶液中溶质的质量分数的大小关系为A B 。
实验操作 实验结果 取100mL 水,加入25g 硝酸钾,搅拌,恢复至20°C 全部溶解,得溶液①再加w g 硝酸钾,搅拌,恢复至20°C恰好饱和,得溶液② 再加25g 硝酸钾,搅拌,恢复至20°C 得溶液③加热 全部溶解,得溶液④冷却至20°C析出晶体,得溶液⑤解析:在(3)中将t l ℃是A 、B 的饱得溶液分别升温到t 2℃时,将A 平移到A`,在线下方为不饱和溶液,且前后无晶体析出。
A 溶液质量分数不变。
同理,将B 平移到B`质量分数不变,但B`高于A`,所以质量分数B`>A`。
在t 3℃时A 、B 的饱和溶液分别降温至t 2℃,将A 、B 平移到A2,B2;在各自曲线上方,都用点K 代替,A 、B 在降温过程中不断有晶体析出,溶质质量分数不断变小,但降温后质量分数二者相等。
描点,是数学和化学知识结合的综合运用,具有简单直观的特点,学生易于掌握。
比单一用公式法来判断溶液的质量分数大小更快捷。
运用更灵活。
更好的展示了溶液在升温或降温过程中晶体的析出和溶液中溶质质量分数大小的变化。
巩固训练:1. 甲、乙两物质的溶解度曲线如图所示,下列说法正确的是 A .甲和乙的饱和溶液,从t 1℃升温到t 2℃,仍是饱和溶液 B .t 1℃时,甲和乙的溶解度相等C .t 1℃时,甲和乙各30g 分别加入80g 水中,均能恰好完全溶解D .t 2℃时,在100g 水中放入60g 甲,形成不饱和溶液2. 右图是a 、b 两种固体物质的溶解度曲线。
从图中可获得的信息是 A. 固体物质的溶解度均随温度升高而增大 B .t ℃,相同质量的a 、b 溶解时放出热量相同C .升高温度,可使a 或b 的饱和溶液变为不饱和溶液D .将相同质量的a 、b 分别加入100g 水中,所得溶液质量分数相同3.右图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是 A .甲的溶解度大于乙的溶解度 B .乙的不饱和溶液降温可变成饱和溶液 C .20oC 时,甲、乙两种物质的溶解度相等D .50o C 时,甲的饱和溶液中溶质的质量分数为40%4. 右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确的是 A.b 的溶解度大于a 的溶解度B.t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发等质量的水, 析出晶体的质量一定相等C.将t 2℃时的b 的不饱和溶液降温至t 1℃,一定能得到b 的饱 和溶 液D.t 2℃时,a 溶液的溶质质量分数一定小于b 溶液的溶质质量分数50- 40- 30- 20-甲乙温度/℃t 1t 2 0溶解度/g5.右图是a、b两种固体物质的溶解度曲线,下列说法中正确的是A.a的溶解度大于b的溶解度B.在20℃时,a、b的溶液中溶质的质量分数相同C.a、b的溶解度都随温度升高而增大D.a、b都属于易溶物质6.t2℃时往盛有100g水的烧杯中先后加入a g M和a g N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。
将混合物的温度降低到t1℃,下列说法正确的是A.t2℃时,得到M的饱和溶液B.t2℃时,得到N的不饱和溶液C.温度降低到t1℃时,M、N的溶质质量分数相等,得到M、N的不饱和溶液D.温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液7.右图是a、b、c三种固体物质的溶解度曲线,下列叙述正确的是A.将a、b、c三种物质t1℃时的饱和溶液升温至t2℃,所得溶液的溶质质量分数大小关系是a>b>cB.t2℃时30g物质a加入到50g水中不断搅拌,形成80g溶液C.t1℃时a、b、c三种物质的饱和溶液中含有溶质质量按由小到大的顺序排列是b>a=cD. 若a中混有少量c,可以采用冷却热饱和溶液的方法提纯a8.两种不含结晶水的固体物质a、b的溶解度曲线如右图,下列说法正确的是A.b的溶解度小于a的溶解度B.分别将t2℃时a、b两种物质的溶液降温至t1℃,肯定都有晶体析出C.要从含有少量a的b溶液中得到较多的b晶体,通常可采用降温结晶的方法D.在t2℃时,用a、b两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水9.右图所示曲线a、b、c分别代表A、B、C三种物质的溶解度曲线。
下列说法正确的是A.t1 ℃时,三种物质溶解度大小的顺序是B>C>AB.t2℃时,A和B两种物质的饱和溶液中溶质质量相同C.t3℃时,在100g水里分别加入三种物质各mg,只有b能形成饱和溶液D.从混有少量C的A物质中提取较纯净的A,最适宜用蒸发溶剂的方法10.右图是a、b、c三种固体的溶解度曲线,下列说法正确的是A.b的溶解度一定小于a的溶解度B.当a中含有少量b时,可以用降温结晶的方法提纯aC.通过降低温度可将c的不饱和溶液变为饱和溶液D.a的饱和溶液从t2℃降温至t1℃时变为不饱和溶液温度/℃t 1t 2ba溶解度\g11.有关a 、b 两种物质的溶解度曲线如图所示,下列叙述不正确的是 A .a 物质的溶解度随着温度的升高而增大B .在t 2℃时,a 、b 两种物质的溶液中溶质的质量分数一定相等C .将a 、b 两种物质的饱和溶液从t 3℃降温至t 1℃,a 有晶体析出,b 无晶体析出D .t 3℃时,a 物质的溶解度大于b 物质的溶解度12.右图所示为甲、乙两物质(均不含结晶水)的溶解度曲线。
50℃时,取甲、乙两种物质各50g ,分别加人100g 水中,使之充分溶解。
下列有关说法不正确的是………( )A .上述混合物在20℃时,甲和乙形成溶液的质量相等B .在0℃时,溶液中溶质的质量分数甲小于乙C .温度高于50℃时,甲和乙形成的溶液都变为不饱和溶液D .50℃时,将甲、乙两种物质的混合物分别降温至20℃,溶液中未溶解晶体的质量相等13、右图是a 、b 两种固体物质的溶解度曲线图,下列说法中不正确的是A .任何温度下,a 的溶解度大于b 的溶解度B .a 的溶解度受温度变化的影响比b 的大C .t 1 ℃至t 2 ℃之间b 曲线以下区域为a 、b 两物质的不饱和溶液D .对于a 与b 混合溶液,可利用冷却结晶的方法来分离14.甲、乙两物质的溶解度曲线如右图所示。
