5常用化学反应还原的方法及化学还原剂还原能力的比较
典型还原反应及机理

2.5 还原酰胺
采用NaBH4/CoCl2还原时,羟基/非羟基溶剂均可使用
2.5 还原酰胺
Se化合物与NaBH4反应产生化合物5和6 1、没有Se化合物,反应不能进行 2、该反应不能还原仲酰胺和伯酰胺
2.6 还原腈基
LiAlH4还原 效率低
方案1
2.2 还原羧酸
方案
方案3
2.2 还原羧酸
1、n(CF3COOH) : n(RCOOH)= 1 : 1; 2、芳香族羧酸产率低(<30%)
采用比底物酸性更强的羧酸促进还原转化
方案4
2.2 还原羧酸
方案5 1、ZrCl4比ZnCl2具有更高的催化活性; 2、I2催化可实现-COOH、-COOMe的选择性还原。
碱土金属可 促进α,β-不 饱和酮的选 择性还原
2.9 还原醛和酮
α-烷基β酮酯还原
3-酮-2-甲基 酯/酰胺还原
2.9 还原醛和酮
1、高位阻酮生成醇 2、芳环上氯被还原
镧系 金属
-COOH,-NO2 -CONH2,-Cl -COOMe ,-CN
不受还原影响
2.9 还原醛和酮
镧系金属在促进化学、立体选择性上应用:
叠氮等基团的影响。
2.3 还原氨基酸
1、还原时,立体构型不变,未外消旋化 2、氨基酸及被保护的氨基酸均可被还原
2.3 还原氨基酸
Pentachlorophenol Boc
Boc保护基不受还原作用影响
2.4 还原酯基
(式1)
n(NaBH4) : n(ZnCl2) : n(叔胺) = 2 : 1 : 1 THF为最佳溶剂,醇中主要发生酯交换反应
还原反应

烯烃
烯,炔同时存在,还原到停留在烯的一步。
(三) 不同催化剂催化氢化反应 1.装置: (1)常压或低压氢化反应装置
b.脱硫
(2)铂催化剂
活性很强
可以还原除了酯、羧酸和酰胺外,各种不饱和基 团均可被还原。如:醛酮、腈、硝基化合物,还 原氨化反应等。反应通常可在较低温度和较低氢 气压力下反应。 铂黑、铂炭、二氧化铂等。
载体铂催化剂:Pt/C 酸能促进铂的催化氢化。
缺点:价格昂贵。
(3)钯催化剂
对烯烃、炔烃加氢活性高,还原酮、腈、硝基 化合物,还原氨化反应等,氢解活性也很强。 为最常用的催化剂之一, 可制成氧化钯、钯黑和载体钯(Pd/C)
氢解 (Hydrogenolysis) :在催化氢化的条件下,底物分子被 化验裂解成两个或两个以上的小分子的反应。使一些单键 发生裂解:如卤代物,苄醇类,苄胺类,酰卤类的氢解和 脱硫、酯的酯解等 .
O
O
Pd/C, H2
OCH2Ph
Pd/C, H2 ArCH2NR2
OH
ArCH3 +
R2NH
立体化学:
(1)还原芳环
(2)炔烃
得到反式烯烃
Na RC CH
NH3
RCH CH2
(二)其它金属 1.Fe, HCl(30%)
NO2
NH2
Fe, HCl
2. Sn, HCl
NO2
NH2
Sn, HCl
COOH
COOH
3.Zn-Hg, 浓盐酸,
03.2_还原反应

催化氢化反应活性还与催化剂种类、催化剂用量、反应
温度、压力等直接相关。常用低活性催化剂有:
Lindlar催化剂,0.3%Pd-CaCO3等;活性较高的催化剂 可用Raney镍、Pd-C等。
2019/6/26
6
叁键比双键容易被氢化,所以当叁键与双键共存时,以喹啉部 分毒化的钯作为催化剂可将叁键还原成双键,得到二烯类产物。
Na C2H5OH
Li NH3 THF
2019/6/26
28
了解
当芳烃与环酮稠合时,控制不同的条件可选择性地 还原芳环或羰基
HO
HO
+
OH O
Li-NH3
NH4Cl
O O OH
1)Li-NH3/ C2H5OH
2)H+
96%
O 75%
2019/6/26
29
3.2.4 卤代烷和醇的还原
叁键比双键容易氢化,可能是由于叁键比双键容易被催化剂表 面吸附的缘故。
RCH=CHCH2C
CH 5% Pd BaSO4 H2, quinoline
RCH=CHCH2CH=CH2
碳碳双键催化氢化的活性比酮羰基高,所以,当双键与羰基 共存时可以选择性地还原双键而保留羰基。
CH3 CH3
O H2/Pt
CH3COOH
NO2
H NO2
1) e-
2) H+
H
HH
HH
供电子基团不利于负电荷的分散而使反应难于进行。并且在
形成的负离子中间体中,供电子基团与负电荷或单电子尽可
能远离时,对反应有利。这时产物是2,5-二氢化苯衍生物。
OH
H
HO
HO
H 1) e-O
中考科学专题复习 三种还原剂还原氧化铜
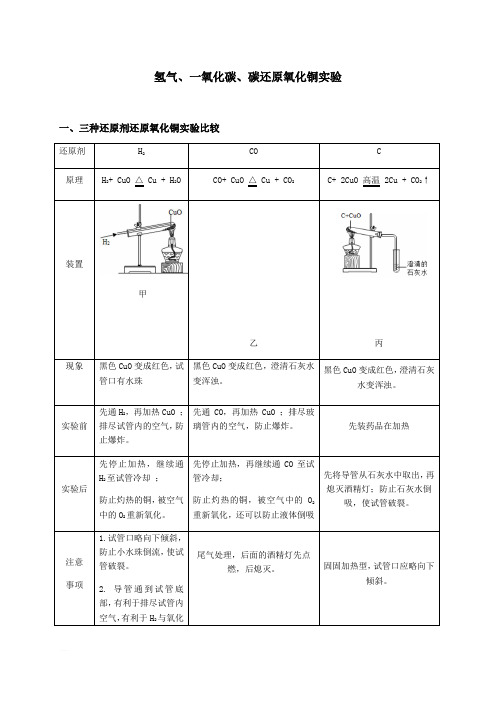
氢气、一氧化碳、碳还原氧化铜实验一、三种还原剂还原氧化铜实验比较甲黑色CuO变成红色,试黑色二、经典题型训练1.一氧化碳还原氧化铜实验的过程中有如下几步操作: ①点燃酒精灯,加热氧化铜; ②撤去酒精灯,停止加热; ③通入一氧化碳气体; ④停止通入一氧化碳气体; ⑤让还原出的金属铜完全冷却。
其中正确操作的顺序为()A. ①③②④⑤B. ③①②⑤④C. ③①②④⑤D. ①③②⑤④2.用一氧化碳还原氧化铜后,发现已制得的铜又很快变黑了,请推测产生这种现象的原因可能是( )A. 温度太低B. 试管口倾斜了C. 反应开始时,没有把试管内的空气排干净D. 铜没有在一氧化碳气流中冷却而又被空气中的氧气所氧化3.氢气和一氧化碳还原氧化铜的实验装置如下,有关说法错误的是()A. 实验时都应该先通入气体后加热,防止发生爆炸B. 两者都可以通过观察黑色固体颜色的变化判断反应是否发生C. 甲试管略向下倾斜,乙玻璃管保持水平,是因为两种气体的密度不同D. 甲无尾气处理装置而乙有,是因为一氧化碳有毒而氢气无毒4.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如下,下列说法正确的是()A.木炭、一氧化碳与氧化铜的反应都属于置换反应B.两空实验的相关反应中,只有碳元素的化合价发生改变C.两个实验中都可观察到红色固体变黑D.两个实验的操作中都要防止液体倒吸5.如图是木炭与氧化铜反应的实验装置图,下列说法错误的是()A.给酒精灯加网罩,目的是使火焰集中并提高温度B.实验过程中,可观察到澄清石灰水变浑浊C.碳在反应中发生了氧化反应,表现出还原性D.实验结束后,应先停止加热,再将导气管从澄清石灰水中撤出6.氢气、木炭、一氧化碳是金属冶炼中常用的还原剂.如图甲是氢气还原氧化铜的实验,如图乙是木炭还原氧化铁的实验,如图丙是一氧化碳还原氧化铜的实验.(1)实验装置的设计应考虑反应物、生成物的性质和反应条件等因素。
比较图甲和图丙所示的实验装置,从反应物的角度分析它们的不同点,写出一点并说明原因 。
第三章 还原反应

若用0.25当量LiAlH4可停在亚胺阶段,水解得醛。
a.酰氯易被LiAlH4还原为醇,但用氢化三-(叔一丁氧基)铝锂得醛:
O 2N COCl LiAlH(O-Bn) 3/diglyme -78℃ (甘醇二) O 2N CHO
⑵ 氰用LiAlH4还原得胺。
CH3 LiAlH 4/Et 2O 回流 CH=N-AlH 3 CH3 ① LiAlH ② H 3O
+
O Al (oPr-i) 2 R
(Me) 2CO
+ R1
+
Al(oPr-i)3
注: ①酮类与异丙醇铝配比为1:3可得较高收率. ②异丙醇铝是脂肪和芳香醛、酮的专属性还原剂,也适用于 醌类。结构中的烯键、炔键、硝基、缩醛。碳-卤键,氰基不 受影响。
2.影响异丙醇铝还原剂的因素。 ⑴异丙醇铝进行的还原反应是可逆的,加入过量或定量三氯化铝可 提高收率。 AlCl 3 2Al(oPr-i)3 3ClAl(oPr-i) 2 H R R C(CH 3)2 Cl Al(oPr-i)2 O R1 O R1 O Al Cl oPr-i
BH3
+ ( R ) 2CHO
( R ) 2CHOBH 3 3( R) 2CO [ ( R) 2CHO] 4B
( R ) 2CHOH
+H3Biblioteka OMe3.羰基化合物还原的立体化学:
若羰基的α位具有不对称碳原子,则四氢铝离子将从羰基双键主体位阻最 小的一边向羰基碳原子进攻。如:
O M S HX R L M
含水量近于计算量,使生成粒状偏铝酸锂,便于分离:水多则成胶 状氢氧化铝处理困难。
LiAlH 4 2H2O 4H2↑
+
LiAlO 2
chapter还原反应

PhCH=CHCO2Na
Na-Hg H2O
PhCH2CH2CO2Na H+ PhCH2CH2CO2H
1.以甲苯和C3以下的有机物合成PhCH2CH(Li、Na 、K)与液氨、醇组成的混合物进行的还原 谓Birch还原。碱金属在液氨中的溶解度次序为:Li>K>Na。 醇作为质子供给剂。进行还原时,务必除去存在于未经蒸馏的液 氨中的铁盐及其它杂质,少量的这些杂质将促进金属氢化物的 形成,从而抑制碱金属的还原。由于有机反应物在液氨中溶解 度较小,往往于反应体系中加入除去过氧化物和水的干醚和THF 等溶剂溶解。
镁汞齐能还原酮为相应的仲醇,并发生双分子还原反应 生成片呐醇。
1.Mg-Hg/PhH
2 (CH3)2C=O 2.H2O
(CH3)2C C(CH 3)2 OH OH
2PhC=O 1.Al-Hg /THF Ph2C CPh2
2.H2O
OH OH
O + (CH3)2C=O Mg-Hg
Ti C l4
CH3 C CH3 OH OH
NaHB4, LiAlH4, Al(OCH(CH3)2)3: 羰基还原成羟基, 不还原双键 Mg(-Hg) /苯; 双分子还原,得到邻二醇
Zn-Hg/HCl: 羰基---亚甲基 与羰基 共轭的双键也被还原
NH2NH2 + NaOH/O(CH2CH2OH)2 Fe+HCl, 如果芳环上有易被还原的羰基(如醛基),用SnCl2+HCl 较好
O CH3 Na,NH3 EtO H
O CH3
Li ,EtNH2
EtO H Na,NH3
1,4-二氢萘
EtO H
1,4,5,8 四氢萘
COOH Na,NH3 EtO H
化学氧化还原反应归纳总结

氧化还原反应中电子的转移表示方法——双线桥法 双线桥法
注意事项: (1)箭头必须由反应物指向生成物,且两端对准同种元素。 (2)箭头方向不代表电子转移方向,仅表示电子转移前后的变化。 (3)在“桥”上标明电子的“得”与“失”,得(或失)电子数=元素化合价变化数 ×化合价发生变化的原子数,且得失电子总数应相等。
又有还原性,如 ( Fe2+、S、Cl2)。
应用于判断元素或物质的氧化性、还原性。
3.强弱律:强氧化性的氧化剂跟强还原性的还原性反应,生成弱还原性的还原 产物和弱氧化性的氧化产物。
氧化剂 + 还原性 = 还原产物+氧化产物
↓
↓
↓
↓
强氧化性 强还原性 弱还原性 弱氧化性
应用于在适宜条件下,用氧化性强的物质制备氧化性弱的物质;用还原性强 的物质制备还原性弱的物质;用于比较物质间氧化性或还原性的强弱。
中失电子被氧化,而不是失电子被还原。
答案:A
1.守恒律:对于一个氧化还原反应,元素化合价升高总数与降低总数相等; 还原性失电子总数与氧化剂得电子总数相等;反应前后电荷总数相等(离子 反应)。
应用于有关氧化还原反应的计算。
2.价态律:元素处于最高价,只有氧化性(如Fe3+、KMnO4中
等);元素
处于最低价,只有还原性(如S2-、I-等);元素处于中间价态,既有氧化性
【例1】 (2009·福建理综,6)下列类型的反应,一定发生电子转移的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
氧化还原反应中的还原剂

氧化还原反应中的还原剂在化学的奇妙世界里,氧化还原反应如同一场精彩的“电子转移大战”,而还原剂则是这场大战中的关键角色。
那么,什么是还原剂呢?简单来说,还原剂就是在氧化还原反应中失去电子、化合价升高的物质。
为了更深入地理解还原剂,让我们先从一些常见的氧化还原反应例子入手。
比如,在氢气还原氧化铜的反应中,氢气(H₂)就是还原剂。
化学方程式为:H₂+ CuO == Cu + H₂O 。
在这个反应中,氢气失去电子,化合价从0 价升高到+1 价,而氧化铜中的铜元素得到电子,化合价从+2 价降低到 0 价。
再来看铁与硫酸铜溶液的反应:Fe + CuSO₄== FeSO₄+ Cu 。
这里的铁(Fe)是还原剂,它失去电子,化合价从0 价升高到+2 价,而铜离子得到电子,化合价从+2 价降低到 0 价,生成了铜单质。
那么,还原剂在这些反应中究竟发挥了怎样的作用呢?首先,还原剂为氧化还原反应提供了电子。
就好像是在一场交易中,还原剂慷慨地“送出”了自己的电子,使得其他物质能够得到电子,从而实现化合价的变化。
其次,还原剂的存在使得化学反应能够朝着特定的方向进行。
没有还原剂,很多重要的化学反应就无法发生,许多物质的转化也就无从谈起。
比如,在金属的冶炼过程中,常常需要使用还原剂将金属氧化物还原为金属单质。
此外,还原剂在生活和工业生产中也有着广泛的应用。
在电池中,负极材料通常充当还原剂,通过失去电子产生电流,为我们的电子设备提供能量。
例如常见的干电池,锌筒就是还原剂,它在反应中逐渐被消耗。
在化学分析中,还原剂也经常被用于定量分析某些物质的含量。
比如,通过使用特定的还原剂与待分析物质发生反应,然后测量反应中消耗的还原剂的量,就可以计算出待分析物质的含量。
不同的还原剂具有不同的还原能力。
这主要取决于它们失去电子的难易程度。
一些常见的强还原剂,如金属钠(Na)、钾(K)等,它们非常容易失去电子,反应活性很高。
而像一氧化碳(CO)这样的还原剂,其还原能力相对较弱。
