基础化学习题答案
基础化学练习题(有答案)

复习思考题一一、 填空题1.5.0g ·L -1的硼酸(H 3BO 3)溶液,其物质的量浓度为0.081 mol ·L -1。
2.不同基本单元的高锰酸钾溶液,其浓度关系为c (KMnO 4)= 0.2 c (51KMnO 4)。
4.产生渗透现象的两个必要条件是 有半透膜 和 存在浓度差 。
5.25℃时,已知难溶电解质MX 2的溶度积为K sp ,溶解度为S ,其K sp 与S的关系为 (Ksp / 4)^(1/3) 。
6.在水溶液中有Ac -、HCO 3-、H 2O 、NO 2-、HS -、CO 32-、H 2S 、H 2PO 4-、PO 43-、HCN ,根据质子理论,能作酸不能作碱的有 H2S 、 HCN;能作碱不能作酸的有 Ac- 、NO2-、CO32-、 PO43 ;既能作酸又可作碱的有 HCO3- 、H 2O 、 HS-、H2PO4- 。
7.在HAc 溶液中加入NaAc ,HAc 的解离度将会 减小 ,这种现象称为 盐 效应。
8. 已知HAc 、H 2PO 4-和NH 4+的p K a 分别为4.76、7.21和9.25。
若欲配制与正常人血浆pH 相同的缓冲溶液,应选用的缓冲系为 H2PO4- 、HPO42- ,其中抗酸成分是 HPO42- 。
9.用一级标准物质Na 2B 4O 7·10H 2O 标定HCl 溶液的浓度时,滴定反应式 为_ Na2B4O7(aq)+_HCl (aq )+5 H2O (l )===4H3BO3+2NaCl (aq )_______,化学计量点时计算[H +]的公式为 -0.5log(Ka* C) ,可以选择 甲基红 为指示剂。
10.下列数据:0.00841、1.24×10-5、0.0020、1000和pH=10.50的有效数字位数分别是 3 、 3 、 2 、 4 和 2 。
11.用Na 2C 2O 4作一级标准物质标定KMnO 4溶液,标定是时要添加__硫酸___ 以维持溶液的酸性,不能用盐酸,因 高锰酸根会氧化氯离子 ;也不能用硝酸,因硝酸会氧化草酸根。
化学基础习题+参考答案

化学基础习题+参考答案一、单选题(共107题,每题1分,共107分)1.一个化合物虽然含有手性碳原子,但化合物自身可以与它的镜像叠合,这个化合物叫().A、外消旋体B、对映异构体C、内消旋体D、低共熔化合物正确答案:C2.漆酚,若涂在物体表面,在空气中干燥时会产生黑色漆膜,则漆酚不具有的化学性质是()A、可与溴水发生取代反应B、可与烧碱溶液反应C、可与酸性高锰酸钾溶液反应D、可与碳酸氢钠溶液反应放出二氧化碳正确答案:D3.改变压强,平衡不移动的是()A、H2O(g)+C(s)⇌CO(g)+H2(g)B、CO(g)+H2O(g)⇌CO2(g)+H2(g)C、CaCO3(s)⇌CaO(s)+CO2-QD、2SO2(g)+O2(g)⇌2SO3(g)+Q正确答案:B4.输液时,下面叙述正确的是A、高渗溶液B、任意浓度C、等渗溶液D、低渗溶液正确答案:C5.人体中血液的pH值总是维持在7.35~7.45范围内,这是由于()A、人体内有大量的水分(水约占体重70%)B、新陈代谢的CO2部分溶解在血液中C、新陈代谢的酸碱物质等量地溶在血液中D、血液中的HCO3-和H2CO3只允许在一定的比例范围中正确答案:D6.能与斐林试剂反应的是.()A、苯酚B、苯甲醛C、丙酮D、乙醛正确答案:D7.下列化合物中无顺反异构现象的是()A、2-甲基-2-丁烯B、2-氯-2-丁烯C、2-丁烯D、3-甲基-2-戊烯正确答案:A8.下列化合物不属于酮体成分的是()A、丙酮B、β-丁酮酸C、丙酮酸D、β-羟基丁酸正确答案:C9.下列哪种试剂可用于区别1-丁醇和2-丁醇.()A、卢卡斯试剂B、硫酸C、三氯化铁D、溴水正确答案:A10.在氨水中加入NH4Cl后,NH3的α和pH值变化是:()A、α和pH值都增大B、α减小,pH值增大C、α增大,pH值变小D、α、pH值都减小正确答案:D11.蛋白质的基本成分A、糖原B、淀粉C、纤维素D、氨基酸正确答案:D12.1,3-丁二烯与溴水发生加成反应在高温时,反应主要产物是()A、生成较多1,4-加成产物B、生成较多1,2-加成产物C、生成1,4-加成产物和1,2-加成产物D、无法确定正确答案:A13.丁烷有几种同分异构体()A、3个B、2个C、4个D、1个正确答案:B14.下列化合物中酸性最强的是()A、乙酸B、乙二酸C、甲酸D、丙酸酸正确答案:B15.下列各组混合溶液中,不具有缓冲作用的是()A、100mL0.10mol·L-1KH2PO4溶液和50mL0.10mol·L-1NaOH溶液B、100mL0.10mol·L-1HAc溶液和50mL0.10mol·L-1NaOH溶液C、100mL0.10mol·L-1NaH2PO4溶液和50mL0.20mol·L-1NaOH溶液D、100mL0.10mol·L-1KH2PO4溶液和50mL0.10mol·L-1HCl溶液正确答案:C16.对处于平衡状态的反应2A(g)+B(g)⇌2C(g)+Q(Q>0),下列叙述正确的是:()A、增大压强.V正增大,V逆减小B、升高温度,V正减小,V逆增大C、增大A浓度的瞬间,V正增大,V逆不变D、增大A浓度瞬间,V正增大而V逆减小正确答案:C17.乙醇胺(HOCH2CH2NH2)和乙醇胺盐配制缓冲溶液的有效pH范围是多少(乙醇胺的PKb=4.50)A、6~8B、4~6C、10~12D、8~10正确答案:D18.下列有机物分子中不含有羧基的是()A、乳酸B、苯酚C、过氧乙酸D、苯甲酸正确答案:B19.下列关于苯的说法正确的是()A、苯的分子式是C6H6,不能使酸性KMnO4溶液褪色,属于饱和烃B、从苯的凯库勒式看,分子中含有双键,所以属于烯烃C、在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应D、苯分子为平面正六边形结构,6个碳原子之间的键完全相同正确答案:D20.欲配制pH=5.0的缓冲溶液,应选用下列缓冲系中的()A、甲酸(pKa=3.75)B、乙酸(pKa=4.756)C、硼酸(pKa=9.27)D、甲胺盐酸盐(pKa=10.63)正确答案:C21.下列叙述中,与烷烃的性质不符的是()A、很稳定,不与强酸、强碱作用B、难与强氧化剂发生反应C、燃烧时,生成二氧化碳和水,并放出大量的热D、烷烃均易溶于水、乙醇等正确答案:D22.人类最早合成的有机物是()A、尿素B、甲醛C、甲烷D、乙烯正确答案:A23.[Fe(H2O)5]2+的共轭碱是()A、不存在。
基础化学第二版课后习题答案

基础化学第二版课后习题答案【篇一:基础化学第二版习题答案chap5】1.何谓沉淀溶解平衡?同物质的量的bacl2和h2so4混合溶液中,含有哪些离子?这些离子浓度之间存在着哪些关系?答:难溶电解质溶解和沉淀速度相等,固体的量和溶液中分子或离子的量不再改变的状态,称为沉淀溶解平衡。
ba2+、cl-、so4、h+、oh-2?2.活度积、溶度积、离子积之间有何区别与联系?答:活度积、溶度积指平衡状态下的活度积或浓度积,对给定的难溶电解质其活度积只与温度有关,溶度积不但与温度有关,还和溶液离子强度有关,对于ma型难溶电解质:?ksp(ma)。
离子积指任意状态下的浓度积,其值是任意的。
?(m?)??(a?)3.无副反应时,沉淀的溶度积与溶解度有何关系?溶度积小的物质,它的溶解度是否一定小?举例说明。
答:s?mmnn不同类型难溶电解质的溶解度不能根据溶度积数值大小直接判断。
溶度积小的物质,它的溶解度是不一定小,如ag2cro4与agcl。
4.除了沉淀物质本性以外,影响沉淀溶解度的主要因素有哪些?答:除了沉淀物质本性以外,影响沉淀溶解度的主要因素还有:同离子效应、盐效应、酸碱效应、配位效应等。
5.判断下列操作中可能发生的反应和现象并予以解释。
(1)将少量caco3固体放入稀hcl中。
(2)将少量mg(oh)2放入nh4cl溶液中。
答:(1)caco3固体溶解,有无色无味气体产生。
caco3(s)ca2+ + co32-+2h+h 2co 3→co2 +h 2o(2)mg(oh)2固体溶解,有无色刺激性气体产生。
的氨水,有肉色沉淀生成。
原因是饱和h2s水溶液提供的s2-很少,此时mg(oh)2(s)mg2+ + 2oh-+2nh4+(4)黑色固体变成白色固体。
so42- +h2o(5)白色沉淀变成黄色沉淀。
agcl(白)+ i-(6)浅兰色沉淀消失,生成深兰色溶液。
cu(oh)2 + 4nh3pb2++so42-→pbso4↓(白)agi(黄)+cl-[cu(nh3)4](oh)2答:(1)(2)减小(同离子效应);(3)增大(盐效应);(4)增大(配位效应)。
大学基础化学考试练习题及答案141

大学基础化学考试练习题及答案11.[单选题]吸收瓶内装有许多细玻璃管或一支气泡喷管是为了A)增大气体的通路B)延长吸收时间C)加快吸收速度D)减小吸收面积答案:C解析:2.[单选题]分子中含有一个或一个以上苯环的碳氢化合物称为A)烷烃B)烯烃C)炔烃D)芳香烃答案:A解析:3.[单选题]实验室制取氯化氢的方法是()。
A)氯化钠溶液与浓硫酸加热反应B)氯化钠溶液与稀硫酸加热反应C)氯化纳晶体与浓硫酸加热反应D)氯化钠晶体与稀硫酸加热反应答案:C解析:4.[单选题]配合物Na[Cu(CN)2]的正确命名是( )A)二氧合铜(III)化钠B)二氧合铜(I)化钠C)二氧合铜(II)酸钠D)二氰合铜(I)酸钠答案:D解析:5.[单选题]配制 I2 标准溶液时,正确的是( )。
A)碘溶于浓碘化钾溶液中B)碘直接溶于蒸馏水中C)碘溶解于水后,加碘化钾D)碘能溶于酸性中6.[单选题]以下难溶电解质在水中,溶解度最大的是A)AgIO3﹙Ksp=3.0×10-8﹚B)BaSO4﹙Ksp=1.08×10-10﹚C)Mg(OH)2﹙Ksp=5.6×10-12﹚D)PbI2﹙Ksp=9.8×10-9﹚答案:D解析:7.[单选题]乙醇氧化的最终产物是( )A)乙酸B)乙醛C)乙烯D)乙醚答案:A解析:8.[单选题]天然气的主要成分是( )A)甲烷B)乙烷C)丙烷D)丁烷答案:A解析:9.[单选题]急性呼吸系统中毒后的急救方法正确的是A)要反复进行多次洗胃B)立即用大量自来水冲洗C)用3%~5%碳酸氢钠溶液或用(1+5000)高锰酸钾溶液洗胃D)应使中毒者迅速离开现场,移到通风良好的地方,呼吸新鲜空气。
答案:D解析:10.[单选题]已知2SO2(g)+O2(g)=2SO3(g)(正反应放热)。
若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列说法正确的是( )A)若降低温度,可以加快反应速率B)使用催化剂是为了加快反应速率C)在上述条件下,SO2能完全转化为SO3D)达到平衡时,SO2和SO3的浓度一定相等答案:A11.[单选题]能和水剧烈反应的金属是()A)FeB)ZnC)NaD)Cu答案:C解析:12.[单选题]有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3固体,有四位同学为鉴别它们采用了以下不同方法,其中可行的是( )A)分别将它们配制成溶液,再加入澄清石灰水B)分别将它们配制成溶液,再加入NaOH溶液C)分别将它们配制成溶液,再进行焰色反应D)分别加热,再用澄清石灰水检验是否有气体产生答案:D解析:13.[单选题]在[Co(NH3)5Cl]Cl2中,内界是()A)Co(NH3)5B)Co(NH3)5ClC)CoD)Cl-答案:B解析:14.[单选题]蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是( )。
《基础化学》课后习题参考答案(有机部分)
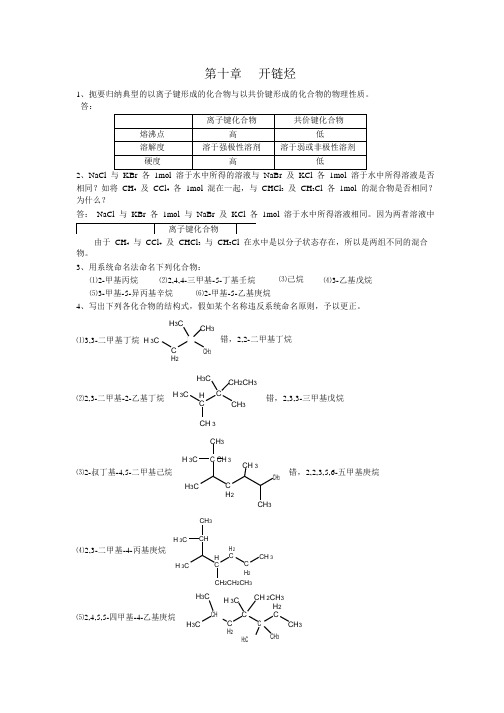
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。
化学基础习题库及答案

化学基础习题库及答案一、单选题(共100题,每题1分,共100分)1、下列化合物能与托伦试剂反应生成银镜的是()A、丙酸B、丙酮C、甲醇D、甲酸正确答案:D2、下列化合物中酸性最强的是()A、α-羟基丙酸B、β-羟基丙酸C、丙酸D、α,β-二羟基丙酸正确答案:D3、在氨溶液中加入少量盐酸,使:( )。
A、溶液OH-浓度变小B、NH3的Kb变大C、NH3的α增大D、pH值保持不变正确答案:C4、下列说法正确的是:()A、增大反应物的浓度,平衡向生成物浓度增大的方向移动。
B、有气体存在的可逆反应,该变压强,都会使化学平衡移动。
C、加热能使吸热反应速率加快,放热反应速率减慢,平衡向吸热反应方向移动。
D、凡能影响反应速率的因素,都能使化学平衡移动正确答案:A5、下列可用来区分葡萄糖和果糖的是( )A、斐林试剂B、苯肼C、托伦试剂D、赛利凡诺夫试剂正确答案:D6、 CH3CH2CH2CH3与CH3CH(CH3)2是什么异构体?( )A、碳架异构B、位置异构C、官能团异构D、互变异构正确答案:A7、既能发生水解反应,又能发生银镜反应的物质是()A、麦芽糖B、蔗糖C、丙酸甲酯D、葡萄糖甲苷正确答案:A8、欲使蛋白质沉淀而不变性,应选用( )A、浓硫酸B、重金属盐C、甲醛D、硫酸铵正确答案:B9、人体血浆中最重要的缓冲对是A、H2PO4 — HPO42-B、HCO3 — CO32-C、H2CO3 — HCO3-D、HPO42 — PO43-正确答案:C10、下列试剂中,常用于糖尿病患者尿液中葡萄糖含量检查的是( )A、FeCl3B、溴水C、班氏试剂D、茚三酮溶液正确答案:C11、医用生理盐水的质量浓度是多少?A、8g/LB、10g/LC、9g/LD、7g/L正确答案:C12、有关简单的饱和链烃的叙述:①都是易燃物;②特征反应都是取代反应;③相邻两个烷烃在分子上组成相差一个甲基。
正确的是( )A、②和③B、①和②C、①D、①和③正确答案:B13、可以用来判断油脂不饱和程度的是( )A、酸值B、皂化值C、碘值D、密度正确答案:C14、某缓冲溶液的共轭碱的Kb=1.0×10-6,从理论上推算该缓冲溶液的缓冲范围是( )A、5~7B、6~8C、7~9D、5~6正确答案:C15、 HPO42-的共轭酸是( )A、H2PO4-B、OH-C、H3PO4D、PO43-正确答案:A16、下列哪种物质具有致癌性( )A、蒽B、菲C、萘D、苯并芘正确答案:D17、下列有机物分子中不含有羧基的是()A、苯甲酸B、过氧乙酸C、乳酸D、苯酚正确答案:D18、人的肠胃不能消化的多糖是. ( )A、纤维素B、糖原C、右旋糖酐D、淀粉正确答案:A19、将淀粉碘化钾混合溶液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后取出杯中液体进行试验,不能证明半透膜有破损的是:( )A、加入碘水变蓝B、加入碘化钠不变蓝C、加入FeCl3 溶液变蓝D、加入溴水变蓝正确答案:B20、下列化合物中无顺反异构现象的是()A、2-氯-2-丁烯B、2-甲基-2-丁烯C、3-甲基-2-戊烯D、2-丁烯正确答案:B21、下列不属于有机物的是 ( )A、HCOOHB、C2H4C、CH3OHD、HCN正确答案:D22、不能配制 pH = 7 左右的缓冲溶液的共轭酸碱混合物是( ) (已知HClO :K = 3.4 × 10-8 H2CO3 :K1 = 4.2 × 10-7 ,K2 = 5.6 × 10-11 H3PO4 :K1 = 7.6 × 10-3 ,K2 = 6.3 × 10-8 ,K3 = 4.4 × 10-13)A、NaHCO3-Na2CO3B、NaH2PO4-Na2HPO4C、HClO-NaClOD、H2CO3-NaHCO3正确答案:A23、构成蛋白质的基本单位是( )A、多肽B、β-氨基酸C、α-氨基酸D、肽链正确答案:C24、β-醇酸加热脱水生成( )。
基础化学(判断题)模拟练习题(含参考答案)
基础化学(判断题)模拟练习题(含参考答案)一、判断题(共100题,每题1分,共100分)1、实验室中常采用金属锌标定EDTA的浓度。
A、正确B、错误正确答案:A2、器皿不洁净,溅失试液,读数或记录差错都可造成偶然误差。
A、正确B、错误正确答案:A3、酸碱指示剂的变色与溶液中的氢离子浓度无关。
A、正确B、错误正确答案:B4、苯酚具有较强的酸性,可以使指示剂变色。
A、正确B、错误正确答案:B5、系统误差是由某些必然的或经常的原因造成的。
A、正确B、错误正确答案:A6、pH 越大,酸效应系数越小。
A、正确B、错误正确答案:A7、凡是基准物质,使用前都要进行灼烧处理。
A、正确B、错误正确答案:B8、由于K2Cr207容易提纯,干燥后可作为基准物自接配制标准液,不必标定。
A、正确B、错误正确答案:A9、滴定突跃范围的宽窄,与酸碱的浓度无关,只与酸碱的性质有关。
A、正确B、错误正确答案:B10、滴定分析的相对误差一般要求小于0.1%,滴定时消耗的标准溶液体积应控制在10~15mL。
A、正确B、错误正确答案:B11、指示剂在溶液中显现的颜色是随着指示剂的浓度变化而变化。
A、正确B、错误正确答案:B12、在滴定分析过程中,当滴定至指示剂颜色改变时,滴定达到终点。
A、正确B、错误正确答案:A13、苯是易溶于水的有机物。
A、正确B、错误正确答案:B14、溶液稀释前后溶质的质量发生变化。
A、正确B、错误正确答案:B15、一定温度下,氧化还原电对中氧化型的浓度降低,则还原型的还原能力增强。
A、正确B、错误正确答案:A16、当溶液中存在两种以上的离子可与同一试剂反应产生沉淀,首先析出的是离子积最先达到溶度积的难溶电解质。
A、正确正确答案:A17、有机化合物的分子结构中化学键的主要类型为共价键。
A、正确B、错误正确答案:A18、48g换算为毫克的正确写法是11480mg。
A、正确B、错误正确答案:B19、化学反应达到平衡状态时,反应各组分的浓度相等。
基础化学习题及详细答案
电解质溶液首 页 难题解析学生自测题学生自测答案章后习题解答难题解析 [TOP]例3-1 (1) NaOH 和H 3PO 4溶液等体积混合,测得溶液pH 值为4.66,溶液的渗透浓度为200 mmol·L -1,求混合前NaOH 和H 3PO 4溶液的浓度各为多少?(2)若此 NaOH 和H 3PO 4溶液以2:1的体积混合,溶液pH 和渗透浓度各为多少? (已知H 3PO 4:p K a1=2.16;p K a2=7.21;p K a3=12.32)分析 (1) NaOH 和H 3PO 4溶液等体积混合,由pH=4.66知混合后只有NaH 2PO 4,那么NaOH 和H 3PO 4浓度相等,再由混合溶液渗透浓度求得NaOH 和H 3PO 4溶液的浓度。
(2)NaOH 和H 3PO 4以2:1体积混合,可计算出溶液pH 和渗透浓度。
解 (1)因NaOH 和H 3PO 4溶液等体积混合后pH=4.66=(p K a1+p K a2)/2,可判断混合溶液只含有NaH 2PO 4,因此混合前NaOH 和H 3PO 4浓度相等,又混合溶液的渗透浓度为200 mmol·L -1,即2×c (NaH 2PO 4)= 200 mmol·L -1 c (NaH 2PO 4)= 0.10 mol·L -1根据c (NaH 2PO 4)推出混合前c (NaOH)= 0.20 mol·L -1,c (H 3PO 4)= 0.20 mol·L -1 (2) NaOH 和H 3PO 4溶液以2:1的体积混合发生的反应为:2NaOH(aq) + H 3PO 4(aq)Na 2HPO 4(aq) + 2H 2O(aq)由于混合前c (NaOH)= 0.20 mol·L -1,c (H 3PO 4)=0.20 mol·L -1,混合后溶液只含有Na 2HPO 4,浓度为c (Na 2HPO 4)= (2/3)×0.20 mol·L -1因此溶液的渗透浓度为3×(2/3)×0.20×1000 mmol·L -1=400 mmol·L -1由于混合溶液只含有Na 2HPO 4两性物质,pH=(p K a2 + p K a3)/2=(7.21+12.32)/2=9.76例3-2 在0.100 mol·L -1HA 溶液的解离度α为1.32%,(1)计算HA 的解离常数。
基础化学第二版课后习题答案
基础化学第二版课后习题答案【篇一:基础化学第二版习题答案chap5】1.何谓沉淀溶解平衡?同物质的量的bacl2和h2so4混合溶液中,含有哪些离子?这些离子浓度之间存在着哪些关系?答:难溶电解质溶解和沉淀速度相等,固体的量和溶液中分子或离子的量不再改变的状态,称为沉淀溶解平衡。
ba2+、cl-、so4、h+、oh-2?2.活度积、溶度积、离子积之间有何区别与联系?答:活度积、溶度积指平衡状态下的活度积或浓度积,对给定的难溶电解质其活度积只与温度有关,溶度积不但与温度有关,还和溶液离子强度有关,对于ma型难溶电解质:?ksp(ma)。
离子积指任意状态下的浓度积,其值是任意的。
?(m?)??(a?)3.无副反应时,沉淀的溶度积与溶解度有何关系?溶度积小的物质,它的溶解度是否一定小?举例说明。
答:s?mmnn不同类型难溶电解质的溶解度不能根据溶度积数值大小直接判断。
溶度积小的物质,它的溶解度是不一定小,如ag2cro4与agcl。
4.除了沉淀物质本性以外,影响沉淀溶解度的主要因素有哪些?答:除了沉淀物质本性以外,影响沉淀溶解度的主要因素还有:同离子效应、盐效应、酸碱效应、配位效应等。
5.判断下列操作中可能发生的反应和现象并予以解释。
(1)将少量caco3固体放入稀hcl中。
(2)将少量mg(oh)2放入nh4cl溶液中。
答:(1)caco3固体溶解,有无色无味气体产生。
caco3(s)ca2+ + co32-+2h+h 2co 3→co2 +h 2o(2)mg(oh)2固体溶解,有无色刺激性气体产生。
的氨水,有肉色沉淀生成。
原因是饱和h2s水溶液提供的s2-很少,此时mg(oh)2(s)mg2+ + 2oh-+2nh4+(4)黑色固体变成白色固体。
so42- +h2o(5)白色沉淀变成黄色沉淀。
agcl(白)+ i-(6)浅兰色沉淀消失,生成深兰色溶液。
cu(oh)2 + 4nh3pb2++so42-→pbso4↓(白)agi(黄)+cl-[cu(nh3)4](oh)2答:(1)(2)减小(同离子效应);(3)增大(盐效应);(4)增大(配位效应)。
化学基础复习题(附答案)
化学基础复习题(附答案)、单选题(共100题,每题1分,共100分)l、下列化合物中,不能发生酣化反应的是A、HCOOHB、CH3COOHC、CH3CH20HD、CH3CHO正确答案:D2、能与浓澳水反应生成白色沉淀的是()A、乙烯B、苯酚C、乙醇D、苯正确答案:B3、乙醇沸点(78.3°C)与分子量相等的甲腿沸点(—23.4°C)相比高得多是由于()A、乙醇能形成分子间氢键,甲酕不能B、甲酕能与水形成氢键C、甲酕能形成分子间氢键,乙醇不能D、乙醇能与水形成氢键,甲酕不能正确答案:A4、分子中含有碳碳双键的是()A、苯B、丙烯C、乙块D、聚乙烯正确答案:B5、下列使蛋白质变性的物理方法是()A、紫外线照射B、加重金属盐C、加酸D、加有机溶剂正确答案:A6、一定温度下,加水稀释弱酸,数值将减小的是()B、aC、pHD、[H+]正确答案:D7、与溶液渗透压大小有关的因素是A、溶质颗粒的大小B、溶质的颗粒总数C、溶质的性质D、溶剂的性质正确答案:B8、欲配制PH=4.50的缓冲溶液,若用H Ac及Na Ac配制,则c(H Ac)及c (Na Ac)的浓度之比为(H Ac的pKa=4.76) ()A、4.76/1B、1/4.76C、1.78/1D、1/1.78正确答案:C9、下列哪项不属于狻酸衍生物()A、乳酸B、甲酸乙酣C、乙酰胺D、乙酸酐正确答案:A10、苯酚俗称()A、石炭酸B、澳苯C、羊醇D、甘油正确答案:A11、在常温下,pH=6的溶液与pOH=6的溶液相比,其氢离子浓度A、高10倍B、高2倍C、高100倍正确答案:C12、单糖与浓酸和a-蔡酚反应能显紫色,这一鉴定糖的反应叫()A、糖胖反应B、Seliwa n o ff反应C、成昔反应D、Mol ish反应正确答案:D13、下列不能做为配位体的物质是()A、C6H5NH2B、CH3NH2C、NH4+D、NH3正确答案:C14、为了保证某工作液的PH值为4——5,应选用()缓冲对配制缓冲溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录第一章绪论 (1)第二章稀溶液的依数性 (8)第三章电解质溶液 (14)第四章缓冲溶液 (31)第五章酸碱滴定 (50)第八章氧化还原反应与电极电位 (62)第九章原子结构和元素周期律 (73)第十章共价键与分子间力习题答案 (82)第十一章配位合物 (88)第十二章可见分光光度法和紫外分光光度法 (100)模拟试题一 (108)模拟试题二 (113)第一章 绪 论习 题 解 答3.求0.01kgNaOH 、0.100kg(21Ca 2+)、0.100kg(21Na 2CO 3)的物质的量。
解:NaOH 、21Ca 2+和21Na 2CO 3的摩尔质量分别为: M (NaOH )= 40g ·mol -1 M (21Ca 2+)= 20g ·mol -1 M (21Na 2CO 3)= 53g ·mol -1 所以,它们的物质的量分别为:n (NaOH) =1molg 40g 100001.0-⋅⨯= mol n (21Ca 2+) =1mol g 20g 1000100.0-⋅⨯= mol n (21Na 2CO 3) =1mol g 53g 1000100.0-⋅⨯= mol 4. 20℃,将350gZnCl 2溶于650g 水中,溶液的体积为739.5ml ,求此溶液的物质的量浓度和质量摩尔浓度。
解:ZnCl 2的摩尔质量为:M (ZnCl 2)= g ·mol -1,则该溶液的物质的量浓度和质量摩尔浓度分别为:c (ZnCl 2)=L7395.0mol g 3.136/g 3501-⋅= 3.47 mol ·L -1 b (ZnCl 2)=kg650.0mol g 136/g 3501-⋅= 3.95 mol ·kg -1 5.每100ml 血浆含K +和Cl -分别为20mg 和366mg ,试计算它们的物质的量浓度,单位用mmol ·L -1表示。
解:K +和Cl -的摩尔质量分别为:M (K +)= 39g ·mol -1 M (Cl -)= g ·mol -1所以,它们的物质的量浓度分别为:c (K +) =L100.0m m ol m g 39/m g 201-⋅= mmol ·L -1 c (Cl -) =L 100.0mm ol m g 5.35/m g 3661-⋅= 103 mmol ·L -1 6. 如何用含结晶水的葡萄糖(C 6H 12O 6·H 2O)配制质量浓度为50g ·L -1·L -1,该溶液的物质的量浓度和葡萄糖C 6H 12O 6的摩尔分数是多少?解:查表可知:M (C 6H 12O 6·H 2O )= 198g ·mol -1M (C 6H 12O 6)= 180g ·mol -1500ml 葡萄糖溶液所含C 6H 12O 6的质量为:m (C 6H 12O 6)= 50g ·L -1×0.5L = 25g则配制500ml 葡萄糖溶液所需C 6H 12O 6·H 2O 的质量为:m (C 6H 12O 6·H 2O )= 25g ×11molg 180mol g 198--⋅⋅= 27.5 g 称取27.5g C 6H 12O 6·H 2O 晶体,溶于适量蒸馏水中,再稀释至500ml ,混匀,即可配制成500ml 50g ·L -1的葡萄糖溶液。
该溶液的物质的量浓度为:c (C 6H 12O 6)=11molg 180L g 50--⋅⋅= 0.278 mol ·L -1 ·L -1,500ml 溶液中溶剂的质量为:m (H 2×1000g ·L -1×)-25g = 475 g所以,溶液中C 6H 12O 6的摩尔分数为:x (C 6H 12O 6)=()()111mol g 18/g 475mol g 180/g 25mol g 180/g 25---⋅+⋅⋅ = 0.005247. 某患者需补充Na +5.0g ,如用生理盐水补充[ρ g ·L -1],应需多少? 解:查表可知:M (NaCl )= 58.5g ·mol -1 M (Na +)= 23g ·mol -1 需补充NaCl 的质量为:m (NaCl )×11molg 23mol g 5.58--⋅⋅= 12.7 g 需补充生理盐水的体积为:V (生理盐水)=1L g 0.9g 7.12-⋅= 1.4 L 8. 溶液中KI 与KMnO 4gI 2析出,以(KI +51KMnO 4)为基本单元,所消耗的反应物的物质的量是多少?解:题中的反应方程式为:10KI + 2KMnO 4 + 8H 2SO 4 = 5I 2 + 2MnSO 4 + 6K 2SO 4 + 8H 2O将上述反应方程式按题意变换为: KI +51KMnO 4 +54H 2SO 4 =21I 2 +51MnSO 4 +53K 2SO 4 +54H 2O 1mol 21mol n (KI +51KMnO 4·mol -1 则所消耗的反应物的物质的量为:n (KI +51KMnO 4)= 2×1mol g 254g 508.0-⋅ ×10-3 mol= 4.00 mmol测 试 题一、 填空题: 1.·L -1的硼酸(H 3BO 3)溶液,其物质的量浓度为mol ·L -1。
2.在100ml 溶液中含Ca 2+离子8.0mg ,则Ca 2+离子的浓度是 mmol ·L -1。
3.配制c mol ·L -1的溶液300ml ,需要固体NaOH的质量是 g 。
4.不同基本单元的高锰酸钾溶液,其浓度关系为c (KMnO 4)= c (51KMnO 4)。
5.某患者输入500ml 生理盐水,所输入的NaCl 的质量为g 。
二、单选题:1.下列符号中表示物质的量的符号是( )。
A .molB .nC .mol ·L -1D .c2.500g 水中含有22.5g 葡萄糖(Mr =180),这一溶液中葡萄糖的质量摩尔浓度最接近下列中的( )mol ·kg -1。
A .0.75B .0.50C .0.25D .0.153.人体血浆中平均每100ml 含19mgK +,则血浆中K +浓度是( )mol ·L -1。
A .4.75×10-1B .4.75×10-2C .4.75×10-3D .4.75×10-44.配制1g ·L -1的新洁尔灭消毒液1000ml ,应取50g ·L -1新洁尔灭消毒液的体积是( )。
A .100mlB .80mlC .50mlD .20ml5.在下列溶液组成标度的表示方法中,与温度无关的是( )。
A .物质的量浓度B .质量摩尔浓度C .质量浓度D .质量分数三、是非题:1.在法定计量单位制中,“物质B 的浓度”就是“物质B 的物质的量浓度”的简称。
( )2.表示质量浓度时,质量的单位可以改变,但表示溶液体积的单位只能用L 。
( )3.“氧的物质的量是1mol ”的说法是不正确的。
( )4.物质的量也就是物质的质量。
( )5.对于任意化学反应a A+b B = c C+d D ,当完全反应时各物质的物质的量之间的关系为D C B A 1111n dn c n b n a ===。
( )四、计算题:0.944 mol ·L -1葡萄糖溶液,20℃·ml -1,计算此葡萄糖溶液中葡萄糖的摩尔分数和质量摩尔浓度。
参 考 答 案一、填空题:1.0.081;0.0803.1.24.515.4.5二、单选题:1.B 2.C 3.C 4.D 5.D三、是非题:1.√2.×3.√4.×5.√四、计算题:解:1.00L葡萄糖溶液中水的物质的量为:n(H2O)=() ()OHOH22Mm=0.18180 944.000.106.11000⨯⨯-⨯= 49.4(mol)此溶液中葡萄糖的摩尔分数和质量摩尔浓度分别为:x (C 6H 12O 6)=()()()O H O H C O H C 261266126n n n + =4.49944.000.1944.000.1+⨯⨯ ×10-2b (C 6H 12O 6)=()()O H O H C 26126m n =3100.184.49944.000.1-⨯⨯⨯ = 1.06(mol ·kg -1)第二章 稀溶液的依数性习 题 解 答7. 试排出在相同温度下下列溶液渗透压力由大到小的顺序:(1) c (C 6H 12O 6)= 0.2 mol ·L -1;(2) c (21Na 2CO 3)= 0.2 mol ·L -1; (3) c (31Na 3PO 4)= 0.2 mol ·L -1; (4) c (NaCl )= 0.2 mol ·L -1。
解:在相同温度下,溶液的渗透压力与渗透浓度成正比,可以通过比较溶液渗透浓度的大小,确定溶液渗透压力的大小。
(1) 溶液的渗透浓度为:c os (C 6H 12O 6)= c (C 6H 12O 6)= 0.2 mol ·L -1(2)溶液的渗透浓度为:c os (21Na 2CO 3)= 0.2 mol ·L -1 +21×0.2 mol ·L -1 = 0.3 mol ·L -1(3)溶液的渗透浓度为:c os (31Na 3PO 4)= 0.2 mol ·L -1 +31×0.2 mol ·L -1= 0.267 mol ·L -1(4)溶液的渗透浓度为:c os (NaCl )= 2×0.2 mol ·L -1 = 0.4 mol ·L -1溶液的渗透压力由大到小的顺序为:(4)>(2)>(3)>(1)9. 100,25℃时此溶液的渗透压力为0.717kPa ,求白蛋白的相对分子质量。
解:白蛋白的摩尔质量为:M (白蛋白)=ΠVRT m B =L 100.0kPa 717.0K 298mol K L kPa 314.8g 00.211⨯⨯⋅⋅⋅⨯-- ×104 g ·mol -1白蛋白的相对分子质量为×104。
