【文献快递】伽玛刀立体定向放射外科治疗脑转移瘤后长期生存者放射性坏死的预测因子
【文献快递】胰岛素样生长因子指数和生物有效剂量对肢端肥大症立体定向放射治疗后预后的影响

【文献快递】胰岛素样生长因子指数和生物有效剂量对肢端肥大症立体定向放射治疗后预后的影响《Neurosurgery.》杂志2020年 4月 8日在线发表美国明尼苏达的Mayo Clinic的Graffeo CS , Donegan D , Erickson D ,等撰写的《胰岛素样生长因子指数和生物有效剂量对肢端肥大症立体定向放射治疗后预后的影响:队列研究。
The Impact of Insulin-Like Growth Factor Index and Biologically Effective Dose on Outcomes After Stereotactic Radiosurgery for Acromegaly: Cohort Study.》(doi: 10.1093/neuros/nyaa054. )。
【背景】立体定向放射外科治疗(SRS)是一种安全有效的治疗肢端肥大症的方法。
在过去的30年里,立体定向放射外科(SRS)被认为是一种安全有效的治疗方法,用于治疗残留或复发的分泌生长激素的垂体腺瘤(GHA)。
可能预测SRS治疗后生化缓解的因素包括SRS治疗前胰岛素样生长因子-1 (IGF-1)水平,IGF-1指数(IGF-1i), SRS治疗时使用的垂体抑制药物,以及照射剂量。
生物有效剂量(BED)是一个放射生物学参数,用来估计靶组织损伤的随机风险。
与处方照射剂量不同(Unlike prescribed radiation dose),BED合并(incorporate)一个时间校正因子(a time correction factor),可以解释辐射期间的DNA修复(accounts for DNA repair during irradiation)。
BED与在体外实验中的细胞杀伤增强以及动物模型中正常组织毒性显著相关。
BED估计历来是一项艰巨的任务(adaunting practice);然而,最近有报道一个简化的估计方法,提供一个框架来分析BED对SRS治疗后的临床结果的影响。
脑转移瘤伽玛刀放疗两种体位固定方式的摆位误差比较

RESEARCH WORK引言脑转移瘤是颅内一种常见的恶性肿瘤,大约有20%~40%的癌症患者会发生脑转移[1-2]。
研究表明,伽玛刀立体定向放疗治疗脑转移瘤可获得较好的局部控制率,延长生存期[3-4]。
脑转移瘤患者在接受伽玛刀治疗时,摆位的准确性和重复性直接影响患者的放疗疗效,准确的摆位可以减少患者在放疗过程中的靶区位移,使靶区接受更精脑转移瘤伽玛刀放疗两种体位固定方式的摆位误差比较高文超a,王军良a,林鸿宇a,曹井丽a,解传滨b,戴相昆b,王超a,张征召a,张冰a 中国人民解放军总医院 a. 第五医学中心放疗科;b. 第一医学中心放疗科,北京 100071[摘 要] 目的 比较脑转移瘤伽玛刀放疗时应用热塑膜联合发泡胶和热塑膜联合负压垫两种固定方式治疗的摆位误差。
方法 选取2019年11月至2020年6月20例我院收治的脑转移瘤伽玛刀放疗患者,随机分为A组(热塑膜联合发泡胶,n=10)和B 组(热塑膜联合负压垫,n=10)。
患者分别在核磁定位后及完成首次治疗后,进行Philips大孔径CT扫描,并将两次扫描得到的CT图像传输至大图医疗软件中进行融合配准,得到x(左右)、y(前后)、z(头脚)、R x(前后旋转)、R y(头脚旋转)、R z(左右旋转)6个方向上的摆位误差,分析A、B两组体位固定的差异。
结果 A组在x、y、z、R x、R y、R z方向上的摆位误差分别为(0.07±0.04)cm、(0.08±0.05)cm、(0.08±0.04)cm、(0.46±0.39)°、(0.36±0.39)°、(0.42±0.50)°;B组在x、y、z、R x、R y、R z方向上的摆位误差分别为(0.13±0.07)cm、(0.09±0.07)cm、(0.27±0.16)cm、(1.40±1.11)°、(0.91±0.34)°、(0.83±1.14)°,A、B两组在y、R z方向的摆位误差比较,差异无统计学差异(P>0.05),A组在x、z、R x、R y方向的摆位误差小于B组(P<0.05)。
立体定向放射外科(伽玛刀)与普通放疗的区别:
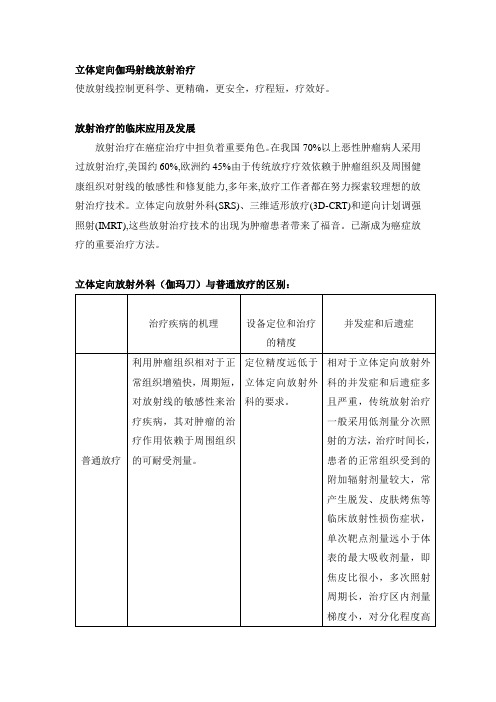
立体定向伽玛射线放射治疗使放射线控制更科学、更精确,更安全,疗程短,疗效好。
放射治疗的临床应用及发展放射治疗在癌症治疗中担负着重要角色。
在我国70%以上恶性肿瘤病人采用过放射治疗,美国约60%,欧洲约45%由于传统放疗疗效依赖于肿瘤组织及周围健康组织对射线的敏感性和修复能力,多年来,放疗工作者都在努力探索较理想的放射治疗技术。
立体定向放射外科(SRS)、三维适形放疗(3D-CRT)和逆向计划调强照射(IMRT),这些放射治疗技术的出现为肿瘤患者带来了福音。
已渐成为癌症放疗的重要治疗方法。
立体定向放射外科(伽玛刀)与普通放疗的区别:立体定向放射外科:方法简便而安全,在门诊即可完成,易为病人接受。
手术:创伤性大,病人的痛苦大,死亡率及并发症发生率较高,还有感染及出血的危险,有些深部病变根本无法手术切除。
立体定向放射治疗(SRT)与立体定向放射外科(SRS)的概念与区别:共同点:都是利用立体定向技术进行病灶定位,照射靶区的放射治疗技术。
不同点:常规分割放疗与伽玛刀治疗的关系单次大剂量对控制属于早反应组织的肿瘤有利, 伽玛刀大剂量的照射注定只能治疗较小病变,常规分割放疗时,医生可以大胆地做减量全脑照射,残灶留给后续的补充性伽玛刀消灭之。
两者可相辅相成。
头部伽玛刀的组成部分及种类:头部伽玛刀的组成:放射源、准直器、立体定向仪、计算机剂量计划系统及治疗床。
目前全世界仅有两2种头部伽玛刀产品:瑞典医科达(Elekta)公司生产的静态伽玛刀:组成:201个60Co作为放射源。
深圳奥沃国际公司(OUR。
Co.)设计生产的旋转式伽玛刀:组成:30个60Co作为放射源,采用旋转聚焦方式。
旋转式伽玛刀相对静态式伽玛刀治疗后脑水肿相对较轻。
头部伽玛刀治疗:一般不需要住院1、动静脉畸形(包括隐性者)2、转移瘤3、各种良性肿瘤:如听神经瘤、脑膜瘤、颅咽管瘤、三叉神经瘤、松果体瘤、脊索瘤、垂体瘤等。
4、胶质瘤等恶性肿瘤,5、颅内肿瘤总体的适应症,1)肿瘤最大直径<3.0cm,中线结构无移位及颅高压症状尚不明显者;2)鞍区肿瘤没有视神经受压现象者;3)脑干肿瘤在脑干中体积不超过1/4者;4)转移瘤瘤体数不超过3个月,且无严重颅高压症状者;5)颅内肿瘤术后复发,或首发肿瘤因病人高龄、体质虚弱,难以承受手术风险者。
【文献快递】立体定向放射外科治疗节细胞胶质瘤的放射影像学效果和临床结果

【文献快递】立体定向放射外科治疗节细胞胶质瘤的放射影像学效果和临床结果《Journal of Neurosurgery》杂志2022年3月25日在线发表美国、捷克、加拿大、土耳其的Georgios Mantziaris , Joshua Diamond , Stylianos Pikis , 等联合撰写的《立体定向放射外科治疗节细胞胶质瘤的放射影像学效果和临床结果。
Radiological and clinical outcomes of stereotactic radiosurgery for gangliogliomas: an international multicenter study》(doi: 10.3171/2022.2.JNS212813.)。
目的尚不清楚复发和残留的节细胞胶质瘤的最佳治疗方法。
本研究的目的旨在评价立体定向放射外科(SRS)治疗复发或残留的颅内节细胞胶质瘤的安全性和有效性。
节细胞胶质瘤是一种罕见的神经胶质组织病理肿瘤。
它们占中枢神经系统肿瘤的1%以下,通常为良性(WHO分级I级),但也可能发生非典型(WHO分级II级)和间变性(WHO分级III级)节细胞胶质瘤。
这些肿瘤多见于儿童和年轻人,通常位于颞叶,是引起肿瘤相关颞叶癫痫的最常见原因。
大体全切除术(GTR)通常提供长期的肿瘤控制,是治疗新诊断和复发病灶的选择。
尽管对辅助放射治疗的必要性还存在争议当GTR不可行时,通常采用观察或辅助放射治疗作为治疗选择。
在本研究中,我们讨论了辅助立体定向放射外科(SRS)治疗残留和复发的节细胞胶质瘤中的作用。
方法回顾性多中心研究采用SRS治疗的节细胞胶质瘤患者。
研究终点包括局部肿瘤控制和治疗后与肿瘤相关的或与SRS治疗相关的神经系统并发症发生率。
分析了与肿瘤进展和神经系统并发症发生率相关的因素。
于麻醉监护下将立体定向Leksell框架安装于取坐姿的患者头上。
年龄<18岁的在全麻下安装头架。
211225279_伽马刀联合放疗对脑转移瘤患者近期疗效及1年期生存率的影响

论著China &Foreign Medical Treatment 中外医疗伽马刀联合放疗对脑转移瘤患者近期疗效及1年期生存率的影响倪园园,王慧,曹文娟,张旭东徐州医科大学第二附属医院伽马刀科,江苏徐州 221000[摘要] 目的 分析伽马刀联合放疗对脑转移瘤患者近期疗效及1年期生存率的影响。
方法 选取2018年1月—2021年1月徐州医科大学第二附属医院收治的68例脑转移瘤患者作为研究对象,按照随机数字原则分两组,对照组34例,实施常规放疗治疗;观察组34例,实施伽马刀联合放疗。
对比两组患者的近期疗效、1年期生存率、神经功能、认知功能与生活质量。
结果 观察组近期疗效有效率(79.41%)高于对照组(55.88%),差异有统计学意义(χ2=4.300,P <0.05)。
观察组1年期生存率(73.53%)高于对照组(44.12%),差异有统计学意义(χ2=6.071,P <0.05)。
术前两组患者美国国立卫生研究院卒中量表(NHISS )评分、蒙特利尔认知评估量表(MoCA )评分比较,差异无统计学意义(P>0.05);术后3、6、12个月,观察组NIHSS 评分为(15.53±2.63)、(10.51±2.55)、(8.67±1.33)分,均低于对照组的(21.20±2.51)、(15.23±2.72)、(12.47±1.90)分,差异有统计学意义(t =9.094、7.382、7.438,P <0.05);观察组MoCA 评分分别为(21.90±2.71)、(22.62±3.50)、(28.41±3.85)分,均高于对照组的(18.22±2.40)、(19.30±3.21)、(23.90±3.42)分,差异有统计学意义(t =5.928、4.076、3.735,P<0.05)。
【文献快递】多中心一线放射外科治疗与全脑放射治疗小细胞肺癌脑转移瘤的对比评估

【文献快递】多中心一线放射外科治疗与全脑放射治疗小细胞肺癌脑转移瘤的对比评估《JAMA Oncology》杂志. 2020 年6月4日刊载美国、日本、加拿大、德国、瑞士等国的Chad GRusthoven , Masaaki Yamamoto , Denise Bernhardt ,等34位学者联合撰写的《一线放射外科治疗与全脑放射治疗小细胞肺癌脑转移瘤的对比评估:FIRE-SCLC(一线放射外科治疗小细胞肺癌)队列研究。
Evaluation of First-line Radiosurgery vs Whole-Brain Radiotherapy for Small Cell Lung Cancer Brain Metastases: The FIRE-SCLC Cohort Study》(doi:10.1001/jamaoncol.2020.1271.)。
要点问题对于小细胞肺癌的脑转移瘤,仅采用立体定向放射外科治疗有哪些结果?这些结果与标准的全脑放疗方法如何比较?发现在对710例接受一线立体定向放射外科治疗的小细胞肺癌脑转移瘤患者的队列研究中,中位总生存期为8.5个月,出现中枢神经系统进展的中位时间为8.1个月。
在控制了多种预后因素后,全脑放疗(相比立体定向放射外科)与出现中枢神经系统进展的时间上占优相关,但没有提供总体生存获益。
意义这项研究为立体定向放射治疗的结果提供了一个基准,并提示这种单独治疗是小细胞肺癌患者的一个潜在选项。
【介绍】在SRS治疗联合或不联合全脑放疗(WBRT)多项3期随机临床试验后,立体定向放射外科(SRS)已经确立为一线治疗脑转移有限个数脑转移的方法,共同证明,尽管观察到WBRT在中枢神经系统(CNS)控制方面有出色表现.但在SRS治疗中增加WBRT,没有总体生存期的获益。
由于缺乏总体的生存优势以证明有WBRT对认知功能和生存质量的毒副作用影响,使单纯SRS治疗在大多数情况下成为有限脑转移瘤的首选治疗方法。
立体定向放射外科

立体定向放射外科立体定向放射外科(stereotaxic radio surgery,SRS)作为一种特殊的治疗手段,在临床中应用越来越广泛,其安全性及有效性得到了医学界的广泛认可,但SRS有其严格的应用指征,只有严格掌握适应证,才能在尽可能降低并发症的前提下发挥最大功效。
SRS是立体定向神经外科技术与放射治疗学相结合而形成的一门新兴学科,属于立体定向外科学范畴。
SRS的概念最早于1951年由瑞典神经外科专家Leksll提出,是指利用立体定向技术对颅内靶点进行精确定位,再用单次大剂量放射线集中照射靶组织,使之产生特殊的放射生物学效应而发生局灶性坏死,从而达到类似外科手术的效果。
SRS自20世纪50年代开始临床应用以来,经历了50多年的发展,近10年来随着医学影像学和计算机技术的迅速发展,SRS技术被广泛用于治疗神经外科疾病,并发展为神经外科的重要组成部分,为神经外科医生提供了一种成熟、可靠的治疗手段。
与传统的神经外科开颅手术相比,SRS治疗具有无创伤、不出血、不需全麻、治疗时间短、定位精确、对颅内重要功能区损伤小、术后并发症少等特点。
经国内外大量临床实践证明,SRS对某些颅脑疾病疗效肯定,甚至可以达到超过显微外科手术的治疗效果,但采用SRS技术治疗颅内疾病也存在很多不足和需要探讨之处,如不易明确病变性质、治疗后显效缓慢、不能尽快解除占位效应、脑动静脉畸形闭塞缓慢、某些疾病治疗后有发生脑水肿可能等,这些都是我们今后需进一步深入研究解决的问题。
(一)立体定向放射外科的放射物理学及放射生物学基础SRS的放射物理学及放射生物学知识是相当复杂的,有关这方面的介绍比较少,这里只对临床上经常涉及到的问题简单做一阐述。
1.放射物理学基础要提高肿瘤放射治疗的效果,必须提高其治疗的增益比,即最大限度地将射线集中到病变内,杀死肿瘤细胞,而使周围正常组织和器官少受或免受不必要的照射,这正是肿瘤放射治疗的目标。
近年来,随着影像诊断与放疗技术的进步,开展了三维适形放射治疗,这在肿瘤放射治疗方面可以说是一大进步,是放射肿瘤治疗学上的一项重要变革。
【文献快递】双盲评估基于治疗指证的伽玛刀放射外科治疗脑内海绵状血管瘤的疗效

【文献快递】双盲评估基于治疗指证的伽玛刀放射外科治疗脑内海绵状血管瘤的疗效《Radiation Oncology》杂志2021年8月28日刊载[16(1):164.]台中荣民总医院的 Chiung-Chyi Shen, Ming Hsi Sun, Meng-Yin Yang,等撰写的《双盲评估基于治疗指证的伽玛刀放射外科治疗脑内海绵状血管瘤的疗效。
Outcome of intracerebral cavernoma treated by Gamma Knife radiosurgery based on a double-blind assessment of treatment indication》(doi: 10.1186/s13014-021-01885-4. )。
背景:仍然不完全确定伽玛刀放射外科(GKRS)治疗脑内海绵状血管瘤的益处和风险,部分原因是这种血管畸形的出血发生率低和自行退缩的自然史( the natural history of low incidence of bleeding and spontaneous regression)。
在本研究中,我们从前瞻性收集的数据库中检索病例,以评估使用GKRS治疗的脑内海绵状血管瘤的结果,使用双盲审查程序进行治疗(using a double blinded review process for treatment)。
根据大量的尸检和前瞻性队列研究,在一般人群中,脑内海绵状血管瘤(CM)并不常见,患病率在0.3 - 0.6%之间。
脑内海绵状血管瘤的发病率增加(患病率0.4- 0.9%)主要是由于在临床实践中使用磁共振成像(MRI)的广泛的诊断方面的进步。
CM患者可出现癫痫发作(占病例的23-50%)、头痛(6-52%)、局灶性神经系统功能障碍(20-45%)或出血(9-56%)。
永久性神经功能障碍的程度与反复出血的次数高度相关,发作再次出血往往以进行性较短的时间间隔发生(re-bleeding episodes tend to occur at progressively shorter time intervals)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【文献快递】伽玛刀立体定向放射外科治疗脑转移瘤后长期生存者放射性坏死的预测因子
《Neurooncology Practice》 杂志2020年7月刊载[ Jul;7(4):400-408.]美国密歇根洲Beaumont Health System的Zaid A Siddiqui ,Bryan S Squires ,Matt D Johnson ,等撰写的《伽玛刀立体定向放射外科治疗脑转移瘤后长期生存者放射性坏死的预测因子。Predictors of radiation necrosis in long-term survivors after Gamma Knife stereotactic radiosurgery for brain metastases 》(doi: 10.1093/nop/npz067. )。
背景 尚不清楚放射外科治疗脑转移瘤后坏死的长期风险。我们的目的是调查脑转移瘤放射治疗后生存超过1年的患者放射性坏死的发生率和预测因素。 脑转移瘤在癌症患者中较为常见,估计发病率高达17%。过去对这些病灶的治疗包括类固醇、全脑放疗(WBRT)和切除术,后者被证明对有单一转移留的患者的生存有利。此后,立体定向放射外科(SRS)作为一种安全有效的治疗方法,包括与手术、全脑放疗联合使用或单独使用时,在各种临床方案中建立了长期的记录。重要的是,有证据表明,使用SRS代替WBRT不会导致生存损害,且能降低毒性副作用。虽然放射外科早期的经验集中在少数转移瘤的患者(少于4处),但最近的数据表明,中度疾病负荷的患者单独使用放射外科治疗也有很好的效果。这些数据使得SRS在治疗脑转移瘤患者中的应用越来越多。脑转移瘤患者的较长生存期也使他们暴露于直接针对颅脑的治疗的晚期毒性。虽然神经认知能力下降是WBRT的一个可怕的晚期并发症,但SRS通常保留认知能力。SRS治疗后最相关的晚期并发症是放射性坏死。放射性坏死在两个方面会带来挑战。首先,它给治疗医师提出了一个诊断难题,他们必须决定在监测影像上肿块的扩大或水肿的增加是否代表治疗效果或肿瘤进展。更严重的是,放射性坏死可能是由于附近皮质功能中断而引起的症状,可能危及生命。放射性坏死通常可以通过保守治疗加以控制,而有症状的坏死则可能需要手术干预。以前关于放射性坏死的报道集中于所有的患者,包括放射治疗后生存时间短的患者。随着诊断特异性分级预后评估(ds-GPA)在脑转移瘤患者中的验证,我们现在可以预先预测不同组患者的中位生存其;诊断特异性分级预后评估(ds-GPA)高于3分的患者往往生存时间超过1年。我们假设在这些长期生存者中,迟发放射性坏死的发生率被低估了。本研究旨在探讨放射外科治疗脑转移瘤后生存期延长的患者放射性坏死的发生率及危险因素。 方法 回顾性分析2006年12月至2014年12月间诊断为脑转移瘤的患者,并对首次放射外科治疗后生存至少1年的患者进行回顾性分析。使用Kaplan-Meier预估程序分析生存率,并以死亡或手术切除作为竞争风险来估计放射性坏死的发生率。同时分析与放射性坏死有关的患者和治疗因素。 我们对2006年12月至2014年12月在 William Beaumont Hospita接受伽玛刀放射外科治疗的患者的前瞻性的医院结果数据库进行回顾性分析,这些患者在接受脑转移瘤放射外科治疗后至少存活了1年。对所有患者都采用我们之前报道过的Leksell 4C (Elekta)型伽玛刀治疗。医院的伦理审查委员会批准了该项目。 使用前瞻性机构数据库和患者的电子图表和纸质图表进行交叉参照,收集了患者的年龄、性别、诊断日期、颅内转移的日期以及给予WBRT的日期和剂量等数据。伽玛刀放射外科治疗参数包括靶区体积、肿瘤位置、处方体积、处方剂量、处方等剂量线,以及靶区部位是空腔还是完整的病灶也从前瞻性收集的数据表中收集。为了本研究的目的,我们回顾性收集了同步全身治疗的数据(重叠或在放射外科治疗90天内开始)。放射性坏死是前瞻性的记录在我们的队列患者,和其他关于诊断和治疗的数据是回顾性的。 坏死的诊断是基于排除疾病进展后的临床和诊断性影像学表现或手术切除时的组织病理学表现。诊断方法分为5类。第一项是基于标准对比/液体衰减反转恢复MRI,显示病变扩大,随后对类固醇有反应,而无需进一步治疗。第二项是在先前标准的基础上增加MR灌注。第三种是将波谱学加入到MRI中。第四种是同时加入灌注和波谱学。我们医院对坏死的灌注和波谱学标准已经在以前描述过,包括相对脑血容量、信号强度恢复百分比、胆碱:肌酸比值、胆碱:N -乙酰天冬氨酸比值、代谢产物与正常脑的相对比值的测量。第五种诊断方式是手术活检(确认坏死为主,病变中无活的细胞或有无关精要的[insignificant]细胞)。 对毒性分级按如下进行:1级是单纯影像像变化,2级指要求任何药物治疗(地塞米松,维生素E, 己酮可可碱[pentoxifylline]、贝伐珠单抗或高压氧)3级指需要手术的,4级指有需要重症监护级别医疗的症状,和5级是死亡。值得注意的是,这一分级并不完全依赖于症状,因为一些治疗是由于影像学表现而开始的,我们认为对放射性坏死的任何治疗方法的捕获都能更好地抓住这一事件的负荷。 结果 分析198例患者的732个病灶。34个病灶需要行抢救性放射外科治疗,10个病灶需要行手术治疗。平均随访时间为24个月。估计该人群的中位生存期为25.4个月。估计每一个病灶4年放射性坏死的发生率为6.8%。60%的坏死事件需要药物或手术治疗。肿瘤体积和男性性别是影响放射性坏死的重要因素。4年后再次接受放射外科治疗的患者的每个病灶的坏死发生率为33.3%。 在第一次伽玛刀放射外科治疗后,我们的数据库产生了198例732个转移瘤病灶,并进行了1年的随访。平均每位患者随访时间23.8个月,平均病灶随访时间20.6个月,其中694个(94.5%)病灶随访12个月以上。患者及肿瘤特征见表1。 最常见的原发肿瘤部位是肺、乳腺和黑色素瘤。78例(39%)患者接受了WBRT治疗。对于有剂量信息的72例患者,中位剂量为35Gy。除5名患者外,所有患者都有WBRT时间信息。在这些患者中,39例患者在首次放射外科治疗前接受了WBRT治疗,中位接受放射治疗时间为10.3个月(范围0.2-23.7个月),34例患者在首次放射外科治疗后接受WBRT治疗,中位接受WBRT时间为11.7个月(范围0.3-52.2个月)。732个病灶中有68个为切除术瘤腔。 对31个病灶进行了重复的放射外科治疗。重复放射治疗的中位时间为12.6个月(范围1.4-29.7个月)。 表2列出了完整相比切除术瘤腔以及先期(upfront)相比再程治疗的分层的各个病变的放射外科参数。一般情况下,再次治疗的病变较大,切除术瘤腔也较大。这些病变通常也用较低剂量治疗。同时全身性治疗包括9例(23个病灶)采用抗表皮生长因子受体(EGFR)治疗,10例(56个病灶)采用抗人表皮生长因子受体2 (HER2)治疗,其余患者采用常规细胞毒性治疗。2例患者(5个病灶)在90天内给予免疫治疗(伊匹单抗ipilimumab)。
732个病变接受初始SRS治疗, 44例患者经历放射性坏死事件,,因为病人死亡竞争风险,413个病灶接受回顾审查,10个因为手术抢救的竞争风险接受回顾审查,,31个因为重复放射治疗的竞争风险,接受回顾审查,和234个因为研究期间随访结束接受审查。
以每位患者为基础,在我们的人群中,198例患者中有49例经历了放射性坏死事件。MRI及临床判断5例,MRI及灌注7例,MR及波谱学2例,MRI、灌注及波谱学31例,手术切除10例。22次事件的毒性等级为1级,23次事件为2级,10次事件为3级。无4级或5级事件。 Kaplan-Meier估计中位总体生存期为25.2个月(95% CI: 22.9-28.4个月)。生存曲线如图1A所示。点图(point)估计2年、3年、4年和5年生存率分别为52.8%、33.4%、22.1%和16.6%。图1B显示,放射性坏死患者的生存时间比非放射性坏死患者的生存时间长(P = 0.02)。
前5年估计的坏死的累积发病率分别为2.9%,4.9%,6.2%,6.8%,和6.8%(图2)。31个接受再次治疗的病变,11个有放射性坏死,15个因为病人死亡的竞争风险,,2个因为手术抢救的竞争风险,和3个因为研究期间随访结束,接受审查。在本研究的随访中,所有纳入分析的病灶都未发生第二次放射外科治疗后的再次治疗事件。在首次放射治疗后的头4年再次治疗的发生率分别为6.5%,16.5%,31.6%和36.3%(再次治疗组中无5年生存者)。
为了找到初始SRS队列中放射性坏死的预测因子,我们运行了3个精细和灰色次分布比例风险模型( Fine and Gray Subdistribution Proportional Hazards models)(表4):模型1使用了前瞻性的伽玛刀参数,模型2添加了系统治疗信息。系统治疗考虑的是抗EGFR或抗HER2治疗,因为只有2例患者(5个病灶)在放射外科治疗后的3个月内接受了免疫治疗。模型也运行重复放射外科治疗的损伤。肿瘤体积是前期坏死风险的一个有效的连续预测因子。在所有的模型中,女性对坏死都有保护作用。由于女性对放射性坏死有很强的保护作用,我们建立了一个不考虑性别的单独模型来评估性别是否掩盖了乳腺癌组织学的影响;然而,组织学的回归系数在统计学上仍然不显著(数据未显示)。此外,使用累积剂量而不是第二次放射治疗剂量来运行复发病灶模型,显示累积剂量仍然没有统计学意义(数据未显示)。组织学、全脑照射、手术瘤腔与完整病变的治疗都不能预测坏死。同时全身治疗类型与坏死风险无相关性;然而,由于危险病变太少,并发免疫治疗没有建模。分界点( Cut point)分析表明,0.305cc为坏死最具预测价值的肿瘤体积阈值。肿瘤体积大于或小于该阈值时坏死的危险比为4.66。
讨论 我们的长期生存存者队列揭示了脑转移瘤治疗后有放射性坏死的相当大的负担。我们发现,在头4年的随访中,放射性坏死
