碳酸氢钠含量的测定(去除了碳酸钠干扰)
测定小苏打片中碳酸氢钠的含量(硼砂版).ppt

实验目的
ⅰ:掌握药用小苏打片中碳酸氢钠含 量的测定 ⅱ:正确掌握滴定终点的方法和滴定 步骤 ⅲ:熟练使用容量瓶、移液管 ⅳ:巩固分析天平的使用和滴定操作 ⅴ:培养独立分析问题的能力
仪器材料与试剂
仪器:分析天平、酸式滴定管(50mL)、 容量瓶(25℃、250mL)、移液管(25mL) 、锥形瓶(250mLX3)、烧杯(50ml、 200ml、1000mL)、量筒(10mL、500mL) 、试剂瓶(500mL)、洗瓶、玻璃棒、洗 耳球。 材料与试剂:6mol/L浓盐酸、 甲基红 、甲基橙、小苏打片(4片)、蒸馏水, 硼砂。
实验原理1
用硼砂标定HCL溶液时,反应如 下:
指示剂,有下列关系 化颜色由黄色变为微 红色。
2HCl+Na2B4O7*10H2O=4H3BO3+2 NaCl+5H2O 用HCl标准溶液滴定配置出 来的Na2B4O7*10H2O溶液,用甲基红作
W(NaHCO3)=
c ( N a H C O 3 ) V ( 总 ) M ( N a H C O 3 ) 1 0 0 % m ( 样 品 )
甲基橙在PH>4.4显黄色.PH<3.1显红色 .3.1~4.4显橙色. 滴定NaHCO3甲基橙加在NaHCO3溶液中显
实验步骤2
1、用分析天平称取2片小苏打片,将样 品在小烧杯中加入少量蒸馏水溶解, 转移至容量瓶中配置成250.00ml溶液 ,用 HCl标准溶液润洗酸式滴定管,装 HCl标准溶液至酸式滴定管中至0刻度 ; 2、用移液管转移20ml小苏打溶液至锥形 瓶中并滴入2滴甲基橙; 3、用HCl标准溶液对小苏打溶液进行滴 定,待溶液由黄色变为橙红且30s不退 色即为终点。 4、按照上面步骤重复实验2次,按下表 记录实验数据:
碳酸氢钠片中NaHCO含量的测定ppt课件

pH <3.1
>4.4
橙色
黄色
甲基红-溴甲酚绿,变色范围 4.9~5.1,何时使用?
pH <4.9
> 5.1
紫红色 (灰绿) 绿色
酚酞,变色范围8.2~10.0,强碱中和弱酸时使用
pH <8.2
>10.0
无色
红色
6
背景知识与实验原理
4. 实验原理
中和滴定反应:
NaHCO3 + HCl = NaCl + CO2↑+ H2O
碳酸氢钠片含量的测定
每人一组,平行测定三次
1
实验目的
了解碳酸氢钠片中NaHCO3含量的测 定方法及原理。
掌握滴定分析的基本操作。 加强理性思维能力,学以致用。
2
药品
碳酸氢钠溶液 aqueous solution of sodium bicarbonate
盐酸标准溶液 aqueous standard solution of hydrochloric acid
甲基红-溴甲酚绿 methyl red and bromocresol green
3
acid burette
仪器
pipette
酸式滴定管
移液管 烧杯
锥形瓶
conical flask
beaker
4
背景知识与实验原理
1. NaHCO3的物理化学性质
1.1 固体50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水. 1.2 是强碱弱酸的酸式盐,溶于水时呈现弱碱性。
13
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
14
容量瓶的使用:配制溶液时的定容操作
混合碱中碳酸钠和碳酸氢钠含量的测定演示教学

混合碱中碳酸钠和碳酸氢钠含量的测定实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1.了解双指示剂法测定混合碱的原理;2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理混合碱试样溶液(含Na 2CO 3、NaHCO 3) ↓酚酞指示剂 红色↓HCl 溶液滴定(V 1mL )无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3)↓溴甲酚绿-二甲基黄指示剂(混合指示剂) 绿色↓HCl 溶液滴定(V 2mL )亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)100001.84))((%10000.106)(%123132⨯⨯-=⨯⨯=s s m V V HCl c NaHCO m V HCl c CO Na又 Na 2O+CO 2=Na 2CO 3 n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl 所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl1000))((21%212⨯+=s m V V HCl c O Na三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:mL g 1000试样00.50定容定量转溶解−−→−−−−→−−−→−移 2.试样溶液的测定及数据处理[已知c(HCl)= mol·L -1]。
混合碱中碳酸钠和碳酸氢钠含量的测定

实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1.了解双指示剂法测定混合碱的原理;2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理混合碱试样溶液(含Na 2CO 3、NaHCO 3)↓酚酞指示剂 红色↓HCl 溶液滴定(V 1mL)无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),(cV 1)HCl =n (Na 2CO 3)=n 1(NaHCO 3) ↓溴甲酚绿-二甲基黄指示剂(混合指示剂) 绿色↓HCl 溶液滴定(V 2mL )亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)100001.84))((%10000.106)(%123132⨯⨯-=⨯⨯=s s m V V HCl c NaHCO m V HCl c CO Na又 Na 2O+CO 2=Na 2CO 3n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O )=n (2NaHCO 3)=1/2n (NaHCO 3)=1/2c (V 2-V 1)HCl 所以 n (NaO )=n 1(Na 2O)+n 2(Na 2O )=1/2c (V 1+V 2)HCl1000))((21%212⨯+=s m V V HCl c O Na三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:mL g 1000试样00.50定容定量转溶解−−→−−−−→−−−→−移 2.试样溶液的测定及数据处理[已知c(HCl )= mol·L —1]。
小 苏打 片中 碳酸 氢钠 含量 的测 定

LOGO
3
ω(NaHCO3)
ω平均(NaHCO3)
Page 11
相对偏差%
实验结果与讨论
LOGO
1.标定用的一级标准物质应该具备哪些条件? 2.酸碱指示剂选择的原则是什么? 3.标准溶液的配制方法有哪些?
Page
12
定
Page
2
LOGO
实验原理
i.由于盐酸易挥发,不能用直接法配制标准溶液,只能先 配成近似浓度的溶液,再用一级标准物质硼砂标定。当盐酸 滴定一级标准物质硼砂,到达反应终点时,用消耗HCl的量及
一级标准物质硼砂的质量可计算出HCl的标准浓度。再根据
HCl与碳酸氢钠反应即可求出小苏打中碳酸氢钠的含量
Page
9
数据记录及处理
1.1硼砂标定HCL溶液
项目 m(Na2B4O7· H2O)/g
V(HCL)初 读数/ml V(HCl) 终 读数/ml
LOGO
1
2
3
△V(HCl)/ml
C(HCl)/mol/L C平均(HCl)/mol/L
相对平均偏差%
Page 10
数据记录及处理
1.2标定的HCL溶液滴定待测溶液 项目 待测溶液/ml V(HCL)初 读数/ml V(HCl) 终 读数/ml △V(HCl)/ml 1 2
7
Page
实验步骤
3.HCL标准溶液的直接标定
LOGO
取一支50ml酸式滴定管,按照滴定管的基本操作要求做 好准备。用配好的的HCL标准溶液润洗滴定管3次,装满至 “0”刻度线以上检查有无气泡调至零刻度线。用移液管吸 取25.00ml硼砂溶液放入250ml的洁净锥形瓶内,加甲基红 指示剂1-2滴,用HCL标准溶液滴至从黄色变为微红色为止, 记录读数。重复2次,根据3次滴定结果,计算出HCL的准确 浓度。 在分析天平称取小苏打片用分析天平称量约1.0-1.2g (精确至±0.0001g)置于200ml烧杯中,加20-30ml去离子 水溶解后转入250ml的容量瓶中,定容至刻度线,摇匀
碳酸氢钠中碳酸钠含量测定

碳酸氢钠中碳酸钠含量测定哎呀,今天咱们聊聊碳酸氢钠里的碳酸钠含量测定。
说到碳酸氢钠,可能很多人第一反应就是咱们厨房里那包白白的泡打粉。
你知道吗?这玩意儿不仅能让蛋糕蓬蓬松松的,还在化学上有一番大作为呢。
你可能会问,碳酸钠是什么鬼?别着急,咱慢慢来。
碳酸钠其实就是我们常说的苏打,泡泡水里那个带劲的东西。
咱们先来讲讲怎么测定碳酸氢钠中含有多少碳酸钠。
你得准备一堆东西,像是烧杯、试管,当然还有那些化学试剂。
这就像做饭,得有配料才行。
你需要一杯碳酸氢钠溶液,简单来说就是把那白粉溶在水里。
然后,把它放到热水里加热,慢慢地,别急,这时候泡沫开始冒出来,就像炸了的油条,哇,好看得很。
随着水分蒸发,剩下的就是碳酸钠。
你看,这过程是不是很像魔法?魔法不离生活,对吧?接着咱们得使用酸碱指示剂。
你可能不知道这个指示剂啥意思,其实就是一种能变颜色的液体。
就像调色板里的颜料,加入一点就能看到颜色的变化。
把这个指示剂滴到咱们的碳酸钠溶液里,看它变成什么颜色。
一般来说,碱性溶液是蓝色,酸性就是红色。
这时,你要用酸滴到碳酸钠溶液里,观察变化。
这个过程就像调味料的比拼,谁能让它的味道更好?只要找到颜色变化的临界点,哇,那一瞬间就像找到了宝藏一样。
好了,测量完之后,你可以通过公式计算出碳酸钠的含量。
这个公式嘛,听起来有点复杂,但其实就像算账一样,简单的加减乘除,谁都能学会。
把你得到的数据带回家,跟朋友们一炫耀,立马成了化学小达人,绝对让人眼前一亮。
别以为测定碳酸钠就这么简单,实际上每一步都有讲究。
比如说,水温、溶液浓度,甚至是搅拌的速度,都是影响结果的重要因素。
就像煮汤,火候不对,味道就不行。
所以,实验的时候要细心,别马虎哦。
现在,想想你家里的碳酸氢钠,也许下次做饼干的时候,能不知不觉地算一算碳酸钠的含量。
这不仅能让你的烘焙更上层楼,还能让家人惊叹你的小聪明。
想想那一张张吃惊的脸,哈哈,真是太妙了。
哎,化学其实并不神秘,生活中的很多事情都和它息息相关。
混合碱中碳酸钠和碳酸氢钠含量的测定
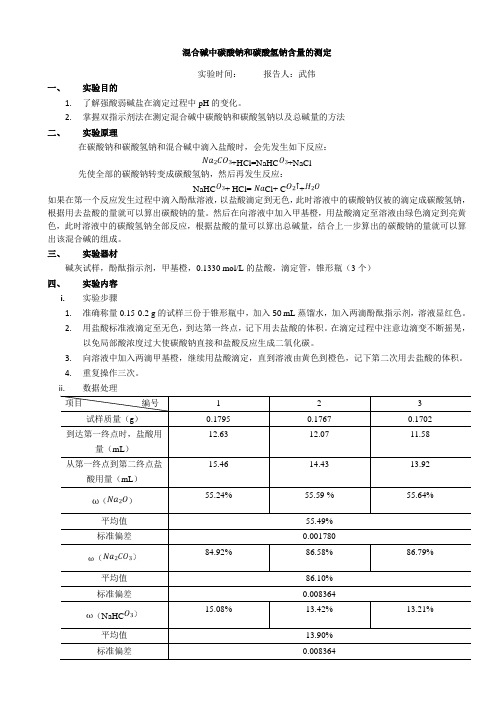
混合碱中碳酸钠和碳酸氢钠含量的测定实验时间:报告人:武伟一、实验目的1.了解强酸弱碱盐在滴定过程中pH的变化。
2.掌握双指示剂法在测定混合碱中碳酸钠和碳酸氢钠以及总碱量的方法二、实验原理在碳酸钠和碳酸氢钠和混合碱中滴入盐酸时,会先发生如下反应:+HCl=NaHC+NaCl先使全部的碳酸钠转变成碳酸氢钠,然后再发生反应:NaHC+ HCl=Cl+ C+如果在第一个反应发生过程中滴入酚酞溶液,以盐酸滴定到无色,此时溶液中的碳酸钠仅被的滴定成碳酸氢钠,根据用去盐酸的量就可以算出碳酸钠的量。
然后在向溶液中加入甲基橙,用盐酸滴定至溶液由绿色滴定到亮黄色,此时溶液中的碳酸氢钠全部反应,根据盐酸的量可以算出总碱量,结合上一步算出的碳酸钠的量就可以算出该混合碱的组成。
三、实验器材碱灰试样,酚酞指示剂,甲基橙,0.1330 mol/L的盐酸,滴定管,锥形瓶(3个)四、实验内容i.实验步骤1.准确称量0.15-0.2 g的试样三份于锥形瓶中,加入50 mL蒸馏水,加入两滴酚酞指示剂,溶液显红色。
2.用盐酸标准液滴定至无色,到达第一终点,记下用去盐酸的体积。
在滴定过程中注意边滴变不断摇晃,以免局部酸浓度过大使碳酸钠直接和盐酸反应生成二氧化碳。
3.向溶液中加入两滴甲基橙,继续用盐酸滴定,直到溶液由黄色到橙色,记下第二次用去盐酸的体积。
4.重复操作三次。
ii.数据处理()((NaHC五、思考题1.本实验用酚酞做指示剂时,所消耗的盐酸较用甲基橙少,为什么?因为用酚酞做指示剂时只是盐酸和碳酸钠反应,而用甲基橙做指示剂时,是上一步反应完的生成的碳酸氢根和溶液中本身存在的碳酸氢根的和来反应,反应的比例又相同,所以第二次总会多一点。
2.在总碱量的计算式中,V有几种求法?如果只要求测定总碱量,实验应该怎样做?V表示用去盐酸的总体积,可以直接读出来;如果只要求测定总碱量,只需要用甲基橙做指示剂,滴定至橙色。
3.在测定一批烧碱或碱灰样品时,若分别出现的情况,说明样品的4.滴定管和移液管使用前均需要用操作溶液荡洗,而滴定用的烧杯或锥形瓶为什么不能用待测液润洗?因为滴定管的移液管要求里面的溶液的浓度一定要准确,所以要润洗,避免内壁的水珠对溶液的稀释;而烧杯或锥形瓶要求里面的总物质的量要准确,所以不可以润洗,避免液体挂在内壁上。
实验08-混合碱中碳酸钠和碳酸氢钠含量的测定

实验八混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1、掌握采用双指示剂法测定混合碱中碳酸钠和碳酸氢钠含量的原理和方法。
2、巩固酸碱滴定的有关知识。
二、实验原理(双指示剂法)在混合碱试液中先加入酚酞指示剂,用HCl标准溶液滴定至由红色刚好变为无色,达到第一终点。
此时NaCO3被滴定生成2NaHCO3,用去酸的体积为V1(mL),反应式为:NaOH+HCl= NaCl+H2ONa2CO3+HCl= NaHCO3+NaCl然后加入甲基橙指示剂,继续用HCl标准溶液滴定至由黄色变为橙色,达到第二终点。
所消耗酸的体积为V(mL)。
此时2NaHCO3全部被滴定,产物为H2CO3(CO2+H2O),反应式为:NaHCO3+HCl=NaCl+H2CO3CO2+H2ONa 2CO 3为多元碱,能被强酸准确滴定的条件是:cK b ≥10-8能分步滴定的条件是:K b1 /K b2≥104Na 2CO 3的K b1=2.08×10-4,K b2=2.33×10-8,K b1 /K b2≈104。
所以Na 2CO 3第一步离解产生的OH -可勉强被分步滴定,有一个突跃,理论终点时产物NaHCO 3为两性物质,故第一终点时:8106.5102.4lg KK lg 11721≈×××−=×−−−ΘΘa a pH =第二终点时:9.3102.404.0lg K c lg 71≈××−=⋅−−Θa pH =三、实验步骤(1)准确称取混合碱样品4.5~5.0 g于150 mL烧杯中,加50 mL蒸馏水溶解。
然后定量转移至250 mL容量瓶中,加蒸馏水至刻度,摇匀。
(2)用25 mL移液管移取试液25.00mL置于250mL锥形瓶中,加入1~2滴酚酞指示剂,用HCl标准溶液滴定至红色恰好消失,(mL);然后加入1~2滴甲基橙指示剂,继续记下HCl用量V1用HCl标准溶液滴定至溶液由黄色变为橙色,记录HCl溶液的体(mL)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳酸氢钠含量的测定
酸碱滴定,目视终点测试
1. 范围
测定1-170mg的碳酸氢钠含量,碳酸钠将不会产生干扰。
不存在其他碳酸盐。
1.1样品量
1g
1.2所需时间
15分钟
阿克苏诺贝尔公司将不承担由于使用本方法而引起的负面结果的任何责任。
使用者在使用本方法之前,应事先了解在该报告中提到的产品,试剂和仪器对他自己是否适用。
2. 原理
碳酸氢盐溶解在水中,加入过量的氢氧化钠中和。
过量的氢氧化钠溶液用盐酸标准溶液滴定,用酚酞作指示剂。
碳酸盐引起的干扰,可以通过转换成BaCO3来消除。
3. 仪器
--
4. 试剂
除非另有说明,均为分析纯试剂
盐酸溶液: 0.1N滴定液(制备和标定,见SMA Ti/90.2)
氢氧化钠溶液: 0.1N
氯化钡溶液: 100g/l
酚酞溶液: 1g/l 溶解在96% V/V的乙醇中。
5. 样品
样品应完全混合均匀
6. 步骤
准确称取约150mg(精密到0.1mg)样品于200ml 锥形瓶中。
加入25ml水,溶解样品。
准确加入25.00ml 0.1N NaOH 溶液,立刻加入10ml 100g/L BaCL2溶液和 几滴酚酞溶液。
立即用0.1N HCl 标准溶液,滴定过量的氢氧化钠,直至溶液由粉红色变成无色。
同时做一个空白。
7. 结果报告
7.1计算
碳酸氢钠含量(% m/m )=
m N V V 10000.84)-12⨯⨯⨯(
式中: V1=滴定样品消耗盐酸溶液的ml 数
V2=滴定空白消耗盐酸溶液的ml 数
N=盐酸溶液的浓度
m=样品的质量,mg
7.2统计
-
7.3报告
酸度含量报告接近于0.1% m/m
8. 注释
8.1较前版的变化如下:
-
对版本的布局和内部风格上有所改变。
9. 文献
9.1参考标准 9.1.1 SMA Ti/90.2
10. 图表
-。
