第四章酶的来源与筛选..
酶的筛选方法

酶的筛选方法酶,这玩意儿可神奇啦!就好像是化学反应中的小精灵,能让很多事情变得轻而易举。
那怎么筛选出我们需要的酶呢?嘿,这可得好好说道说道。
你想想看,酶就像是一把钥匙,得找到那把能开特定锁的钥匙才行。
我们得有各种方法来找出它。
比如说,咱可以从大自然中去寻觅呀。
大自然就像一个巨大的宝库,里面说不定就藏着我们想要的酶呢。
去那些特别的环境里,比如热泉啦、深海啦,在那些极端的地方,说不定就有独特的酶在等着我们发现。
这就好比去挖宝藏,你不知道下一秒会挖出啥宝贝来,但就是充满了期待,对吧?然后呢,还可以通过培养微生物来筛选酶。
微生物可是个大家族,里面的酶种类繁多。
就像一个大超市,你可以在里面尽情挑选。
培养不同的微生物,看看它们能产生什么样的酶,这不就像在超市里逛来逛去,找自己喜欢的东西一样嘛。
还有啊,我们可以根据酶的特性来筛选。
酶都有自己的脾气和特点呢,有的喜欢高温,有的喜欢低温,有的在酸性环境里活跃,有的在碱性环境里更来劲。
我们就根据这些特点,设置合适的条件,把那些符合要求的酶给挑出来。
这就好像是给酶们举办一场考试,只有符合条件的才能通过,是不是很有意思?再说说利用基因工程的方法。
这可高级啦!就像是给酶来个定制,按照我们的要求去打造酶。
可以对酶的基因进行改造,让它变得更符合我们的需要。
这就好像给一辆汽车改装,让它跑得更快、更稳。
筛选酶的过程可不简单,需要我们有耐心、有智慧。
就像钓鱼一样,得静静地等,还得知道用什么鱼饵才能钓到想要的鱼。
而且有时候可能试了很多次都不成功,但别灰心呀,说不定下一次就成功了呢!总之呢,酶的筛选是个有趣又充满挑战的事情。
我们要像探险家一样,在酶的世界里勇敢前行,找到那些能为我们所用的酶。
这不仅能帮助我们解决很多实际问题,还能让我们对生命的奥秘有更深的了解。
所以呀,让我们积极地去探索、去尝试吧,说不定会有很多惊喜等着我们呢!原创不易,请尊重原创,谢谢!。
酶的来源介绍

酶的生产目前只宜直接从生物体中提取分离。 早期酶的生产多以动植物为主要原料,如激肽释放酶、菠萝蛋白酶、 木瓜蛋白酶。 近10年来,研究发展了动植物组织培养技术,但周期长、成本高。 工业生产一般都以微生物为主要来源。目前使用的千余种商品酶, 大多数是微生物生产的。
二、酶的来源
利用微生物生产酶制剂,其特点是: 1. 微生物种类繁多,凡是动植物体内存在的酶,几乎都年从微生物中
三、酶的产生菌
目前常用的产酶微生物:
1. E.coli :是应用最广泛的产酶菌。分泌胞内酶,经细胞破碎分离得 到。在工业上用于生产谷氨酸脱羧酶、天门冬氨酸酶、青霉素酰化酶、β-半 乳糖苷酶。
2. 枯草杆菌:主要用于生产α-淀粉酶、β-葡萄糖氧化酶、碱性磷酸酯 酶。
3. 啤酒酵母:丙酮酸脱羧酶、乙醇脱氢酶等。 4. 曲霉(黑曲霉和黄曲霉):主要生产糖化酶、蛋白酶、淀粉酶、果 胶酶、葡萄糖氧化酶、氨基酰化酶和脂肪酶。 5. 其他产酶菌:青霉菌、木霉菌、根霉菌、链霉菌等。
A-L-Ala A-D-Ala
储 罐
固定化 酶柱子
泵
离心机
反应产物 L-Ala A-D-Ala
晶体 L-Ala
消旋 反应器
三、酶的产生菌
生产菌的来源:
1. 菌种保藏机构和有关研究部门获得; 2. 大量要从自然界中分离筛选;自然界是产酶菌种的主要来源,土壤、 深海、温泉、火山、森林等都是菌种采集地。
筛选产酶菌的方法:采集、菌种的分离初筛、纯化、复筛和生产性能鉴 定等。
菌种改良的途径:应用遗传学原理进行基因突变、基因转移和基因克隆
得到; 2. 微生物生长繁殖快、生产周期短、产量过控制培养条件
来提高酶的产量; 4. 微生物具有较强的适应性和应变能力,通过各种遗传变异的手段,
生物化学:第四章 酶(6周1-2节)
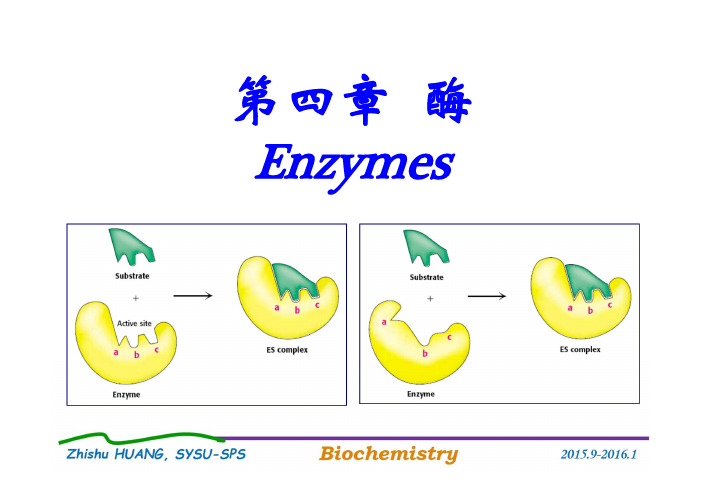
第四章酶Enzymes本章主要内容(9学时)一.酶的概念(重点)二.维生素与辅酶(重点)三.酶促反应动力学(重点)四.酶的结构和催化作用机制(重点)五.酶的调控(重点)六.人工酶与酶工程(自学为主)一、酶的概念⏹生物机体的一切生理活动,都是由无数复杂的化学变化(反应)来实现的。
⏹生物体内进行的所有这些化学变化都在酶的催化下进行的。
⏹Much of the history of biochemistry is the history of enzyme research.一、酶的概念⏹In the late 1700s, biological catalysis was first recognized.⏹1897年,E. Büchner,首次从酵母细胞中提取出酶,实现无细胞生醇发酵。
一、酶的概念⏹1926年,James Sumner,结晶出第一个蛋白酶---脲酶。
⏹pepsin, trypsin, andother digestive enzymesAll enzymes are proteins.一、酶的概念⏹J. B. S. Haldane⏹A paper entitled “Enzymes”.weak bonding interactions between an enzyme and its substrate might be used to catalyze a reaction.一、酶的概念⏹1989年,推翻“酶都是蛋白质”这一传统概念。
⏹In 1982,Thomas Cech,RNA spliced itselfaccurately without anyprotein enzymes fromTetrahymena(四膜虫).Most Enzymes Are Proteins.一、酶的概念酶是生物催化剂⏹生物催化剂(Biocatalysts):活细胞产生的一类具有催化功能的生物分子。
生化诊断用酶制备方法

生化诊断用酶制备方法全文共四篇示例,供读者参考第一篇示例:生化诊断用酶是一类广泛应用于医学、生物化学等领域的重要酶类,可以通过检测生物体内的代谢物来诊断疾病和监测病情。
生化诊断用酶的制备方法对于其活性和纯度的要求非常高,下面我们将详细介绍一种常用的生化诊断用酶制备方法。
生化诊断用酶的制备方法主要分为以下几个步骤:酶源筛选、提取与纯化、酶活性测定、酶稳定性测定和储存。
第一步,酶源筛选。
选择合适的酶源是制备生化诊断用酶的第一步。
常见的酶源包括微生物、植物和动物组织等。
在选择酶源时需要考虑到酶活性、稳定性和纯度等因素。
第二步,提取与纯化。
在获得合适的酶源后,需要进行提取和纯化工作。
提取酶的方法包括离心、超声破碎、冷冻-融化等方法。
而酶的纯化则需要通过分离技术如离子交换层析、凝胶过滤层析、亲和层析等来提高酶的纯度。
第三步,酶活性测定。
获得纯化的酶后,需要进行酶活性测定,以确定酶的活性和稳定性。
常见的酶活性测定方法包括比色法、发光法、荧光法等。
通过测定酶的活性可以评估酶的纯度和稳定性,并确定最佳的保存条件。
第四步,酶稳定性测定。
酶的稳定性是制备生化诊断用酶的重要指标之一。
主要包括热稳定性、抗氧化性、抗蛋白酶性等。
通过测定酶在不同温度和pH条件下的稳定性,可以评估酶在生化诊断中的应用潜力。
第五步,储存。
储存是生化诊断用酶制备过程中不可忽视的一环。
在制备完成后,需要将酶进行冻干或冷冻保存,以确保酶的活性和稳定性。
需要定期对储存条件进行监测,以确保酶的长期保存和应用。
生化诊断用酶的制备方法是一个复杂和多步骤的过程。
通过精心筛选酶源、提取与纯化、酶活性测定、酶稳定性测定和储存等多个步骤,可以获得高质量、高活性的生化诊断用酶,为生命科学研究和医学诊断提供有力支持。
【2000字】第二篇示例:生化诊断用酶制备方法随着科学技术的不断发展,生化诊断手段的精确度和灵敏度也得到了很大的提升,其中使用酶作为试剂的生化诊断方法在临床实践中越来越受到重视。
第四章 酶工程

丙酮酸+CO2+ATP+H2O 草酰乙酸+ADP+Pi
正反应、逆反应都用同一名称
DH2+NAD+D+NADH+H+
DH2NAD+氧化还原酶
各大类酶的 特殊命名规则
转移酶为供体 受体被转移 基团转移酶
氧化还原酶往往可 命名为供体受体 氧化还原酶,
值得注意的是来自不同物种或同 一物种的不同组织或不同细胞器 的同一种酶,虽然他们催化同一 个生化反应,但它们本身的一级 结构可能并不相同,命名也有所 区别
酶的一级结构
酶的二级结构
多肽链主 链原子的 局部空间 排列
酶的 二级 结构
螺旋结构 β-折叠
没有考虑到它的侧链的构象 或与其它部分的相互关系
酶蛋白的-螺旋结构
酶蛋白的折叠结构
由-螺旋、折叠和随机结构 构成的溶菌酶的空间结构
酶的三级结构
指单一的多肽链 或共价连接的多 肽链中,所有原 子在空间上的排 列
酶活性中心示意图
酶的活性中心构成
酶分子中的 氨基酸残基
酶 的 活 性 中 心
辅酶或辅助因子 或它们的部分 结构
酶的结构
四级结构
二级结构
酶的结构
三级结构
一级结构
酶的一级、二级、三级和四级结构示意图
酶的空间结构
三级结构
二级 结构
《生物化学第四章酶》PPT课件

2×9600 2×56000
第三节 酶的分类和命名
一、酶的分类
1. 氧化还原酶 Oxido-reductase
氧化-还原酶催化氧化-还原反应。主要包括脱氢
酶(dehydrogenase)和氧化酶(Oxidase)。
AH2+B
A+BH2
如: 乳酸脱氢酶催化乳酸的脱氢反应。
CH3CHCOOH NAD+
根据酶蛋白质分子的特点,将酶分为:
单体酶:仅有一个活性中心,由一条或多条共价 相连的肽链组成的酶分子。
牛胰RNase 鸡卵清溶菌酶 胰凝乳蛋白酶
124 aa 129 aa 三条肽链
单链 单链
寡聚酶:由两个或多个相同或不同亚基组成的酶。 单独的亚基一般无活性。
① 含相同亚基的寡聚酶: 苹果酸脱氢酶(鼠肝),2个相同的亚基
二、酶的命名
(1) 国际系统命名法(systematic name)
是以酶所催化的整体反应为基础,规定每一种酶的名 称应当明确标明酶的底物及催化反应的性质。
(2)习惯命名法(recommended name)
根据酶的作用底物及其所催化的反应类型来命名。
如: 谷氨酸 + 丙酮酸 -酮戊二酸 + 丙氨酸 丙氨酸: -酮戊二酸氨基转移酶 谷丙转氨酶
比非催化高108~1020倍,比非生物催化剂高107~1013
2. 倍酶。具有高度专一性
酶对反应的底物和产物都有极高的专一性,几乎没 有副反应发生。
3. 酶易失活
常温、常压,中性pH 环境下反应。
4. 酶的催化活性可被调节控制
酶抑制剂调节、反馈调节、酶原激活、共价修饰、 激素控制等。
三、酶的化学本质
O
《酶的来源与筛选》课件
本课件将介绍酶的基本概念、分类和来源,以及酶的筛选与优化方法。探讨 常用的酶筛选方法、酶筛选的应用领域,同时展望酶筛选的意义和未来发展。
酶的基本概念
了解酶是一类生物催化剂,能够加速生物化学反应的进程,使其在温和条件 下快速进行。
酶的分类和来源
分类
酶可分为氧化还原酶、转移酶等多个类别。
来源
天然酶可从细胞内提取,也可通过基因工程技术获得重组酶。
工业应用
酶可从微生物、植物和动物中获得,用于工业生产和生物制药。
酶的筛选与优化
1
筛选方法
通过高通量筛选、分子进化等方法寻找具有理想特性的酶。
2
优化技术
利用基因重组、蛋白工程等技术改良酶的催化效率和稳定性。
3
结构分析
通过3D结构分析了解酶的活性中心,为酶的设计和改造提供依据。
常用的酶筛选方法
基于酶活性
Hale Waihona Puke 基于酶底物亲和性高通量筛选
利用底物转化能力评估酶的活性, 包括颜色反应、发光反应等。
选择具有特定底物亲和性的酶, 如蛋白酶、酶联免疫吸附试验等。
利用自动化设备和微孔板实现对 大量酶样本的快速筛选。
酶筛选的应用领域
1 医药
用于制造药物、生物传感器和生物医学材料 等领域。
2 食品工业
可用于提高食品加工效率、改善产品质量和 降低成本。
3 能源领域
用于生物燃料生产和生物能源开发等可持续 能源研究。
4 环境保护
可应用于废水处理、有机废弃物降解等环保 领域。
酶筛选的意义与前景
酶筛选的意义在于发现更高效、特异性更好的酶,为产业发展和生物医学研 究提供有力支撑。
总结及展望
《生物化学》课件——酶(人卫版)
苷酸,辅酶I)
NADP+(尼克酰胺腺嘌呤二核
苷酸磷酸,辅酶II)
FMN (黄素单核苷酸)
FAD(黄素腺嘌呤二核苷酸)
醛基
TPP(焦磷酸硫胺素)
酰基
辅酶A(CoA)
硫辛酸
烷基
钴胺素辅酶类
二氧化碳
生物素
氨基
磷酸吡哆醛
甲基、甲烯基、 四氢叶酸
甲炔基、甲酰基
等一碳单位
尼克酰胺(维生素PP之一)
尼克酰胺(维生素PP之一)
• 将酶促反应达到最大速度的某一温度范围叫
做酶作用的最适温度。
反 应 速 度
最适温度 温度
•
温度对酶促反应速度的影响在临床上
具有理论指导意义。
• 低温一般不破坏酶,一旦温度回升后,酶又恢复活性。
所以对酶制剂和酶检测标本(如血清、血浆等)应放在 低温保存。
• 低温麻醉可通过低温降低酶活性以减慢组织细胞代谢速
第四章 酶
enzyme
酶(enzyme ):生物催化剂(biocatalyst)
两类生物催化剂:
酶(enzyme,E)是机体内催化 各种代谢反应最主要的催化剂 。
核酶(ribozyme)是具有高 效、特异催化作用的核酸
第一节 概述
introduction
酶(enzyme ):
由活细胞合成的、对其特异底物具有高效 催化作用的特殊蛋白质 。
(一)绝对特异性 (absolute specificity)
(二)相对特异性 (relative specificity)
(三)立体异构特异性 (stereo specificity)
三、酶催化活性的可调节性
物质代谢在动态平衡中 催化各条代谢过程酶活性的调节作用是维持 这种平衡的重要环节 。
生物化学教案——第四章 酶
第四章酶一、酶的概念:由活细胞产生的,以蛋白质为主要成分的生物催化剂。
酶与一般催化剂相比的异同:相同特点:1、只催化热力学上允许的化学反应(△G<0);2、降低活化能,但不改变化学反应的平衡点;3、加快化学反应速度,但催化剂本身反应前后不发生改变。
特殊之处:1.催化具有高效性;2.高度的专一性(只能催化一种底物或一定结构的底物);3.易失活;4.催化活性受到调节和控制;5.催化活性与辅助因子有关(全酶=酶蛋白+辅助因子)。
二、酶的组成1、按组成成分来分:1)单纯酶:仅由氨基酸残基构成的酶。
2)结合酶:除了蛋白质组分外,还含有对热稳定的非蛋白的小分子物质。
结合酶的全酶=酶蛋白+辅助因子a.酶蛋白:决定反应的特异性;b.、辅助因子:决定反应的种类与性质;可以为金属离子或小分子有机化合物。
辅助因子可分为辅酶:与酶蛋白结合疏松,可以用透析或超滤方法除去;辅基:与酶蛋白结合紧密,不能用透析或超滤方法除去。
酶蛋白与辅助因子结合形成的复合物称为全酶,只有全酶才有催化作用。
2、按酶蛋白的亚基组成及结构特点分类1)单体酶由一条或多条共价相连的肽链组成的酶分子牛胰RNase 124a.a 单链;胰凝乳蛋白酶三条肽链单体酶种类较少,一般多催化水解反应。
2)寡聚酶由两个或两个以上亚基组成的酶,亚基可以相同或不同,一般是偶数,亚基间以非共价键结合。
寡聚酶中亚基的聚合,有的与酶的专一性有关,有的与酶活性中心形成有关,有的与酶的调节性能有关。
大多数寡聚酶是胞内酶,而胞外酶一般是单体酶。
3)多酶复合体由两个或两个以上的酶,靠非共价键结合而成,其中每一个酶催化一个反应,所有反应依次进行,构成一个代谢途径或代谢途径的一部分。
如脂肪酸合成酶复合体。
例如:大肠杆菌丙酮酸脱氢酶复合体由三种酶组成①丙酮酸脱氢酶(E1)以二聚体存在2×9600②二氢硫辛酸转乙酰基酶(E2)70000③二氢硫辛酸脱氢酶(E3)以二聚体存在2×56000复合体:12个E1二聚体24×96000;24个E2单体24×70000;6个E3二聚体12×56000 。
生物化学-酶
酶一级结构的差别也决定了催化性质的不同, 如胰蛋白酶、 胰糜蛋白酶和弹性蛋白酶三种蛋白 酶的活性中心Ser残基附近都有一个在立体结构上 的“口袋”状结构。由于三种蛋白酶的口袋”状结 构不同,决定其与不同底物结合即有不同特异性。
酶的特异的三维空间结构是酶催化功能的基础。 酶的二、三级结构是维持酶的活性中心空间构象的 必需结构。
酶的命名包括习惯命名和系统命名,酶可分为六类。 酶与疾病发生、诊断、治疗等密切相关。
➢一、酶的概念 酶是由生物活细胞产生的具有高效催化功能
和高度专一性的一类特殊蛋白质,又叫生物催化 剂•.绝大多数的酶都是蛋白质。
酶的化学本 质是什麽?
酶的概念
• 一、相关概念 • 酶催化的生物化学反应,称为酶促反应。 • 被酶的催化的物质称为底物(S) • 反应的生成物为产物(P) • 酶所具有的催化能力称酶的活性. • 酶失去催化能力称酶的失活.
第四章 酶 (Enzymes)
内容简介
酶是具有高度催化效率及高度特异性的蛋白质。 酶通过多种机制降低反应活化能使反应速率增加。 酶分子一级结构及空间结构是催化功能的基础。 酶促反应速率受到[S]、[E]、pH、T、抑制剂及激活
剂的影响
酶活性可受到别构调节、共价修饰、酶原激活、关键 酶、多酶体系、同工酶等调节
H N C O
COOH CH
R6
氨基酸
氨基酸
消化道中各种蛋白酶的专一性
3.立体异构特异性:一些酶仅能催化一种立体异
构体进行反应,或其催化的结果只产生一种立体异
构体,酶对立体异构物的选择性称为立体异构特异
性(stereospecificity)。
L-乳酸
D-乳酸
H
H
C
OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从自然界筛选产酶微生物一般步骤:
1.采样:生物多样性环境;高选择压力环境(针对
与工艺条件相似的环境)。
2.富集培养:取其所好,投其所抗。
3. 分离:稀释涂布、划线分离。
4.筛选 • 初筛:最普通的筛子 —— 快速简单,筛去大部分 非目标株,尽量保留有潜力的候选株。
1)琼脂板涂布法 筛子: • 以底物或底物类似物为唯一的碳、氮原 ; • 底物的转化或产物的形成在琼脂培养皿上产生的 半透明圈。 • 产物的衍生化或络合:衍生化或络合试剂与产物 的某些功能团形成呈色圈。 • 色原性底物:通过酶催化时颜色的变化,对菌群进 行可视的直接鉴定。 • 指示菌株:对产物能显示某种生理变化,如生长、 或不生长。
二、酶的寻找和发现 1. 反应过程的设计 • 选择合适的合成的反应途径、反应底物 或原料 • 底物:价廉、易合成
• 酶:是否易得、活性、稳定性。
• 资料查阅:是否有已确定的能转化该反应的或相似反
应的酶。
氨基酸生物合成的多条途径
• brenda (http://www.brenda.uni-koeln.de/) • 大量关于酶的信息:包括酶的分类,序列、结 构、功能、特性(稳定性、最佳pH、最佳反应 温度)、底物\产物、催化的反应,代谢途径, 抑制剂、激活剂,辅助因子等 • Ligand 数据库http://www.genome.ad.jp/ligand/ • 包含了化合物(除常规代谢途径的化合物外还 包括其他化合物、如:药物、多糖)、酶、反 应。 • Biocatalysis/biodegradation • 代谢途径和生物转化,主要包含代谢途径、反 应、化合物、酶。
要求,筛选出最佳的产酶菌株; (2)繁殖快,发酵周期短,培养简便,能通过控制 培养条件大幅度提高酶的产量; (3)微生物具有较强的适应能力,可采用各种遗传
变异手段,培育出新的、更理想菌株。
Байду номын сангаас
微生物多样性赋予的酶开发的巨大开发潜力
生物 细菌 古细菌 真菌 病毒 已知种类 4760 <500 69000 5000 估计总的种 类 800000 ~ 3000000 50000 500000 1500000 130000 ~ 所占百分率 0.2%-0.6% 0.1%-1% 5%
• 细胞通过高速流动系统, 排成单行,逐个流经 检测区进行。
• 复筛:特定筛 —— 慢、精确。使用准确的 定量分析方法,确定反应速率、选择性等。 (液、气相色谱、分光光度法等)
• 毛细管电泳法,质谱法,红外热成像法,酶法检 测,酶联免疫等多种现代分析方法逐渐应用于酶
尤其是酶立体选择性的筛选。
5.生产菌的改良 • 诱变、定向突变;代谢调控。
第三章 酶的筛选
一、酶的来源与多样性 可以通过两条途径 1 .化学合成,包括酶的化学全合成、模拟酶的 化学合成。
2.生物合成,从生物中提制。
少数来自于动植物,多数( 80% 以上)来源于 微生物;
微生物作为酶源的优点:
(1)种类繁多,易筛选:凡是动植物体内有的酶几
乎都能从微生物中找到.并可根据应用特点和
4)从基因库筛选
分子筛选(molecular screening)
基于序列(sequence-based)的筛选。 数据库挖掘(Database mining) 基于序列的同源性,从已知酶基因(蛋 白)出发,搜索数据库。
PCR筛选 • 根据已知酶蛋白,设计兼并引物,PCR克隆 ,表达,活性检测。
2. 酶的寻找
获得新酶的方法
⑴筛选新酶:从自然环境中; ⑵发现现有酶的新活力(非自然); ⑶利用新的反应条件,如改变反介质,或 新的影响因素(如金属离子); ⑷酶的改造,主要指利用基因工程技术, 突变酶,定向进化;
⑸人工酶。
脂肪酶的催化混杂性
脂肪酶的催化混杂性
3.酶或产酶微生物的筛选 (1)从商品酶库中筛选 (2)从已知菌种来源和菌种保藏中心筛选 (3)从自然界发现和筛选产酶微生物 (4)从基因库筛选
• 缺点:只能模拟目标真实底物。
氧化还原酶活性检测
• 基于NAD(P)H生成的比色法 NAD(P)H在340nm的吸光度可用于检测信号。 间接法:四唑氮蓝(NBT)/吩嗪硫酸甲酯 (PMS)法,在PMS存在下,NAD(P)H与 黄色的 NBT反应,可生成蓝紫色甲臜 (formazan),吸计兼并引物,PCR克隆 (Southern 杂交),表达,活性检测。
宏基因组(metagenome)法 宏基因组是特定小生境中全部微小生 物遗传物质的总和。 • 土样 — 分离收集 DNA 片断 — 限制酶剪切 — PCR 扩增 — 克隆到载体内 — 转化(大肠杆 菌)—筛选转化株—功能基因—新酶。
4%
1)不可培养微生物:指在实验室内,采用常 规培养方法培养不出的微生物。(占全 部微生物的99%)
• 绕开菌种分离、纯化的步骤,应用分子 生物学方法,直接从中寻找有开发价值 的、新的微生物酶基因和新的酶种。
2)嗜极端环境微生物 • 嗜热微生物(250~350℃); • 嗜冷微生物(-10~0℃); • 嗜酸微生物(pH0); • 嗜碱微生物(pH11); • 嗜盐微生物[饱和食盐溶液(含盐32%或 5 2mol/L)]; • 耐有机溶剂微生物
水解释放黄色对 硝基苯酚或苯胺 对硝基苯糖苷 水解酶活性检测中最常用的色原性底物-对硝 基苯基衍生物 脂肪酶—对硝基苯酯 蛋白酶—对硝基苯酰胺 糖苷酶—对硝基苯糖苷
其他常用的发光底物 • 试卤灵(resorufin),1-萘酚衍生物。 • 荧光底物-伞形酮(umbelliferone)作为内置 荧光团的衍生物
过氧化物酶
• ABTS(2,2’-连氮基-双-(3-乙基苯并二氢噻唑 啉-6-磺酸)二铵盐)检测法 ABTS可被过氧化物酶氧化呈浓绿色 • 邻联茴香胺-氧化呈红色。
2) 微孔板悬浮法
• 需有吸光度的变化,可见,或荧光。 3)微珠细胞固定化法 • Freeman等人设计的微珠固定化方法,通过物 理手段使单个细胞附着在单个聚丙烯酰胺 固体。 .4)流式细胞计数法
