4.8物理性质和化学性质
钒化合物性质
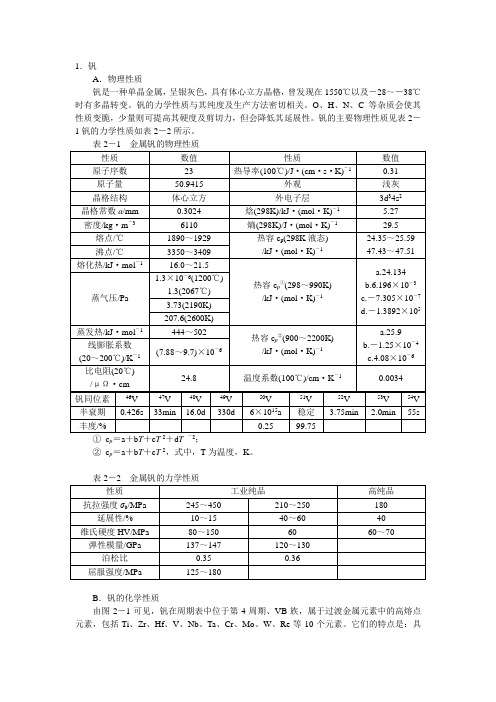
1.钒A.物理性质钒是一种单晶金属,呈银灰色,具有体心立方晶格,曾发现在1550℃以及-28~-38℃时有多晶转变。
钒的力学性质与其纯度及生产方法密切相关。
O、H、N、C等杂质会使其性质变脆,少量则可提高其硬度及剪切力,但会降低其延展性。
钒的主要物理性质见表2-1钒的力学性质如表2-2所示。
表2-1 金属钒的物理性质性质数值性质数值原子序数23 热导率(100℃)/J·(cm·s·K)-10.31原子量50.9415 外观浅灰晶格结构体心立方外电子层3d34s2晶格常数a/mm 0.3024 焓(298K)/kJ·(mol·K)-1 5.27密度/kg·m-36110 熵(298K)/J·(mol·K)-129.5熔点/℃1890~1929 热容c p(298K液态)/kJ·(mol·K)-124.35~25.59 47.43~47.51沸点/℃3350~3409熔化热/kJ·mol-116.0~21.5热容c p①(298~990K)/kJ·(mol·K)-1a.24.134b.6.196×10-3c.-7.305×10-7d.-1.3892×105蒸气压/Pa 1.3×10-6(1200℃)1.3(2067℃)3.73(2190K) 207.6(2600K)蒸发热/kJ·mol-1444~502热容c p②(900~2200K)/kJ·(mol·K)-1a.25.9b.-1.25×10-4c.4.08×10-6线膨胀系数(20~200℃)/K-1(7.88~9.7)×10-6比电阻(20℃)/μΩ·cm24.8 温度系数(100℃)/cm·K-10.0034钒同位素46V 47V 48V 49V 50V 51V 52V 53V 54V 半衰期0.426s 33min 16.0d 330d 6×1015a 稳定 3.75min 2.0min 55s 丰度/% 0.25 99.75①c p=a+b T+c T 2+d T -2;②c p=a+b T+c T 2,式中,T为温度,K。
基础有机化学(邢其毅、第三版)第四章PPT4

§4 烯烃§4.1 烯烃的结构1、双键(C= C)的结构π键特点: a.π键不能独立存在;与σ键共存; b.π键不能旋转;产生几何异构; c, π键富含电子;易与缺电子试剂反应; d, π键受原子核控制弱;易被极化。
CH2 = CCF3 CF3H H C H H H C C CF3 CF3H C H-CF3 为吸电子基团 2. 几何异构 A. 产生条件 a. 分子中有阻碍旋转的因素 b. 被阻碍旋转的碳原子上连有不同基团C H3 C = C H cis a C = C b♦ 产生顺反异构的条件:C H3 HH C = C C H3 tra n s c dC H3 Ha ≠ b;c ≠ d总结 —— 异构体的分类几何异构 立体异构 对映异构 构型异构 部位异构 异构 构象异构 链异构 官能团异构B. 几何异构的标识a. 顺反命名法 相同基团在同侧时称为顺(cis); 在异侧时称为反(trans);CH3 C=CCH3H C=CCH3H H 顺-2-丁烯H CH3 反-2-丁烯C1的两个基团与C2的两个基团相同时, 常使用该命名法.b. Z/E标识法 (普遍适用)含不同基团时,先按定序规则排大小, 两个大的在同侧时为Z,异侧为E1Cl C=CCH3 2Cl C=C CH3C 2H5 CH32C 2H5 1 CH3 E-2-氯-3-甲基-2-戊烯Z-2-氯-3-甲基-2-戊烯注意:顺反命名和Z/E命名的区别 顺反 两碳原子上基团相同 Z/E 各种均可,与R/S对应§4.2 烯烃的命名1.习惯命名法CH3 - C = CH2 CH3异丁烯 CH2 = CH CH3CH=CH CH2=CHCH2 CH2= (-CH2-) 乙烯基 丙烯基 烯丙基 亚甲基2. 系统命名法 a. 选含双键的最长碳链为主链; b. 从双键最近处编号; c. 双键位置写在母体化合物命名前加‘-’; 取代基写在更前面; d. 如有几何异构,在最前面用Z,E标识。
有机化学-芳香烃

“ 优先次序 ”是人为规定次序。
-COOH > -SO3H (磺酸) > -COOR (酯) > - COX(酰卤)> -CONH2 (酰胺) > -CN (腈) > -CHO > >C=O > -OH (醇) > -OH (酚) > - SH(硫醇) > -NH2 (胺) > -CC- > >C=C< > -OR > -SR > -R > - H > -X > -NO2
12
一价芳基: Ar- (Aryl)
C6H5
Ph
(Phenyl)
苯基
有机化学
芳烃
13
CH3 CH CH
CH2 CH
CH2
H H
CH3
H H
丙烯基
CH2
烯丙基
苯甲基或苄基
CH3
H
CH3
甲苯
CH3
邻甲苯基
有机化学
间甲苯基
芳烃
对甲苯基
14
练习
CH3 Cl NO2
O2N CH3 HOOC
2-硝基- 6-氯甲苯
4.4.1 亲电取代反应 4.4.2 加成反应 4.4.3 氧化反应
4.4.4 还原反应
4.4.5 芳烃侧链的反应
4.4.1 亲电取代反应
常用的亲电试剂有-X、-NO2、-SO3H、--R、 -COR、等,可发生以下几种反应。 1. 卤代反应
2. 硝化反应
3. 磺化反应 4. 傅瑞德尔-克拉夫茨烷基化反应 5. 傅瑞德尔-克拉夫茨酰基化反应
共轭效应的结果:
1) 键长完全平均化,六个 C—C 键等长(0.139nm),
2012高考复习学案与练习系列1——第一章物质的组成分类

第一章化学物质及其变化第一节物质的组成和分类、物质的性质与变化(第一课时物质的组成和分类)【基础回顾】思考预习:1.将空气、水、硫酸、矿石、石油、煤炭从物质的状态进行分类,可以将___________归为一类,将___________________归为一类,将________________归为一类。
2.初中学习中,将元素分为______元素和______元素;将化合物分为______、______、______、______。
对于化学反应,我们把它分为四种基本反应类型,分别是______反应、_______反应、________反应、__________反应。
一、物质的分类:关键是把大量事物按照事先设定的“标准”即分类依据进行分类。
常见的分类方法有以下两种。
1.交叉分类法:对某类事物按照多种标准进行再分类。
(1)例如,Na2CO3按其组成的阳离子来分类,属于______盐;按其组成的阴离子来分类,属于______盐;按其溶解性来分类,属于________盐。
(2)在不同的物质和它所属的类别之间进行连线①强碱NaOH ②金属氧化物CO2弱碱KOH 非金属氧化物CaO一元碱NH3·H2O 酸性氧化物SO2二元碱Ba(OH)2碱性氧化物Na2O2.树状分类法:对同类事物按照某种属性进行再分类。
如:将Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl填入下图。
二、分散系及其分类1.把___________分散在_____________中所得到的体系叫分散系。
其中__________的物质称为分散质;______________________的物质称为分散剂。
种组合方式。
当分散剂是水或其他液体时,按照分散质粒子的大小来分类,分散系可以分类如右:3.胶体的制备和性质:(1)Fe(OH)3胶体的制备:将烧杯中的_________加热至沸腾,向其中逐滴加入5~6滴________________,继续煮沸至液体呈__________色,停止加热,得到的分散系即为Fe(OH)3胶体。
钠的性质

石龙区高中
一、钠
(一)物理性质
(二)化学性质
1.与非金属单质反应(O2、Cl2)
(1)Na与O2反应 常温下,4Na+O2 == 2Na2O
加热时,2Na+O2
=△==
-1 Na2O2
(淡黄色)
石龙区高中
取用钠的方法:用刀切开一小块钠,观察断面变化。
现象: 切开的光亮的金属断面很快地变暗。
反应: 4Na + O2 = 2Na2O (白色)
• A、钠是银白色金属,硬度很大 • B、将金属钠放在石棉网上,加热后金
属钠剧烈燃烧,发出黄色火焰,生成过 氧化钠 • C、金属钠在空气中燃烧,生成氧化钠 D、金属钠的熔点很高
石龙区高中
• 3、一小块钠置于空气中,有下列现象:① 变成白色粉末;②变暗;③变成白色固体; ④变成液体。上述现象出现的先后顺序是 ()
点燃
2Na+Cl2 === 2NaCl
石龙区高中
【实验4】向一只盛有水的大烧杯中滴加几滴 酚酞试液,然后将一小块金属钠投入烧杯中,
观察实验现象。金属钠与水的反应
石龙区高中
实验现象讨论
现象
结论
浮
小于水的密度,0.97g/cm3
熔
反应放热 ,熔点低,97.81℃
游
有气体产生
响
有气体产生
红
有碱生成,NaOH
2. Na与水反应
3. Na与盐溶液反应
先与水反应: 2Na+2H2O == 2NaOH+H2 ↑ 再与盐反应: 2NaOH+CuSO4== Cu(OH)2 ↓+Na2SO4
石龙区高中
一、钠
(一)物理性质 (二)化学性质
七年级科学上册第8节-物理性质与化学性质

天然气!
哪些是描述天然气发生的变化?
天然气是世界上继煤和石油之后的第三大能源。主 要存在于油田气、气田气、煤层气、泥火山气和生物生 成气中,也有少量出于煤层。密度约0.65g/L,比空气轻, 无色、无味。压缩和降温的条件下可以变成液态。能燃 烧,因为它的主要成分为甲烷,燃烧时产生明亮的淡蓝 色火焰,生成二氧化碳和水等物质。
哪些是描述天然气具有的性质?
天然气,世界上继煤和石油之后的第三大能源。主 要存在于油田气、气田气、煤层气、泥火山气和生物生 成气中,也有少量出于煤层。密度约0.65g/L,比空气轻, 无色、无味。压缩和降温的条件下可以变成液态。能燃 烧,因为它的主要成分为甲烷,燃烧时产生明亮的淡蓝 色火焰,生成二氧化碳和水等物质。
2、用嘴通过玻璃管向澄清的石灰水中吹气, 可以发现石灰水变得浑浊不清,这个变化是物 理变化还是化学变化?
3、“蜡烛会燃烧,蜡烛在燃烧”,文中指的是蜡烛的( B ) A、前者指化学变化,后者指化学性质 B、前者指化学性质,后者指化学变化 C、前者指物理变化,后者指化学性质 D、前者指物理变化,后者指化学变化
出现水雾。这两个过程发生的变化( C )。
A.都是物理变化 B.都是化学变化 C.前者是物理变化,后者是化学变化 D.前者是化学变化,后者是物理变化
▪ 3. 炒锅通常是用铁制成的,这主要是利用
了铁的什么性质?这些性质是物理性质 还是化学性质?
炒锅用铁制成,是利用铁具有 较高的熔点和良好的导热性能, 铁的这些性质不需要物质发生 化学变化就能表现出来,属于 物理性质。
2、化学性质:
只在化学变化中表现出来的性质。 如 :酸性、碱性、可燃性、助燃性、稳定性等。
七年级上册第4章-物质的特性知识点
七年级上册第4章物质的特性知识点4.1物质的构成1、物质是由分子构成:分子是构成物质的一种极其微小的粒子,用扫描电子显微镜观察。
2、分子之间存在空隙:水和酒精混合后的总体积小于水和酒精的体积之和。
(气体分子之间空隙最大,液体第二,固体第三),现象:气体很容易压缩,固体和液体不容易压缩。
3、分子处于不停的运动之中:扩散现象。
可以在固体、液体、气体中进行,且温度越高,扩散越快。
扩散现象说明分子处于不停的运动之中和分子之间存在空隙。
4、分子之间存在着相互作用的引力和斥力。
4.2 质量的测量1、一切物体都是由物质组成的,质量表示物体所含物质的多少。
物体的质量是由物体本身决定的,是物质的一种属性,不随物体的位置、形状、温度、状态的改变而改变。
2、物体质量的单位是千克,用“kg”表示。
常用质量单位还有吨(t)、克(g)、毫克(㎎)。
单位换算:1吨=1000千克 1千克=1000克1克=1000毫克3、实验室里常用天平来测量物体的质量。
(重、难)①调平。
把天平放在水平桌面上,把游码移到横梁标尺左端的零刻度线处。
调节衡量两端的平衡螺母(向指针偏转的相反方向),使指针对准分度盘中央刻度线,这时横梁平衡。
②称量。
把被测物体放在左盘里,用镊子向右盘里加减砝码(先大后小)并调节游码在横梁标尺上的位置,直到天平恢复平衡。
这时盘里砝码的总质量加上游码指示的质量值,就等于被测物体的质量。
③称量完毕,用镊子将砝码逐个放回砝码盒内。
4.3 物质的密度(重、难)1、密度定义:单位体积的某种物质的质量叫做这种物质的密度。
(l)密度是物质的一种特性,与物体的形状、体积、质量无关,即对于同一物质而言,密度是不变的。
(如:一杯水和一桶水的密度是一样的;)(2)不同的物质,密度不同;2. 密度的公式:ρ=m / v(公式变形:m=ρv v=m/ρ)ρ表示密度, m表示质量(单位:千克或克),v 表示体积(单位:米3或厘米3)水银的密度为13.6×103千克/米3,它所表示的意义是1米3水银的质量为13.6×103千克,3、密度的单位:(1)密度的单位:千克/米3 或克/厘米3,(2)两者的关系:1克/厘米3=1000千克/米3(3) 水的密度:1×103千克/米3或1克/厘米3其含义是:1立方米水的质量是1000千克,或1立方厘米水的质量是1克。
4.8 物理性质与化学性质
最大最全最精的教育资源网 www.xsjjyw.com 全国中小学教育资源门户网站 | 天量课件、教案、试卷、学案 免费下载 | www.xsjjyw.com 4.8 物理性质与化学性质
1.下列关于二氧化硫的自述,属于物理性质的是(D) A. 我能使石蕊试液变红 B. 我能形成酸雨 C. 我能使澄清石灰水变浑浊 D. 我有刺激性气味 2.下列变化中属于物理变化的是(C) A. 氢气燃烧 B. 菜刀生锈 C. 冰雪熔化 D. 电解水 3.用电设备发生火灾时,可用装有液态四氯化碳的“灭火弹”扑灭。灭火时,液态四氯化碳迅速转化为气态并覆盖在火焰上。据此推测四氯化碳可能具有的性质是(B) A. 能导电 B. 不易燃烧 C. 不易汽化 D. 密度比空气小 4.米饭在嘴里慢慢细嚼会感觉有甜味产生,这是因为米饭中的淀粉在口腔中消化酶的作用下生成了麦芽糖。上述过程中所发生的变化是(C) A.只有化学变化,没有物理变化 B.只有物理变化,没有化学变化 C.既有化学变化,又有物理变化 D.无法确定 5.下列诗句中只涉及物理变化的是(C) A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干 C.只要功夫深,铁杵磨成针 D.爆竹声中一岁除,春风送暖入屠苏 6.下列被媒体曝光的质量问题事件中,一定涉及化学变化的是(C) A.用工业石蜡等给瓜子“美容” B.奶粉中查出含有三聚氰胺 C.用硫黄燃烧法熏蒸粉丝 D.用酱色、水、盐等兑制成“假酱油” 7.下列物质的用途利用了其物理性质的是(B) A. 酒精作燃料 B. 生活中用镶有金刚石的玻璃刀裁划玻璃 C. 工业上常用一氧化碳作还原剂将金属氧化物冶炼成金属单质 D. 化工生产中以煤为原料制取甲醇(CH3OH) 8.厨房里有多种调味品,以下描述表示其化学性质的有(C) ①蔗糖能溶于水 ②料酒具有挥发性 ③食盐有咸味 ④醋酸具有酸性 ⑤桂花干有淡淡的香味 A. ② B. ②④ C. ④ D. ④⑤ 9.2015年4月13日,西昌市动物疫病预防控制中心堆放在仓库中浓度为21%过氧乙酸消毒液发生泄漏。经查阅资料可知:过氧乙酸是无色液体,有强烈刺激性气味,易溶于水、 最大最全最精的教育资源网 www.xsjjyw.com 全国中小学教育资源门户网站 | 天量课件、教案、试卷、学案 免费下载 | www.xsjjyw.com 乙醇等,易挥发,与其他酸有相似的化学性质,温度稍高即分解为乙酸、氧气。请回答下列问题:
物理性质与化学性质(OU)
2、用嘴通过玻璃管向澄清的石灰水中吹 气,可以发现石灰水变得浑浊不清,这 个变化是物理变化还是化学变化?
1、下列各组物质中都属于酸性物质的是( B ) A、人的胃液和洗衣粉
B、酸奶和桔子汁
C、纯碱和酸梅 D、熟石灰和洗发液
2、下列物质具有一定的去污能力,可以作洗涤剂的是( B )
A、食醋 B、纯碱 C、盐酸溶液 D、食盐溶液
4.6
物理性质与化学性质
一、物理变化和化学变化 二、物理性质和化学性质
1.物理性质: 2.化学性质: 3.性质和变化的区别: 4.酸碱性: (1)酸性物质:
你能说说认识的酸性物质和碱性物质吗? 闻一闻食醋的气味。
酸性物质
为什么需要轻轻扇动?
原因:有些物质可能具有 毒性,所以实验室里的化 学药品都不能用鼻子直接 闻,更不能用嘴尝,这是 一个操作规范。
1.测定物质酸碱性强弱(酸碱度)的方法: 2. pH值是反映物质酸碱性强弱的指标: 3. pH值的测定:
测定下列物质的酸碱性强弱
①菠萝汁 ②醋 ③自来水 ④洗洁精 pH= 3
pH= 3
pH= 7 pH=10 pH=9
酸性的有(
)
⑤牙膏
⑥汽水
中性的有(
)
pH= 6 ⑦胃舒平药片pH= 8 碱性的有( pH= 8 ⑧洗发液 ⑨土壤浸出液 pH= 7 ⑩茶水 pH= 7~8 ⑾肥皂水 pH= 12
酸溶液能使紫色石蕊试液变红色
碱溶液能使紫色石蕊试液变蓝色
盐碱地
酸雨伤害的树木
4.6
物理性质与化学性质
一、物理变化和化学变化 二、物理性质和化学性质 三、物质酸碱性的测定 四、物质酸碱性强弱的测定
1.测定物质酸碱性强弱(酸碱度)的方法:
七年级科学上册 4.6物理性质和化学性质课件2 浙教版
pH数值越低,酸性越强; pH数值越高,碱性越强; pH数值等于7的物质呈中性。
实验三:怎样判断酸碱性的强弱?
• 将pH试纸撕成3小块放在表面皿上
• 用洁净的玻璃棒蘸取被测试的液体,滴在 pH纸试上 • 用镊子夹起试纸,将显示的颜色与标准比 色卡对照
• 用清水洗净玻璃棒,用滤纸擦干,再去蘸 取下一种液体
硫酸 5、常见的三大强酸有盐酸、____
氢氧化钾 碱有氢氧化钙、________ 、 氢氧化钠 ________和氢氧化钡。
弱碱性 6、人的胃酸过多时,医生常配一些具有_______性的胃舒
平药片来中和治疗。
7、土壤的酸碱性直接影响农作物的生长。 已知某地区土壤显微碱性,参照下表,从 土壤酸碱性考虑,在该地区适宜种植的作 物是( 甘草 )
土地盐碱化的直 接后果就是“贫 穷”
酸雨的危害
1、下列 各组物质中都属于酸性物质的是( B ) A、人的胃液和洗衣粉 B、酸奶和桔子汁 C、纯碱和酸梅 D、熟石灰和洗发液 2、浓硫酸是强酸,具有很强的腐蚀性,在使用过程时,如果不 小心沾上皮肤,下列措施正确的是( B )
A、应立即用大量的水冲洗。
4.6 物理性质和化学性质(二)
正 确 的 闻 气 方 法
用手扇动,让少量气体进入鼻腔。
食醋的气味是 酸 的。 食醋是一种酸溶液,具有酸性。
说一说:
你能说出哪些像醋这样的酸性的物质?
弱酸性物质
强 酸
一、常见的酸性物质
强酸:盐酸、硫酸、硝酸 弱酸性物质:醋酸、汽水、 橘子汁、番茄汁、苹果、柠 檬汁、
身边的科学:
你参加过卫生清理工作吗? 用湿布擦沾有油污的瓷砖,容易擦干净吗? 沾有油污的瓷砖、玻璃你如何把它擦干净? 知识加油站
