北京高考一模试题分类汇编工艺流程试题(带答案)10页word
高考化学一轮复习化学工艺流程大题(2016一模汇编)

高考化学一轮复习化学工艺流程试题汇编(学生版)(14分)Na2SO3应用广泛。
利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
(1)举例说明向大气中排放SO2导致的环境问题:。
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。
则初期反应(图中A 点以前)的离子方程式是。
(3)中和器中发生的主要反应的化学方程式是。
资料显示:Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O;Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因。
②结晶时应选择的最佳操作是(选填字母)。
a. 95~100℃加热蒸发,直至蒸干b.维持95~100℃蒸发浓缩至有大量晶体析出c.95~100℃加热浓缩,冷却至室温结晶(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是、。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是:IO3-+SO32- =+(将方程式补充完整)②成品中Na2SO3(M = 126 g/mol)的质量分数是。
2.(2016年西城区期一模)以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如下图所示:(1)Al2O3可用于电解制Al,其反应的化学方程式是_______。
北京市2017高三各区一模化学工艺流程题汇编教师版
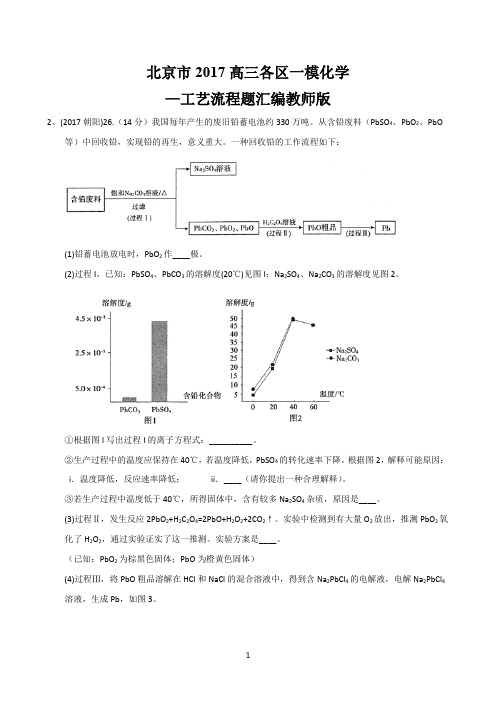
北京市2017高三各区一模化学—工艺流程题汇编教师版2、(2017朝阳)26.(14分)我国每年产生的废旧铅蓄电池约330万吨。
从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。
一种回收铅的工作流程如下:(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。
根据图2,解释可能原因:i.温度降低,反应速率降低;ii.____(请你提出一种合理解释)。
③若生产过程中温度低于40℃,所得固体中,含有较多Na2SO4杂质,原因是____。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。
实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。
实验方案是____。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。
1①阴极的电极反应式是____________。
②电解一段时间后,PbCl2'浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
2、(2017朝阳)26.(1)正;(2)①PbSO4 (s) +CO32- (aq)PbCO3 (s) +SO42- (aq)②Na2SO4、Na2CO3浓度降低,反应速率降低③温度低于40℃时,温度降低,平衡“Na2SO4(s)2Na+(aq) +SO42- (aq)”逆向移动,产生较多Na2SO4固体杂质(3)取少量PbO2于试管中,向其中滴加H2O2溶液,产生可使带火星木条复燃的气体,同时棕黑色固体变为橙黄色,证实推测正确(4)①PbCl42-+2e-=Pb+4C1-;②继续向阴极区加PbO粗品3、(2017丰台)27.(14分)锂离子电池正极材料需要纯度较高的硫酸锰,目前工业硫酸锰中杂质(钙、镁、铁等)含量高,利用下图流程可制取纯度较高的硫酸锰溶液。
2018年高考化学模拟工艺流程题汇编word版

2018年高考化学模拟(工艺流程题汇编)1、CoCl 2·6H 2O 是一种饲料营养强化剂。
一种利用水钴矿[主要成分为Co 2O 3、Co(OH)3,还含少量Fe 2O 3、Al 2O 3、MnO 等]制取CoCl 2·6H 2O 的工艺流程如下:已知:①浸出液含有的阳离子主要有H +、Co 2+、Ca 2+、Mg 2+、Fe 2+、Mn 2+、Al 3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH 见下表:③CoCl 2•6H 2o 熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃ 时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co 2O 3发生反应的离子方式 。
(2)NaClO 3的作用是 写出该反应的离子方程式_____________; 若不慎向“浸出液”中加过量NaClO 3时,可能会生成有毒气体是 (填化学式)。
(3)加Na 2CO 3调pH 至5.2所得沉淀为 。
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2 开始沉淀 2.7 7.6 7.6 4.0 7.7 完全沉淀3.79.69.25.29.8(4)萃取剂对金属离子的萃取率与pH的关系如下图。
加萃取剂的目的是;其使用的最佳pH范围是(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl2•6H2O需减压烘干的原因是。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。
已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。
当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。
【答案】(1)Co2O3+SO32-+4H+=2Co2++SO42-+2H2O(2分);(2)将Fe2+氧化成Fe3+(1分); ClO3-+6Fe2++6H+=Cl -+6Fe3++3H2O(2分); Cl2(1分);(3)Fe(OH)3 Al(OH)3(2分)(4)除去溶液中的Mn2+ 1分);B(2分);(5)降低烘干温度,防止产品分解;(1分);(6)0.49(2分)2、钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。
2020年高考化学最新一模、二模试题分类汇编专题十一 工艺流程综合题(A型题组)(考试版)

2020年高考化学一模、二模试题分类汇编专题十一工艺流程综合题(A型题组)
高考命题动向预测:
T3、T5、T10 1.(东北三省三校2020届高三一模)工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
已知:①VO3-+2H+ VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法B.热还原法C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式____________
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因____,浸出液中含钒物质的化学式为____________________________
(4)沉钒过程有气体生成,其反应的离子方程式为_________________
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__________________
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。
加热到200℃时,得到的固体物质化学式为____,300~350℃放出的气态物质化学式为____。
2.(福建省厦门市2020届高三毕业班3月线上质量检查)利用菱锰矿(主要成分是MnCO3,含少量A12O3、Fe2O3、FeO、CaO、MgO等)为原料制备MnO2的工艺流程如下:
1。
2020高考模拟题精细分类精美word版工艺流程专题1废物利用流程

废物利用流程1.(2020·西安一模)一种从废弃钛酸锂电极材料[含Li4Ti5O12、铝箔、碳粉、PVDF (聚偏二氟乙烯)]中回收某些资源的流程如下:已知:Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O,下列叙述错误的是()。
A.步骤②的目的是除去碳粉与PVDFB.步骤③H2O2的作用是氧化剂C.从该电极材料中可回收的金属元素有Al、Ti、LiD.合理处理废旧电池,有利于环境保护和资源再利用【解析】选B。
由于碳粉与PVDF均易与氧气反应转化为挥发性气体而除去,A项正确;由已知可知,步骤③没有元素化合价发生变化,则应是非氧化还原反应,B项错误;由流程图中的“NaAlO2”、“含锂沉淀”、“含钛有机相”可知从该电极材料中可回收的金属元素有Al、Ti、Li,C项正确;合理处理废旧电池,有利于环境保护和资源再利用,D项正确。
2.(2020·济宁6月模拟)工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O)的常用流程如图:下列说法不正确的是()。
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个C.将10L上清液中的S2-转化为SO42-(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2D.过程Ⅱ中,反应的离子方程式为4MnO32-+2S2-+9H2O=S2O32-+4Mn(OH)2↓+10OH-【解析】选B。
催化剂在反应中参加又生成,由图可知,过程Ⅰ、Ⅱ中,起催化剂作用的物质是Mn(OH)2,故A正确;56gCaO(1mol)溶于水,与水反应产生1mol氢氧化钙,但氢氧化钙微溶于水,部分会形成沉淀,因此溶液中的钙离子数目小于6.02×1023个,故B错误;由电子守恒及原子守恒可知,存在2S2-~S2O32-~4Mn(OH)2~8e-~2O2,且两个过程消耗氧气,将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为32g/molg 10mg/L20310L3-⨯⨯⨯2=0.2mol,故C正确;过程Ⅱ中S2-与MnO32-发生氧化还原反应,离子反应为4MnO32-+2S2-+9H2O=S2O32-+4Mn(OH)2↓+10OH-,故D正确。
(完整版)高考化学工艺流程题汇总,推荐文档

高考化学工艺流程题一、解读考试说明,探究命题思路1、化学工艺流程题为何取代传统无机框图题?传统无机框图题多年来一直是高考化学试卷中备受青睐的热门题型,但由于该类试题人为设计成分较多、问题编制模式过于单一、逻辑推理味道浓厚而化学味道淡薄,取而代之的是创新的工业生产流程题。
工业生产流程题取材于真实的、广阔的工业生产和日常生活,问题设计更加灵活,更有化学味,是落实新课程高考对考生素质和能力要求的具体体现,能够考查考生“将与化学相关的实际问题分解,综合运用相关知识和科学方法,解决生产、生活实际和科学研究中的简单化学问题的能力”。
正是新课程突出化学是一门实用性、创造性的科学,化学高考试题的发展趋势必然是重视与生产、生活的紧密联系,化学工艺流程题便成为近年来北京高考的新亮点和主流题型。
2、化学工艺流程题考查三维目标1)知识和技能(1由例题分析,初步认识工业生产流程题的特点。
(2了解工业生产流程题的解题思路和应具备的能力要求。
2)过程和方法采用例举、讨论、演绎、归纳等方式。
3)情感态度和价值观(l通过对工业生产流程题“真实性”的分析,培养学生的化学素养。
(2开展多种形式的讨论交流活动,培养学生的互助合作精神。
3、解流程题的步骤和方法首先,浏览全题,确定该流程的目的;——由何原料获得何产物(副产物),对比原料和产物。
其次,精读局部,明确反应原理——确定各步的反应物、生成物。
第三,针对问题再读图,明确要求——科学表述、规范书写。
4、考查要点:1)物质性质及其相互转化关系2)元素及其化合物的转化网络3)物质的分离和提纯的方法结晶——固体物质从溶液中析出的过程(蒸发溶剂、冷却热饱和溶液、浓缩蒸发)过滤——固、液分离蒸馏——液、液分离分液——互不相溶的液体间的分离萃取——用一种溶剂将溶质从另一种溶剂中提取出来。
升华——将可直接气化的固体分离出来。
盐析——加无机盐使溶质的溶解度降低而析出4)电解质溶液基本理论弱酸、弱碱的电离、水的电离、盐类水解、沉淀平衡5)氧化还原反应原料→产品6)方法:应用三大守恒写出陌生方程式,并能够进行简单计算电子守恒、电荷守恒、元素守恒法二、高考是怎么样考的?——研究试题,把握标高2009——2011年北京化学工艺流程题统计【例1】(2009北京理综,26,15分)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):Ⅰ. 从废液中提纯并结晶出FeSO 4·7H 2O。
2009-2013年北京高考真题--程序框图试题汇编
高考真题分类汇编-教师卷
题号 得分
一
总分
△注意事项: 1.本系列试题包含 2009 至 2013 年北京市高考真题,并经过精心校对。 2.本系列文档包含全部试题分类汇编,命名规律为: 2009-2013 年北京高考真题--******试题汇编。 3.本系列试题涵盖北京高考所有学科,均有相关实体书出售。 i. 、选择题(本大题共 3 小题,每小题 0 分,共 0 分。在每小题给出的四个选项中,只有一 个选项是符合题目要求的) 1.(2011 年北京高考真题数学(文))执行如图所示的程序 框图,若输入 A 的值为 2,则输入的 P 值为 A.2B.3C.4D.5
C.
A. 1
13 21
) B.
3. (2013 年北京高考真题数学(文)) 执行如图所示的程序框图,
【答案解析】C
【答案解析】C
输出的 S 值为(
2 3 610 D. 987【答案解析】C 2.(2012 年北京高考真题数学(文)) 执行如图所示的程序框图,输出的 S 值为 (A) 2 (B) 4 (C) 8 (D) 16
开始
k=0, S=1 k=k+1 S=S∙ 2k k <3 否 输出S 是
结束
_________高考题库,荣誉出品__________ ●-------------------------密--------------封--------------线--------------内--------------请--------------不--------------要--------------答--------------题-------------------------●
2009-2013 年北京高考真题--程序框图汇编
高考化学一轮复习化学工艺流程大题(2015一模汇编)
高考化学一轮复习化学工艺流程试题汇编(学生版)1.(2015年东城区一模)(12分)三氯氧磷(POCl3)常温下为无色液体,有广泛应用。
近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到)。
(1)氧气直接氧化法生产三氯氧磷的化学方程式是,从原理上看,与氯化水解法相比,其优点是。
(2)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。
在废水中先加入适量漂白粉,再加入生石灰将磷元素转化为磷酸的钙盐沉淀并回收。
①漂白粉的主要作用是。
②下图表示不同条件对磷的沉淀回收率的影响(“Ca/P”表示钙磷比,即溶液中Ca2+与PO的浓度比)。
则回收时加入生石灰的目的是。
(3)下述方法可以测定三氯氧磷产品中氯元素含量,实验步骤如下。
ⅰ.先向一定量产品中加入足量NaOH溶液,使产品中的氯元素完全转化为Cl-。
ⅱ.用硝酸酸化后,加入过量的AgNO3溶液,使Cl-完全沉淀,记录AgNO3用量。
ⅲ.再加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与水溶液接触。
ⅳ.最终加入几滴NH4Fe(SO4)2溶液后,用NH4SCN溶液沉淀溶液中过量的Ag+,并记录NH4SCN的用量。
已知相同条件下的溶解度:AgSCN<AgCl①步骤ⅳ中当溶液颜色变为色时,即表明溶液中的Ag+恰好沉淀完全。
②若取消步骤ⅲ,会使步骤ⅳ中增加一个化学反应,该反应的离子方程式是;该反应使测定结果偏低,运用平衡原理解释其原因:,由此计算出ⅱ中消耗的Ag+的量减少。
(13分)工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二注:金属离子的起始浓度为0.1 mol/L回答下列问题:(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是。
盐酸溶解MnCO3的化学方程式是。
(2)向溶液1中加入双氧水时,反应的离子方程式是。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是。
2019届北京各区高三一模化学工艺流程汇编(5个区)
27.(13分)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。
生产流程如下图所示:(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3c.热空气吹出d.降低阳极区液面上方的气压(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。
IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。
通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。
已知:吸光度越高表明该体系中c(I2)越大。
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。
吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mg•L-1时对离子交换膜影响可忽略。
现将1 m3含I-浓度为1.47 mg•L-1的食盐水进行处理,为达到使用标准,理论上至少..需要0.05 mol•L-1 NaClO溶液________L。
(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)27.(13分)以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。
其工作流程如下:(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。
O2氧化MnO(OH)的化学方程式是_______。
高考化学工艺流程试题汇编精选文档
高考化学工艺流程试题汇编精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-TTMSHHJ8】2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质化合物SiCl4TiCl4AlCl3FeCl3MgCl2沸点/℃58136181(升华)3161412熔点/℃?69?25193304714在TiCl4中的溶解性互溶——微溶难溶(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+ kJ·mol-12C(s)+O2(g)=2CO(g) ΔH2= kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工艺流程专门训练西城区一模26.(14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。
其过程如下图所示。
请回答:(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是。
(3)向饱和食盐水中首先通入的气体是,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是。
(4)碳酸钠晶体失水的能量变化示意图如下:Na2CO3·H2O (s) 脱水反应的热化学方程式是。
(5)产品纯碱中常含有NaCl。
取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。
则该产品中Na2CO3的质量分数是。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是。
26.(14分)(1)CaCO3、Mg(OH)2(漏写得1分,错答得0分)(2)2NH4Cl+CaO=CaCl2+2NH3↑+H2O(3)NH3NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl(4)Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH= + 58.73 kJ·mol-1(5)106(b-a)/11a(6)CH4-8e-+4CO32-=5CO2+2H2O丰台区一模27.(15分)近年来,为提高能源利用率,西方提出共生系统。
特指为提高经济效益,人类生产活动尽可能多功能化。
共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O =2H2SO4,该电池电动势为1.06V。
实际过程中,将SO2通入电池的极(填“正”或“负”),负极反应式为。
用这种方法处理SO2废气的优点是。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。
合成路线如下:CaCO3 空气焦炭①生产中,向反应II 中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 。
B .反应III 中发生反应的化学方程式为CaSO 4+4C === CaS +4CO↑ C .反应IV 需控制在60~70℃,目的之一是减少碳酸氢铵的分解D .反应V 中的副产物氯化铵可用作氮肥③ 反应V 中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是 。
④(NH 4)2SO 3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。
写出二氧化氮与亚硫酸铵反应的化学方程式 。
答案27.(15分) (1) 负(2分)SO 2+2H 2O -2e -=SO 42-+4H +(2分)利用上述电池,可回收大量有效能,副产品为H 2SO 4,减少环境污染,实现(能质)共生。
(2分) (2) ①防止亚硫酸铵被氧化(1分) ②ABCD (4分)③ K 2SO 4在有机溶剂乙二醇中溶解度小,能充分析出(2分) ④ 4(NH 4)2SO 3+2NO 2=4(NH 4)2SO 4+N 2(2分)朝阳区一模27.(14分)高铁酸钠(Na 2FeO 4)具有很强的氧化性,是一种新型的绿色净水消毒剂。
工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: 回答下列问题:(1)氢氧化钠的电子式是________。
(2)经过步骤①后,加入NaOH 固体的原因是________。
(3)步骤②反应的离子方程式是________。
(4)从溶液Ⅰ中分离出Na 2FeO 4后,还有副产品Na 2SO 4 、NaCl ,则步骤③中反应的离子方程式为________。
(5)将一定量的Na 2FeO 4投入到pH 不同的污水中(污水中其余成分均相同),溶液中Na 2FeO 4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I 比曲线II 对应的污水pH高温二氧化硫尾气反应II反应IV反应VCO 2氨水 (NH 4)2SO 3· H 2O 碳酸氢铵 氨气CaCO 3KClK 2SO 4NH 4Cl CO________(填“高”或“低”)。
(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_____(答出两点即可)。
答案27.(14分)(1)(2)Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(4)2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O(5)高(6)低,既能消毒杀菌又能净水(或无毒或方便保存等)东城区各校联考26、(12分)氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:(1)试写出吸收塔中反应的离子方程式:__________________________。
(2)饱和FeCl3溶液可制得 Fe(0H)3胶体,胶体区别于其它分散系的本质特征是___。
(3)已知FeCl3·6H2O 在水中的溶解度如下:温度/℃0 10 20 30 50 80 100溶解度74.4 81.9 91.8 106.8 315.1 525.8 535.7(g/100gH20)从332的方法是:。
(4)如何验证FeCl3溶液中是否含有Fe2+ , 请选出正确答案A. KSCN 氯水 B. 铁粉 KSCN C. 酸性高锰酸钾 D. 黄色的 K3 [Fe(CN)6]溶液(5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入淀粉作为指示剂,并用c mol/L Na2S2O3溶液滴定,用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)则滴定终点的现象是:______________________。
m克样品中氯化铁的质量分数为:。
26、(12分)(1)2Fe2++Cl2=2Fe3++2Cl-(2分)(2)分散质粒径不同,胶体粒子直径1nm-100nm之间。
(答丁达尔效应不得分)(2分)(3)加入少量浓盐酸, 加热浓缩,冷却结晶,过滤(2分)(4)CD (2分)(5)滴入最后一滴,溶液颜色由蓝色变为无色。
(2分)( 162.5Vc/m ) % (2分)东城区一模27.(14分)臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)已知O3与KI溶液反应的生成物中有两种单质,其离子反应方程式为。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
pHt/min3.04.05.06.0T/℃20 301 231 169 5830 158 108 48 1550 31 26 15 7①pH增大能加速O3分解,表明对O3分解起催化作用的是___________.②在30°C、pH=4.0条件下,O3的分解速率为__________ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号)a. 40°C、pH=3.0b. 10°C、pH=4.0c. 30°C、pH=7.0(3)O3 可由臭氧发生器(原理如下图)电解稀硫酸制得。
①图中阴极为_____(填“A”或“B”),其电极反应式为。
②若C处通入O 2 ,则A极的电极反应式为。
答案27.(14分)(1)O3 +H2O+2I-= O2+I2+2OH-(2分)(2)①OH-(2分)②1.00×10-4 (2分)③b、a、c(2分)(3)①A(2分)2H++2e-=H2↑(2分)②O2+4H++4e-=2H2O(2分)昌平一模25. (15分)火力发电厂释放出大量气体会造成环境污染。
对燃煤废气进行处理,可实现绿色环保、废物利用等目的。
(1)CO可以与H2O(g)发生反应:CO(g) + H2O(g) CO2(g)+H2(g) ΔH<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
起始物质的量甲乙丙n(H2O)/ mol0.10 0.20 0.20n(CO)/ mol 0.10 0.10 0.20①该反应的平衡常数表达式为。
②平衡时,丙容器中H2O的物质的量是mol,甲容器中CO的转化率是,容器中CO的转化率:乙甲(填“>”、“=”或“<”)。
③丙容器中,其他条件不变时,温度(填“升高”或“降低”),CO的平衡转化率升高。
(2)除去氮氧化物:①利用甲烷催化还原NO x:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1甲烷直接将NO2还原为N2的热化学方程式为__________②也可用氨气与之发生反应:NO x+NH3→N2+H2O。
现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
26 (14分)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)下列有关海水综合利用的说法中正确的是 ( )A.只需通过物理变化,可从海水中得到钾单质B.海水通过蒸发可得到淡水,通过蒸馏可得到粗盐 C .从海水中可制取溴及其化工产品D.利用潮汐发电是将化学能转化为电能(2)写出工业上用MgCl 2制备金属镁的化学方程式(3) 海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是 ②利用下图装置电解饱和食盐水,其中a 为饱和食盐水,X 和Y 是惰性电极。
电解可制备“84”消毒液(主要成分是NaClO )。
通电时阳极产生的气体被溶液完全吸收,若所得消毒液仅含一种溶质,电解的总化学方程式是 。
“84”消毒液在常温下的 PH 7,用离子方程式表示其原因 。
(4)工业上利用一定的装置电解硫酸钾溶液可制取氢气、氧气、硫酸和氢氧化钾。
若将制得的氢气、氧气和氢氧化钾溶液组合成氢氧燃料电池,则电池负极的电极反应式为 。
