2022局部进展期胃癌围手术期治疗的现状与展望(全文)
2024胃癌新辅助治疗后病理完全缓解的意义及治疗策略(全文)

2024胃癌新辅助治疗后病理完全缓解的意义及治疗策略(全文)摘要新辅助治疗作为局部进展期胃癌综合治疗中的重要一环,已被各大指南所推荐。
部分局部进展期胃癌患者在经过新辅助治疗后,可以达到病理完全缓解,从而获得相对较好的预后。
但局部病理学上的完全缓解是否都能转化成生存获益仍存争议;获得病理完全缓解的患者是否等同于治愈、后续是否需要辅助治疗,这些均尚未明确。
因此,如何预测新辅助治疗后能够达到病理完全缓解的患者以及甄别出真正治愈的患者是未来探索的方向。
局部进展期胃癌患者尽管接受了根治性手术和充分的淋巴结清扫,但其预后仍不尽如人意。
越来越多的研究证据表明,新辅助化疗可以降低肿瘤分期、提高R0切除率、降低复发和转移风险,从而改善患者生存[l-2]o因此,虽然在适应人群上有所差别,但新辅助化疗作为局部进展期胃癌综合治疗中的重要一环,已被各大指南所推荐;甚至有部分局部进展期胃癌患者在经过新辅助化疗后,可以达到病理完全缓解(pathological complete response,pCR),从而获得相对较好的预后。
但局部病理学上的完全缓解是否都能转化成生存获益,以及获得PCR的患者后续是否可以豁免辅助治疗,仍然存在争议。
本文从近年来国内外开展的新辅助治疗的临床研究结果及相关研究进展着手,探讨局部进展期胃癌新辅助治疗后获得PCR 的影响因素、预后价值及综合治疗策略,以期为新辅助治疗后获得PCR患者的临床诊疗提供参考。
一、胃癌新辅助治疗后PCR的现状及影响因素PCR是指在接受新辅助治疗后的胃癌切除标本中,大体观察未见明显肿瘤残留,且在原发肿瘤区域广泛取材,镜下未见肿瘤细胞残留。
对于pCR 的评判标准,有研究认为,原发灶完全缓解即可判断为pCR[3-4];也有研究认为,原发灶和淋巴结均完全缓解才能判断为pCR[5-6]o既往研究结果表明,由于治疗人群不同、治疗模式不同、治疗方案和周期不同,pCR 率差异较大(2.2%~26.8%)[7-14]o一项收集2004—2016年美国国家癌症数据库(National Cancer Database,NCDB)资料的回顾性研究发现,接受新辅助治疗后接受手术的胃癌患者PCR率只有2.2%[7]O 在FLOT4-AIO研究中,采用FLOT方案(氟尿嚅嚏+亚叶酸钙+奥沙利钳+多西他赛)的pCR率为16%,采用ECF(表柔比星+顺钳+氟尿嚅嚏)/ECX(表柔比星+顺钳+卡培他滨)方案的pCR率为6%[8]O在NeoFLOT 研究中,采用PLOT新辅助化疗方案治疗进展期胃癌的pCR率为20%[9]o 在AIO研究中,采用DCX方案(多西他赛+顺钳+卡培他滨)新辅助化疗方案的pCR率为13.7%[10]。
局部进展期胃癌围手术期治疗的现状与展望

局部进展期胃癌围手术期治疗的现状与展望作者:朱正纲文章来源:中华胃肠外科杂志,2021,24(02)摘要在我国,每年新增的胃癌患者中,局部进展期胃癌(LAGC)占大宗。
D2根治性手术及其术后辅助化疗已取得了普遍的共识,该治疗策略明显改善了LAGC患者的预后,但是术后复发率仍然较高(50%~80%),致使远期疗效难以进一步提高。
围手术期治疗,特别是术前新辅助治疗(NAT)能否提高LAGC 疗效,已受到越来越多的关注。
NAT主要定义为术前新辅助化疗或放化疗,旨在使肿瘤临床降期,提高根治手术切除率;减灭微小转移灶,并检测自体对化疗药物的敏感性等。
然而,对于LAGC患者能否从NAT中生存获益,仍存有争议并缺乏高度共识。
本文回顾与分析了LAGC患者围手术期治疗的现状,特别列举了诸多高水平临床研究的结果;同时也初步探讨了围手术期化疗联合分子靶向与免疫治疗的成效。
当我们继续实施NAT并期待更多高质量循证医学证据的同时,必须再次强调R0根治性手术才是治愈LAGC患者最重要的手段。
本世纪初始,胃癌的治疗已从单一手术模式逐渐向以手术为主的综合治疗模式转变。
其中,局部进展期胃癌(locally advanced gastric cancer,LAGC)围手术期治疗的临床意义受到了极大的关注。
既往,在施行D2胃癌根治性手术后予以辅助性化疗已获得普遍共识。
多项大型随机对照临床研究业已证实,术后辅助化疗有助于改善患者无复发生存率(recurrence-free survival,RFS)与总体生存率(overall survival,OS)。
近20年来,对于LAGC患者开展术前新辅助治疗(neoadjuvant therapy,NAT)已愈来愈受到临床关注,但尚缺乏普遍的共识。
NAT临床获益之处可能包括:(1)使原发癌灶或转移淋巴结缩减,达到临床降期;(2)减灭隐匿转移灶,降低术后肿瘤复发率;(3)术前患者体力及其对治疗不良反应的耐受性较好,有利于完成治疗计划;(4)能客观地反映治疗方案对肿瘤的敏感性,为后续治疗提供自体药敏参考。
局部进展期胃癌新辅助化疗和转化治疗的现状与进展完整版

局部进展期胃癌新辅助化疗和转化治疗的现状与进展完整版胃癌是全世界常见恶性肿瘤之一,其发病率在东西方差异较大,东亚地区的发病率远高于欧美地区。
我国是胃癌发病例数最多的国家,约占全世界胃癌患者的42%。
多数患者确诊时已进入进展期,因早期胃癌常缺乏典型的临床表现,且胃镜检查普及程度不同。
中国胃肠肿瘤外科联盟收集全国85家医学中心88 340例胃癌手术患者资料,其中局部进展期胃癌比例高达70.8%。
目前,手术治疗为局部进展期胃癌的首选治疗方案,但若病情处于局部晚期阶段,则手术切除难度较大且复发率较高。
为提高胃癌的根治性切除率、改善预后,国际上广泛开展针对局部进展期胃癌治疗模式的探索。
对于初期可切除的局部进展期胃癌患者,新辅助化疗能缩小肿瘤体积,实现肿瘤降期及根除微转移,可提高手术R0率;而对于不可切除的局部进展期胃癌患者,转化治疗则为患者提供了新方向。
一、新辅助化疗(一)新辅助化疗适用人群近年来,世界各国学者针对局部进展期胃癌积极开展前瞻性临床研究,探讨新辅助治疗的疗效,并据此制订针对不同地区和患者情况的胃癌治疗指南。
根据最新版本的不同指南,新辅助化疗在适应人群范围存在差异。
NCCN的胃癌临床实践指南推荐:全身状况良好、潜在可切除病灶且临床分期为cT2~4N0~3期的患者首选新辅助化疗或新辅助放化疗,将术前辅助化疗联合术后辅助治疗模式作为临床分期≥cT2N0期胃癌的首选治疗方式。
欧洲肿瘤内科学会推荐的适用范围较NCCN更广,推荐为临床分期≥cT1N0期可切除胃癌患者。
日本胃癌协会治疗指南对局部进展期胃癌的新辅助治疗适应证相对较保守,推荐的新辅助化疗适应证为:(1)预计可R0切除但复发风险较高的患者,如cTNM ⅢA~ⅢC期[cT4,cN+,无腹膜和(或)肝转移]患者。
(2)预计可R0或R1切除但预后较差的患者,如淋巴结广泛转移、体积较大的Borrmann Ⅲ型、Borrmann Ⅳ型患者。
中国临床肿瘤学会胃癌临床指南对新辅助化疗的适应证进行明确规定,推荐临床分期Ⅲ期(cT3~4aN1~3M0)胃癌和临床分期Ⅱ期(cT1~2N1~3M0及cT3~4N0M0)的胃食管结合部胃癌患者行包括SOX、XELOX、FOLFOX(5-氟尿嘧啶+亚叶酸钙+奥沙利铂)DOS及FLOT 方案的新辅助治疗。
2022胃癌的术后辅助化疗(全文)
2022胃癌的术后辅助化疗(全文)胃癌是最常见的恶性肿瘤之一,发病率及死亡率一直居高不下,严重危害人类的健康。
目前手术根治切除仍然是胃癌根治的主要手段,D2根治术已成为全球公认的可切除胃癌的标准术式,但中晚期胃癌复发率高达50%以上,规范的术后辅助治疗和定期的复查显得尤为重要。
近年来,通过不断地探索,胃癌的术后辅助治疗方案不断完善,疗效也在不断提升,这给患者带来了更多生存获益。
本文将向大家梳理胃癌术后辅助治疗的研究进展,供诸位读者阅读参考。
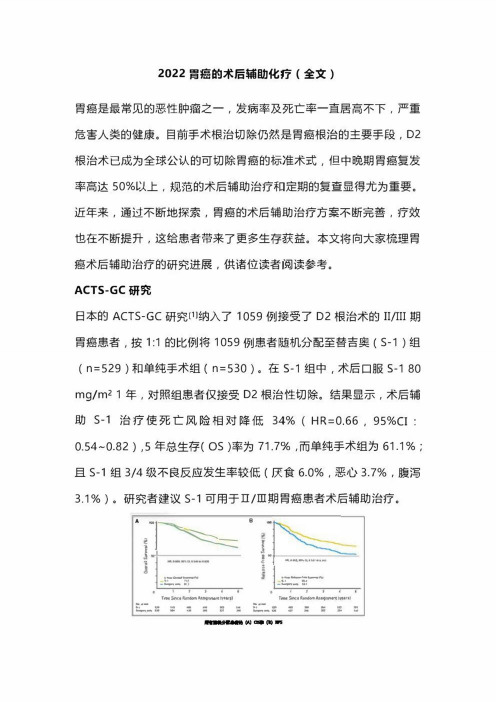
ACTS・GC研究日本的ACTS-GC研究⑴纳入了1059例接受了D2根治术的II/III期胃癌患者,按1:1的比例将1059例患者随机分配至替吉奥(S-1)组(n=529)和单纯手术组(n=530)。
在S・1组中,术后口服S-180 mg/m^1年,对照组患者仅接受D2根治性切除。
结果显示,术后辅助S-1治疗使死亡风险相对降低34%(HR=0.66,95%CI: 0.54~0.82),5年总生存(OS)率为71.7%,而单纯手术组为61.1%;且S-1组3/4级不良反应发生率较低(厌食6.0%,恶心3.7%,腹泻3.1%)。
研究者建议s-1可用于口/ni期胃癌患者术后辅助治疗。
CLASSIC研究⑵是一项随机、开放、平行对照的m期临床研究,纳入了中国大陆、中国台湾地区及薛国共35个中心1035例D2根治术后的II-IIIB期胃癌患者,随机分为单纯手术组(n=515)和术后辅助卡培他滨联合奥沙利钳(XELOX方案)化疗组(n=520)。
结果显示,无论3年无病生存(DFS)率还是5年DFS率,XELOX组较单纯手术组都显著获益(74%vs.59%,HR=0.56,95%CI:0.44-0.72, P<0.0001;68%vs.53%,HR=0.58,95%CI:0.47-0.72,P<0.0001)。
尽管XELOX组表现出较高的3/4级不良反应发生率(中性粒细胞减少22%,恶心8%,血小板减少8%),但基于此研究,XELOX方案也被推荐为胃癌术后辅助化疗的经典方案。
进展期胃癌的治疗现状

蒽环类药物
蒽环类药物在胃癌中的使用频率也很高,目前常用的有阿霉素(ADM)、表阿霉素(EPI)、吡喃阿霉素(THP),它们主要是嵌入DNA碱基对之间,干扰转录过程,阻止mRNA的形成,对细胞周期各阶段均有一定作用,为细胞周期非特异性药物。
蒽环类药物
蒽环类药物与5—FU及其它药物组成的三药联合方案是治疗晚期胃癌的热点。其中含ELFP(EPI、LV、5—FU、CDDP)的方案我国1999年约40多篇报道,其有效率均超过了50%,是令人鼓舞的。
以奥沙利铂为主方案(L-OHP+LV5FU2)在治疗晚期大肠癌中已取得了确切的疗效,国外从1998年,我国从1999年开始用L-OHP+LV5FU2方案治疗晚期胃癌也正在进行,相信不久的将来会设定一个更加合理的治疗方案。
新药
胃癌目前常用化疗方案
FAM方案:5—FU,600mg/m2静滴,d1、8、29、36;阿霉素(ADM),30mg/m2静滴(注),d1、29;丝裂霉素(MMC),10mg/m2 静注,d1,每6周重复。其有效率在33%左右。
小结
肿瘤内科水平的提高(从分子生物学水平进一步了解胃癌的发病机制、提高胃癌早期诊断的水平、化疗理念的更新以及新药的不断出现)必将使晚期胃癌的治疗成果更上一个台阶。
谢谢
添加副标题
演讲人姓名
202X.00.00
拓扑异构酶抑制剂
TopoⅡ抑制剂VP-16、VM-26。
TopoⅠ抑制剂喜树碱类(HCPT、CPT-11、TPT)
拓扑异构酶(包括TopoⅠ、Ⅱ)抑制剂用于治疗胃癌的机会最近不断增多。目前临床常用的有:
拓扑异构酶抑制剂
国内对羟基喜树碱的Ⅱ、Ⅲ期临床资料不太完备,以至于对其最佳治疗剂量缺乏正确的认识。我国已进行最大耐受剂量(MTD)为20mg/m2,d1~5治疗消化道肿瘤的Ⅲ期临床试验,相信将来羟基喜树碱会有一个合适的治疗剂量用于临床。
进展期胃癌外科诊治的现状(一)

进展期胃癌外科诊治的现状(一)【关键词】进展期胃癌分期外科治疗胃癌是常见的恶性肿瘤,全球每年新发病例数达875000〔1〕。
目前我国的胃癌分期主要根据国际抗癌联盟UICC的TNM分期系统和日本胃癌协会JGCA最新胃癌处理规约第13版的分期系统,将胃周淋巴结分为3站33组。
术前分期对胃癌的外科治疗起着关键作用,手术的方式决定依赖于胃癌的分期。
而我国住院患者多属进展期胃癌,故进展期胃癌的诊治是目前胃癌治疗的重要内容。
笔者通过收集近年来的相关文献,对进展期胃癌的外科诊治的现状予以综述,为临床上胃癌的外科治疗提供参考及指导。
一、影像学在进展期胃癌术前分期中的作用1.计算机断层扫描(CT)CT对于胃癌的分期主要依靠增强时的胃壁分层影像,增强的内层为黏膜层,中间或外层的低密度层为黏膜下层。
目前CT对早期胃癌的检出率为50%~81.4%,对进展期胃癌的检出率达90%以上〔2,3〕。
CT对不同大小淋巴结的检出率不同,一般以直径大于10mm者判断为转移淋巴结〔4〕,各文献报道以此标准检出转移淋巴结的特异度均较高,但敏感度较低,因较小的淋巴结也常发生转移,且由于炎性反应等淋巴结直径亦可超过10mm,故单凭大小判断转移显然有许多局限性,容易造成CT分期过低。
若将反应性增生或炎性淋巴结肿大判断为转移,则又可能分期过高。
Jung等〔5〕认为根据大小判断淋巴结转移不能提高准确率。
对于M分期而言,应用CT对肝、脑、肺等远处转移灶的诊断已成为常规。
对于腹膜转移CT判定报道较少,腹膜转移时,腹膜可出现增厚、强化,增厚的腹膜可为均匀型、结节型或不规则型。
如果肠系膜出现种植转移,其CT表现为串状排列的圆形软组织密度影,直径约1~5cm,增厚的肠系膜以系膜根部为中心呈放射状,晚期患者中还可看到所谓的“网膜饼”,它是腹膜转移的最常见征象。
2.磁共振成像(MRI)MRI具有多参数成像能力,腹内各组织器官对比度好,肿大的淋巴结、异常软组织块以及它们对腹内脏器的侵犯,MRI都能较好显示。
进展期胃癌围术期化疗的新进展

进展期胃癌围术期化疗的新进展胃癌是危害人类生命的最常见恶性肿瘤之一,在我国胃癌的发病率和死亡率处于各种恶性肿瘤的前列。
近年来,虽然生活水平和卫生保健意识普遍提高,我国因地区发展不平衡,仍未能在胃癌的高危人群中开展普查,且早期胃癌往往无任何症状,因此进展期胃癌的比例居高不下。
根据最新临床研究成果建立适合我国国情的诊治规范,是未来我国胃癌诊治的主要研究方向[1]。
围术期化疗是进展期胃癌的重要措施之一,但目前尚无标准的化疗方案。
最近几年以来按照循征医学开展临床试验,取得的临床研究成果更加科学,具有更高的可信度。
随着一些新药进入临床,一定程度上提高了进展期胃癌治疗的有效率[2],依据化疗目的分为:新辅助化疗、辅助性化疗,本人对进展期胃癌围术期化疗的进展作一综述。
1 新辅助化疗进展期胃癌新辅助化疗是指患者在术前接受化疗,所针对的是无远处转移的局部进展期胃癌人群,目的在于减少肿瘤的负荷,使肿瘤降期,提高R0切除率,消灭微小转移灶和腹腔种植转移灶,延长肿瘤复发和转移时间,同时可以了解患者对化疗药物的敏感性,指导术后化疗药物的选择[3]。
近年来有许多研究显示,进展期胃癌新辅助化疗的有效性,2005年Cnningham等报道了MAGIC试验结果[4],第一个开展新辅助化疗联合辅助性化疗治疗进展期胃癌试验,开创了进展胃癌化疗的新模式,503例患者随机分为新辅助化疗组和单纯手术组,前者进行ECF(EPI+CDDP+5-FU)方案化疗,术前及术后分别3个疗程,与单纯手术组相比,术后并发症的发生率无差异,R0切除率和5年生存率明显提高。
另有FFCD9703的法国临床试验,观察进展期胃癌术前术后应用顺铂+氟尿嘧啶化疗的疗效,随机分试验组(113例)和单纯手术组(110例),两组5年无病生存率分别为38%和24%,提示FP化疗明显提高了进展期胃癌患者的远期生存。
目前西方国家正在进行MAGIC BⅢ期临床研,采用ECX方案代替ECF方案(即用XLODA代替5-FU),和或加入贝伐珠单抗,随机分为ECX组或ECX联合贝伐珠单抗组,术前术后分别3个周期化疗,观察ECX方案的副作用及疗效,同时观察贝伐珠单抗在围术期化疗的价值。
局部进展期胃癌围手术期化疗的研究进展(全文)

局部进展期胃癌围手术期化疗的研究进展(全文)摘要胃癌D2根治术已成为标准治疗,基于ACTS-GC试验和CLASSIC试验的结果,胃癌D2根治术+辅助化疗成为当前标准治疗策略。
新辅助化疗可以提高R0切除率,但有关新辅助化疗的方案选择、最佳疗程等方面并未达成共识。
本文将回顾近年来胃癌新辅助化疗的研究进展。
近年来,全世界胃癌的发病率呈现了下降的趋势。
但统计显示,2012年,胃癌仍然是世界范围内第5位常见的恶性肿瘤(952 000新发病例),第3位癌症死因(723 000死亡)。
我国是胃癌的高发国家,2015年,胃癌的发病率位居所有恶性肿瘤的第2位,仅次于肺癌。
目前,胃癌的治疗方法主要包括手术、化疗、放疗、靶向药物治疗和免疫治疗。
对于局部进展期胃癌,完整的手术切除是必不可少的治疗方式。
病理报告显示早期胃癌的淋巴结转移率为15%,pT2~T4a肿瘤的淋巴结转移率可达40%~70%,所以淋巴结清扫是必须的。
Dutch试验显示D2清扫后的胃癌相关病死率显著的低于D1清扫。
在日本进行的一项Ⅲ期临床试验中,D2手术+腹主动脉旁淋巴结清扫并没有提高患者的生存率。
基于上述研究,胃癌D2根治术成为局部进展期胃癌的标准手术。
但是,手术的主要作用是切除肉眼可见的肿瘤,不能清除掉术前和术中播散在术野外微小转移的癌细胞。
这些无法看到的癌细胞可以逐渐分化、变为可见的复发病灶。
胃癌术后复发的形式包括局部复发、远处(淋巴结或血行)转移和腹膜转移。
对于局部进展期胃癌,东亚和西方患者的转移形式的发病率不同。
在美国,局部复发和血行转移较为常见;在东亚,腹膜、血行和淋巴结转移更为常见。
在日韩和中国,辅助化疗是手术后的标准治疗,而在美国,放化疗是标准治疗。
辅助化疗的目的就是在根治切除大体肿瘤后,清除肉眼无法看见的微小转移的癌细胞。
为更好地了解国内外胃癌围手术期化疗的现状,本文回顾了近年来的局部进展期胃癌的围手术化疗的研究。
1 局部进展期胃癌的辅助化疗从2005年开始,2项关键的临床试验在东亚地区进行:ACTS-GC和CLASSIC试验,证实了术后辅助化疗使pⅢ期的胃癌患者的生存获益。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2022局部进展期胃癌围手术期治疗的现状与展望(全文)摘要胃癌是常见的消化道恶性肿瘤之一,局部进展期胃癌肿瘤负荷大,多存在微小转移病灶,复发风险高。
“D2根治术+围手术期治疗”的综合治疗逐渐成为局部进展期胃癌的标准治疗模式。
近年来,放疗、靶向治疗、尤其是免疫治疗应用于局部进展期胃癌的围手术期治疗探索不断取得突破。
笔者深入分析国内外相关研究进展,系统阐述局部进展期胃癌围手术期治疗的现状和展望。
关键词胃肿瘤;局部进展期;围手术期治疗;联合治疗;辅助治疗;新辅助治疗中国是全世界胃癌发病率和病死率最高的国家,2020年中国新发病例47.9万人,新发死亡病例37.4万人,在全世界占比分别为43.9%和48.6%[1]。
同为胃癌高发地区,日本与韩国新发病例以早期胃癌为主,而中国则以进展期胃癌为主[2]。
按照美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)联合制订的第8版胃癌cTNM分期,局部进展期胃癌的临床分期包括cT1~2N+M0期或cT3~4b任意NM0期。
高级别临床研究结果显示:D2根治术能有效减少局部复发和提高患者生存率[3‑5]。
中国临床肿瘤学会(CSCO)和日本胃癌学会(JGCA)的胃癌治疗相关指南均推荐进展期胃癌行D2根治术[6‑7]。
近年来,西方国家也逐渐把D2淋巴结清扫作为治疗局部进展期胃癌的推荐手术范围。
CLASS‑01研究比较传统开腹手术与腹腔镜手术的安全性与肿瘤学疗效。
该研究为腹腔镜远端胃癌D2根治术的可行性提供全世界首个高级别证据,使腹腔镜微创手术成为进展期胃癌可选择的手术方式之一[8]。
尽管合适的手术范围与方式已经逐渐明确,但局部进展期胃癌患者术后复发风险高。
因此,能否通过围手术期治疗进一步降低患者术后复发风险成为近20年来的研究热点,多项大型随机对照研究进行不同治疗方案与治疗时机探索。
由于研究结果不尽相同,东西方国家对于局部进展期胃癌的围手术期治疗也存在差异。
在D2淋巴结清扫的手术范围逐渐确立以后,局部进展期胃癌围手术期治疗模式的探索可分为以下3个方面:术后辅助化疗与放化疗、新辅助化疗与放化疗、靶向与免疫治疗。
笔者深入分析国内外相关研究进展,系统阐述局部进展期胃癌围手术期治疗的现状和展望。
一、局部进展期胃癌的术后辅助化疗与放化疗(一)局部进展期胃癌的术后辅助化疗亚洲日本开展胃癌术后辅助化疗的临床研究较早,ACTS‑GC研究及JACCRO GC‑07是代表性研究[9‑10]。
2011年发布的ACTS‑GC研究共纳入1 059例行D2根治术且术后病理学检查为Ⅱ期或Ⅲ期的胃癌患者,随机分配至观察组或S‑1化疗组,该研究结果显示:与观察组比较,S‑1化疗组患者的5年疾病无进展生存率(65.4%比53.1%,HR=0.65,95%CI:0.54~0.80)和5年总体生存率(71.7%比61.1%,HR=0.67,95%CI:0.54~0.83)均显著升高[9]。
进一步亚组分析结果显示:术后单药S‑1辅助化疗能为Ⅱ期或ⅢA期患者带来生存获益,但不能改善ⅢB期患者的生存情况[9]。
Ⅲ期胃癌患者术后辅助化疗中联合用药能否进一步改善生存?为回答该问题,日本进一步开展JACCRO GC‑07研究,比较S‑1联合多西他赛与单药S‑1辅助治疗D2根治术后Ⅲ期胃癌患者的疗效。
该研究纳入915例术后病理学分期Ⅲ期胃癌患者,1∶1随机分为单药S‑1化疗组或S‑1联合多西他赛化疗组,研究结果于2021年发布:与单药S‑1化疗组比较,S‑1联合多西他赛可显著改善患者3年疾病无复发生存率(67.7%比57.4%,P=0.000 8)和3年总体生存率(77.7%比71.2%,P=0.007 6)[10]。
因此,日本推荐S‑1联合多西他赛方案为D2根治术后Ⅲ期胃癌患者术后辅助化疗的新标准。
CLASSIC是一项亚洲多中心随机对照3期临床研究,共纳入1 035例D2根治术后Ⅱ~ⅢB期胃癌患者,1∶1随机分配至术后观察组或术后XELOX 辅助化疗组,结果显示:与观察组比较,术后XELOX辅助化疗可显著改善患者5年无病生存率(68%比53%,P<0.000 1)和5年总生存率(78%比69%,P=0.001 5);且亚组分析结果显示:XELOX辅助化疗带来的生存获益在不同分期、国家、年龄患者中均一致性存在[11]。
2018年韩国学者回顾性分析XELOX方案与单药S‑1用于胃癌D2根治术后辅助治疗的临床疗效,结果显示:与单药S‑1比较,XELOX方案在pⅢA、pⅢB、pⅢC期患者中的疗效更为显著[12]。
CLASSIC研究确立了XELOX方案作为D2根治术后Ⅱ期或Ⅲ期胃癌辅助化疗的地位,获得美国国立癌症综合网络(NCCN)指南及CSCO指南的一致推荐。
我国季加孚教授和沈琳教授牵头开启的RESOLVE研究是一项全国多中心、三臂、随机、开放性3期临床试验,共纳入1 049例cT4aN+M0期或cT4bNxM0期的胃癌或食管胃结合部腺癌患者,按1∶1∶1随机分配至D2根治术+XELOX辅助化疗组、D2根治术+SOX辅助化疗组、SOX术前化疗+D2根治术+SOX术后化疗组[13]。
该研究结果显示:术后XELOX 辅助化疗组与SOX辅助化疗组的3年无病生存率比较,差异无统计学意义(51.1%比56.5%,P=0.170);围手术期SOX化疗组患者的3年无病生存率高于术后XELOX辅助化疗组(59.4%比56.5%,P=0.027)。
RESOLVE研究证实了术后辅助化疗中SOX方案不劣于XELOX方案,且SOX新辅助化疗可进一步提高患者的无病生存率,为中国进展期胃癌患者的治疗提供高级别证据,被中国胃癌诊治专家指南作为Ⅰ级证据录入[6]。
高度微卫星不稳定或错配修复缺陷患者是一类特殊人群,在局部进展期胃癌的相关研究中,一项多中心Meta分析纳入新辅助化疗的MAGIC研究和术后辅助化疗的CLASSIC、ARTIST和ITACA‑S研究,探索高度微卫星不稳定患者的预后和接受围手术期化疗的价值,结果显示:对于局部进展期可手术切除的错配修复缺陷或高度微卫星不稳定患者,与术后辅助化疗比较,单纯手术预后更佳[14]。
2021版的CSCO指南将该类型患者单列,且对术后治疗不作推荐,推荐患者参加相关临床试验。
(二)局部进展期胃癌的术后辅助放化疗与亚洲国家不同,欧美国家在早期多行D1或D0胃癌切除术,因此,其临床研究设计多为术后化疗联合放疗。
2012年发表的北美INT‑0116研究结果奠定了胃癌术后辅助放化疗的地位,该研究纳入1991―1998年559例T3期或T4期可手术切除的胃癌患者,随机分配至手术组或者手术+术后放化疗组(放疗+氟尿嘧啶),结果显示:手术+术后放化疗组3年中位疾病无复发生存时间(27个月比19个月,P<0.001)和3年中位总体生存时间(35个月比27个月,P=0.004 6)均显著优于单纯手术组[15]。
基于该研究结果,术后同步放化疗被NCCN胃癌指南推荐用于局部进展期胃癌术后辅助治疗。
然而,该研究中行D2淋巴清扫术患者仅9.6%,绝大多数患者手术范围为D1(36%)和D0(54%),因此,该研究结论并不适合行D2淋巴结清扫患者。
在亚洲国家,“D2根治术+术后辅助化疗”常规推荐用于局部进展期胃癌患者的治疗,在此基础上,放疗能否进一步改善生存?韩国ARTIST研究比较D2根治术+XP与D2根治术+XP+放疗的疗效,两组3年无病生存率比较,差异无统计学意义(74.2%比78.2%,P=0.086 2)[16]。
ARTIST ‑Ⅱ研究比较针对淋巴结阳性患者的D2根治术+SOX与D2根治术+SOX+放疗的疗效,两组患者3年无病生存率比较,差异无统计学意义(74.3%比72.8%)[17]。
上述2项临床研究证实,在D2淋巴结清扫术+两药辅助化疗的基础上,增加放疗不能进一步改善患者生存。
同时也提示,前述INT‑0116研究术后辅助放化疗获益的主要原因可能来自该研究中患者手术中淋巴结清扫范围不足。
基于多项大型随机对照研究结果(表1),对于局部进展期胃癌患者,D2根治术后辅助化疗可显著改善生存,S‑1、S‑1+多西他赛、SOX、XELOX 均为可选择的化疗方案。
对于D2根治术后Ⅲ期胃癌患者,两药联合化疗比单药化疗疗效更好。
目前,各大指南均推荐局部进展期胃癌术后接受辅助治疗。
在术后化疗基础上增加放疗,可提高D1或D0清扫范围患者的生存率,但不能进一步改善D2根治术后患者生存。
二、局部进展期胃癌的新辅助化疗与放化疗新辅助治疗是指术前给予化疗或放疗等,旨在降低肿瘤临床分期、提高R0切除和病理学缓解程度、改善患者预后。
新辅助化疗有消灭微小转移、减少术后复发等潜在优势。
术前肿瘤血管更丰富,给药更容易通过血管进入肿瘤内部,并可增加放疗敏感性。
术前新辅助放疗更容易针对肿瘤定位,放射容积更精准,从而减少不良反应等。
局部进展期胃癌淋巴结转移和术后复发风险高,且术后辅助放化疗的疗效瓶颈已难以突破。
因此,针对局部进展期胃癌,许多国家开展了一系列新辅助化疗或放化疗研究。
(一)局部进展期胃癌的新辅助化疗欧洲MAGIC研究在2006年首先报道了胃癌新辅助治疗相关数据,该研究纳入503例cⅡ期或cⅢ期的胃癌或食管胃结合部癌患者,1∶1随机分配至单纯手术组或新辅助化疗组(ECF+手术+ECF),结果显示:新辅助化疗组的5年总体生存率(36%比23%,P=0.009)和3年疾病无进展生存率(38%比26%,P<0.001)均高于单纯手术组,且并发症发生率比较,差异无统计学意义(46%比45%,P>0.05)[18]。
2011年发表的FNCLCC/FFCD研究纳入224例胃或食管胃结合部癌患者,随机分配至单纯手术组或两药新辅助化疗组(CF+手术+CF),结果显示:接受新辅助化疗的患者在R0切除率、无病生存率、总体生存率均获益显著[19]。
此研究进一步证实新辅助化疗在局部进展期胃癌的有效性。
MAGIC研究结果奠定了欧洲ECF新辅助化疗的基础,曾被NCCN指南优先推荐。
2019年发布的FOLT4‑AIO研究头对头比较新辅助FLOT方案与ECF/ECX 方案的疗效,共纳入716例cT2~4NxM0期或者cTxN+M0期的胃或食管胃结合部腺癌患者,随机分为FLOT组(FLOT+手术+FLOT)和ECF/ECX 组(ECF/ECX+手术+ECF/ECX),结果显示:与ECF/ECX组比较,FLOT 组患者的R0切除率更高(85%比78%,P=0.016),3年疾病无进展生存时间(30个月比18个月,P=0.004)和5年总体生存时间(50个月比35个月,P=0.012)均显著延长[20]。
基于FLOT4‑AIO研究,欧洲肿瘤内科学会(ESMO)和NCCN指南均将FLOT方案作为局部进展期胃癌围手术期治疗推荐方案,并且删除对ECF方案的推荐。
