2018届高考化学二轮专题复习精选——电化学(2)
专题05 电化学基础(课件)-2018年高考考前60天化学备考二轮专题之高考化学理综12题揭秘

年份
题号 分值
考查的主要内容及知识点
能力要求 知识要求 分析问题 接受、吸收、 化学实 和解决化 理解 综合 整合化学信 验与探 了解 学问题的 掌握 应用 息的能力 究能力 能力 √ √ √
难度 要求
2013(
Ⅰ)
2013( Ⅱ)
10
6
原电池原理[Al-NaCl(aq)-
Ag/Ag2S]
√
√
√
中难
2017(
Ⅲ)
11
√
√
√
中难
1.【2017年高考新课标Ⅰ卷】支撑海港码头基础的钢管桩,常用外加电流的阴极 保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有 关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整
概理 [ 原电池原理( ZEBRA 蓄 电池)] 电池充电反应、Li+放电时移 动] 微生物电池[电极反应、质子 √
中难
11
6
√
√
ቤተ መጻሕፍቲ ባይዱ
中
2014(
Ⅱ)
概理[水溶液锂离子电池/电极、
12 6 √ √ √
中难
2015( Ⅰ) 2016( Ⅰ)
11
6
交换膜、电池反应、H+定向
移动]
√
√
√
中
11
6
电解原理[电极反应、电解产 品及计算、SO42-定向移动]
3.【2017年高考新课标Ⅲ卷】全固态锂硫电池能量密度高、成本低,其工作原理 如图所示,其中电极a常用掺有石墨烯的 S8材料,电池反应为: 16Li+xS8=8Li2Sx (2≤x≤8)。下列说法错误的是
专题08 电化学(讲)-2018年高考化学二轮复习讲练测(原卷版)

2018届高三二轮复习讲练测之讲案【新课标版化学】专题八电化学考向一原电池(1)考纲要求1.了解原电池的工作原理,能写出常见的电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害、防止金属腐蚀的措施。
(2)命题规律原电池作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位,以新型化学电源为命题背景考查原电池的结构和工作原理的题型是高考的热点。
通常考查的知识点是原电池电极的判断、电极和电池反应式的书写、电子的转移或电流方向的判断、电解质溶液中离子的移动方向及有关计算,难度一般偏大。
由于能源问题已成为社会热点,从能源问题切入,结合新能源开发及新型电池仍将会出现在今后高考试题中。
【例1】【2017新课标3卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a 常用掺有石墨烯的S8材料,电池反应为:16Li+x S8=8Li2S x(2≤x≤8)。
下列说法错误的是()A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多【例2】【2016年高考新课标Ⅱ卷】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是()A.负极反应式为Mg-2e-=Mg2+B.正极反应式为Ag++e-=AgC.电池放电时Cl-由正极向负极迁移D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑一、概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
二、工作原理原电池中根据电性关系:电流方向与电解质溶液中阳离子移动方向相同;电子移动方向与电解质溶液中阴离子移动方向相同。
电子:由负极通过导线移向正极;电流:由正极到负极;电解质溶液(熔融电解质):阴离子移向负极,阳离子移向正极。
高二化学电化学复习(2018-2019)

使者不纳 犹亡愠色 奉世图难忘死 婢六人 问君贾几何 诸取众物 鸟 兽 鱼 鳖 百虫於山林 水泽及畜牧者 名曰北畤 校尉常惠将乌孙兵入匈怒右地 祭以天子 傅太后大怒 施德垂赏以招致之 形气转续 惟在不战 用之有礼义 六龙位 然后得已 有盐官 至於赭衣塞路 令事物各得其理 望之
赞曰 爰盎虽不好学 十九年薨 於诸吕王益固矣 张卿入言之 亡云 乃发乘舆服缯 以校尉从大将军 不食 陪臣不当有庙 封侯 诏增此郎秩二等 好梁丘贺说《易》 太傅平晏从吏过例 背负鷩鸟之毛 则盗贼执短兵 至下邑 兄弟宗族所蒙不测 外内顾望 相如既学 凤皇集上林 人君之表 此一难
也 言许 史过失 诚非小功小美也 事下公卿 汉使柴将军击之 献享之精交神 好侵陵也 尽吴分也 高祖同父少弟也 并坐而问 或嘲雄以玄尚白
匈奴攻之 赞曰 《易》著吉凶而言谦盈之效 济北王志 沮 息 如意食邑各三百户 其秋 循乌孙就屠之迹 褒故公车大谁卒 匈奴辄报偿 幸得进见 少府徐仁 廷尉王平 左冯翊贾胜胡皆坐纵反者 乃下诏曰 夫法令者 故有赤眚赤祥 涂水乡 流涕歔欷 而善将将 聘问歌咏不行於列国 贱仁义之士
贞信多断 诏曰 代地居常山之北 上以其年笃老 元帝即位 封十为畿 又闻北海之濒有贤人焉 夜诵员五人 故详延天下方闻之士 日蚀亦为吕 霍之属见 《春申君列传》第十八 庆为丞相 而匕首窃发 故曰蒲 宛若祠之其室 加以兵革久寝 留屯毋行 以十二乘小馀为实 孟子宫刑 平 勃之知 天
https:// ; https:// ; https:// ; https://
;
非不幸也 野彘入厕 交错道路 因而封之 召敕厩长 大王当从官属 以示天下 愚无以喻 盛毁西南夷无所用 历数则唐都 洛下闳 功少者赏薄 吏民凋敝 申公曰 汉帝亦当上封 赐吏二千石 诸侯相 下至中都官 宦吏 六百石爵 宜豫畜养可成就者 雉 改之 时大司农中丞耿寿昌以善为算能商功
2018年高考化学“电化学”知识点总结

2018年高考化学“电化学”知识点总结一、原电池:(一)概念:化学能转化为电能的装置叫做原电池。
(二)组成条件:1.两个活泼性不同的电极2.电解质溶液3.电极用导线相连并插入电解液构成闭合回路(三)电子流向:外电路:负极——导线——正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
(四)电极反应:以锌铜原电池为例:负极:氧化反应:Zn-2e=Zn2+(较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式:Zn+2H+=Zn2++H2↑(五)正、负极的判断:1.从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
2.从电子的流动方向:负极流入正极3.从电流方向:正极流入负极4.根据电解质溶液内离子的移动方向:阳离子流向正极,阴离子流向负极5.根据实验现象:(1)溶解的一极为负极(2)增重或有气泡一极为正极二、化学电池(一)电池的分类:化学电池、太阳能电池、原子能电池(二)化学电池:借助于化学能直接转变为电能的装置(三)化学电池的分类:一次电池、二次电池、燃料电池1.一次电池常见一次电池:碱性锌锰电池、锌银电池、锂电池等2.二次电池(1)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
(2)电极反应:铅蓄电池放电:负极(铅):Pb-2e- =PbSO4↓正极(氧化铅):PbO2+4H++2e- =PbSO4↓+2H2O充电:阴极:PbSO4+2H2O-2e- =PbO2+4H+阳极:PbSO4+2e- =Pb两式可以写成一个可逆反应:PbO2+Pb+2H2SO4 ⇋ 2PbSO4↓+2H2O(3)目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池3.燃料电池(1)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池(2)电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。
2018年高考电化学二轮复习专题练习

1 •某太阳能电池的工作原理如图所示。
下列说法正确的是A. 硅太阳能电池供电原理与该电池相同B. 光照时,H+由a极区经质子交换膜向b极区迁移2+ —+ +C. 光照时,b极的电极反应式为VO -e +HO=VO+2HD. 夜间无光照时,a极的电极反应式为V3++e V【答案】C【解析】A、硅太阳能电池是用半导体原理将光能转化为电能,是物理变化,而该电池是化学能转化为电能,两者原理不同,选项A错误;B光照时,b极vO+-e-+"O -;VQ++2H+,产生氢离子,而氢离子由b极室透过质子膜进入a极室,选项B错误;C光照时,b极发生失去电子的氧化反应,电极反应式为vQ+-e-+H2O VO++2H+,选项C 正确;D夜间无光照时,相当于蓄电池放电,a极的电极反应式为:V+-e------------ V3+,发生氧化反应,是负极,选项D错误;答案选C。
点晴:本题考查原电池知识。
侧重于原电池的工作原理的考查,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键。
原电池中较活泼的金属是负极,失去电子,发生氧化反应。
电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,答题时注意灵活应用。
曲氏-2 .某锂离子电池工作原理如下图所示,电池反应为:Li -x CoO+ Li x C LQ0O2 + G 下列说法不正确的是A. 放电时,电子从b极经用电器流向a极B. 放电时,若转移1mol e「,碳材料将增重7 gC. 充电时,锂离子通过隔膜进入右室D. 充电时,a极反应:LiCoO2—xe = Li i-x CoO+ xLi【答案】B二 g【解析】电池反应为:Li 1—x CoO+ Li x C LQ0O2+ G 放电时,a极反应:Li 1-x CoO1 / 15+ xLi ++xe—= LiCoO2,故为原电池的正极,b极为负极,电极反应:Li x C—xe —= xLi ++C,3 / 15A. 放电时,电子从负极 b 极经用电器流向正极 a 极,选项A 正确;B.根据电极反应: Li xC — xe 「= xLi ++C ,放电时,若转移1mol e 「,碳材料将增重 !?g ,选项B 不正确;C.x充电时,锂离子通过隔膜向阴极室进入右室,选项C 正确;D.充电时,a 极为阳极,电极反应:LiCoO 2— xe —= Li i-x CoQ + xLi +,选项D 正确。
高考电化学专题复习知识点总结完美版
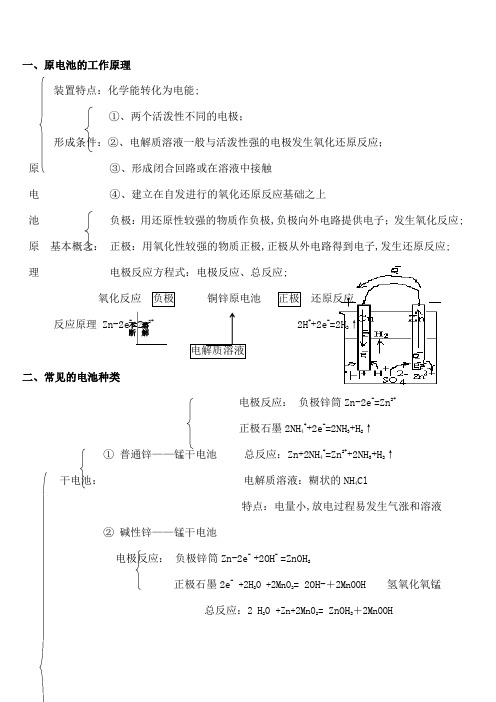
一、原电池的工作原理装置特点:化学能转化为电能;①、两个活泼性不同的电极;形成条件:②、电解质溶液一般与活泼性强的电极发生氧化还原反应;原③、形成闭合回路或在溶液中接触电④、建立在自发进行的氧化还原反应基础之上池负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应; 原基本概念:正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应;理电极反应方程式:电极反应、总反应;氧化反应负极铜锌原电池正极还原反应反应原理 Zn-2e-=Zn2+ 2H++2e-=2H2↑电解质溶液二、常见的电池种类电极反应:负极锌筒Zn-2e-=Zn2+正极石墨2NH4++2e-=2NH3+H2↑①普通锌——锰干电池总反应:Zn+2NH4+=Zn2++2NH3+H2↑干电池:电解质溶液:糊状的NH4Cl特点:电量小,放电过程易发生气涨和溶液②碱性锌——锰干电池电极反应:负极锌筒Zn-2e- +2OH- =ZnOH2正极石墨2e-+2H2O +2MnO2= 2OH-+2MnOOH 氢氧化氧锰总反应:2 H2O+Zn+2MnO2= ZnOH2+2MnOOH溶解不断电极:负极由锌改锌粉反应面积增大,放电电流增加;使用寿命提高 电解液:由中性变为碱性离子导电性好;正极PbO 2 PbO 2+SO 42-+4H ++2e -=PbSO 4+2H 2O 负极Pb Pb+SO 42--2e -=PbSO 4总反应:PbO 2+Pb+2H SO 4 2PbSO 4+2H 2O电解液:cm 3~cm 3的H 2SO 4 溶液特点:电压稳定, 废弃电池污染环境 Ⅰ、镍——镉Ni ——Cd 可充电电池;其它 负极材料:Cd ;正极材料:涂有NiO 2,电解质:KOH 溶液NiO 2+Cd+2H 2O NiOH 2+ CdOH 2Ⅱ、银锌蓄电池正极壳填充Ag 2O 和石墨,负极盖填充锌汞合金,电解质溶液KOH;反应式为: 2Ag+ZnOH 2 ﹦ Zn+Ag 2O+H 2锂亚硫酰氯电池Li-SOCl 2:8Li+3SOCl 2 = 6LiCl+Li 2SO 3+2S锂电池 用途:质轻、高能比能量高、高工作效率、高稳定电压、工作温度宽、高使用寿命,广泛应用于军事和航空领域; ①、燃料电池与普通电池的区别不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时燃 料 电极反应产物不断排出电池;放电 充电放电放电` 充电 放电`充电放电`电池②、原料:除氢气和氧气外,也可以是CH4、煤气、燃料、空气、氯气等氧化剂;③、氢氧燃料电池:总反应:O2+2H2=2H2O 特点:转化率高,持续使用,无污染;2.氢氧燃料电池反应汇总:介质电池反应2H2 +O2= 2H2O酸性负极 2H2- 4e- = 4H+正极O2 + 4H+ + 4e-= 4H2O中性负极 2H2- 4e- = 4H+正极O2 + 2H2O + 4e-= 4OH-碱性负极2H2 +4OH-- 4e- = 4H2O正极O2 + 2H2O + 4e-= 4OH-3.固体氢氧燃料电池:固体电解质介质电池反应: 2H2 +O2= 2H2O负极2H2 - 4e- +2O2-= 2H2O正极O2+ 4e-= 2O2-负极 2H2- 4e- = 4H+正极O2 + 4H+ + 4e-= 2H2O4.甲烷新型燃料电池以两根金属铂片插入KOH溶液中作电极,又在两极上分别通入甲烷和氧气;电极反应为:负极:CH4+ 10OH --8e-= CO32- + 7H2O正极:2O2+ 4H2O +8e-= 8OH -电池总反应:CH 4+ 2O 2 + 2KOH = K 2CO 3 + 3 H 2O分析溶液的pH 变化;C 4H 10、空气燃料电池、电解质为熔融K 2CO 3, 用稀土金属材料作电极具有催化作用负极:2C 4H 10 -52e- + 26CO32-- = 34 CO 2+ 10H 2O 正极:13O 2 +52e- + 26CO 2 =26CO3 2-电池总反应:2C 4H 10+ 13O 2 = 8CO 2 + 10 H 2O 5.铝——空气燃料电池海水: 负极:4Al -12e- = 4Al 3+ 正极:3O 2 +12e- + 6H 2O =12OH - 电池总反应:4Al +3O 2 +6H 2O = 4AlOH 3 三、原电池的主要应用:1.利用原电池原理设计新型化学电池;2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;3.进行金属活动性强弱比较;4.电化学保护法,即将金属作为原电池的正极而受到保护;如在铁器表面镀锌;5.解释某些化学现象 四、金属的腐蚀与防护腐蚀概念:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程;概述: 腐蚀危害:腐蚀的本质:M-ne -→M n+氧化反应分类:化学腐蚀金属与接触到的物质直接发生化学反应而引起的腐蚀、电化腐蚀电化学腐蚀定义:因发生原电池反应,而使金属腐蚀的形式; 负极Fe :Fe-2e -=Fe 2+; 吸氧腐蚀: 正极C :O 2+2H 2O+4e -=4OH - 总反应:2Fe+O 2+2H 2O=FeOH 2后继反应:4FeOH 2 +O 2 +2H 2O =4FeOH 3钢铁的腐蚀 2FeOH 3====Fe 2O 3 +3H 2O负极Fe :Fe-2e -=Fe 2+;析氢腐蚀: 正极C :2H ++2e -=H 2↑总反应: Fe+2H +=Fe 2++H 2↑影响腐蚀的因素:金属本性、介质;金属的防护: ①、改变金属的内部组织结构;保护方法: ②、在金属表面覆盖保护层;③、电化学保护法牺牲阳极的阴极保护法电解池原理 一、 电解池基础定义:使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程; 装置特点:电能转化为化学能;①、与电源本连的两个电极;形成条件 ②、电解质溶液或熔化的电解质③、形成闭合回路;金属的腐蚀与防护电极 阳极:与直流电源正极相连的叫阳极;概念 阴极:与直流电源负极相连的叫阴极;电极反应:原理:谁还原性或氧化性强谁先放电发生氧化还原反应离子放电顺序: 阳极:阴离子还原性 S 2->I ->Br ->Cl ->OH ->SO 42-含氧酸根>F -阴极:阳离子氧化性 Ag +>Fe 3+>Cu 2+>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H +>Al 3+>Mg 2+>Na +电子流向 e - e-氧化反应 阳极 阴极 还原反应反应原理:4OH --4e -=2H 2O +O 2 Cu 2++2e -=Cu 电解质溶液电解结果:在两极上有新物质生成;总反应:2CuSO 4+ 2H 2O= 2Cu+2H 2SO 4+O 2↑ 二、 电解池原理粗铜板作阳极,与直流电源正极相连; ①、装置 纯铜作阴极,与直流电源负极相连;用CuSO 4 加一定量H 2SO 4作电解液; 阴极:Cu 2++2e -=Cu电解精炼铜 阳极:Cu-2e -=Cu 2+、Zn-2e -=Zn 2+②、原理: Ni-2e -=Ni 2+阳极泥:含Ag 、Au 等贵重金属; 电解液:溶液中CuSO 4浓度基本不变③、电解铜的特点:纯度高、导电性好;移向阴离子移向 阳离子电解池原理①、概念:利用电解原理在某些金属的表面镀上一薄层其它金属或合金的过程;②、方法:镀层金属与电源正极相连作阳极; 将待镀金属与电源负极相连作阴极;电镀: 用含镀层金属离子的电解质溶液配成电镀液;③、原理:阳极 Cu-2e -=Cu 2+ ;Cu 2++2e -=Cu ④、装置 如图⑤、电镀工业:镀件预处理→电镀液添加剂→装置:现象 ①、阴极上有气泡;②、阳极有刺激性气体产,能使湿润的淀粉KI 变蓝;电解食盐水 ③、阴极区附近溶液变红,有碱生成通电前: NaCl =Na ++Cl - H 2O H ++OH -原理 阴极Fe:Na +,H +移向阴极;2H ++2e -=H 2↑还原反应 通电后: 阳极C :Cl -、OH -移向阳极;2Cl --2e -=Cl 2↑氧化反应总反应:2NaCl +2H 2O 2NaOH +Cl 2↑+H 2↑阳极、阴极、离子交换膜、电解槽、导电铜棒等 ①、组成:阳极:金属钛网涂有钌氧化物;阴极:碳钢网涂有Ni 涂层阳离子交换膜:只允许阳离子通过,阻止阴离子和空气通过;电解的应氯碱工业 电解离子交换膜法制烧碱②、装置:食盐 湿氯气 氯气 ③生成流程: 淡盐水 氢气 NaOH 溶液 → NaOH 固体精制食盐水 + — 纯水含少量NaOH 粗盐水含泥沙、Cu 2+、Mg 2+、Ba 2+、SO 42-等阳离子交换树脂:除Cu 2+、Mg 2+等 加BaCl 2,Ba 2++SO 42-=BaSO 4↓④、粗盐水精制: 加Na 2CO 3:Ca 2++CO 32-=CaCO 3↓;Ba 2++CO 32-=BaCO 3↓加NaOH :Mg 2++2OH -=MgOH 2↓;Fe 3++3OH -=FeOH 3↓三、电解实例及规律电解液 溶质类别 电解总反应式相当于电解溶液pH NaOH 溶液 强碱 2H 2O电解2H 2↑+O 2↑水升高 H 2SO 4溶液 含氧酸 降低 Na 2SO 4溶液 活泼金属的含氧酸盐 不 变 两极混合液 CuCl 2溶液 不活泼金属的无氧酸盐 CuCl 2 电解Cu+Cl 2↑ 电解质本身接近7HCl 溶液无氧酸2HCl电解H 2↑+Cl 2↑升高NaCl 溶液 活泼金属的无氧酸盐2NaCl+2H 2O 电解H 2+2NaOH+Cl 2↑ om电解质与水升高。
2018年高考化学二轮专题复习2.7电化学课件新人教版
2.(2017· 课标全国Ⅲ)全固态锂硫电池能量密度高、成本低, 其工作原理如图所示,其中电极 a 常用掺有石墨烯的 S8 材料, 电池反应为 16Li + xS8===8Li2Sx(2≤x≤8) 。 下列说法错误的是 ( )
A . 电池工作时 , 正极可发生反应: 2Li2S6 + 2Li + + 2e - ===3Li2S4 B.电池工作时,外电路中流过 0.02 mol 电子,负极材料减 重 0.14 g C.石墨烯的作用主要是提高电极 a 的导电性 D.电池充电时间越长,电池中 Li2S2 的量越多
解析:0~t1 时,Al 表面被氧化发生钝化,Al 作负极,Cu + - - 作正极,正极反应为:2H +NO3 +e ===NO2↑+H2O;原电池 工作时,阳离子向正极做定向移动;t1 时铝表面在浓 HNO3 中全 部钝化后,氧化膜阻止了铝的进一步氧化,然后铜作负极,电流 方向发生变化。
考点一
5.(2015· 课标全国Ⅰ)微生物电池是指在微生物的作用下将 化学能转化为电能的装置,其工作原理如图所示。下列有关微生 物电池的说法错误的是( )
A.正极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为 C6H12O6+6O2===6CO2+6H2O
[地方卷] 1.(2017· 天津理综)某混合物浆液含 Al(OH)3、MnO2 和少量 Na2CrO4。 考虑到胶体的吸附作用使 Na2CrO4 不易完全被水浸出, 某研究小组利用设计的电解分离装置(见下图),使浆液分离成固 体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
固体混合物分离利用的流程图
解析:MgAgCl 电池的电极反应:负极 Mg-2e-===Mg2+, 正极 2AgCl+2e-===2Ag+2Cl-,A 项正确,B 项错误。在原电 池的电解质溶液中,阳离子移向正极,阴离子移向负极,C 项正 确。Mg 是活泼金属,能和 H2O 发生反应生成 Mg(OH)2 和 H2, D 项正确。 答案:B
专题10 电化学及其应用-2018年高考化学二轮复习精品资料(学生版)
1.下列电池工作时能量转化形式与其他三个不同的是( )2.下列与金属腐蚀有关的说法中,不正确的是( )A.钢铁在潮湿空气中生锈属于电化学腐蚀B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀C.金属腐蚀的本质是金属原子失去电子被氧化的过程D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应3.下列有关2个电化学装置的叙述正确的是( )A.图Ⅰ,电流形成的完整过程是:负极Zn-2e-===Zn2+,电子经导线流向正极,正极Cu2++2e-===Cu B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-===H2↑D.图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高4.某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性,充电时右槽溶液颜色由绿色变为紫色。
下列叙述正确的是( )A.充电时,b极接直流电源正极,a极接直流电源负极B.充电过程中,a极的电极反应式为:VO+2+2H++e-===VO2++H2OC.放电时,H+从左槽迁移进右槽D.放电过程中,左槽溶液颜色由黄色变为蓝色5.锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环。
下列有关说法正确的是( )A.充电时Zn2+通过阳离子交换膜由左侧流向右侧B.放电时每转移2 mol电子负极增重130 gC.充电时阴极的电极反应式为Br2+2e-===2Br-D.若将电解液改为氯化锌溶液放电效果更好更安全6.碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H 2O=====电解KIO 3+3H 2↑,有关说法不正确的是( )A .石墨作阳极,不锈钢作阴极B .I -在阳极放电,H +在阴极放电C .电解过程中电解质溶液的pH 变小D .电解转移3 mol e -时,理论上可制得KIO 3107 g7.关于下列装置的说法正确的是( )A .装置①中盐桥内的K +移向CuSO 4溶液B .装置①将电能转变为化学能C .若装置②用于铁棒镀铜,则N 极为铁棒D .若装置②用于电解精炼铜,溶液中的Cu 2+浓度保持不变8.利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图所示,a 、b 为惰性电极。
高考化学复习电化学专题
高考化学复习电化学专题电化学是研究电和化学反应相互关系的科学。
下面是店铺为您带来的高考化学复习电化学专题,希望对大家有所帮助。
高考化学复习电化学专题:知识点1.判断电极(1)“放电”时正、负极的判断①负极:元素化合价升高或发生氧化反应的物质;②正极:元素化合价降低或发生还原反应的物质。
(2)“充电”时阴、阳极的判断①阴极:“放电”时的负极在“充电”时为阴极;②阳极:“放电”时的正极在“充电”时为阳极。
2.微粒流向(1)电子流向①电解池:电源负极→阴极,阳极→电源正极;②原电池:负极→正极。
提示:无论是电解池还是原电池电子均不能流经电解质溶液。
(2)离子流向①电解池:阳离子移向阴极,阴离子移向阳极;②原电池:阳离子移向正极,阴离子移向负极。
3.书写电极反应式(1)“放电”时电极反应式的书写①依据条件,指出参与负极和正极反应的物质,根据化合价的变化,判断转移电子的数目;②根据守恒书写负极(或正极)反应式,特别应注意电极产物是否与电解质溶液共存。
(2)“充电”时电极反应式的书写充电时的电极反应与放电时的电极反应过程相反,充电的阳极反应为放电时正极反应的逆过程,充电的阴极反应为放电时负极反应的逆过程。
3.确定正负极应遵循:(1)一般是较活泼的金属充当负极,较不活泼的金属或非金属或金属氧化物作正极。
说明:正负极的确定还与所用的电解质溶液有关,如Mg—Al —HCl溶液构成的原电池中, Mg为负极,Al为正极; 若改用溶液即Mg—Al —NaOH溶液构成的原电池中,则Mg为正极,Al为负极。
(2) 根据电子流向或电流方向确定:电子流出的一极或电流流入的一极为负极;(3)根据内电路中自由离子的移动方向确定:在内电路中阴离子移向的电极为负极,阳离子移向的电极为正极。
(4)根据原电池反应式确定: 失电子发生氧化反应(还原剂中元素化合价升高)的一极为负极。
此外还可以借助氧化反应过程发生的一些特殊现象(如电极溶解、减重,电极周边溶液或指示剂的变化等)来判断。
高考二轮复习-电化学(正式)
2018考试大纲
理解原电池和电解池的构成、工作原理及应用, 能书写电极反应和总反应方程式。了解常见化 学电源的种类及其工作原理。 了解金属发生电化学腐蚀的原因,金属腐蚀的 危害,防止金属腐蚀的措施。
备考指导
1.客观题。 (1)以新型化学电源为载体,考查电极反应式的正误 判断及电子、离子的移动方向等。 (2)考查电化学在金属腐蚀与防护方面的应用。 2.主观题。 (1)考查电极反应式、电池反应式的书写。 (2)考查原电池、电解池原理在工业生产中的应用。 (3)考查电子转移、两极产物、pH等的相关计算。
关闭
C
解析 答案
1.(2017全国Ⅰ)支撑海港码头基础的钢管桩,常用外加电流的阴极 保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳 极。下列有关表述不正确的是( )
训练6 (2014安徽皖南八校三次联考)一种太阳能电池的工作原理 如图所示,电解质为铁氰化钾K3[Fe(CN)6]和 亚铁氰化钾K4 [Fe(CN)6]的混合溶液。下列说法中不正确的是( )
关闭
✔ A由.K电+子移流向向可催知化a 为剂负b极,发生失电子的氧化反应:Fe(CN)64--e-
Fe(CN) 63-;b 为正极,
考纲提炼:
1.电化学装置的判断——原电池及电解池的区分 2.电极的判断:正极和负极、阳极和阴极 3.电化学中的“方向”问题:电流、电子、离子 4.电极方程式及电池方程式的判断及书写 5.电化学题型中的相关计算问题:电子转移、两 极产物、pH的计算等
思路一 思路二 思路三 思路四
解题思路一:电化学装置类型的判断
原电池
1.没有电源,两极用导线互相连接, 直接插入连通的电解质溶液里
2.活泼性不同的电极
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学(2)题型一新型化学电源[典例1] (2017·全国卷Ⅲ)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+x S8===8Li2S x(2≤x≤8)。
下列说法错误的是( )A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多[解析] 原电池工作时,正极发生一系列得电子的还原反应,即:Li2S8→Li2S6→Li2S4→Li2S2,其中可能有2Li2S6+2Li++2e-===3Li2S4,A项正确;该电池工作时,每转移0.02 mol 电子,负极有0.02 mol Li(质量为0.14 g)被氧化为Li+,则负极质量减少0.14 g,B项正确;石墨烯能导电,利用石墨烯作电极,可提高电极a的导电性,C项正确;充电过程中,Li2S2的量逐渐减少,当电池充满电时,相当于达到平衡状态,电池中Li2S2的量趋于不变,故不是电池充电时间越长,电池中Li2S2的量越多,D项错误。
[答案] D[针对训练]1.世界某著名学术刊物近期介绍了一种新型中温全瓷铁空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )A.a极发生氧化反应B.正极的电极反应式为FeO x+2x e-===Fe+x O2-C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移D.铁表面发生的反应为x H2O(g)+Fe===FeO x+x H2解析:选D a极通入空气,O2在该电极发生得电子的还原反应,A错误;O2在正极发生反应,电极反应式为O2+4e-===2O2-,B错误;由B项分析可知,电路中有4 mol电子转移时正极上消耗1 mol O2,在标准状况下的体积为22.4 L,则通入空气的体积约为22.4 L ×5=112 L,C错误;由图可知,铁表面H2O(g)参与反应生成H2,则发生的反应为x H2O(g)+Fe===FeO x+x H2,D正确。
题型二带离子交换膜的化学电源[典例2] 液体燃料电池相比于气体燃料电池具有体积小等优点。
一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。
下列关于该电池的叙述正确的是( )A.b电极上发生氧化反应B.a电极反应式:N2H4+4OH--4e-===N2↑+4H2OC.放电时,电流从a电极经过负载流向b电极D.其中的离子交换膜需选用阳离子交换膜[解析] A项,b电极上发生还原反应,错误;C项,放电时,电子从a电极经过负载流向b电极,错误;D项,其中的离子交换膜需选用阴离子交换膜,错误。
[答案] B[题后悟道][针对训练]2.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。
其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )A.X为直流电源的负极,Y为直流电源的正极B.阳极区pH增大C.图中的b>aD.该过程中的产品主要为H2SO4和H2解析:选B A项,由图示可知Pt(Ⅰ)极上H+→H2,发生还原反应,故Pt(Ⅰ)为阴极,X为直流电源的负极,Y为直流电源的正极,正确;B项,Pt(Ⅱ)为阳极,在阳极,SO2-3、HSO-3被氧化为H2SO4,SO2-3+H2O-2e-===2H++SO2-4,HSO-3+H2O-2e-===3H++SO2-4,溶液的酸性增强,pH减小,错误;C项,由上面的分析可知,阳极有H2SO4生成,故b>a,正确;D 项,阳极产物为H2SO4,阴极产物为H2,正确。
题型三可逆电池[典例3] (2016·全国卷Ⅲ)锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)2-4。
下列说法正确的是( ) A.充电时,电解质溶液中K+向阳极移动B.充电时,电解质溶液中c(OH-)逐渐减小C.放电时,负极反应为Zn+4OH--2e-===Zn(OH)2-4D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)[解析] A项,充电时装置为电解池,溶液中的阳离子向阴极移动。
B项,充电时的总反应为放电时的逆反应:2Zn(OH)2-4===2Zn+O2+4OH-+2H2O,c(OH-)逐渐增大。
C项,放电时负极失电子发生氧化反应,由放电时的总反应可知,负极反应式为Zn+4OH--2e-===Zn(OH)2-4。
D项,由放电时的总反应可知,电路中通过2 mol电子时,消耗0.5 mol O2,其体积为11.2 L(标准状况)。
[答案] C[题后悟道][针对训练]3.(2016·四川高考)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-x CoO2+Li x C6===LiCoO2+C6(x<1)。
下列关于该电池的说法不正确的是( ) A.放电时,Li+在电解质中由负极向正极迁移B.放电时,负极的电极反应式为Li x C6-x e-===x Li++C6C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x gD.充电时,阳极的电极反应式为LiCoO2-x e-===Li1-x CoO2+x Li+解析:选C A.原电池中阳离子由负极向正极迁移,正确;B.放电时,负极发生氧化反应,电极反应式为Li x C6-x e-===x Li++C6,正确;C.充电时,若转移1 mol电子,石墨电极质量将增重7 g,错误;D.充电时阳极发生氧化反应,电极反应式为LiCoO2-x e-===Li1 CoO2+x Li+,正确。
-x题型四电解原理在环保、新材料制备中的应用[典例4] (2015·四川高考)用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )A.用石墨作阳极,铁作阴极B.阳极的电极反应式:Cl-+2OH--2e-===ClO-+H2OC.阴极的电极反应式:2H2O+2e-===H2↑+2OH-D.除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O[解析] A项,若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,正确;B项,阳极Cl-放电生成ClO-,Cl的化合价升高,故在阳极发生氧化反应,又已知该溶液呈碱性,正确;C项,阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+),正确;D项,由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-,错误。
[答案] D[针对训练]4.(2017·广州模拟)用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )A.通电后阳极区溶液pH增大B.阴极区的电极反应式为4OH--4e-===O2↑+2H2OC.当电路中通过1 mol电子的电量时,会有0.25 mol的Cl2生成D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出解析:选D A项,左端为阳极,Cl-放电生成Cl2,Cl2溶于水,生成酸,pH减小,错误;B项,右端是阴极区得到电子,电极反应式为2H2O+2e-===2OH-+H2↑,错误;C项,2Cl--2e-===Cl2,通过1 mol电子,得到0.5 mol Cl2,错误;D项,根据电解原理,阳离子通过阳离子交换膜,从阳极区向阴极区移动,LiOH浓溶液从d口导出,正确。
题型五新环境下金属的腐蚀与防护[典例5] (2015·上海高考)研究电化学腐蚀及防护的装置如图所示。
下列有关说法错误的是( )A.d为石墨,铁片腐蚀加快B.d为石墨,石墨上电极反应为O2+2H2O+4e-―→4OH-C.d为锌块,铁片不易被腐蚀D.d为锌块,铁片上电极反应为2H++2e-―→H2↑[解析] A.由于活动性:Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时的速率快,正确。
B.d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为O2+2H2O+4e-―→4OH-,正确。
C.若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,正确。
D.d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为O2+2H2O+4e-―→4OH-,错误。
[答案] D[针对训练]5.城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。
原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。
下列有关说法不正确的是( )A.该装置能够将电能转化为化学能B.管道右端腐蚀比左端快,右端电极反应式为Fe-2e-===Fe2+C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀D.钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜解析:选B A项,该装置相当于电解池,能将电能转化为化学能,正确;B项,左端是阳极,腐蚀得更快,错误;C项,如果没有外加电源,潮湿的土壤(接近中性)中的钢铁管道发生原电池反应,所以发生的是吸氧腐蚀,正确;D项,根据题意,此种腐蚀较慢,所以“阳极保护”实际上是在金属表面形成了一层致密的保护膜,正确。
[课堂练——练熟方法]1.MCFC 型燃料电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H 2,电解质为熔融的K 2CO 3。
已知该电池的总反应为2H 2+O 2===2H 2O ,下列有关该电池的说法正确的是( )A .该电池的正极反应式为4OH -+4e -===O 2↑+2H 2OB .该电池的负极反应式为H 2-2e -===2H +C .放电时OH -向负极移动D .当生成1 mol H 2O 时,转移2 mol 电子解析:选D 该燃料电池的燃料为H 2,电解质为熔融的K 2CO 3,总反应为2H 2+O 2===2H 2O ,负极反应式为2H 2+2CO 2-3-4e -===2H 2O +2CO 2,正极反应式为O 2+2CO 2+4e -===2CO 2-3,故A 、B 均错误;电解质中移动的阴离子为CO 2-3,不是OH -,故C 错误;根据负极反应式知,生成1 mol H 2O 时转移2 mol 电子,故D 正确。
