化学人教版高二选修4素材:教材习题点拨_第二章第二节_影响化学反应速率的因素
(人教版)化学选修四思维导图:2-2影响化学反应速率的因素(含答案)
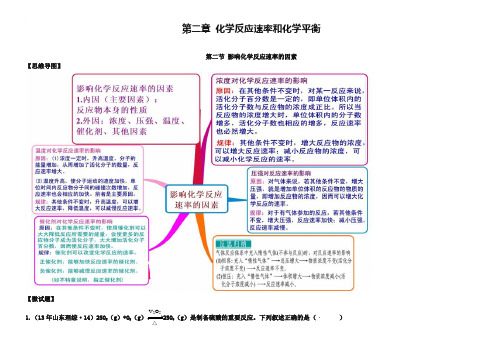
第二章化学反应速率和化学平衡第二节影响化学反应速率的因素【思维导图】【微试题】V2O51.(13年山东理综·14)2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。
下列叙述正确的是()△A .催化剂V 2O 5不改变该反应的逆反应速率B .增大反应体系的压强,反应速度一定增大C .该反应是放热反应,降低温度将缩短反应达到平衡的时间则时间间隔t 1~t 2内,SO 3(g )生成的平均速率为2121c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】B2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )组别 c(HCl)(mol·L-1) 温度(℃) 状态1 2.0 25 块状2 2.5 30 块状3 2.5 50 粉末状 42.530粉末状A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3【答案】C3.把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是()A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4【答案】D4.(海南16分)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态C(H2SO4)/mol·L-1V(H2SO4)/mL溶液温度/℃金属消失的时间/s反应前反应后1 0.10 丝0.5 50 20 34 5002 0.10 粉末0.5 50 20 35 503 0.10 丝0.7 50 20 36 2504 0.10 丝0.8 50 20 35[: 2005 0.10 粉末0.8 50 20 36 256 0.10 丝 1.0 50 20 35 1257 0.10 丝 1.0 50 35 50 508 0.10 丝 1.1 50 20 34 1009 0.10 丝 1.1 50 30 44 40分析上述数据,回答下列问题:(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);(3)本实验中影响反应速率的其他因素还有,其实验序号是。
人教版高中化学选修四2.2《影响化学反应速率的因素》配套教学课件优质课件PPT

第二节 影响化学反应速率的因素
木炭在氧气中剧 烈燃烧
人们用蜂窝煤取代大 块实心煤烧水做饭
可以得出什么结论?
• 温度越高,反应速率越大 • 浓度越大,反应速率越大 • 表面积越大,反应速率越大 • 使用催化剂能加快反应速率
影响反应速率的条件:
(一)内因(起决定作用)
1. 恒温、恒压时,充入惰性气体
保持压强 冲入
不变
惰性
气体
容器体 积增大
反应物 浓度减 小
2. 恒温、恒容时,充入惰性气体
体积不 冲入 反应物浓度不
变
惰性 气体
变
反应速率 减慢
反应速率 不变
随堂训练
3、反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变 对其反应速率几乎无影响的是(AC )
4. 催化剂对反应速率的影响
【实验2-4】
4. 催化剂对反应速率的影响
【实验2-4】
4. 催化剂对反应速率的影响
催化剂
——改变反应的途径
其他条件不变时,使用催化剂可以大大 降低反应所需要的能量,会使更多的反 应物分子成为活化分子,大大增加活化 分子百分数,因而使反应速率加快。
4. 催化剂对反应速率的影响
【实验2-3】
实验操作
实验温度 出现浑浊时间
结论
低
高
长
短
温度高的溶液先出现浑浊来自结论:升高温度,化学反应速率增大。 降低温度化学反应速率减慢。
3. 温度对反应速率的影响
升温
升高温度,反应物 能量增加
活化分子 百分数增 多
有效碰撞 几率增多
微观 解释
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡

第二章化学反应速率和化学平衡一、化学反应速率(1)化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
(2)化学反应速率的表示方法对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
某一物质A的化学反应速率的表达式为:式中——某物质A的浓度变化,常用单位为mol·L-1。
——某段时间间隔,常用单位为s,min,h。
υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反应速率的计算规律①同一反应中不同物质的化学反应速率间的关系同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。
②化学反应速率的计算规律同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
(4)化学反应速率的特点①反应速率不取负值,用任何一种物质的变化来表示反应速率都不取负值。
②同一化学反应选用不同物质表示反应速率时,可能有不同的速率数值,但速率之比等于化学方程式中各物质的化学计量数之比。
③化学反应速率是指时间内的“平均”反应速率。
小贴士:①化学反应速率通常指的是某物质在某一段时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。
②由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。
其化学反应速率与其表面积大小有关,而与其物质的量的多少无关。
通常是通过增大该物质的表面积(如粉碎成细小颗粒、充分搅拌、振荡等)来加快反应速率。
③对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。
因此,表示化学反应的速率时,必须指明是用反应体系中的哪种物质做标准。
人教版高中化学选修4第二章第二节 影响化学反应速率的因素 课件 .(共23张PPT)

师生互析1:
结论:
凡是能影响活化分子数的方法, 则能影响有效碰撞频率,则能影 响化学反应的速率!
师生互析1:浓度对反应速率的影响
浓度影响原因:在其他条件不变时,对某一反应来
说,活化分子百分数是一定的,即单位体积内的活化分 子数与反应物的浓度成正比。所以当反应物的浓度增大
讨论压强对化学反应速率的影响
结论:对气体来说,若其他条件不变,增大压 强,反应速率加快;减小压强,反应速率减慢。 为什么?
温馨提示:
提示1. 此处增大压强,指减小体 积,减小压强,指增大体积。 提示2. 压强的改变可考虑成浓度 的改变。
师生互析2:压强对化学反应速率的影响
对气体来说,若其他条件不变,增大压强,就是减小体积, 即增加反应物的浓度,增加单位体积里活化分子数,因而有 效碰撞几率增大,化学反应的速率加快。反之,化学反应速 率减慢。
注意事项:
1.请同学们在实验之前,先阅读实验,检查 实验所需的仪器、药品是否完备,明确实验 步骤及操作的要求。
2.实验过程中一定要注意安全!!!
自主学习
设计实验探究浓度对化学反应速率的影响:
实验结论: 增大浓度,化学反应速率 加快 。 减小浓度,化学反应速率 减慢 。
有效碰撞 = 分子具有足够的能量 + 取向合适的碰撞 = 活化分子 + 取向合适的碰撞
反应速率加快!
N2分子
? 师生互析2:压强对化学反应速率的影响
恒温恒容条件下,反应N2+3H2 2NH3 中充入He气,反应速率如何改变?
反应速率无变化!
He分子
? 师生互析2:压强对化学反应速率的影响
恒温恒压条件下,反应N2+3H2 2NH3 中充入He气,反应速率如何改变?
影响化学反应速率的因素( 温度、催化剂对化学反应速率的影响)高二化学(人教版选修4)

第1 页
若反应是离子反应,写出离子方程式;
若反应是氧化还原反应,分析电子转移关系
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
10e-
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
化 学
物质本身的结构和性质
反
应 速
浓度
率
压强
的 因 2、外因 温度
素
催化剂
其它
第 12 页
外因对速率影响的有效碰撞理论解释
影响
单位体积内
外因 增大反应物浓度
分子总数 活化分子数
增加 增加
活化分子 百分数
不变
增大压强 升高温度 使用催化剂
增加 不变 不变
增加 增加 增加
不变 增加 增加
第 13 页
有效碰撞 化学反应
( 2 ) 温度升高,使分子运动的速度加快,单位时间内反应物 分子间的碰撞次数增加,反应速率也会相应的加快。
【规律】反应若是可逆反应,升高温度,正、逆反应速率都加快, 降低温度,正、逆反应速率都减小。
(2)一般,温度每升高10℃,化学反应速率增大2~4倍。
节好【pH小和试F牛e2+刀浓】度F的en废to水n法中常加用入于H处2O理2,含使难产降生解的有羟机基物自p由-C基P的氧工化业降废解水污,染在物第调p 6- 页 CP。控制p -CP的初始浓度相同,其余实验条件见下表,探究有关因素对该降 解反应速率的影响。下列说法不正确的是( B )
次数
2.2.2 影响化学反应速率的因素 温度、催化剂对化学反应速率的影响 教学设计(含解析) 人教版高中化学选修4

(人教版选修4)第二章《化学反应速率和化学平衡》教学设计第二节影响化学反应速率的因素(第二课时温度、催化剂对化学反应速率的影响)【科学探究】已知4H++4I―+O2 == 2I2 +2H2O ,现有1 mol/L KI溶液、0.1 mol/L H2SO4溶液和淀粉溶液,请探究溶液出现蓝色的时间与温度的关系。
【交流】试剂种类及用量 2 mL KI溶液、2滴淀粉溶液、2 mL 稀硫酸实验温度①室温②冰水混合物试剂加入顺序及理由分别向2 mL KI溶液滴加2滴淀粉溶液后,再分别加入2 mL 稀硫酸。
因为在不加酸的情况下,O2不能氧化I―实验现象①室温的一组溶液快出现蓝色结论其他条件相同时,升高温度反应速率加快,降低温度反应速率减慢【问题讨论1】对吸热反应和放热反应,温度对反应速率的影响规律是否相同?【交流】其他条件不变时,升高温度,不管是吸热反应还是放热反应,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子(如图所示)→活化分子百分数增加→有效碰撞次数增多→反应速率增大。
因此,升高温度均可以增大反应速率。
反之,降低温度均可以降低反应速率。
如图:【问题讨论2】通常情况下,你认为温度、浓度、压强对反应速率的影响谁更强一些呢?在日常生活中有哪些应用?【交流1】一般而言,温度对化学反应速率的影响比浓度、压强等对化学反应速率的影响要大,【交流】当其他条件不变时,使用催化剂,化学反应速率增大。
【问题讨论2】请从微观角度对上述规律作出解释。
【交流】使用催化剂→改变了反应的路径(如下图),反应的活化能降低→活化分子的百分数增大→单位时间内有效碰撞几率增加→反应速率加快。
如下图所示:【小组讨论1】我们在讨论催化剂对化学反应速率的影响时,还应注意哪些问题?【交流1】催化剂有正、负之分,一般情况下的催化剂是指正催化剂。
【交流2】催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
【小组讨论2】根据催化剂对化学反应速率的影响实质,分析催化剂对可逆反应中的正、逆反应速率的影响是否相同?【交流】因催化剂对化学反应速率的影响是降低反应的活化能,增加有效碰撞次数,对正、逆反应的影响是相同的,所以催化剂对正、逆反应速率的影响相同。
高中化学人教选修4课件 第2章 第2节 影响化学反应速率的因素
新知识· 导学探究
●新知导学
1.有效碰撞理论 (1)化学反应
断裂
生成 重新组合
碰撞
有效碰撞
(2)有效碰撞
化学反应
有效碰撞 活化能
(3)化学反应的过程
①图示
(反应物、生成物的能量与活化能的关系)
E1:反应的活化能 ______________________; E :活化分子变为生成物分子放出的能量 ______________________;
4.温度对反应速率的影响
增大 ; (1)影响:其他条件相同时,升高温度,反应速率_______ 减小 降低温度,反应速率_________ 。 活化分子百分数 (2)原因:其他条件相同时,升高温度→_______________ 碰撞频率 提高→_______________ 有效碰撞几率 提高、 较高能量的分子间的__________ 增大 提高→化学反应速率____________ 。
成才之路 ·化学
人教版 ·选修④
路漫漫其修远兮 吾将上下而求索
第二章
化学反应速率和化学平衡
第二章 第二节 影响化学反应速率的因素
1
新情境· 激趣入题
4
新考题· 随堂自测
2
新知识· 导学探究
5
新提升· 达标作业
3
新思维· 名师讲堂
6
新视点· 专家博客
新情境· 激趣入题
我们知道,有些化学反应在瞬间就能 完成,如火药爆炸、酸、碱在水溶液中的 中和反应;而有些化学反应却进行地非常 缓慢,如煤和石油的形成,需要经过漫长 的地质年代。为什么不同的化学反应的反 应速率差别如此之大呢?木炭在氧气中燃 烧比在空气中燃烧更旺,夏天将食品放在 冰箱里不容易腐败。对于同一化学反应, 其反应速率的快慢受哪些外界条件的影响 呢?请让我们一起走进教材第 2 节: 影响化学反应速率的因素。
人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳
第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L•s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件外因对化学反应速率影响的变化规律条件变化活化分子的量的变化反应速率的变化反应物的浓度增大单位体积里的总数目增多,百分数不变增大减小单位体积里的总数目减少,百分数不变减小气体反应物的压强增大单位体积里的总数目增多,百分数不变增大减小单位体积里的总数目减少,百分数不变减小反应物的温度升高百分数增大,单位体积里的总数目增多增大降低百分数减少,单位体积里的总数目减少减小反应物的催化剂使用百分数剧增,单位体积里的总数目剧增剧增撤去百分数剧减,单位体积里的总数目剧减剧减其他光,电磁波,超声波,固体反应物颗粒的大小,溶剂等有影响※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变.(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1。
定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡)定(各物质的浓度与质量分数恒定) ;变(条件改变,平衡发生变化)3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据例举反应mA(g)+nB(g)C(g)+qD(g)混合物体系中各成分的含量①各物质的物质的量或各物质的物质的量的分数一定平衡②各物质的质量或各物质质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压力、总物质的量一定不一定平衡正、逆反应速率的关系①在单位时间内消耗了mmolA同时生成m molA,即V(正)=V(逆)平衡②在单位时间内消耗了n m olB同时消耗了p molC,则V(正)=V(逆)平衡③V(A):V(B):V(C):V(D)=m:n:p:q,V(正)不一定等于V(逆)不一定平衡④在单位时间内生成n molB,同时消耗了q molD,因均指V(逆)不一定平衡压强①m+n≠p+q时,总压力一定(其他条件一定)平衡②m+n=p+q时,总压力一定(其他条件一定) 不一定平衡混合气体平均相对分子质量Mr ①Mr一定时,只有当m+n≠p+q时平衡②Mr一定时,但m+n=p+q时不一定平衡温度任何反应都伴随着能量变化,当体系温度一定时(其他不变)平衡体系的密度密度一定不一定平衡其他如体系颜色不再变化等平衡(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
2020秋高中化学人教版选修4课件:第二章第二节 影响化学反应速率的因素
(2)解释。 对于有气体参与的反应,在相同温度下,增大压强→ 反应物浓度增大→反应速率增大;反之,减小压强→反应 速率减小。 易错提醒 对于无气体参与的化学反应,改变压强对反应速率的 影响可以忽略不计。
4.催化剂对化学反应速率的影响。
(1)实验探究。
原理
2H2O2=M=n=O==22H2O+O2↑
(2)恒容时: ①充入气体反应物―引―起→浓度增大―引―起→总压增大 ―引―起→反应速率增大; ②充入“惰气”―引―起→总压增大,但各气体的分压不 变,即各气体的浓度不变,反应速率不变。 (3)恒压时: 充入“惰气”―引―起→体积增大―引―起→各反应物浓度减 少―引―起→反应速率减小。
4.催化剂对化学反应速度的影响。 催化剂同等程度地增大,正、逆反应的化学反应速 率。
3.双氧水(H2O2)分解时加入少量 MnO2 的作用是: 作催化剂,加快 H2O2 的分解速率。
自主学习 一、有效碰撞理论 1.化学反应。
2.有效碰撞。
3.活化分子与活化能。 (1)活化分子:能够发生有效碰撞的分子。 (2)活化能:活化分子比普通分子多出的那部分能量。
4.解释化学反Βιβλιοθήκη 的过程。2.温度对化学反应速度的影响。 其他条件不变,升高温度,反应速率增大;降低温度, 反应速率减小。 注意: (1)温度对吸热反应影响显著,则有: ①升高温度,吸热反应、放热反应的化学反应速率都 增大,但吸热反应增大得多; ②降低温度,吸热反应、放热反应的化学反应速率都 减小,但吸热反应减小得多。
3.压强对化学反应速度的影响。 对于有气体参加的反应而言,改变压强,对化学反 应速率产生影响的根本原因是引起浓度改变所致。所以, 在讨论压强对反应速率的影响时,应区分引起压强改变 的原因。 对于气体反应体系,有以下几种情况: (1)恒温时: 增加压强―引―起→体积缩小―引―起→浓度增大―引―起→反应 速率增大。
人教版化学选修四第二节影响化学反应速的因素PPT精品课件
发散思考:压强对于任意化学反应的速率都有影响吗?
人教版化学选修四第二章第二节 影响化学反应速的因素
人教版化学选修四第二章第二节 影响化学反应速的因素
压强对反应速率的影响
思考:在N2+3H2 2NH3中,当其他外界条件不变时: Ⅰ减小体系压强,该反应的速率怎么变?
Ⅱ在反应中保持体系容积不变,充入N2 ,反应的速率怎么变? Ⅲ在反应中保持体系容积不变,充入He,反应的速率怎么变?
反应速率;减小反应物的浓度,可以减小化学反应的速 率。
本 浓度对反应速率的影响 质 原 因
反应物浓度增大,单位体积内活化分子数增 多,有效碰撞的频率增加,反应速率增大。
人教版化学选修四第二章第二节 影响化学反应速的因素
注意:
a、此规律只适用于气体或溶液的反应,对于纯固 体或液体的反应物,一般情况下其浓度是常数,因此 改变它们的量一般不会改变化学反应速率。
一个反应经历的过程
合理
普通 分子
活化 能
活化 分子
取向的 碰撞
有效 碰撞
新物质
能量
活化分子百分数:
(活化分子数/反应物分子数)×100% n活=n总×活%
化学反应速率主要取决于: 有效碰撞的几率
所有能够改变内能,运动速率,以及碰撞几率的方 法,都可以用来改变、控制反应的速率。
一、浓度对反应速率的影响
以上说明化学反应速率的决ห้องสมุดไป่ตู้因素是什么?
决定化学反应速率的因素是参加反应 的物质本身的化学性质。
影响反应速率的因素
(1)内部因素(主要因素):参加反应物质 的性质
(2)外部因素: ①浓度:②压强:③温度:④催化剂:
⑤其他因素:光、颗粒大小、溶剂等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教材习题点拨
[科学探究]
[科学探究]
1.不同催化剂对反应速率的影响
设计实验比较在2 mL 5%的H2O2中加入FeCl3和CuSO4溶液各1 mL,比较二者的分解速率。
2
设计实验比较在4 mL 0.01 mol·L-1 KMnO4和2 mL 0.1 mol·L-1 H2C2O4,加不加MnSO4对反应速率是否有影响。
3.
现有5 mL淀粉溶液、碘水、2 mol·L-1硫酸溶液。
设计实验比较唾液、稀硫酸对反应速率影响效果如何。
有选择性。
目前,催化作用的研究一直是受到高度重视的高科技领域。
催化剂在现代化学和化工生产中占有极为重要的地位。
大约85%的反应需要催化剂。
尤其是现代大型化工业、石油工业中,很多反应还必须使用性能良好的催化剂。
教材习题
1.(1)加快增大反应物氢气的浓度,反应速率加快。
(2)不加快通入氮气后,容器内的气体物质的量增加,容器内压强增加,但反应物的浓度不变,故反应速率不变。
(3)减慢保持压强不变,向其中充入N2,体积变大,造成反应物氢气和碘蒸气浓度减小,反应速率减慢。
(4)不变保持温度和压强不变,向其中充入1 mol H2和1 mol I2,反应物的物质的量增加一倍,体积也增加一倍,反应物浓度不变,反应速率不变。
(5)加快升高温度,反应物分子能量增加,提高了活化分子百分数,运动速率加快,有效碰撞次数增加,反应速率加快。
点拨:对一具体反应而言,外界条件对化学反应速率的影响及对其改变的原因的分析,是本节知识的重点。
2.A使用催化剂能降低该反应的活化能,提高活化分子的百分数,成千上万倍地提高反应速率,使得缓慢发生的反应迅速进行。
给汽车尾气加压、升高温度的想法不切合实际。
点拨:在具体情况下,选择合适的条件加快该反应的反应速率。
