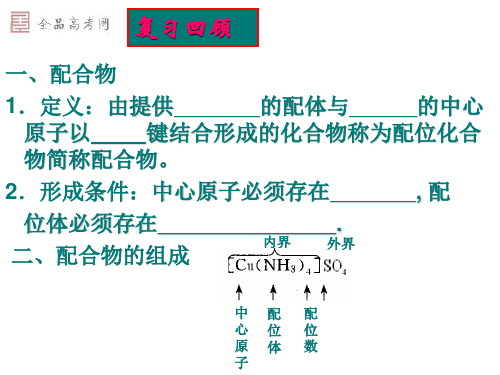
空间构型和立体构型表
配合物结构的空间构型汇总.
Cl
Cl Cl Co
+
Cl
+
NH3 NH3
Cl H3N
Co
NH3 NH3
NH3
顺式
Cl
反式
例题讲解
例1
设计实验证明[CoSO4(NH3)5]Br(红色) 与[Co Br (NH3)5] SO4 (红色)(化学式相同) 互为同分异构体。
解: 分别取二种溶液少许,向其中分别滴加 BaCl2溶液稀硝酸,其中[Co Br (NH3)5] SO4 有白色沉淀生成,CoSO4(NH3)5]Br无明显现 象,说明它们虽然化学式相同,但结构不同, 因此互为同分异构体。
ML3±
实例 [Ag(NH3)2]+
[HgI3]-
Sp
Sp2
Sp3 *dsp2
* sp3 d
4 4
5
正四面体型 平面四边型
三角双锥体
ML4± ML4±
ML5±
[Zn(NH3)4]2+ [Pb(CN)4]2PF5
*dsp3
* sp3 d2 * d2sp3
5
6 6
四方锥体
八面体 八面体
ML5±
ML6± ML6±
交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 讨 论
1. 怎样判断顺式和反式?
2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表. 配合物 顺式 Cl Pt NH3 反式 NH3 NH3 Cl
非极性分 子
结构式 Cl
分子极性 在水中溶解 性
中心原子杂化方式
sp
配位数
高三化学课件2.2共价键与分子的空间构型

看图整第理16 页
巴斯德实验室合成的有机物酒石酸盐 并制得手性机物酒石酸盐
共价键与分子的空间构型
看图整第理17 页
2、手性分子 (1)手性异构体
具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜
像,却在三维空间里不能重叠,互称手性异构体
左右手不能重叠互为镜像
• (1)若将三种分子分别绕 C1、C2、C3 轴旋转一定角度后可与原分子重合 ,C1、C2、C3 分别为相应分子的对称轴。
共价键与分子的空间构型
1、分子的对称性
• (2)甲烷分子中碳原子和其中两个氢原子所构成的平面为甲烷分子的对称面。
• (3)依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子 所具有的这种性质称为对称性。
第 28 页
• 4、对物质性质的影响 • (1) 熔、沸点:在相对分子质量相同的情况下,极性分子构成的物质
比非极性分子构成的物质沸点高,如沸点:N2 < CO。 • (2) 溶解性:极性分子易溶于极性溶剂(如水),非极性分子易溶于非
极性溶剂(如四氯化碳),这就是相似相溶原理中的一种类型。
共价键与分子的空间构型
3、分子的极性 (2)判断方法 ①双原子分子
共价键的极性 分子空间构型
取决于成键原子之间的共价键是否有极性
决定分子极性
A-B型分子(HCl ):异核双原子分子都是极性分子 A-A型分子(Cl2):同核双原子分子是非极性分子 同核多原子分子也有非极性分子,如:P4,C60、S8 、B12
特别注意:O3(V型)是极性分子
总结感第悟29 页
课时小结
1、手性碳原子的“一个不同” 连接C原子的四个基团或原子各不相同。
一些典型分子的空间构型

3、价层电子对互斥理论
(1)理论要点:
对ABm型分子或离子,中心原子A价层电 子对(包括成键电子对和孤对电子)之间存 在排斥力,将使分子中的原子处于尽可能远 的相对位置上,以使各原子之间斥力最小, 分子体系能量最低。
精选ppt
5
(2)模型:
电子对数
目与立体 2
结构
3
4
5
精选ppt
6
6
一个分子或离子中的价层电子对在空间的分布(即含 孤对电子的VSEPR模型)
120°
109028’
空间构型 实例
直线
BeCl2
平面三角形 BF3
四面体形
CH4
精选ppt
3
2.苯分子的空间结构
杂化轨道理论解释苯分子的结构:
C为SP2杂化 C-C (sp2-sp2 ) ; C-H (sp2-s ) 所有原子(12个)处于同一平面 分子中6个碳原子未杂化的2P轨道 上的未成对电子重叠结果形成了 一个闭合的、环状的大π键 形成的π电子云像两个连续的面包圈,一个位于平面上面, 一个位于平面下面,经能量精选计pp算t ,这是一个很稳定的体系。4
型
分子的立体 结构模型
直线形
分子 的空 间构 型
直线形
H2O
22
4
四面体
V形
NH3
314四面体 Nhomakorabea三角锥形
CH2O CH4
30 40
3
平面三角形
4
精选ppt
正四面体
平面三角形
正四面体
13
第2节 共价键与分子的空间构型
第2课时
精选ppt
1
【学习目标】:
1.知道常见分子苯的空间构型; 2.了解价电子对互斥理论的基
选修二2.2.3 解题策略 分子的空间结构及判断方法

sp
1个ns和 1个np
轨道夹角 180°
实例
CO2
sp2
1个ns和 2个np
120°
BF3
sp3
1个ns和 3个np
109°28 ′ CH4
【典例1】下列分子中,中心原子杂化轨道类型相同,分子的空间结构也相
同的是( )
A.H2O、SO2 答案 B
B.BeCl2、CO2
C.H2O、NH3
D.NH3、CH2O
VSEPR模型
分子或离子的立体构型。
2.确定分子或离子的立体构型。
①若中心原子A无孤电子对,则分子或离子的立体构型为价层电子对的立体构
型—VSEPR模型。
②若中心原子A有孤电子对,则分子或离子的立体构型为略去中心原子孤电子
对后的成键电子对的立体构型。
【三言两语话重点】
(1)1个公式:
1
中心原子的价层电子对数=σ键电子对数+ 2 (a-xb)。
空间结构 间结构
直线形 直线形
三角形
三角形 V形
正四面体形
四面体形 三角锥形
V形
实例
BeCl2 BF3
SnBr2 CH4 NH3 H2O
3.利用键角判断 一般来说,高中阶段知道了多原子分子中的键角数据,就可确 定该分子的空间几何构型。常见分子的键角与分子构型如下表:
分子 硫化氢
水
氨
甲烷
二氧化碳
键角 约90° 105°
107° 109°28′
180°
分子构型 V形
V形 三角锥形 正四面体形 直线形
分子 白磷 三氯化硼 乙烯
乙炔
苯
键角 60° 120°
120°
高二化学配合物结构的空间构型

交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 讨 论
1. 怎样判断顺式和反式?
2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表. 配合物 顺式 Cl Pt NH3 反式 NH3 NH3 Cl
非极性分 子
结构式 Cl
分子极性 在水中溶解 性
极性分子
比反式大
Cl Pt NH3
小
总结
MA2B2的平面形存在几何异构,在顺反异构中, 反式为非极性分子,顺式为极性分子.
+ +
MA4B2的八面体也存在顺反异构。如[CoCl2(NH3)4]+ NH3
Cl Cl Co Cl
NH3 NH3
H3N H3N
Co
NH3 NH3
NH3
顺式
Cl
反式
MA3B3的八面体也有顺反异构。如[CoCl3(NH3)3]+
新课总结
三、配合物的空间构型 配合物的空间构型是由中心原子杂化方式决定的 四、配合物的同分异构现象 几何异构 对于四配体MA2B2的平面形有顺反异构. 如Pt(NH3)2Cl2 对于六配体MA2B4 或MA4B2型有顺反异构 如Pt(NH3)2Cl4 五.配合物的性质: 1.配合物中的配位键越强,配合物越稳定。 2. 如果配体易与 H+ 结合 , 必定易与 Mn+ 结合 . 如 NH3 > H 20 3. 形成配合物后,颜色、溶解性、酸碱性、氧化 还原性等都有可能发生改变。
Cl
Cl Cl Co
+
Cl
+
NH3 NH3
Cl H3N
共价键及分子结构知识梳理

共价键及分子结构知识梳理】一、共价键1-1共价键的实质、特征和存在实质:原子间形成共用电子对特征:a.共价键的饱和性,共价键的饱和性决定共价分子的。
b.共价键的方向性,共价键的方向性决定分子的。
1-2共价键的类型σ键:s-sσ键、s-pσ键、p-pσ键,特征:轴对称。
π键:p-pπ键,特征:镜像对称【方法引领】σ键和π键的存在规律σ键成单键;π键成双键、三键。
共价单键为σ键;共价双键中有1个σ键、1个π键;共价三键中有1个σ键、2个π键。
对于开链有机分子:σ键数=原子总数-1;π键数=各原子成键数之和-σ键数(环状有机分子,σ键数要根据环的数目确定)原子形成共价分子时,首先形成σ键,两原子之间必有且只有1个σ键;σ键一般比π键牢固,π键是化学反应的积极参与者。
形成稳定的π键要求原子半径比较小,所以多数情况是在第二周期元素原子间形成。
如CO2分子中碳、氧原子之间以p-pσ键和p-pπ键相连,而SiO2的硅、氧原子之间就没有p-p π键。
【课堂练习1】(1)下列说法不正确的是A.乙烷分子中的6个C-H和1个C-C键都为σ键,不存在π键B.气体单质中,一定有σ键,可能有π键C.两个原子间共价键时,最多有一个σ键D.σ键与π键重叠程度不同,形成的共价键强度不同(2)有机物CH2=CH-CH2-C≡CH分子中,C-Hσ键与C-Cσ键的数目之比为;σ键与π键的数目之比为。
二、键参数——键能、键长与键角2-1键能的意义和应用a.判断共价键的强弱b.判断分子的稳定性c.判断物质的反应活性d.通过键能大小比较,判断化学反应中的能量变化【思考】比较C-C和C=C的键能,分析为什么乙烯的化学性质比乙烷活跃,容易发生加成反应?2-2键长的意义和应用键长越短,往往键能越大,表明共价越稳定。
(键长的长短可以通过成键原子半径大小来判断)2个原子间的叁键键长<双键键长<单键键长2-3键角的意义键角决定分子的空间构型,是共价键具有方向性的具体表现。
分子的空间结构 课件 2022-2023学年高二化学人教版(2019)选择性必修2

3、混杂前后轨道总数不变
4、体系的能量降到最低(轨道间的排斥力 最小)
四、杂化轨道理论简介
s轨道个数 p轨道个数 杂化轨道数 价层电子对数 轨道夹角
sp3
1
3
4
4
109°28′
sp2
1
2
3
sp
1
1
2
3
120°
2
180°
理论要点:杂化轨道数=价层电子对数=孤电子对数+σ键数
四、杂化轨道理论简介
思路:中心原子上的价层电子对数→杂化轨道数目→杂化轨道类型
分子式
价层
杂化 杂化
电子对数 轨道数 类型
VSEPR 模型
分子 空间结构
CH4
4+0=4
4
sp3 正四面体形 正四面体形
NH3
3+1=4
4
H2O
2+2=4
4
sp3 四面体形 三角锥形
sp3 四面体形
V形
四、杂化轨道理论简介
练、CH2O分子有__3__个σ键,有__1_个π键,中心原子有__0__对 孤对电子,中心原子的价层电子对数为__3__,杂化轨道的数目 为___3__,中心原子的杂化类型为_s_p_2_,键角为_1_2_0_°_。 理论要点:杂化轨道只能用于形成σ键或者用来容纳未参与成 键的孤电子对 思考: π键是如何形成的呢?
轨道 夹角
分子空 间构型
键角
CO2
2
SO2
3
CH2O 3
NH4+
4
CH4
4
NH3
4
H2O
4
sp
直线形 180° 直线形 180°
sp2
平面
高二化学《物质结构与性质》精品课件8:2.2.1一些典型分子的空间构型

4.sp 型杂化轨道分类
杂化类型
sp1
sp2
sp3
参与杂化的原子 1 个 s 和 1 1 个 s 和 2 1 个 s 和 3
轨道及数目 个 p 轨道 个 p 轨道 个 p 轨道
杂化轨道的数目 _2___
_3___
4
杂化轨道间的夹
_1_8__0_°_ _1_2__0_°__ _1_0_9__.5_°_
2
。
其中配位原子中,卤素原子、氢原子提供1个价电子,硫原 子、氧原子不提供价电子,即提供价电子数为0。
例如:
代表物 杂化轨道数 杂化轨道类型
CO2
12(4+0)=2
sp1
CH2O 12(4+2+0)=3
sp2
CH4
12(4+4)=4
sp3
SO2
12(6+0)=3
sp2
NH3
12(5+3)=4
sp3
典例 (高考组合题)(1)(2012·山东高考节选)甲醛(H2C O) 在 Ni 催化作用下加氢可得甲醇(CH3OH)。甲醇分子内 C 原 子的杂化方式为________,甲醇分子内的 O—C—H 键角 ________( 填 “ 大 于 ”“ 等 于 ” 或 “ 小 于 ”) 甲 醛 分 子 内 的 O—C—H 键角。
氰化 H—C≡N
氢 sp1
乙炔 H—C≡C—H
2个σ键 2个π键 3个σ键 2个π键
180° 直线形 180° 直线形
4.当杂化轨道中有未参与成键的孤对电子时
由于孤对电子对成键电子对的排斥作用,会使分子的 构型与杂化轨道的形状有所区别。如水分子中氧原子的sp3 杂化轨道有2个是由孤对电子占据的,其分子不呈正四面体 构型,而呈V形;氨分子中氮原子的sp3杂化轨道有1个由孤 对电子占据,氨分子不呈正四面体构型,而呈三角锥形。
