无机答案(d区元素)
15d区元素(高二)

Mn Tc Re
Fe Ru Os
Co Rh Ir
Ni Pd Pt
30 Cu(●-●) Ag(■-■) Au(▲-▲)
1.2.2 d区元素的氧化态
元 素 Sc +3 氧化态 Ti +2 +3 +4 V +2 +3 +4 +5 Cr +2 +3 Mn +2 +3 +4 +6 +7 Fe +2 +3 Co +2 +3 +4 Ni +2 +3 +4
上,形成d π-π*(NO)反馈键。
(2)弯曲型端基配位
N原子以sp2 杂化向过渡金属 提供一个电子(NO为1电子给予 体)形成σ键,∠MNO约120°。 如: [Co(NH3)5NO]2+、
Rh(Cl)2(NO)(pph3)2
[Ir(CO)Cl(NO)(pph3)2]BF4。 [RuCl(NO)2(pph3)2]+为直线 和弯曲端基混合配位 ,如图。
2. 羰基簇合物
过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。 双核和多核羰基簇合物中金属原子与羰基的结合方式有: 端基(1个CO和1个成簇原子相连);边桥基(1个CO与2个成
簇原子相连);面桥基(1个CO与3个成簇原子相连)。
端基
边桥基
面桥基
金属-金属(M-M)键是原子簇合物最基本的
+6
+6
(划横线表示常见氧化态)
左 Fe +2、+3 Ru +4 Os +4、+6、+8
无机化学完整16-d区元素(一)PPT

K sp (Ag2CrO4) 1.1×1012 K sp (Ag2Cr2O7 )2.0×107
4Ag Cr2O72 H2O 2Ag2CrO4 (s,砖红) 2H
2Ba2 Cr2O72 H2O 2BaCrO4 (s,柠檬黄)2H
2Pb2 Cr2O72 H2O 2PbCrO4 (s,黄) 2H
可 氧 化 物 种SO 32- I- C l- H 2S Fe2+ 产 物 SO 42- I2 C l2 S或 SO 42- Fe3+
Sn2+ Sn4+
溶液的酸度不同,MnO4—被还原的产物不同:
2M 4 53 2 S n 6 O O H 22 M 52 4 S n 3 2 O O H
族族
4(第一 过渡系)
Sc
Ti
V
Cr
Mn
Fe Co Ni
铁系
Cu
Zn
5(第二
Ru Rh Pd
过渡系) Y Zr Nb Mo Tc 轻铂组 Ag Cd
6 (第三 La过渡系) Lu
Hf
Ta
W
Re
Os Ir Pt
重铂组
Au
Hg
7(第四 Ac过渡系) Lr
Rf
Db
Sg
Bh Hs Mt Uun Uuu Uub
6Fe3 2Cr3 7H2O 3Sn 4 2Cr3 7H2O
K 2Cr2O7 (s) 14HCl(浓)
.
3Cl2 2CrCl3 2KCl 7H2O
21
2.铬(Ⅲ)的化合物 (1) Cr2O3的制备与性质 性质:C2rO36H C3r3H 2O
3H 2OC2rO32OHCr(O 4 H)
(n-1)d1-10ns1-2 (Pd为5s0)
无机化学课后习题参考答案大全【优秀】

无机化学课后习题参考答案大全【优秀】(文档可以直接使用,也可根据实际需要修订后使用,可编辑推荐下载)无机化学课后习题参考答案大全第一章原子结构与元素周期系 (1)第二章分子结构 (4)第三章晶体结构 (6)第4章酸碱平衡 (9)第五章化学热力学基础 (15)第六章化学平衡常数 (16)第七章化学动力学基础 (23)第八章水溶液 (29)第9章配合物 (32)第十章沉淀平衡 (34)第11章电化学基础 (39)第12章配位平衡 (43)第13章卤素 (44)第14章氧族元素 (46)第15章氮磷砷 (48)第16章碳硅硼 (51)第17章S区金属(碱金属与碱土金属) (55)第18章过渡元素(一) (58)第18章过渡元素(二) (63)第19章镧系与锕系金属 (66)第一章原子结构与元素周期系1-1:区分下列概念(1) 质量数和相对原子质量(2) 连续光谱和线状光谱(3) 定态、基态和激发态(4) 顺磁性和逆磁性(5) 波长、波数和频率(6) 经典力学轨道和波动力学轨道(7) 电子的粒性与波性(8) 核电荷和有效核电荷答:(1) 质量数:指同位数原子核中质子数和中子数之和, 是接近同位素量的整数。
相对原子质量:符号为Ar,被定义为元素的平均原子质量与核素12C 原子质量的1/12 之比,代替“原子量”概念(后者已被废弃);量纲为1(注意相对概念)。
(2) 连续光谱: 波长连续分布的光谱。
炽热的固体、液体或高压气体往往发射连续光谱。
电子和离子复合时,以及高速带电离子在加速场中运动时亦能发射这种光谱。
线状光谱:彼此分立、波长恒定的谱线。
原子受激发(高温、电孤等)时,电子由低能级轨道跃迁到高能级轨道,回到低能级时产生发射光谱(不同原子具有各自特征波长的谱线)。
(3) 定态是由固定轨道延伸出来的一个概念。
电子只能沿若干条固定轨道运动,意味着原子只能处于与那些轨道对应的能态,所有这些允许能态统称为定态。
主量子数为1 的定态叫基态,其余的定态都是激发态。
《无机化学》第6版-张天蓝主编-课后习题答案

《无机化学》第6版张天蓝主编课后习题答案第一章原子结构1、υ=∆E/h=(2.034⨯10-18 J) / (6.626⨯10-34 J⋅s)=3.070⨯1015 /s; λ=hc/∆E= (6.626⨯10-34 J⋅s ⨯2.998⨯108 m/s ) / (2.034⨯10-18 J)= 9.766⨯10-8 m2、∆υ≥ h/2πm∆x = (6.626⨯10-34 kg⋅m2/s) / (2⨯3.14⨯9.11⨯10-31 kg⨯1⨯10-10m)=1.16⨯106 m/s。
其中1 J=1(kg⋅m2)/s2, h=6.626⨯10-34 (kg⋅m2)/s3、(1) λ=h/p=h/mυ=(6.626⨯10-34 kg⋅m2/s) / (0.010 kg⨯1.0⨯103 m/s)=6.626⨯10-35 m,此波长太小,可忽略;(2)∆υ≈h/4πm∆υ =(6.626⨯10-34 kg⋅m2/s) / (4⨯3.14⨯0.010 kg⨯1.0⨯10-3 m/s)= 5.27⨯10-30 m,如此小的位置不确定完全可以忽略,即能准确测定。
4、He+只有1个电子,与H原子一样,轨道的能量只由主量子数决定,因此3s与3p轨道能量相等。
而在多电子原子中,由于存在电子的屏蔽效应,轨道的能量由n和l决定,故Ar+中的3s与3p轨道能量不相等。
5、代表n=3、l=2、m=0,即3d z2轨道。
6、(1)不合理,因为l只能小于n;(2)不合理,因为l=0时m只能等于0;(3)不合理,因为l只能取小于n的值;(4)合理7、(1)≥3;(2)4≥l≥1;(3)m=08、14Si:1s22s22p63s23p2,或[Ne] 3s23p2;23V:1s22s22p63s23p63d34s2,或[Ar]3d34s2;40Zr:1s22s22p63s23p63d104s24p64d25s2,或[Kr]4d25s2;Mo:1s22s22p63s23p63d104s24p64d55s1,或[Kr]4d55s1;79Au:421s22s22p63s23p63d104s24p64d104f145s25p65d106s1,或[Xe]4f145d106s1;9、3s2:第三周期、IIA族、s区,最高氧化值为II;4s24p1:第四周期、IIIA 族、p区,最高氧化值为III;3d54s2:第四周期、VIIB族、d区,最高氧化值为VII;4d105s2:第五周期、IIB族、ds区,最高氧化值为II;10、(1)33元素核外电子组态:1s22s22p63s23p63d104s24p3或[Ar]3d10s24p3,失去3个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s2或[Ar]3d104s2,属第四周期,V A族;(2)47元素核外电子组态:1s22s22p63s23p63d104s24p64d05s1或[Kr]4d105s1,失去1个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s24p64d10或[Kr]4d10,属第五周期,I B族;(3)53元素核外电子组态:1s22s22p63s23p63d104s24p64d105s25p5或[Kr]4d105s25p5,得到1个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s24p64d105s25p6或[Kr]4d105s25p6,属第五周期,VII A族。
无机化学实验报告-D

无机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1) 蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I - = 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
将溶液稀释,得白色CuCl 沉淀:Cu + Cu2++ 4Cl - = 2[CuCl 2]-[CuCl 2]-←稀释→CuCl↓白 + Cl -卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH 3 = [Ag(NH 3)2]++ Cl -红色HgI 2难溶于水,但易溶于过量KI 中,形成四碘合汞(II)配离子:HgI 2 + 2I -= [HgI 4]2-黄绿色Hg 2I 2与过量KI 反应时,发生歧化反应,生成[HgI 4]2-和Hg :Hg 2I 2+ 2I - = [HgI 4]2-+ Hg↓黑三、实验内容 1、氧化物的生成和性质(1) C u 2O 的生成和性质Cu 2+ + 2OH - =Cu(OH)2↓ 蓝色 Cu(OH)2 + 2OH - = [Cu(OH)4]-2- 蓝色2[Cu(OH)4]2-+ C 6H 12O 6 (葡萄糖) =Cu 2O↓(红) + 4OH -+C 16H 12O 7+2H 2O或:2Cu 2+ + 5OH - +C 6H 12O 6 = Cu 2O↓+ C 6H 11O 7- + 3H 2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
第20章d区元素(二)
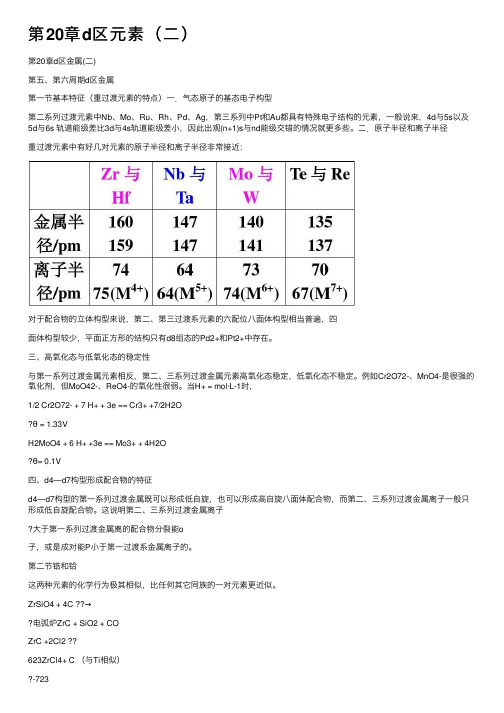
第20章d区元素(⼆)第20章d区⾦属(⼆)第五、第六周期d区⾦属第⼀节基本特征(重过渡元素的特点)⼀.⽓态原⼦的基态电⼦构型第⼆系列过渡元素中Nb、Mo、Ru、Rh、Pd、Ag,第三系列中Pt和Au都具有特殊电⼦结构的元素,⼀般说来,4d与5s以及5d与6s 轨道能级差⽐3d与4s轨道能级差⼩,因此出观(n+1)s与nd能级交错的情况就更多些。
⼆.原⼦半径和离⼦半径重过渡元素中有好⼏对元素的原⼦半径和离⼦半径⾮常接近:对于配合物的⽴体构型来说,第⼆、第三过渡系元素的六配位⼋⾯体构型相当普遍,四⾯体构型较少,平⾯正⽅形的结构只有d8组态的Pd2+和Pt2+中存在。
三、⾼氧化态与低氧化态的稳定性与第⼀系列过渡⾦属元素相反,第⼆、三系列过渡⾦属元素⾼氧化态稳定,低氧化态不稳定。
例如Cr2O72-、MnO4-是很强的氧化剂,但MoO42-、ReO4-的氧化性很弱。
当H+ = mol·L-1时,1/2 Cr2O72- + 7 H+ + 3e == Cr3+ +7/2H2Oθ = 1.33VH2MoO4 + 6 H+ +3e == Mo3+ + 4H2Oθ= 0.1V四、d4—d7构型形成配合物的特征d4—d7构型的第⼀系列过渡⾦属既可以形成低⾃旋,也可以形成⾼⾃旋⼋⾯体配合物,⽽第⼆、三系列过渡⾦属离⼦⼀般只形成低⾃旋配合物。
这说明第⼆、三系列过渡⾦属离⼦⼤于第⼀系列过渡⾦属离的配合物分裂能o⼦,或是成对能P⼩于第⼀过渡系⾦属离⼦的。
第⼆节锆和铪这两种元素的化学⾏为极其相似,⽐任何其它同族的⼀对元素更近似。
ZrSiO4 + 4C ??→电弧炉ZrC + SiO2 + COZrC +2Cl2 ??623ZrCl4+ C (与Ti相似)-723→ZrO2 + 2C + 2Cl2 ??→1173ZrCl4 + 2COKZrCl4(g) + 2Mg(l) ??11502MgCl2(s) + Zr(粗)→KArZr(粗) + 2I2 ??→473ZrI4KZrI4??→1673Zr + 2I2K第⼆节铌和钽(Niobium and Tantalum)铌、钽在空⽓中很稳定,能抵抗除氢氟酸以外的⼀切⽆机酸,包括王⽔。
无机化学习题库(湖北大学)参考答案(1)
第一章 气体 参考答案一、选择题1. (C)2. . (A)3. (C)二、填空题 ( 共10题 20分 )1. 1/4 ; 1/2 。
2. 3NH p :3.9 MPa 2N p : 1.5 MPa 2H p :4.6 MPa3. 分子间的作用力 , 分子的体积三、计算题 ( 共 3题 15分 )22. 5 分 (0152)0152设经过 t 秒 后白环在距离氨棉塞一端 x cm 处出现 , 根据气体扩散定律, 有:(97.1 -x )/t 3NH M 17.0──── = ( ──── )1/2 = ( ─── )1/2 ∴ x = 57x/t M HCl 36.5即白环在距离润湿的氨棉塞一端 57.8 cm 处出现。
第二章 溶液 参考答案一、选择题1. (D)2. (A)3. (D)二、填空题1. 174 g ·mol -12. 54.23. 0.299三、问答题答:用乙二醇较好。
因为它的沸点高, 难挥发。
而乙醇的沸点比水低, 在汽车行驶时,当散热器水箱受热后, 溶液中的乙醇先挥发, 容易着火。
第三章 化学热力学 参考答案一、选择题1. (A)2. (B)3. (A)二、填空题4. ΔG < 0 为 -ΔS > 0 为 +5. 435.76. -241.8 kJ ·mol -1三、计算题7. 待求的反应 = 反应(1) - 反应(2) - 反应(3) -12反应(4) 按Hess 定律,有:m r H ∆= m r H ∆(1) – m r H ∆(2) – m r H ∆(3) -12m r H ∆(4)= 25.9 - 218 - 75.7 - 62.3 ⨯12= -299 (kJ ·mol -1) 四、问答题8. Q p = Q V +ΔnRT ,第(1)种情况放热量为Q p ,第(2)种情况为Q V ,因为变化过程有气体产生,Δn 为正值。
无机化学第二章答案
无机化学第二章答案【篇一:大学无机化学第二章(原子结构)试题及答案】txt>本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立学会讨论氢原子的玻尔行星模型e?第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(??2:学习运用不确定原理(?x??p?第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低○的院子轨道。
2pauli原则——在同一原子中没有四个量子数完全相同的电子,或者说是在○同一个原子中没有运动状态完全相同的电子。
3hund原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式○hh)。
?pmv13.6ev。
n2h)。
2?m分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1从左向右,随着核电荷的增加,原子核对外层电子的吸引1:原子半径——○2随着核外电子数的增加,电子间的相互斥力力也增加,使原子半径逐渐减小;○也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。
无机化学第五章习题参考答案
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。
ds区,d区和f区元素
子构型具有接受配位体孤对电子的条件,因此它
们容易形成配合物,一般容易形成氟配合物、氰 配合物和氨配合物。 此外,过渡元素氧化物水合物的酸碱变化规律 和主族元素相似。对同种元素而言,低价的显碱
性,高价的显酸性。注意p304列出的ⅢB-ⅦB族过
渡元素最高价态氧化物水合物的酸碱性。
8.2 铜族和锌族元素的化合物 8.2.1 通性
3. 锌配合物 Zn2+和氨水、KCN等能形成无色的四配位离子: [Zn(NH3)4]2+、[Zn(CN)4]2-、[Zn(CN)4]2-用于电镀中 4. 汞配合物 Hg(I)形成配合物倾向较小。 Hg(II)易和CN-、SCN-、Cl-、Br-、I-离子均生成 [ML4]2-配离子。
Hg2++2I-→HgI2↓(红色)+2I-→[HgI4]2[HgI4]2-与碱混合后叫奈氏试剂,用于鉴定NH4+、
3. 形成配合物(Zn2+,Al3+的分离)
Zn 2 Al3
2 NH 3O H
Zn(OH ) 2 Al(OH ) 3
2 NH 3O H
[ Zn( NH 3 ) 4 ] 2 (白色) Al(OH )(白色) 3
8.2.3 重要的盐类 1. 几种常用的盐 硫酸铜、硝酸银、氯化汞、氯化亚汞(p306-308自 己看书,了解基本性质和用途) 2. Cu2+和Cu+的相互转化 从Cu(I)结构(3d10)看,Cu(I)是稳定的,如自然 界中有Cu2O和Cu2S的矿物存在。但在水溶液中Cu+ 易歧化,这是由于Cu2+的电荷比Cu+多,半径又小, 所以Cu2+的水合焓(-2100kJ· -1)比Cu+的(-593 mol kJ· -1)代数值小得多,∴水溶液中Cu2+比Cu+稳)4)]2+、[CuCl4]2-、[Cu(NH3)4]2+等,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
d区元素答案
一、选择题:
1. (4603) (C) 2. (4601) (B) 3. (1699) (B) 4. (1695) (D) 5. (7644) (B)
6. (7643) (D) 7. (7642) (A) 8. (4681) (B) 9.(4679) (A) 10. (4677) (B)
11. (4604) (A) 12. (4606) (C) 13. (4609) (D) 14. (4610) (C) 15. (4616) (B)
16.(4617) (D) 17. (7688) (D) 18. (7692) (B) 19. (7707) (A) 20. (7711) (B)
21. (4672) (B) 22.(4671) (D) 23.(4670) (D) 24.(4663) (A) 25. (4659) (B)
26. (4654) (A) 27.(4653) (D) 28. (4648) (A) 29. (4646) (C) 30. (4645) (C)
31. (4643) (C) 32. (1660) (D) 33. (1657) (B) 34. (1654) (B) 35. (1644) (C)
36. (1638) (D) 37. (1637) (A) 38. (1627) (A)
二、填空题 :
39. (4417) (Cl2/Cl) <(Bi(V)/Bi(III)),
HCl将被NaBiO3氧化,有Cl2产生,有碍于MnO4生成。
40. (7652) 2FeSO4 = Fe2O3 + SO3 + SO2 :(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
41. (4657) (1) C > B > A (2) A > B > C
42.(4675) BaCrO4 K2CrO4 CrCl3 CrO5
43. (1613) (1)Cr(OH)3: (2)Cr(OH)3: (3)Cr(OH)3 NaCr(OH)4
44. (4600) CoCl2(蓝) + 6H2OCoCl2·6H2O(粉红)
45. (7685) 磁,黑,+2,+3,红,+2,+4
46. (1647) Fe3+、Fe2+、Fe3+的价电子排布为稳定的半充满状态。
三、计算题 :
47. (1621) (1) 因为(Fe3+ / Fe2+) >(O2 / H2O2)
所以 Fe3+离子有可能把H2O2氧化成O2
(2) zE= 2(–)
lg K = 0591.0)]414.0(771.0[2= 40.1
K = 1 1040
四、问答题:
48. (1606) Cr3+ + OH = Cr(OH)3↓ Cr(OH)3 + OH = Cr(OH)4
2Cr(OH)4+ 3Br2+ 8OH = 2-24CrO+ 6Br 2-24CrO+ 2H+-272OCr+ H2O
49. (4629) 可应用还原、中和、沉淀法除去废水中的铬。
第一步:先将废水用硫酸酸化后用NaHSO3进行还原处理,使废水中Cr(VI)还原为
Cr(III):
2H2Cr2O7 + 6NaHSO3 + 3H2SO4 = 2Cr2(SO4)3 + 3Na2SO4 + 8H2O
第二步:用石灰将经还原处理后的废水中和至呈碱性,使Cr(III)沉淀然后过滤分离:
Cr2(SO4)3 + 3 CaO + 3 H2O = 2 Cr(OH)3↓+ 3 CaSO4↓
2
50. (4638) A. K2MnO4 B. MnO2 C. KMnO4 D. Cl2 E. MnCl2
51. (6701) (1) (4MnO/ MnO2) =2126.2256.01= 1.69 (V)
(2) Mn3+易歧化为MnO2和Mn2+;-24MnO易歧化为4MnO和MnO2;
(3) 先发生下列反应:4MnO+ 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
当 KMnO4过量时还发生下列反应:
24MnO+ 3Mn2+ + 2H2O = 5MnO2↓+ 4H+
所以4MnO可氧化Mn2+成为MnO2沉淀。
52. (1684) Co3+ 是强氧化剂,它能与水反应也能与I反应:
2Co3+ + H2O O2 + 2H+ + 2Co2+
2Co3+ + 2I2Co2+ + I2
Cu2+ 与I 发生下列反应:
2Cu2+ + 4I2CuI + I2
故这一说法不合理。
53. (7622) 可以。
因为 (Co3+/Co2+) > (Cl2/Cl) (否则Co3+不可能氧化Cl)
而 (Co(NH3)36/Co(NH3)26) <(Cl2/Cl) (否则[Co(NH3)6]3+会氧化Cl)
所以 Co(NH3)36稳定性明显大于Co(NH3)26
Co3+ + e Co2+ 平衡移动方向如图所示,使Co3+ 氧化能力下降。
+ +
NH3 ─── NH3
↓ ↓
Co(NH3)36 Co(NH3)26
54. (7631) CoCl2 + 2NaOH = Co(OH)2↓+ 2NaCl
Co(OH)2在久置时会被空气中氧氧化:
2Co(OH)2 +21O2 + H2O = 2Co(OH)3↓
Co(III)在酸化条件下有强氧化性,产生Cl2气有刺激性。
2Cl + 2Co(OH)3 + 6H+ = 2Co2+ + 6H2O + Cl2↑
55. (7715)根据电对的电极电势:A(Fe3+/Fe2+) = 0.77 V,A(O2/H2O2) = 0.68 V,
A
(H2O2/H2O) = 1.77 V 可知:
Fe3+可将H2O2氧化:
2Fe3+(aq) + H2O2(aq) = 2Fe2+(aq) + O2(g) + 2H+(aq) E= 0.09 V
而H2O2又可将Fe2+氧化:
2Fe2+(aq) + H2O2(aq) + 2H+(aq) = 2Fe3+(aq) + 2H2O(l) E= 1.00 V
因此,从热力学考虑,Fe3+对H2O2的分解有催化作用。另外,实验证明,Fe3+催化分解
H2O2的速率是很快的。
