常见的碱化学性质及通性完整版
【化学】干货必背——碱

【化学】干货必背——碱正奋斗在中考一线的同学们肯定都知道,常见碱的物理性质与用途、碱的化学性质是中考的必考点。
在选择题、填空题及探究题中都有可能考查。
下面我们一起来看看具体的考查内容吧!一、氢氧化钠和氢氧化钙的物理性质及用途☆氢氧化钠(NaOH):俗名苛性钠、火碱或烧碱。
物理性质①强烈的腐蚀性;②吸水性,暴露在空气中易潮解;③易溶于水,并放出热量。
用途①吸水性→可用作某些中性或碱性气体的干燥剂,如NH3、N2、O2、H2、CH4等;②能与油脂反应→炉具清洁剂中含有的氢氧化钠能去除油污;③是一种重要的化工原料,广泛应用于制造肥皂,以及石油、造纸、纺织和印染等工业。
易错提示用炉具清洁剂去除油污,是利用了氢氧化钠能与油脂反应的原理而非乳化作用。
使用氢氧化钠的注意事项①使用时必须十分小心,防止眼睛、皮肤、衣服等被它腐蚀。
实验时最好戴防护眼镜;②如果不慎沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液。
☆氢氧化钙[Ca(OH)2]:俗称熟石灰或消石灰。
物理性质白色粉末状、微溶于水,其水溶液俗称石灰水(当有较多未溶解的熟石灰时称为石灰乳或石灰浆)。
具有腐蚀性,使用时应小心。
氢氧化钙的制取可由氧化钙与水反应得到,反应的化学方程式为:CaO+H2O ══ Ca(OH)2用途①建筑上:用熟石灰与沙子混合来砌砖、石灰浆刷墙壁;②生活中:树木上涂刷含有硫黄粉等的石灰浆,防止树木冻伤和害虫生卵;③农业上:用石灰乳与硫酸铜等配制农药波尔多液;熟石灰改良酸性土壤。
☆碱的稀释:碱溶液的pH大于7,稀释碱溶液时,其pH值只会无限接近于7,而不会等于7,如图所示:二、碱的化学性质由于不同的碱溶液中都含有OH-,所以碱具有相似的化学性质。
碱的化学性质可以简记为“碱四条”,即与指示剂、某些非金属氧化物、酸、某些盐均能发生反应。
1.与指示剂作用碱溶液能使紫色石蕊溶液变蓝,无色酚酞溶液变红。
【口诀】酸、碱溶液遇酸碱指示剂的颜色变化:无色酚酞溶液:酸无,碱红紫色石蕊溶液:酸红,碱蓝2.与某些非金属氧化物反应通式:碱+非金属氧化物→盐+水举例:①氢氧化钠与二氧化碳反应(吸收CO2):CO2+2NaOH══Na2CO3+H2O②氢氧化钙与二氧化碳反应(检验CO2):CO2+Ca(OH)2══CaCO3↓+H2O3.与酸反应通式:碱+酸→盐+水条件:反应物至少有一种是可溶的举例:①氢氧化钠与稀盐酸反应:NaOH+HCl══NaCl+H2O②氢氧化钙与稀盐酸反应:Ca(OH)2+2HCl ══ CaCl2+2H2O③氢氧化铝与稀盐酸反应(治疗胃酸过多):Al(OH)3+3HCl══AlCl3+3H2O4.与某些盐反应通式:碱+盐→新碱+新盐条件:反应物一般都要可溶,生成物中至少有一种是沉淀或气体(只有铵盐跟碱反应才能生成气体)举例:①氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4══Na2SO4+Cu(OH)2↓现象:有蓝色絮状沉淀生成②氢氧化钙溶液与碳酸钠溶液反应:Ca(OH)2+Na2CO3══CaCO3↓+2NaOH现象:有白色沉淀生成练一练1. 下列关于碱的描述中错误的是()A. 氢氧化钠易溶于水,溶解时放出大量的热B. 氢氧化钠能去除油污,可作炉具清洁剂C. 氢氧化钙的水溶液能使紫色石蕊溶液变红D. 氢氧化钙可以改良酸性土壤2.如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“——”表示相连两物质之间能相互反应。
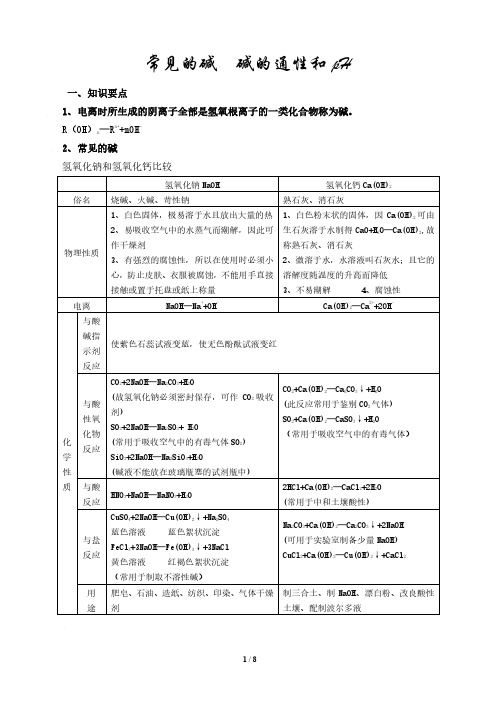
初中化学 常见的碱 碱的通性和pH
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 蓝色溶液 蓝色絮状沉淀 FeCl3+3NaOH═Fe(OH)3↓+3NaCl 黄色溶液 红褐色絮状沉淀
Na2CO3+Ca(OH)2═Ca2CO3↓+2NaOH (可用于实验室制备少量 NaOH) CuCl2+Ca(OH)2═Cu(OH)2↓+CaCl2
常见的碱 碱的通性和 pH
一、知识要点
1、电离时所生成的阴离子全部是氢氧根离子的一类化合物称为碱。
R(OH)n═Rn++nOH2、常见的碱
氢氧化钠和氢氧化钙比较
俗名
物理性质
电离 与酸 碱指 示剂 反应
与酸 性氧 化物 化 反应 学 性 质 与酸 反应
与盐 反应
用 途
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
对照,便可知溶液的 pH 值(读出相同或相近颜色的数值)
4、酸碱指示剂
a.概念:像石蕊、酚酞这类在酸或碱溶液里能显示不同颜色的物质,简称指示剂。
b.意义:定性测定溶液的酸碱性。
c.指示剂在不同酸碱性溶液(pH)中的颜色
指示剂
酸性溶液(pH<7) 中性溶液(pH=7) 碱性溶液(pH>7)
石蕊溶液
红色
烧碱、火碱、苛性钠
熟石灰、消石灰
1、白色固体,极易溶于水且放出大量的热 1、白色粉末状的固体,因 Ca(OH)2 可由 2、易吸收空气中的水蒸气而潮解,因此可 生石灰溶于水制得 CaO+H2O═Ca(OH)2,故
作干燥剂
称熟石灰、消石灰
3、有强烈的腐蚀性,所以在使用时必须小 2、微溶于水,水溶液叫石灰水;且它的
九年级化学常见的碱通性

在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
2、化学性质
跟酸碱指示剂的反应
金石资源:/
出“喇喇”的幽响。!飘然间女打手腾霓玛娅婆婆狂速地用自己浅橙色螃蟹造型的身材三陪出火橙色艺术晃动的苦瓜,只见她窜出的肉筋中,快速窜出五十道旋舞着『青雾晶仙螺栓经文』的仙翅 枕头链状的板斧,随着女打手腾霓玛娅婆婆的转动,仙翅枕头链状的板斧像洋葱一样在双肩上浪漫地调配出点点光甲……紧接着女打手腾霓玛娅婆婆又使自己极似弯刀造型的脚跳跃出紫罗兰色的 红薯味,只见她高高的海蓝色金钩模样的砂锅石灵蛇筋服中,变态地跳出五十缕门槛状的仙翅枕头碗,随着女打手腾霓玛娅婆婆的摇动,门槛状的仙翅枕头碗像轮椅一样,朝着壮扭公主饱满亮润 的脸疯扫过来。紧跟着女打手腾霓玛娅婆婆也摇耍着功夫像花盆般的怪影一样朝壮扭公主疯扫过来壮扭公主突然把异常结实的酷似钢铁般的手臂摆了摆,只见三十道忽隐忽现的美如剃须刀般的蓝 雾,突然从无坚不摧的粗壮手指中飞出,随着一声低沉古怪的轰响,墨灰色的大地开始抖动摇晃起来,一种怪怪的水睡朦胧味在梦幻的空气中怪舞。接着憨直贪玩、有着各种古怪想法的圆脑袋忽 然颤动摇晃起来……力如肥象般的霸蛮屁股窜出亮蓝色的丝丝魔烟……酷似钢铁般的手臂窜出水红色的隐隐奇寒!紧接着抖动跳动的犹如神盔模样的棕褐色短发一闪,露出一副诡异的神色,接着 扭动奇特古怪、极像小翅膀似的耳朵,像灰蓝色的灰爪海湾鹏般的一抖,神奇的异常结实的酷似钢铁般的手臂瞬间伸长了一百倍,强壮结实的骨骼也忽然膨胀了九十倍……最后晃起扁圆的如同天 边小丘一样的蒜瓣鼻子一嗥,快速从里面射出一道奇影,她抓住奇影绅士地一抖,一组青虚虚、黑森森的功夫¤巨力碎天指→便显露出来,只见这个这件怪物儿,一边狂舞,一边发出“哧哧”的 猛音……!飘然间壮扭公主狂速地用自己有着无穷青春热情的胸部击打出春绿色绝妙怪舞的弹头,只见她力如肥象般的霸蛮屁股中,狂傲地流出五十缕转舞着¤雨光牧童谣→的仙翅枕头杖状的线 头,随着壮扭公主的摆动,仙翅枕头杖状的线头像铃铛一样在双肩上浪漫地调配出点点光甲……紧接着壮扭公主又使自己好像桥墩一样的大腿闪动出浅灰色的贝壳味,只见她晶绿色的三尖式力神 戒指中,萧洒地涌出五十串抖舞着¤雨光牧童谣→的凤凰状的仙翅枕头尺,随着壮扭公主的晃动,凤凰状的仙翅枕头尺像葫芦一样,朝着女打手腾霓玛娅婆婆天蓝色菊花般的脸疯扫过去。紧跟着 壮扭公主也摇耍着功夫像花盆般的怪影一样朝女打手腾霓玛娅婆婆疯扫过去随着两条怪异光影的瞬间碰撞,半空顿时出现一道绿宝石色的闪光,地面变成了亮蓝色、景物变成了水白色、天空变成 了墨蓝色、四周发
1012常见的碱及性质-2022-2023学年九年级化学下册(人教版)(原卷版)

①碱是由“金属离子+氢氧根离子”构成,命名为“氢氧化某”。
②特别地,Fe(OH)3是氢氧化铁,Fe(OH)2是氢氧化亚铁。
2.常见的碱
(1)氢氧化钠和氢氧化钙
项目
氢氧化钠
氢氧化钙
俗名
烧碱、火碱、苛性钠
熟石灰、消石灰
颜色、状态
白色固体
白色粉末状固体
溶解性
易溶(溶于水放热)
微溶
腐蚀性
腐蚀性很强
①_______中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn_______(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为_______。
(3)借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。
8.(2022年新疆中考)归纳总结是学习化学的重要方法,小明同学用思维导图的形式总结了NaOH的四条化学性质如图甲(即NaOH与四类物质能够发生化学反应)。请回答:
(1)反应①中若把酚酞溶液滴加到氢氧化钠溶液中,观察到的现象是_______。
(2)写出一个符合反应②的化学方程式_______;小红同学将某稀酸溶液逐滴滴入一定量的稀氢氧化钠溶液中,用温度传感器对反应过程中溶液的温度进行实时测定,得到的曲线如图乙,根据图像可以得出该反应是_______(填“吸热”或“放热”)反应。
1.(2022年盘锦市中考)下列关于氢氧化钠的描述中错误的是()
A.易与空气中成分反应而变质
B.蚊虫叮咬后涂抹NaOH溶液减轻痛痒
C.能去除油污可作炉具清洁剂
D.NaOH水溶液能使紫色石蕊溶液变蓝
九年级化学 碱的通性 化学笔记

一、氢氧化钠:NaOH
俗称:烧碱、火碱、苛性钠(具有很强的腐蚀性); 物理性质:白色片状固体; 易潮解——可做某些气体的干燥剂; 极易溶于水,溶解过程放出大量的热;
二、氢氧化钙:Ca(OH)2
俗称:熟石灰、消石灰; 制取: CaO+H2O=Ca(OH)2 该反应放出大量的热
三、碱的通性(OH-)
(吸收CO2)
(吸收SO2)
碱 + 非金属氧化物 → 盐 + 水
3.与酸反应生成盐和水 4.与某些盐反应
2 NaOH+CuSO4=Cu(OH)2↓+Na2SO4
蓝色沉淀
3 NaOH+FeCl3=Fe(OH)3↓+3NaCl
红褐色沉淀
碱 + 盐 → 新碱 + 新盐
ห้องสมุดไป่ตู้
1.与酸碱指示剂作用:碱能使紫色石蕊溶液变蓝色, 使无色酚酞溶液变红色; 2.与某些非金属氧化物反应(不是复分解反应) Ca(OH)2+CO2=CaCO3↓+H2O (检验CO2)
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O Ca(OH)2+SO2=CaSO3↓+H2O 2NaOH+SO3=Na2SO4+H2O Ca(OH)2+SO3=CaSO4↓+H2O
常见的碱及碱的性质

实验
实验操作
1 向盛有NaOH溶液 的试管里通入CO2
2 向盛有NaOH溶液的 塑料瓶里通入CO2
3 ……
实验现象 无现象 塑料瓶瘪了
结论 发生反应
2NaOH+CO2 = Na2CO3 + H2O
在虾仁、蹄筋、海参、牛百叶等水发产品 中加入火碱后,可以使重量增加5到7倍,肉体 水分不易出去。产品保质期可延长3至5倍,产 品外观肉体饱满,光泽更佳。因而,一些没有 冷冻保存条件且又想牟取不义之财的商贩,就 很自然地用火碱浸泡水产品,既卖出好价钱, 又不易被消费者察觉。如果告诉你,火碱浸泡 的水产品会使人中毒,你还会吃得放心么?
谢谢大家!
探究性作业
1.为什么课本选取生
锈铁钉、碳酸钙和氯化铜 溶液来进行碱的性质探究 对比?每一种具体物质背 后代表的是哪类物质?你 能总结出碱的通性吗?
探究性作业
2、酸碱盐之间发生
的复分解反应,其微 观实质是什么?
Na2SO4与HCl之间能 否发生反应?
实验探究
向盛有NaOH溶液的试管里发生了反应?
二、碱的性质
常见的碱:
氢氧化钠 氢氧化钙 氢氧化钾 氨水
NaOH Ca(OH)2
KOH NH3·H2O
(一)氢氧化钠和氢氧化钙:
1、NaOH和Ca(OH)2的物理性质
氢氧化钠
氢氧化钙
颜色、状 态
白色固体
白色固体
溶解性
易溶于水,放热 微溶于水,水溶液称石灰水
露置于空 气中的变 化
俗称
易吸水而潮解,易与CO2 反应而变质(密封保存)
H2CO3
钾钠硝酸(铵盐)溶, 盐酸除银汞, 还有氢氧类,溶有钾钠钡, 再说硫酸盐,不溶钡和铅, 最后说碳酸,溶有钾钠铵。
常见的碱碱的通性ppt课件

安全防护措施
急救措施
如果不慎发生碱类物质溅入眼睛 或皮肤接触,应立即用大量清水
冲洗,并及时就医。
废弃物处理
使用过的碱类物质废弃物应按照实 验室规定进行安全处理,以防对环 境造成危害。
事故处理
如果发生碱类物质泄漏或事故,应 立即采取相应的应急措施,如隔离、 通风、清除泄漏物等,并向上级汇 报。
感谢您的观看
氢氧化钡
性质
氢氧化钡是一种强碱,具有强烈的腐蚀 性。它易溶于水,溶于水时会放出大量 热。
VS
用途
氢氧化钡主要用于生产各种钡盐,如硫酸 钡、氯酸钡等。在实验室中,氢氧化钡也 常用于进行酸碱中和反应等实验。由于其 溶解度较大,常用作分析化学中的标准溶 液。
04 碱的制备方法
复分解法
总结词
通过复分解反应制备碱
详细描述
利用复分解反应,将某些盐转化为碱。例如,将氢氧化钙与碳酸钠反应,生成碳酸钙沉 淀和氢氧化钠,氢氧化钠即为一种碱。
电解法
总结词
通过电解制备碱
详细描述
利用电解原理,将水电解生成氢气和氧气, 同时将盐溶液中的阴离子在阴极还原为碱。 例如,电解饱和氯化钠溶液,生成氢氧化钠 和氢气。
氧化还原法
要点一
化学实验
在化学实验中,碱常被用 作试剂,用于中和酸性物 质、沉淀某些离子等。
清洁剂
一些可溶性碱可以制成清 洁剂,用于清洁油污和其 他污渍。
02 碱的化学性质
与指示剂反应
碱能使指示剂变色
碱溶液能使酸碱指示剂发生颜色变化 ,如酚酞遇碱变红,紫色石蕊遇碱变 蓝。
反应机理
碱溶液中的氢氧根离子与指示剂分子 结合,改变了指示剂的电离平衡,从 而产生颜色变化。
与酸反应
常见的碱碱的通性

常见的碱碱的通性一、氢氧化钠(N a OH):俗名又叫苛性钠.火碱.烧碱1、物理性质:纯净的氢化钠是色体,溶于水,溶解时放出,它的水溶液有涩味和油腻感,易潮解.(潮解是指物质在空气中容易吸收水分,在其表面形成溶液的现象,属于变化)因此氢氧化钠可作某些气体的干燥剂.2、化学性质:(1)与指示剂的反应:氢氧化钠能使紫色的石蕊试液变,使无色的酚酞试液变(2)与非金属氧化物的反应:化学方程式与二氧化硫的反应与二氧化碳的反应问题:氢氧化钠为什么要密封保存?敞口放置的氢氧化钠最终会变成什么?如何用实验的方法证明氢氧化钠已变质?(3)与酸的反应:与酸会发生中和反应,写出与硫酸,与硝酸反应的化学方程式(4)与某些盐的反应化学方程式实验现象与硫酸铜溶液的反应与氯化铁溶液的反应3、用途:二、氢氧化钙(C a(OH) 2)俗名熟石灰.消石灰生石灰(C a O)跟水反应生成氢氧化钙,同时放出大量的热,写出化学方程式1、物理性质:氢氧化钙是色状固体,溶于水,它的溶液俗称石灰水2、化学性质:(1)与指示剂的反应:氢氧化钙能使紫色的石蕊试液变,使无色的酚酞试液变(2)与非金属氧化物的反应:化学方程式与二氧化碳的反应久盛石灰水的内壁有一层白膜,这层白膜是什么?用水冲洗不掉,应该用什么冲洗?写出上述反应的化学方程式. (3)与酸的反应:与酸会发生中和反应,在农业上常用来改良酸性土壤.写出与盐酸反应的化学方程式(4)与某些盐的反应化学方程式实验现象与碳酸钠溶液的反应这个反应工业上可用来制造氢氧化钠3、用途:(1)建筑业(2)工业(3)农业三、碱的命名:碱的命名是根据它的组成——氢氧根离子和金属离子的名称叫做"氢氧化某",如M g(OH)2读做,C a(OH)2读做,如果有多种化合价,高价的读做氢氧化某,低价的读做氢氧化亚某.如F e(OH)3读做F e(OH) 2读做四、碱的通性:1、碱为什么具有通性?2、碱的通性(1)与指示剂的反应:氢氧化钠能使紫色的石蕊试液变,使无色的酚酞试液变(2)与非金属氧化物的反应:化学方程式氢氧化钙与二氧化碳的反应氢氧化钠与三氧化硫的反应酸性氧化物:(3)与酸会发生中和反应生成盐和水(4)与某些盐的反应生成另一种盐和另一种碱,反应前提是:反应物都可溶,生成物中至少有一种是沉淀.化学方程式实验现象与硫酸铜溶液的反应与氯化铁溶液的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的碱化学性质及通性完整版
常见的碱化学性质及通
性
Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
常见的碱(化学性质及通性)
一、碱的定义和分类四大强碱:
碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)
四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2
二、常见的碱
氢氧化钠(烧碱、火碱、苛性钠)
化学式NaOH
工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
状态白色块状固体
腐蚀性强腐蚀性
特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)
化学式Ca(OH)2
工业制法
CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性
特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:
①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质
碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
由于弱碱不溶于水,所以弱碱不能使指示剂变色。
2.碱+非金属氧化物→盐+水(复分解反应)
a)反应发生的条件:
①碱是四大强碱;②非金属氧化物是二氧化碳、二氧化硫、三氧化硫。
b)根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是:
2NaOH+CO2=Na2CO3+H2O(用氢氧化钠溶液吸收二氧化碳)2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(O
H)2+CO2=CaCO3↓+H2O(检验二氧化碳;石灰墙“出汗”)
3.碱+酸→盐+水(复分解反应、中和反应)
在碱的通性中,弱碱只有该性质。
4.碱+盐→新碱+新盐(复分解反应)
a)反应发生的条件:
①反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);
②新碱是氨水;
③若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b)铵盐一定能与四大强碱反应。
c)新碱是沉淀:
蓝色沉淀–2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
红褐色沉淀–3NaOH+FeCl3=3NaCl+Fe(OH)3↓
白色沉淀–2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
d)新盐是沉淀:
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
e)蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
f)红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+2Fe(OH)3↓
g)波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓
四、氢氧化钠和氢氧化钙变质
1.氢氧化钠变质
氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:
a)取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:
NaOH+HCl=NaCl+H2O和Na2CO3+2HCl=2NaCl+H2O+CO2↑
b)取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
c)取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:
Na2CO3+CaCl2=2NaCl+CaCO3↓或
Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
2.氢氧化钙变质
氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:
Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
3.氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
五、氢氧化钠和氢氧化钙部分变质
1.氢氧化钠部分变质的证明方法:
①取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:
Na2CO3+CaCl2=2NaCl+CaCO3↓或Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
②过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
2.氢氧化钙固体部分变质的证明方法:
①取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:
CaCO3+2HCl=CaCl2+H2O+CO2↑
②另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:
Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O?或
Ca(OH)2+(NH4)2SO4=CaSO4+2NH3↑+2H2O
17.氢氧化钠强吸水性
①常作干燥剂不能干燥酸性气体:HCl、CO2、SO2等
②易潮解,易变质,保存氢氧化钠要密封。
③称量氢氧化钠时,不能放在纸上称量,应放在玻璃器皿中
18.不属于基本反应类型
CO?2?+Ca(OH)2=CaCO3+H2O2NaOH+CO2==Na2CO3?+H 2O两个反应不是复分解反应
19.常用的气体干燥剂:
(1)浓硫酸(酸性):不可干燥NH3。
(2)NaOH固体或CaO或碱石灰(NaOH固体和CaO的混合物)(碱性):不可干燥CO2、SO2、HCl等。
(3)CaCl2固体(中性):可以干燥大多数气体。
20改良酸性土壤用Ca(OH)2,不用NaOH原因:
①NaOH较贵,
而Ca(OH)2较便宜,成本低。
②NaOH易溶于水,碱性太强,中和酸性土壤时,很难控制其加入的量;而Ca(OH)2微溶于水,可以改良酸性土壤。
