2012年高考理科化学模拟试题
2012年高考终极仿真模拟试题化学(新课标卷).pdf

二、教学重点: 人们离不开大自热,大自然是人类的朋友。
三、教学难点: 食物链与生态平衡。
第二课时 生存的空间 一、导入:视频,美丽的地球 播放视频资料,讲解地球的以及地球上一些生物的来源及其自然环境的关系等。
二、教学 环节一:美丽的地球,人类生存的基础 1.学生从视频中找出地球的来源,自然环境的构成以及人们赖以生存的物质基础。
2.教师把学生说出的地球的来源、自然环境的构 成以及人们赖以生存的物质基础进行总结,把意义写在黑板上。
3.学生阅读教科书第 4~5页的相关内容,进一步了解地球自然环境的 构 成和人们赖以生存的物质基础。
4.补充完善教师板书。
环节二:奇妙 的食物链 1.展示一些动物、植物、微生物的图片,请学生说明这些生物如何为彼此提供食物。
2.请同学到黑板上将它们之间的关系用线条连接起来。
3.教师依据学生的连接结果,讲解食物链的含义。
4.提供一些生物的名称,让学生自己连接,强化对食物链的理解。
环节三:可爱又可恶的外来物种 1.展示外来物种入侵带来的利益和危害(如水葫芦等)的案例并给以简单讲解。
2.学生分组交流外来物种给本土环境和生物带来的危害及其原因,讨论我们在引进外来物种时应该注意些什么。
(具体教学过程参考“教学活动设计”,有关资料可参考“教学参考资料”) 3.教师总结:自然环境的规律是很微妙的,其中食物链就是生物微妙关系的例证。
一个平衡的生态环境是经过千百年的发展而形成的,其中的任何环节都是很重要的。
任何人为的破坏都将造成整个食物链的破坏,必然将影响整个生态环境,甚至破坏整个生态环境。
所以,我们对自然环境必须坚持科学的态度,要尊重自然规律,不要以人类为中心。
环节四:我们身边的污染种类 1. 展示部分环境污染的图片,学生观看。
2. 学生分组讨论环境污染的种类以及对人类的危害。
3.小组上台汇报,教师总结。
四、小结: 环境是我们赖以生存和发展的物质空间和物质条件,我们应该珍惜大自然、尊重大自然中的一切生命,维持生态系统的平衡。
2012年高考2模拟考试理科综合化学卷试题分析
潍坊2012年高考模拟考试理科综合化学卷试题分析2012-4-27 试题组成:第I卷有7个单项选择题,每小题4分,共28分;第II卷必做部分有3个大题,共42分;选作部分命题了2个模块(物质结构与性质模块,有机化学基础模块),学生选作其中一个,8分;化学总共78分。
符合山东2012年考试说明的试题结构。
第I卷选择题分析:7题考查了化学与生活,与山东理综考试模式相似。
较简单。
8 题考查了简单有机化合物知识,涉及甲苯的硝化反应、油脂的皂化反应、石油的裂解等知识。
同时增加了卤代烃同分异构体的内容。
或许这是向全国新课标理综模式靠拢的表现。
9、考查了元素化合物相关内容,主要涉及到Si、P、S、Cl非金属性的比较,Si的存在及应用;铁、铝、铜的抗腐蚀性等知识,同时联系到了电解的相关内容。
考查内容面广,较简单。
10题属于组合题型,综合考查了化学用语的使用。
主要有离子方程式正误判断,水解原理,氧化还原反应基本规律的应用,热化学方程式的书写。
能考查学生的基本功,区分度较高。
有向全国卷靠拢的倾向。
11题考查了元素周期表与元素周期律知识,是山东理综常规题型,选项A考查金属失电子能力强弱的比较、B项考查过渡元素的原子结构、C项考查元素氢化物性质递变规律、D同位素的概念。
很基础,较易。
12题属于以图表形式对电解质溶液性质的考查,图表题型在山东理综化学选择题中出现频率较高,该题很吻合高考题型,考生首先得从表中提取信息,即几种酸的相对强弱,然后结合选项回答问题。
属于较难题型。
13题以读表数据形式考查了沉淀溶解平衡、Ksp,水解反应的应用,SO2的漂白性等。
难度较大。
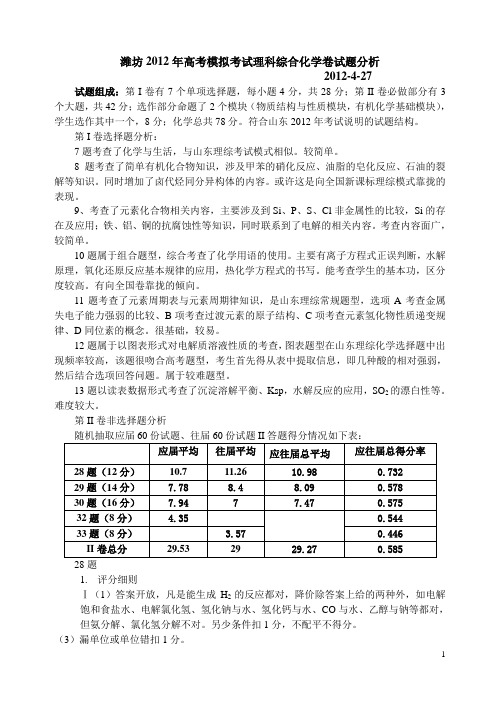
第II卷非选择题分析随机抽取应届60份试题、往届60份试题II答题得分情况如下表:1.评分细则Ⅰ(1)答案开放,凡是能生成H2的反应都对,降价除答案上给的两种外,如电解饱和食盐水、电解氯化氢、氢化钠与水、氢化钙与水、CO与水、乙醇与钠等都对,但氨分解、氯化氢分解不对。
2012年普通高考北京卷理科综合化学试题与解析

2012年普通高等学校招生全国统一考试理科综合能力测试(北京卷)化学试题第Ⅰ卷(选择题共120分)本卷共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
相对原子质量(原子量):H 1 C 12O 16Na 23Cl 35.5Br 80⒍下列用品的有效成分及用途对应错误..的是()A B C D用品有效成分NaCl Na2CO3Al(OH)3Ca(ClO)2用途做调味品做发酵粉做抗酸药做消毒剂⒎下列解释实验现象的反应方程式正确的是()A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl-C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物2Na2O2+2CO2=2Na2CO3+O2D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+ CO32-+2H2O⒏下列实验中,所选装置不合理...的是()A.分离Na2CO3溶液和CH3COOC2H5,选④B.用CCl4提取碘水中的碘,选③C.用FeCl2,溶液吸收Cl2,选⑤D.粗盐提纯,选①和②⒐已知33As、35Br位于同一周期。
下列关系正确的是()A.原子半径:As>Cl>P B.热稳定性:HCl>AsH3>HBrC.还原性:As3->S2->Cl-D.酸性:H3AsO4>H2SO4>H3PO4⒑用下图所示装置进行下列实验,实验结果与预测的现象不一致...的是()①中的物质②中的物质预测①的现象A 淀粉KI溶液浓硝酸无明显变化B 酚酞溶液浓盐酸无明显变化C AlCl3溶液浓氨水有白色沉淀D 湿润红纸条饱和氯水红纸条褪色⒒下列说法正确的是()A.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖C.若两种二肽互为同分异构体,则二者的水解产物不一致D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体⒓人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。
2012年全国高考仿真模拟题(北京理综卷化学部分)

第 1卷
一
( 选择题 共 4 分) 2
) .
、
选择题 ( 本大题包括 7 小题 , 每小题 6 , 4 分. 分 共 2 每小题只有 1 个选项符合题意. )
A 铁是人 体 内重要 的微量元 素 之一 , 可通 过酱 油加 铁补 充人 体所 需铁 元素 ;
6 .化 学与 生活 密切 相关 . 下列 叙述 正确 的是 (
CH CO OCH 2 \ CH 3 CO0 \H2 、
. C C —
/
\
、
、
.
2 .( 5 )A、 C、 6 1分 B、 D为 常见 双原子 分子气 态单 质 , E为第 三周 期金属 单质 . 已知 : A 和 B可在 一定条 件下 化 ①
指t 时改 变某一 反应 条件 ( 他条 件不 变) 其 引起 平衡 移动 的情 况. 列叙 述 中正确 下
的是 ( ) .
A
改 变 的条 件 可能是 增 大 了反应 器 的体积 ;
B 改 变 的条件 可能 是 升高温 度 ;
C 改变 的条 件可 能是 增 大反应 体 系 的压强 ;
B 柑橘 、 红柿 等有 酸 味的食 物属 于 酸性食 品 ; 西
C 维生 素与糖 类 、 油脂 、 白质 一样属 于 有机 高分 子化合 物 ; 蛋
D 推 广使 用无磷 洗 涤剂 主要 是 因为无 磷洗 涤剂 的洗 涤效 果更好 7 .据 报道 , 星球 大气 中含有 一种 称 为硫化 羰 ( OS 的化 合物 , 某 C ) 其结 构 与二 氧 化碳 类 似 , 能在 氧 气里 燃烧 . 下列 说 法正 确 的是 ( ) . ‘
: : 竺 1 竺
21 0 2年全 国高 考仿 真 模 拟 题
2012高考化学模拟试题9

2012高考化学模拟试题6.下列实验操作与安全事故处理错误的是A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中B.用试管夹从试管底由下往上夹住距离管口约1/3处,手持试管夹长柄末端,进行加热C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中D.把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中7.能正确表示下列反应的离子方程式是A.甲酸钠溶液和盐酸反应:HCOO-+H+HCOOHB.硫化钠的第一步水解:S2-+2H2O H2S+2OH-BaSO4↓C.醋酸钡溶液和硫酸反应:Ba2++SO 24D.氢氧化钙溶液和过量碳酸氢钠反应:Ca2++HCO3-+OH-CaCO3↓+H2O8.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH 溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为A、6:1B、3:1C、2:1D、1:2 9.关于某无色溶液中所含离子的鉴别,下列判断正确的是A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-10.已知反应A2(g)+2B2(g)2AB2(g)的△H<0,下列说法正确的是 A.升高温度,正向反应速率增加,逆向反应速率减小B.升高温度有利于反应速率增加,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动11.下列有关pH变化的判断中,正确的是A.随着温度的升高,碳酸钠溶液的pH减小B.随着温度的升高,纯水的pH增大COOH │ OH ╲ HO ╱ OHC .新制氯水经光照一段时间后,pH 减小D .氢氧化钠溶液久置于空气中,pH 增大12.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
2012广东高考化学模拟一(含答案)

2012 广东高考化学模拟一7.化学与生产、生活、社会密切相关,下列说法正确的是A.钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料B.蛋白质、棉花、核酸、PVC、淀粉、油脂都是由高分子组成的物质C.淀粉和纤维素,都可用(C6H10O5) n 表示,但淀粉能发生银镜反应,而纤维素不能D.煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法8.设N A 代表阿伏伽德罗常数的值,下列说法正确的是:A.1mol 甲基中含有电子数为7N AB.25℃时,pH=7 的NH 4Cl 和NH3?H2O 混合溶液中,OH -7-离子数为10N AC.42g 丙烯中含有共价键的数目为9N A-1 的盐酸和氢氧化钠溶液充分反应,转移D.两份 2.7g 铝分别与100mL 浓度为 2 mol L·电子数均为0.3N A9.下列各组离子能在指定溶液中大量共存的是+①无色溶液中:K、Cl --2-3-、H2PO4 、PO4 、SO4-②使pH=14的溶液中:CO32③室温下水电离的c(H +) =10-13mol/L 的溶液:K -+ -2+、HCO3、Br 、Ba+④加入Mg能放出H2 的溶液中:NH4 、Cl -+ 2-、Na 、SO4--+ 3+ ⑤使甲基橙变红的溶液中:MnO4 、NO3 、Na 、Fe⑥室温下c(H +)/c(OH -) =10122+的溶液中:Fe 、Al 3+-、NO3、I-A.①③⑥B.①②⑤C.②④⑤D.①③④10.常温常压时,下列说法正确的是A .中和pH 与体积都相同的盐酸和醋酸,消耗NaOH 的物质的量之比为1︰ 1 +)相等B.pH=3 的盐酸和pH=3 的FeCl3 溶液中,水电离的c(HC.0.1mol /L NaHSO4 溶液中:c(H +)=c( 2SO )+ c(OH )4+)>c( D.0.1mol /L NaHCO 3 溶液中:c(Na HCO )>c(32CO )>c(H 2CO3)311.下列装置所示的实验不能..达到目的的是H2O2 水Na红墨水MnO 2A .定量测定化学反应速率B.验证Na 和水反应的热效应浓盐酸冷水KMnO 4Na2S 溶液S iO 2中混有NH 4ClA.SO2 通入Ba(NO3)2 溶液中:SO2+Ba 2+ ++H2O= BaSO3↓+2H B.铝铵矾[NH 4Al(SO 4)2·12H2O]溶液中加入过量Ba(OH) 2 溶液:1Al 3+ 2-2++2SO4 +2Ba +4OH-=AlO 2-+2BaSO4↓+2H2O-+C.H2O2 溶液中滴加酸性KMnO 4 溶液:2MnO 4 +5H2O2+6H =2Mn D.少量NaHSO4溶液与足量Ba(OH) 2 溶液反应离子方程式为:2++5O2↑+8H2O2H +2-+Ba2++SO4+2OH -=BaSO4↓+2H2O22.从目前电动汽车的发展动向来看,使用铁锂电池是较为合适的方向,比亚迪用的铁电池其实是铁锂电池。
2012年3-5月份全国名校高三模拟化学试题高频考点分类汇编:高考频点十五__化学反应原理综合题
高考频点十五 化学反应原理综合题题目一 反应热、化学反应速率及化学平衡综合题1.(邯郸市2012年高三第一次模)在一定温度下,向一容积为2L 升的恒容密闭容器内加入0.2 mol 的N 2和0.6 mol 的H 2,发生如下反应:N 2(g)+ 3H 2(g) 2NH 3(g) △H <0。
反应中NH 3的物质的量浓度的变化的情况如下图所示:(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH 3)= 。
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH 3的物质的量浓度不可能为 (选填字母编号)。
a .0.20 mol·L -1b .0.16 mol·L -1c .0.10 mol·L -1d .0.05 mol·L -1(3)该反应的化学平衡常数表达式为___________________。
反应达到平衡后,第5分钟时,若保持其它条件不变,只把容器的体积缩小一半,平衡 移动(选填“正向”、“逆向”或“不”),化学平衡常数K (选填“增大”、“减小”或“不变”)。
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH 3的浓度约为0.25 mol·L -1),请在上图中画出从第5分钟开始变化直至到达新平衡时NH 3浓度的变化曲线。
(5) 常温下,向0.001 mol·L -1的AlCl 3 溶液中通入NH 3直至过量,现象 ,当PH= 时,开始生成沉淀(已知:Ksp[Al (OH )3]= 1.0×10-33)。
【答案】(1)0.025 mol·L -1·min -1(2分)(2)a 、c (2分,全对给2分,漏选正确给1分,错选、多选不给分)(3))()]([)]([23223N c H c NH c K (2分); 正向 (1分);不变(1分) (4)(2分,画图起点终点正确即给分,不必延长)(5)白色沉淀(2分,溶液出现浑浊也给分),4(2分)【解析】本题考查化学平衡、平衡常数和溶解度积常数的计算。
2012年高考终极仿真模拟试题化学(全国卷).pdf
【教学准备】 1.学情分析 中学阶段的青少年对劳动的价值和劳动者的作用还没有全面的认识,对于劳动付出与收获的关系还认识不足,通过前面的的学习,学生对劳动的重要作用已有初步的认识,本节课需要重点引导学生学会劳动,并从现在起多实践。
2.物质资料准备 教师准备多媒体课件。
【课时安排】1课时 【板书设计】 【教学活动设计】 教学环节教学活动设计设计意图导入1.教师展示生产工具的演变。
2.学生欣赏并交流。
通过不同时期生产工具的巨大变化,反映劳动力的历史变迁,从而让学生认识到新型劳动这师时代的要求,师社会发展的必然趋势认识时代变化对劳动者素质要求的变化 了解社会发展对劳动者的要求不断提高,懂得有些人不适应社会的发展而被淘汰的原因。
了解新型劳动者的素质 人才结构图 展示劳动力人才结构图,学生交流 1.这两幅图说明了什么? 2.根据这两幅图推测未来几年我国劳动力市场的人才需求情况。
通过域西方发达国家对比,使学生感受我国对科技人才的迫切需要,激发学习热情,立志努力学习,喂将来成为一名新型的劳动者做好知识储备。
认识新新劳动者代表1.播放视频《包起帆》 2.学生交流:他们身上具备那些素质? 以社会上的榜样给学生以启发,树立新型的劳动观。
创新实践第24届河北省青少年科技创新大赛在唐山举行通过实践活动,让学生发现自己的创新能力,培养学生的创新精神。
学生谈自己的收获与启示总结我们是未来社会的劳动者,而社会的发展对我们的要求也越来越高。
成为合格的劳动者,成为优秀的、杰出的劳动者是社会对我们的要求。
我们也必须努力学习,积极参加社会实践,不断进步,成为社会需要的有用的劳动者。
提高认识,巩固学习效果 初中学习网,资料共分享!我们负责传递知识! 含义 具备的素质 做新型的劳动者 新型的劳动者。
2012年高考化学 高考试题+模拟新题分类汇编专题2 化学物质及其变化
B单元化学物质及其变化B1 离子反应与离子方程式11.B1 H3[2012·重庆卷] 向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL。
下列叙述正确的是( )A.x=10时,溶液中有NH+4、Al3+、SO2-4,且c(NH+4)>c(Al3+)B.x=10时,溶液中有NH+4、AlO-2、SO2-4,且c(NH+4)>c(SO2-4)C.x=30时,溶液中有Ba2+、AlO-2、OH-,且c(OH-)<c(AlO-2)D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)11.A [解析] 本题考查离子反应及相关计算。
NH4Al(SO4)2与Ba(OH)2的反应包括:①NH+4+OH-===NH3·H2O;②Al3++3OH-===Al(OH)3↓;③Al(OH)3+OH-===AlO-2+2H2O且反应顺序为②①③;④Ba2++SO2-4===BaSO4↓。
当x=10时,即NH4Al(SO4)2与Ba(OH)2等物质的量混合,令各为1 mol,n(NH+4)=n(Al3+)=n(Ba2+)=1 mol,n(SO2-n(OH-)=2 mol。
4)=对A选项,由反应②得知Al3+过量,无反应①③的存在,无AlO-2生成,则有c(NH+4)>c(Al3+),由④可知剩余的n(SO2-4)=1 mol,溶液中有NH+4、Al3+、SO2-4,故A正确;对B选项,无AlO-2,本题易误认为n(NH+4)=n(SO2-4),因NH+4发生水解,应c(NH+4)<c(SO2-4)。
当x=30时,即令NH4Al(SO4)2为1 mol,Ba(OH)2为3 mol,n(NH+4)=n(Al3+)=1 mol,n(OH-)=6 mol,Al3+→AlO-2,NH+4→NH3·H2O,剩余n(OH-)=1 mol,剩余n(Ba2+)=1 mol,对于C选项,溶液中有Ba2+、AlO-2、OH-,n(OH-)>n(AlO-2) (AlO-2水解略小于1 mol),故C错误;对于D选项,溶液中无Al3+,故D错误。
2012高考化学 真题+模拟新题分类汇编N 物质结构与性质
N单元物质结构与性质N1 原子结构与元素的性质11.N1 E2 H2 D5[2011·安徽卷] 中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO11.N1 E2 H2 D5【解析】 D Mg元素具有全充满的3s2状态,Al元素的3s23p1不是全充满、半充满或全空的状态,因此,Mg的第一电离能比Al大,故A错误;在卤族元素中F元素是非金属性最强的元素,只能显负价,不能显正价,故B错误;溶液中水的电离程度受温度的影响,C项中没有说明溶液的温度,因此,无法判断溶液的酸碱性,故C错误;由于H2CO3的酸性比HClO 的强,故将CO2通入NaClO溶液能生成HClO,符合较强酸制取较弱酸的规律,D正确。
25.F1N1[2011·北京卷] 在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:化学方程式K(t1)K(t2)F2+H2 1.8×1036 1.9×1032Cl2+H29.7×1012 4.2×1011Br2+H2 5.6×1079.3×106I2+H243 34(1)已知t2>t1,HX的生成反应是__________反应(填“吸热”或“放热”)。
(2)HX的电子式是__________。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是__________。
(4)X2都能与H2反应生成HX,用原子结构解释原因:________________________________________________________________________ ________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 8 页 2012年高考理科化学模拟试题 一、单项选择题(本题包括6小题,每小题4分,共24分) 7.设阿伏加德罗常数为NA,下列说法正确的是( ) A.5.6g Fe与足量盐酸反应,反应中转移的电子数为0.3NA
B.标准状况下,11.2L己烷含有的碳原子数为3NA
C.常温下,28g的N2和CO混合气体含有的原子数为2NA
D.常温下,1L 0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA
8.化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是( )
A.检验C2H5Cl中Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化 B.鉴别溶液中是否含有Br- 时,所加的AgNO3 溶液用硝酸酸化 C.鉴定待测溶液中是否含有Fe2+ 时,用硝酸酸化 D.为提高KMnO4 溶液的氧化能力,用盐酸将KMn04 溶液酸化 9.下列离子方程式正确的是( ) A.氢氧化钡溶液中滴加少量稀硫酸:Ba2++OH-+ H++SO42- = BaSO4↓+H2O B.NH4HCO3溶液与少量NaOH溶液反应:NH4++OH- = NH3↑+H2O C.向碳酸氢钠溶液中滴入过量澄清石灰水: Ca2+ + 2OH— + 2HCO3— = CaCO3↓+ CO3
2—
+ 2H2O D.次氯酸钙溶液中通入过量二氧化碳:ClO— +H2O+CO2 = HCO3—+HClO 10.用右图表示的一些物质或概念间的从属关系中不正确的是( ) X Y Z A 苯的同系物 芳香烃 芳香族化合物
B 胶 体 分散系 混合物
C 电解质 离子化合物 化合物
D 碱性氧化物 金属氧化物 氧化物
11.已知t℃时一种饱和溶液的以下条件:①溶液质量 ②溶剂质量 ③溶液体积 ④溶质的摩尔质量 ⑤该温度下溶质的溶解度 ⑥溶液密度. 在以上条件的组合中,不能用来计算这种饱和溶液物质的量浓度的是( ) A. ②③④⑥ B. ④⑤⑥ C. ①②④⑥ D. ②③⑤
X Y Z 第 2 页 共 8 页
12.下列各组物质中,不是..按(“→”表示一步完成)关系相互转化的是( ) 选项 A B C D a Fe CH2=CH2 HNO3 Al(OH)3
b FeCl3 CH3CH2Br NO NaAlO2
c FeCl2 CH3CH2OH NO2 Al2O3
二、双项选择题(本题包括2小题,每小题6分,共12分) 22. 按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( ) A. C1上发生还原反应 B. M 装置中SO42-移向Cu电极 C. 工作一段时间后装置M 中溶液PH变大, 装置N中溶液PH变小 D. Cu电极与C2电极上的电极反应相同 23. 现有常温下的四份溶液:①0.01 mol/L CH3COOH;②0.01 mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是 A.①中水的电离程度最小,③中水的电离程度最大 B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③ C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 D.将四份溶液稀释相同倍数后,溶液的pH:③>④,①>② 三、非选择题(本题包括4小题,共64分) 30. (15分) 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
溶解 吸收塔 NaClO3 配料 ClO2发生器 H2O 稀H2SO4 160g/L NaOH SO2和空 气混合气 H2O2 过滤
滤液 NaClO2•3H2O 3 第 3 页 共 8 页
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。 ②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。 ③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。 ⑴ 160 g/L NaOH溶液的物质的量浓度为 。 ⑵ 发生器中鼓入空气的作用可能是 (选填序号)。 a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2 ⑶ 吸收塔内的反应的化学方程式为 。 吸收塔的温度不能超过20℃,其目的是 。 ⑷ 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。 ⑸ 吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。 a.Na2O2 b.Na2S c.FeCl2 ⑹ 从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。 a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶 要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)
31.(18分)某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实
验。 (1)用下图A所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当 时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 。 (2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。 ① 收集并测量气体体积应选上图M,N中的 装置 ② 称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒(选填字母序号) A.100ml B.200ml C.500ml D.1000ml (3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。 第 4 页 共 8 页
现象 结论与解释 可能① 可能② 32.(16分) 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2, 化学方程式如下:
2NO+2CO催化剂2CO2+N2 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表: 时间(s) 0 1 2 3 4 5 c(NO) (mol/L) 1.0×10- 3 4.50×10- 4 2.50×10- 4 1.50×10- 4 1.0×10- 4 1.0×10- 4
c(CO) (mol/L) 3.6×10- 3 3.05×10- 3 2.85×10- 3 2.75×10- 3 2.7×10- 3 2.7×10- 3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响): (1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。 (2)前2s内的平均反应速率υ(N2)= 。 (3)在该温度下,反应的平衡常数K= 。 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。 A.选用更有效的催化剂 B.升高反应体系的温度 C.降低反应体系的温度 D.缩小容器的体积 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。 第 5 页 共 8 页
实验 编号 T(℃) NO初始浓度 (mol/L) CO初始浓度 (mol/L) 催化剂的比表面积(m2/g) Ⅰ 280 1.20×10-3 5.80×10-3 82 Ⅱ 124 Ⅲ 350 124 ①请在上表空格中填入剩余的实验条件数据。(3分) ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。(4分)
c(NO)
t 33.(15分)A~J均为有机化合物,它们之间的转化如下图所示:
实验表明: ① D既能发生银镜反应,又能与金属钠反应放出氢气: ② 核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1; ③ G能使溴的四氯化碳溶液褪色; 第 6 页 共 8 页
④ 1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。 请根据以上信息回答下列问题: (1) A的结构简式为____________,由A生成B的反应类型是__________反应;(4分) (2) D的结构简式为_____________;(2分) (3) 由E生成F的化学方程式为________________________________________ ,E中的官能团有_____________(填名称),与E具有相同官能团的E的同分异构体还有________________(任写两个,不考虑立体结构);(6分) (4) G的结构简式为________________;(1分) (5) 由I生成J的化学方程式________________________________________。(2分)
