第4章 活性区的均匀腐蚀
腐蚀学原理--第四章 析氢腐蚀与吸氧腐蚀资料

4.1.3 析氢腐蚀的控制过程
1 阴极控制
锌在酸中的溶解就是阴极控制下的 析氢腐蚀,腐蚀速度主要取决于析 氢过电位的大小。
由于Zn的溶解反应有低的活化极 化,而氢在Zn上的析出过电位却 非常高,因此Zn的析氢腐蚀为阴 极控制。这种情况下,若Zn中含 有较低氢过电位的金属杂质,如 Cu、Fe等,阴极极化减小,使腐 蚀速度增大。相反,如果Zn中加 入汞,由于汞上的析氢过电位很高, 可使Zn的腐蚀速度大大下降。
3.混合控制
铁和钢在酸性溶液中的析氢腐蚀中存在着阴、 阳极混合控制,因为阴、阳极极化大约相同。 在给定电流密度下,碳钢的阳极和阴极极化都 比纯Fe的低,这意味着碳钢的析氢腐蚀速度比 纯 Fe大。钢中含有杂质 S时,可使析氢腐蚀速 度增大。因为一方面可形成 Fe—FeS局部微电 池,加速腐蚀;另一方面,钢中的硫可溶于酸 中,形成 S2- 离子。由于 S2- 极易极化而吸附在 铁表面,强烈催化电化学过程,使阴、阳极极 化度都降低,从而加速腐蚀。 若含 S 的钢中加入 Cu 或 Mn ,其作用有二,一 是其本身是阴极,可加速Fe的溶解;另一方面 却可抵消 S 的有害作用。因为溶解的 Cu+ 又沉 积在 Fe 表面,与吸附的 S2- 离子形成 Cu2S ,在 酸中不溶(溶度积为10-48)。因此可消除S2-对电 化学反应的催化作用。加入Mn也可抵消S的有 害作用,因为一方面可形成低电导的MnS;另 一方面减少了铁中的 S 含量,而且 MnS 比 FeS 更易溶于酸中。
如果溶液中含有铂离子,它们 将在腐蚀金属Fe上析出,形成 附加阴极。氢在Pt上的析出过 电位比在Fe上小得多,从而加 速Fe在酸中的腐蚀(图4-3)。
如果溶液中含有某种表 面活性剂,会在金属表 面吸附并阻碍氢的析出 ,大大提高析氢过电位 。这种表面活性剂就可 作为缓蚀剂,防止金属 的腐蚀。 溶液的pH值对析氢过电 位的影响是在酸性溶液 中,氢过电位随 pH 值增 加而增大;而在碱性溶 液中,氢过电位随 pH 值 增加而减小。
材料腐蚀与防护 第四章

区域I I I : 金属表面水膜层厚度继续增加 到几十微米厚时.进人到湿大气腐蚀区。 由于氧通过水膜扩散到金属表面困难,所 以腐蚀速度有所下降。
氧化性酸的特点是阴极过程主要是氧化剂的还原过程引起金属腐蚀。 但是当氧化性酸浓度超过某一临界值时,促使钝化型金属进入钝态,而 抑制了腐蚀。
1.金属在无机酸溶液中的腐蚀 (1)硫酸
当质量分数超过50%时.随浓度增加,腐蚀急剧下 降.当质量分数超过70%时.碳钢几乎不腐蚀。这是由于钢 表面生成硫酸盐(FeSO 4)保护膜
大了表面液膜层的电导,氯离子本身有很强的侵蚀性,因
而使腐蚀变得更严重。
3
4
尘埃的腐蚀性
4.2 金属在海水中的腐蚀
海洋约占地球表面积的70%.海水是自然界中数量最大 且具有腐蚀性的天然电解质 一:海水腐蚀特点 1 盐类及导电率
海水作为腐蚀性介质,其特点是含多种盐类,盐分中 主要是NaCl。
海水平均电导率为4x10-2 S/cm,远远超过河水和雨水的 电导率。
SO2的腐蚀作用
多数研究认为,SO2的腐蚀作用机制是硫酸盐穴 自催化过 程
外层FeOOH,内层Fe(OH)2和基体表面FeSO4·nH2O的 构成; FeSO4的可溶性,使锈层保护能力下降
五:影响大气腐蚀的因素及防蚀方法 影响大气腐蚀的因素很多,如湿度、大气成分等。
1 湿度
湿度是决定大气腐蚀类型和速度的一个重要因素。
区域IV:当金属表面水膜层变得更厚, 大于1毫米时已相当于全浸在电解液中的 腐蚀情况。腐蚀速度巳基本不变。
[物理]第四章析氢腐蚀与吸氧腐蚀
![[物理]第四章析氢腐蚀与吸氧腐蚀](https://img.taocdn.com/s3/m/77bcf7d2ba4cf7ec4afe04a1b0717fd5360cb2f7.png)
★和析氢腐蚀一样,对吸氧腐蚀影响因素的讨论 也只局限在电极反应,而没有涉及腐蚀过程的 产物。如金属氧化物、氢氧化物或更复杂化合 物(如铁锈)。它们在金属表面形成膜,必然对 腐蚀过程造成重大影响。
4、影响吸氧腐蚀的因素
★氧极限扩散电流密度id为:
3、吸氧腐蚀的控制过程及特点
1)如果腐蚀金属在溶液中的电位较正,腐蚀过程 中氧的传递速度又很大,则金属腐蚀速度主要由 氧在电极上的放电速度(吸氧阴极反应速度)决 定,属于活化极化控制。
2)如果腐蚀金属在溶液中的电位非常负,如Zn、 Mn等,阴极过程将由氧去极化(吸氧反应)和 氢离子去极化(析氢反应)两个反应共同组成。
几种钢的氧扩散控制腐蚀速度
钢
的
腐
热处理的影响
蚀
0.39
冷拉,500oC退火
0.39
900oC正火20分
0.39
850oC淬火
各试样在300oC~800oC回火
2Had H2
3)H2分子聚集形成气泡离开电极表面。
由于反应途径和控制步骤不同,其反应动力 学机制就会不同。
如果某一步骤进行得较缓慢,就会使整个氢 去极化反应受到阻滞,由阳极来的电子就会在阴 极积累,使阴极电位向负方向移动,产生一定的 析氢过电位H。
研究表明,第一步是整个电极反应最慢的步 骤。
4、析氢腐蚀的阴极H+ 还原反应的动力学特征
5、析氢腐蚀的影响因素
★溶液方面
1)pH值 溶液pH值对析氢腐蚀速度影响很大,随pH值下降,
腐蚀速度迅速增大。 pH值下降造成两方面的影响。一 方面pH值下降使析氢反应平衡电位Eec正移,腐蚀倾向 增大;另一方面pH值下降又使阴极极化过电位减小, 同样使腐蚀速率增大。
材料腐蚀复习
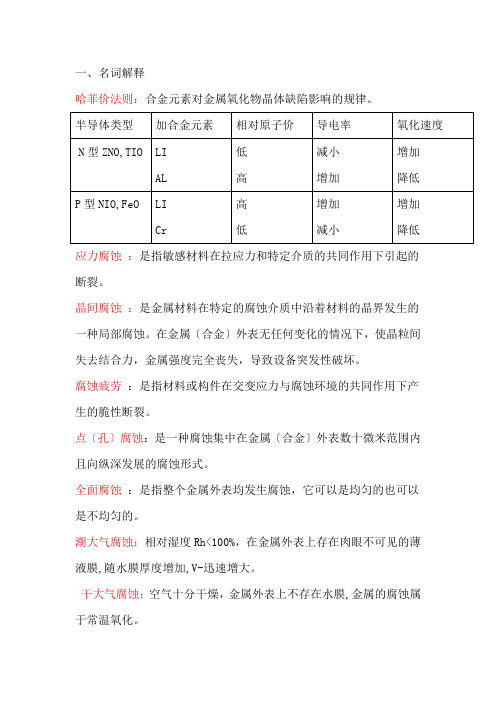
一、名词解释哈菲价法则:合金元素对金属氧化物晶体缺陷影响的规律。
应力腐蚀:是指敏感材料在拉应力和特定介质的共同作用下引起的断裂。
晶间腐蚀:是金属材料在特定的腐蚀介质中沿着材料的晶界发生的一种局部腐蚀。
在金属〔合金〕外表无任何变化的情况下,使晶粒间失去结合力,金属强度完全丧失,导致设备突发性破坏。
腐蚀疲劳:是指材料或构件在交变应力与腐蚀环境的共同作用下产生的脆性断裂。
点〔孔〕腐蚀:是一种腐蚀集中在金属〔合金〕外表数十微米范围内且向纵深发展的腐蚀形式。
全面腐蚀:是指整个金属外表均发生腐蚀,它可以是均匀的也可以是不均匀的。
潮大气腐蚀:相对湿度Rh<100%,在金属外表上存在肉眼不可见的薄液膜,随水膜厚度增加,V-迅速增大。
干大气腐蚀:空气十分干燥,金属外表上不存在水膜,金属的腐蚀属于常温氧化。
湿大气腐蚀:相对湿度Rh≈100%,金属外表上形成肉眼可见的水膜,随水膜厚度增加, V-逐渐减小。
杂散电流腐蚀:是指直流电源设备漏电进入土壤产生的电流,对地下管道、贮罐、电缆等金属设施,造成严重的破坏的腐蚀。
牺牲阳极法阴极保护:在被保护的金属上连接电位更负的金属或合金作为阳极,依靠它不断溶解所产生的阴极电流对金属进行阴极极化。
选择性氧化:如果合金中B组元的浓度低于临界浓度,则最初在合金外表只形成AO,B组元从氧化膜/金属界面向合金内部扩散。
但由于B组元与氧亲和力大,随着氧化的进行,当界面处B的浓度到达形成BO的临界浓度时,将发生B+AO---A+BO的反应,氧化产物将转变为BO。
这种情形称为合金的选择性氧化。
选择腐蚀:是指多元合金中较活泼组分或负电性金属的优先溶解。
电化学保护 :通过施加外电动势将被保护的金属的电位移向免蚀区或钝化区,以减小或防止金属腐蚀的方法。
活化极化〔电化学极化〕:如果金属离子进人到溶液里的速度小于电子从阳极迁移到阴极的速度,则阳极上就会有过多的带正电荷金属离子的积累,由此引起电极双电层的负电荷减少,于是阳极电位就向正方向移动,产生阳极极化。
析氢腐蚀和吸氧腐蚀

(3) 腐蚀电位位于阴极极化曲线的析氢反应 平衡电位以下,在自然腐蚀状态,阴极反 应包括O2还原反应和H+还原反应。如Mg在 中性溶液中的腐蚀。
• 氧扩散控制吸氧腐蚀的特征
在自然腐蚀状态,阴极反应速度,因而 金属腐蚀电流密度等于O2的极限扩散电 流密度id
icor ic Ecor id
特征:
(2) 阳极极化控制
当ia0 << ic0,才会出现阳极极化控制。因为除Pt、 Pd等低氢过电位金属外,在常见的工程金属材料 表面上析氢反应的交换电流密度都不很大,故这 种类型的析氢腐蚀不可能发生在活化极化控制的 腐蚀体系,只有当金属在酸溶液中能部分钝化, 造成阳极反应阻力大大增加,才能形成这种控制 类型。比如铝和不锈钢在稀硫酸中发生析氢腐蚀 就是这种情况。显然,这种类型的析氢腐蚀的阳 极反应不再受活化极化控制。
• 析氢腐蚀的典型例子—Fe在酸中的腐蚀
(1)在pH < 3的酸溶液中,阴极反应受活化极化 控制。
(2)在弱氧化性和非氧化性酸溶液中,在反应速 度不是很大时,阳极反应亦受活化极化控制。
(3)在大多数情况下,Fe在酸溶液中的腐蚀形态 是均匀腐蚀。
所以,Fe在酸溶液中的腐蚀可以当作均相腐蚀电 极处理,作为活化极化控制腐蚀体系的典型例子。
温度:摄氏度 铁在盐酸巾的腐蚀速度与温度的关系
腐蚀影响因素
(2)溶液中的其他组分
(3)温度 温度升高,腐蚀速度迅速增大,因为温度升高时 阳极反应和阴极反应速度都加快了。 金属 方面 (1)金属材料种类和杂质 金属材料种类和所含杂质的影响既涉及阴极反应 又涉及阳极反应这一影响,混合控制腐蚀体系比 阴极极化控制腐蚀体系明显。 (2) 阴极区面积 (3) 金属表面的状态
腐蚀分类

局部腐蚀 ( 点蚀 ) Localized corrosion
( Pitting corrosion )
全面腐蚀 General corrosion
不均匀的全面腐蚀
均匀的全面腐蚀
比较项目
全面腐蚀
局部腐蚀
腐蚀形态 微
腐蚀遍部整个金属材料表面 腐蚀集中在特定的区域,其余部分腐蚀甚
电池 阴、阳极在表面上变幻不定,不可辨别
第四章 局部腐蚀
腐蚀形态分为两大类,即全面腐蚀和局部腐蚀 。
如果腐蚀是在整个金属表面上进行,则称为全面腐蚀。
如果腐蚀只集中在金属表面局部地区上进行,其余大部 分地区则几乎不腐蚀,这种类型的腐蚀便称为局部腐蚀。
全面腐蚀和局部腐蚀具有不同的特征:全面腐 蚀的阴阳极面积非常小,甚至用微观方法也无法辨认出来 ,而且微阳极与微阴极的位置是变幻不定的。因为整个金 属表面在溶液中都处于活化状态,只是各点随时间(或地 点)有能量起伏,能量高时(处)为阳极,能量低时 (处)为阴极,这样使金属表面都遭受腐蚀,金属腐蚀造 成金属的大量损失,但从技术观点来看,这类腐蚀并不可 怕,不会造成突然事故。
阳极: M→M++e ,
阴极: O2+2H2O+4e→4OH-
在经过一个短时间后缝内的氧消失耗完,氧的还原反应不 再进行。这是由于缝内缺氧而缝外富氧,形成了氧浓差电 池,然后金属 M 继续溶解,缝内溶液中 M+ 过剩,为了保持 平衡,氯离子迁移到缝内,缝内已形成金属的盐类发生水 解: M+Cl-+H2O→MOH+HCl 结果使缝内 PH 值下降,可达 23 。这就促使缝内金属溶解速度增加,相应缝外临近表面 的阴极过程,即氧的还原速度也增加,使外部表面得到阴 极保护,而加剧了缝内金属的腐蚀,缝内金属离子进一步 过剩又促使氯离子迁入缝内,形成金属盐类、水解,缝内 酸度增加,更加促使金属溶解,这就是缝隙腐蚀的自催化 过程。
第三章1全面腐蚀与局部腐蚀
(3)环境温度温度和介质流动性的影响
❖ 温度升高时,氯等侵蚀性离子在不锈钢等金属表面的积聚 和化学吸附增加,导致钝态破坏的活性点增多,点蚀电位 降低,点蚀密度增加。温度过高(如对Crl8Ni9钢,温度高 于200℃)时,点蚀电位又升高,这可能是由于温度升高, 参与反应的物质的运动速率加快,使蚀孔内反应物的积累 减少及氧溶解度下降的缘故。 一般来讲,溶液的流动对抑制点蚀具有一定的有益作用。 通常认为介质的流速对点蚀的减缓起双重作用,一方面流 速增大有利于溶解氧向金属表面输送,使钝化膜易于形成: 另一方面可减少沉积物在金属表面沉积的机会,抑制局部 点蚀的发生。流速通常对点蚀电位影响不大,但是对点蚀 密度和深度有明显的影响,而流速过高则可能会引起冲击 腐蚀。
1、点蚀的萌生
❖ 点蚀的发生首先是在金属表面的某些敏感位置(点蚀源处) 形成点蚀核,即萌生点蚀孔。生成第一个或最初几个蚀点 所需要的时间称为点蚀萌生的诱导期(或孕育期),用表示。
点蚀过程是由内因(金属材料的成分和组织结构、表面状态 等因素)和外因(环境介质的成分和温度等因素)共同影响的, 点蚀核的萌生实质上就是钝化膜的局部破坏过程,破坏的 原因有化学的或机械的作用,化学作用的模型目前尚无统 一的认识.较为典型的有穿透模型、吸附模型和钝化成相 膜局部破裂模型等。下面仅以纯金属为对象作简要描述.
第三章1全面腐蚀与局部腐蚀
Contents
1
全面腐蚀
2
局部腐蚀
3
点腐蚀
3.1全面腐蚀与局部腐蚀的比较
❖ 按腐蚀破坏形态的区别可以将金属材料的腐蚀分为全面 腐蚀和局部腐蚀两大类。
❖ 全面腐蚀(General corrosion)是指腐蚀发生在整个金属材 料的表面,其结果是导致金属材料全面减薄。
腐蚀学第四章 常见的两类去极化腐蚀课件
(4)溶液
• 溶液中存在正电性离子如Pt离子 • 溶液中含有表面活性物质 吸附在金属表面,阻碍析氢,ηH 增大。作缓蚀剂 • 溶液pH值对ηH的影响 酸性介质pH ↓ →ηH↑,碱性 pH↑→ηH↓ • 溶液温度 T↑→ηH↓
添加铂盐对酸中 铁腐蚀的影响
4.析氢腐蚀的控制过程
• 阴极控制: 腐蚀速度主要取决于析氢过电位的大小。 例如:锌在酸中的溶解就是阴极控制下的析氢腐蚀。
0
E0=1.229V(SHE) pO2=0.021MPa,氧还原反应的平衡电位与pH的关系为:
EO2 1.229 0.0591pH
中性溶液中,金属的电位 低于0.805V即可发生吸 氧腐蚀
电极 Na/Na+ Mg/Mg2+ Be/Be2+ Al/Al3+ Ti/Ti2+ Zr/Zr2+ Mn/Mn2+ Zn/Zn2+ Cr/Cr3+ Fe/Fe2+ Cd/Cd2+ In/In3+ Co/Co2+
在给定的电流密度下,碳钢的
阳极极化和阴极极化都比纯铁 的低 钢中含S时:Fe-FeS微电池;S2催化——析氢速度增大 含S钢中加入Cu:铜作为阴极, 加速了铁的腐蚀;可形成Cu2S 沉淀
铁和碳钢的析氢腐蚀(混合控制)
• 腐蚀速度与腐蚀电位间 的变化没有简单的相关 性 • 腐蚀速度增加
5.氢去极化腐蚀的特征
0
E 0 =0.401V(SHE)
空气中pO2=0.021MPa,当pH=7时
பைடு நூலகம்
0.0591 0.21 EO2 0.401 lg 7 4 0.805V(SHE) 4 [10 ]
(2)在酸性溶液中氧的还原反应为 电极反应 O2+4H++ 4e-2H2O 平衡电位为
电化学腐蚀的阴极过程-文档资料
1
第4章 电化学腐蚀的阴极过程
• 金属发生电化学腐蚀的根本原因: • 溶液中含有能使该金属氧化的物质,H+或O2等
即腐蚀过程的去极化剂,它和金属构成了不稳定的腐蚀原电池 体系。
没有阴极过程,阳极过程就不会发生,金属就不会腐蚀。
2
本章运用腐蚀热力学和腐蚀动力学的理论和概念,讨论常 见的电化学腐蚀阴极过程的发生条件、进行的规律及其影 响因素。
影响析氢腐蚀的主要因素有: (1)金属材料的性质EMn+/M ; (2)溶液的pH值; (3)析氢过电位ηH2
8
4.2.2 金属材料的性质 • 发生析氢腐蚀的体系 (1) 标准电位很负的活泼金属;Mg (2) 大多数工程上使用的金属,如Fe; (3) 正电性金属Cu等一般不会发生析氢腐蚀。
9
• 析氢腐蚀的典型例子—Fe在酸中的腐蚀(1 )
ηH2 = f (金属电极材料的种类)
(1).高氢过电位金属:Hg,Pb,Zn,Cd;(H2不易析出) (2).中氢过电位金属:Cu,Fe,Ni; (3).低氢过电位金属:Pt,Pd (H2极易析出)
13
• 不同金属的析氢过电位H2
不同金属的腐蚀极化图
14
纯锌及含杂质锌在酸中的腐蚀极化图
15
4.2.4 析氢腐蚀的控制
19
4.3. 吸氧腐蚀
• 溶液中的氧发生的还原反应 • O2 + 2H2O +4e → 4OH- (中性或碱性) • O2 + 4H+ + 4e → 2H2O (酸性)
定义:氧的离子化过程: 氧分子在阴极上的还原反应也称为氧的离子化过程。
20
4.3.1. 吸氧腐蚀的必要条件
化学反应工程第四章习题答案
化学反应工程第四章习题答案work Information Technology Company.2020YEAR第四章 非理想流动1.停留时间分布的密度函数在t <0时,E (t )=_______。
(0) 2.停留时间分布的密度函数在t ≥0时,E (t )_______。
(>0) 3.当t=0时,停留时间分布函数F (t )=_______。
(0) 4.当t=∞时,停留时间分布函数F (t )=_______。
(1) 5.停留时间分布的密度函数E (θ)=_______E (t )。
(t )6.表示停留时间分布的分散程度的量=2θσ_______2tσ。
(21t )7.反应器物料的停留时间的分布曲线是通过物理示踪法来测定的,根据示踪剂的输入方式不同分为_______、_______、_______、_______。
(脉冲法、阶跃法、周期示踪法、随机输入示踪法) 8.平推流管式反应器t t =时,E (t )=_______。
(∞) 9.平推流管式反应器t t ≠时,E (t )=_______。
(0) 10.平推流管式反应器t t ≥时,F (t )=_______。
(1) 11.平推流管式反应器t <t 时,F (t )=_______。
(0)12.平推流管式反应器其E (θ)曲线的方差=2θσ_______。
(0) 13.平推流管式反应器其E (t )曲线的方差=2t σ_______。
(0) 14.全混流反应器t=0时E (t )=_______。
(tte t -1)15.全混流反应器其E (θ)曲线的方差=2θσ_______。
(1) 16.全混流反应器其E (t )曲线的方差=2t σ_______。
(2t ) 17.偏离全混流、平推流这两种理想流动的非理想流动,E (θ)曲线的方差2θσ为_______。
(0~1)18.当流体在半径为R 的管内作层流流动时,在径向存在流速分布,轴心处的流速以0u 记,则距轴心处距离为r 的流速=r u _______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
已知:对铁上的析氢反应来说,vc=1, c =0.5,则 va+0.5=a 假设:H+或OH−不参加阳极反应,即va=0,则a=0.5, ba118mV >> 实测值(40mV)。 因此,假设不成立,即H+或OH−参加阳极反应。设va=1, 则a=1.5, ba39.4mV实测值。
2016/6/24
第4章 活性区的均匀腐蚀
4.1 腐蚀电流密度 4.2 铁的酸腐蚀 4.3 析氢反应 4.4 铁的阳极溶解反应
4.1 腐蚀电流密度
假设: ⑴ 电极上同时、均匀地进行着两个反应
i 阳极反应[1]:M M n n1e
1a 1
阴极反应[2]:O n2e R
i2 c
FE
RT
k ,i
E 0.118lg(ic / 2 Fk1) 0.118vc pH
25℃下,Ee= 0.059pH 在酸性溶液中(pH<7),vc=1,则
c Ee E 0.118 lg(
ic ) 0.059pH c 59mV 2 Fk1 pH i
0 0 va ia na Fka aH exp(
Eea
a
) (4.2.2)
将(4.2.1)和(4.2.2)代入(4.1.4)得
c a c c E a Eec ln c ea a c n Fk 0 a exp( Eea ) a c a a H a
式(4.2.3)和(4.2.4)只有在阴、阳极反应速度都符合 Tafel公式的条件下才成立。否则,Ecorr ~ pH关系将不会 如此简单。 但是 , 对于金属在酸溶液中的活性均匀腐蚀 但是, 对于金属在酸溶液中的活性均匀腐蚀, , Ecorr随 pH 值降低而正移的趋势是肯定的。 值降低而正移的趋势是肯定的 。 而 在 中 性 溶 液 中 , pH 值 ↓ → 铁 表 面 钝 化 膜 减 薄 或 破 坏 →Ecorr↓。 因此, 因此 ,对于 对于“ “pH差异 差异” ”腐蚀电池 腐蚀电池, , 在酸溶液中, 在酸溶液中 ,pH值较高的部位为阳极; 在中性溶液中, 在中性溶液中 ,pH值较低的部位为阳极 值较低的部位为阳极。 。
4.2 铁的酸腐蚀
1.特点
⑴ 阳极反应 - 铁的溶解反应 [1],活化极化控制 ⑵ 阴极反应 - H+的还原反应 [2],活化极化控制 ① 通常,除了溶解氧,无其他氧化剂。 ② 溶解氧的影响 一般,静止酸溶液中,可忽略。 存在缓蚀剂,特别是剧烈搅拌下,不可忽略 ③ 浓度极化的影响。pH<3时,可忽略(DH+特别大; 析氢搅拌;电迁移;金属阳极溶解产生H+) 结论:铁的酸腐蚀是活化极化控制的均匀腐蚀。
a
a
c
阴极反应的极化方程 E Ee2 0 i2c i2 i2 exp( ) (4.1.2)
式(4.1.3)取对数,整理或消 )取对数,整理或消去 去Ecorr后整理 后整理得 得
Ecorr
c
a c i0 a c ln 2 Ee2 Ee1 (4.1.4) a c i10 a c a c
bc 2.3RT 118mV F
vc ic 2 Fk1aH (1 ) exp(
b.反应[1]很快,反应[2a]为RDS。 此时,可近似认为反应[1]处于平衡状态。
)
1 1 H e H ad k ,i 1 1
令k1=k1(1 ),由式(4.3.1)可得
1
ln I 2
Es E2
2
E1
取对数得 ln I s ln I1
Es E1
1
ln I s ln I 2
Es E2
2
Es
1
2
1
ln I 2 ln I1
1
E2
1 ln I s 1 ln I1 Es E1 2 ln I s 2 ln I 2 Es E2
ln I s 可得I1 exp(Es E1
1
) I 2 exp( Es E1
Es E2
2
) (2)
) (1)
I s I1 exp(
1 2 E E1 ln I1 ln I 2 2 (F3) 1 2 1 2 1 2
1
I s I 2 exp(
3.icorr~ pH关系
式(4.2.1&2)取对数,整理得
vc ic0 nc Fkc0 aH exp( Eec / c ) 0 0 va ia na Fka aH exp( Eea / a )
lg icorr
0 0 a ln ia a ln(na Fka ) a a ln aH Eea
FE
由于反应[2a]很快,可近似 很快,可近似处于平衡状态,则 处于平衡状态,则
K 2a
pH 2
2 aH
pH 2 (k ) 2
1 pH 2 k K 2a
当pH2一定时为常数,与电位无关(若k如此 如此)。 )。
3
2016/6/24
在酸性溶液中, 在酸性溶液中 ,vc=1,如取=0.5,c=0.5,则25℃时
a c c a pH (4.2.6) a c
a ln(na Fka0 ) c ln(nc Fkc0 ) c c a a ln aH (4.2.5) a c a c
通常avccva>0,∴ pH↓→ icorr↑,如图4-2-2所示 。
a lg(na Fka0 ) c lg(nc Fkc0 ) c c a a pH a c a c
0 a lg(na Fka ) c lg( nc Fkc0 ) a c
c ln ic0 c ln(nc Fkc0 ) c c ln aH Eec
ln icorr
a
RT
1n1F
c
RT
a c E Ee1 ln i 0 ln i 0 e2 (4.1.5) a c 1 a c 2 a c
2 n2 F
icorr和Ecorr 的影响因素及其分析方法
常用公式-1
公式(F2)&(F3)推导过程
4.3 析氢反应
1.反应历程
总 反 应:2H+ + 2e → H2 主要步骤: [1] 放电步骤: H+ + e → Had (Volmer反应) [2] 复合步骤 [2a] 化 学 复 合: 2Had → H2 (Tafel反应) [2b] 电化学复合:H+ +Had+ e → H2(Heyrovsky反应) [3] H2离开电极表面
⑵ 2个反应均为活化极化控制,且Ee2EcorrEe1 即在Ecorr附近,阳极反应和阴极反应均为强极化
则由电化学步骤的基本动力学方程得 阳极反应的极化方程
E Ee1 i1a i1 i10 exp( ) (4.1.1)
将稳态条件:E =E corr 时,i1a=i2c=icorr 。 将稳态条件: 代入上面两式,得 E Ee1 E Ecorr 0 icorr i10 exp( corr ) i2 exp( e2 ) (4.1.3)
2
相加,消除Es得
( 1 2 ) ln I s 1 ln I1 2 ln I 2 E2 E1
整理得
(
1
1
2
) Es
1 2 I E E E ln 2 1 2 1 2 s I1 1 2
除以 1 2 得
ln I s
Ecorr ( Ecorr ) pH 0
Ecorr
2.3 a c nc kc0 2.3 a c lg (v v ) pH (4.2.3) a c na ka0 a c a c
a c
va vc 2.3RT pH (4.2.4) F
2
2016/6/24
讨论: (1)Ecorr ~ pH关系
(2)利用式(4.2.4) ,通过测定Ecorr ~ pH直线的斜率,利 用已知的vc和 c可推测na和va,为研究金属阳极溶解的机 理提供重要线索。 例如,实验发现Fe/酸性SO42−溶液的Ecorr~ pH为直线关 系,且斜率为58mV。根据式(4.2.4)得 (va+vc)/(a+c)1。
则式( 则式 (4.2.3)变为:
Ecorr
a c n k 0 (v v ) ln c c a c a c ln aH a c na ka0 a c a c Eec Eea c Eea a Eec ( ) a c c a a c
一般地,由
I s I1 exp( Es E1
由
I s I1 exp(
Es E1
1
) I 2 exp(
Es E2
2
) (F1)
1
) I 2 exp(
Es E2
2
) (F1)
可得
I 1 2 Es 1 2 ln 2 E E (F2) 1 2 I1 1 2 2 1 2 1
2.反应途径和RDS
(1) 化学脱附,[1]→[2a] a. 反应[2a]很快,反应[1]为RDS。则
) (4.3.1) RT 式中, 为Had的表面覆盖度 的表面覆盖度; ; ic和i1分别为整个反 应和Volmer反应的电流密度。
