巨噬细胞表型转换及其在肾缺血再灌注损伤中作用的研究进展
丙泊酚对脊髓缺血再灌注损伤保护作用的研究进展

丙泊酚对脊髓缺血再灌注损伤保护作用的研究进展摘要:近些年胸腹主动脉瘤、溶栓疗法等得到临床推广,采取上述疗法,能尽快加大缺血组织、器官供血量,防范细胞受损,改善预后。
但相关临床观察、动物实验显示,血液循环恢复后,患者或动物细胞受损可能加重,结构被破坏,会出现功能代谢障碍。
脊髓缺血再灌注损伤(SCII)属于神经系统受损,程度严重,其主要特征为出现显著二次损伤。
多项研究证实,丙泊酚能对SCII起到保护作用,本文主要就此进行综述。
关键词:丙泊酚;脊髓缺血再灌注损伤;保护作用;神经系统受损SCII保护措施较多,例如药物干预、采取亚低温技术、进行缺氧预处理和采用高压氧等[1]。
多项研究提出,有关中药制剂、激素类药物和麻醉药物等,能保护脊髓损伤。
提供丙泊酚后,患者脊髓匀浆及血清中的相关指标变化不明显,例如Zn2+、Mg2+等,证实该药物可以防范金属离子大幅度波动[2]。
本文以SCII为对象,主要探讨SCII机制、丙泊酚对其起到的保护作用及相关研究进展。
1.SCII发生机制受诸多因素影响,导致脊髓受损,其中尤以机械性压迫损伤最为常见,受到压迫后,脊髓内血流量显著减少,脊髓水肿变严重,出现髓内出血,干扰到神经功能[3]。
低灌注是多种病变形成的病理基础,包括血脊髓屏障受损、血管自由基反应、脊髓微循环障碍等。
SCII具有复杂机制,和其他组织、器官相比,面对损伤微环境时,脊髓具有更高敏感性,该现象可能是引发SCII的基础[4]。
1.1脂质过氧化反应影响患者出现脊髓损伤后,其血流量显著减少,具有进行性特征,同时其缺氧缺血表现进一步变重,大量Ca2+内流,导致细胞内聚集众多Ca2+,产生相应生化反应,病理自由基含量增加,进而引发脂质过氧化反应。
最近研究表明,SCII和自由基损伤关系密切,是导致脂质过氧化反应的一项重要因素[5]。
对于脊髓组织膜,其内部含有大量脂质,当脊髓缺血时,会影响到神经细胞线粒体,干扰到氧化还原酶,致使其系脱耦联,释放出氧自由基,对脂质进行攻击,形成过氧化反应,干扰到膜结构,其完整性被破坏。
巨噬细胞胞葬作用及表型转化与慢性皮肤溃疡-北京中医研究所

慢性皮肤溃疡巨噬细胞表型转化与胞葬功能障碍的研究进展林燕何秀娟赵京霞薛妍蒙玉娇李萍*慢性皮肤溃疡是糖尿病、周围血管病、微生物感染、放疗等常见的并发症,是外科领域颇为棘手的难题。
虽然原发疾病是引起慢性皮肤溃疡的重要原因,但是创面局部微环境的异常也是影响创面难以修复的关键因素。
巨噬细胞被认为是创伤愈合和组织修复过程的“总指挥”,对整个愈合过程具有不可替代的调控作用[1]。
慢性皮肤溃疡以局部持续存在的炎症反应为主要特征,巨噬细胞作为炎症主要效应细胞,其功能和状态决定了炎症反应的强度和时间。
其中巨噬细胞胞葬功能及表型转化障碍在慢性皮肤溃疡炎症持续状态中的作用越来越受到重视[2]。
1 胞葬作用胞葬作用(Efferocytosis,来自拉丁语efferre)是吞噬细胞将程序性死亡的凋亡细胞移除的过程,这一过程可以理解为埋葬凋亡的细胞,因而称“胞葬”[2]。
它不仅由专职吞噬细胞:巨噬细胞和树突细胞完成,而且体内许多非专职细胞完成如上皮细胞、内皮细胞和纤维细胞也具有摄入凋亡细胞的能力。
在胞葬过程中,吞噬细胞会将凋亡细胞吞噬,并形成一个体积较大的包含有死亡细胞液泡。
这个泡被称作“胞葬体”,与吞噬体类似。
巨噬细胞胞葬作用在生物学进化过程中高度保守,识别及清除凋亡细胞主要涉及以下几个步骤:①“find-me”阶段。
早期凋亡细胞表面“do not eat me”信号(例如,CD31和CD47)消失,并且释放“eat me” 信号(例如, PS and ACAMPs) 与巨噬细胞受体P2Y2/CX3CR/G2A 等结合,诱导巨噬细胞至凋亡细胞附近,引发凋亡细胞被吞噬细胞识别[3,4]。
②“eat-me”阶段。
凋亡细胞通过“eat-me”信号分子与巨噬细胞的吞噬受体识别并结合,这些受体包括在PS受体(TIM4、stabilin-2和BAI1)、MERTK受体、SCARF1受体、CD36受体通过桥接分子(例如,TSP-1、 C1q、 Gas6、 MFG-E8和蛋白S)与整合素αVβ5结合来识别凋亡细胞。
心肌缺血再灌注损伤中细胞焦亡的研究进展

国际免疫学杂志2021年1月第44卷第1期丨m j hnmUn 〇U a n .2021,V 〇1.44,N 〇. 1• 71 ••综述•心肌缺血再灌注损伤中细胞焦亡的研究进展刘成兴林吉斌李大主华中科技大学同济医学院附属协和医院心内科,武汉43〇〇22 通信作者:李大主,E m a i l :lid a z h u h p @ s o h u . c o m ,电话:139****1110【摘要】细胞焦亡是近年来发现并被证实的一种新的细胞程序性死亡方式,它的特征是依赖半胱氨酸天冬氨酸酶丨(cysteinyl aspartate specific proteinase 1 ,caspase-l)并伴随大量炎症因子的释放。
细胞 焦亡参与了包括感染性疾病在内的多种疾病的病理生理过程作为一种新的调节性细胞死亡方式,近 年来细胞焦亡受到了广泛的关注。
新近研究发现,细胞焦亡也参与了心肌缺血再灌注损伤(myocardialiscliemia reperfusion injury,MIRI)过程,文摩:就M 丨R I 中细胞焦亡的研究进展进行综述.【关键词】细胞焦亡;心肌缺血再灌注损伤;炎性小体基金项目:国家自然科学基金(8〗670404,81700390)D O I :10. 3760/cma.j. issn. 16734394.2021.01.012Research progress of cell pyroptosis in myocardial ischemia reperfusion injuryLiu Chengxing,Lin Jibin ,Li DazhuDepartment of Cardiology .Union Hospital ,Tongji Medical College ,Haazhong University o f Science and Technology ,Wuhan 430022, ChinaCorresponding author : Li I)azhu , Email : lidazkuhp@ sohu. com , Tel : 13971091 1 10【Abstract 】 Cell pyroptosis is a newly found m o d e of regulated cell death and experimentally verified re-c-ently. I t i s characterized l )y i t s dependence on cysteinyl asparlale specific proteinase 1 (caspase-1 ) and the release of a large numb e r of inflammatory factors. Pyroptosis i s involved in the pathophysiological process of m a n y diseases including infectious diseases. As a new way of regulatory cell death, pyroptosis has attracted extensive attention in recent years. Recent studies have found that i t participates iq the pathological processes of myocardial ischemia reperfusion injury ( M I R I ) . This review summarized the research progress of cell pyroptosis in MIRI.【Key words 】Cell pyroptosis; Myocardial ischemia reperfusion injury; InflammasomeFund program : National Natural Science Foundation of China( 81670404,81700390)D O I : 10. 3760/cma. j . issn. 16734394. 2021.01.012上的模式识别受体(pattern recognition receptor ,P R R)识别并诱导相应的炎症反应过程,这些炎症细胞包括单核/巨噬细胞、中性粒细胞和树突状细胞 等夂。
Wnt 、β-Catenin通路促进替代活化型巨噬细胞的激活将加重肾纤维化

在BMM中,IL-4或TGFβ1刺激的巨噬细胞M2极化被ICG-001处理显着抑制。 我们还从小鼠分离的BMM以诱导β-catenin蛋白基因缺失, β-catenin在BMM 中的消除可以阻止IL-4或TGFβ1刺激的巨噬细胞M2极化。
为了探讨β-catenin调节巨噬细胞M2极化的机制,我们检测了两种细 胞类型中STAT3在Y705的磷酸化。
为了探讨STAT3激活在Wnt3a加重巨噬细胞M2极化中的作用,我们用STAT3抑制剂 Stattic处理BMMs。结果表明,Stattic可以很大程度上抑制STAT3磷酸化和IL-4或 TGFβ1加Wnt3a诱导的巨噬细胞M2极化,表明STAT3激活促进巨噬细胞M2极化的 关键作用。
因此,可以得出结论,Wnt3a通过上调STAT3表达和活化来加剧IL-4-或TGFβ1诱导 的巨噬细胞M2极化。
Wnt信号传导被分为经典和非经典信号通路,取决于β-catenin是否被激 活。对于经典的Wnt信号通路,β-catenin在激活后积累在细胞质中,然 后转移到细胞核中,结合细胞因子并刺激参与组织纤维形成的靶基因的 转录。
Wnt / β-catenin激活可以防止小鼠肾小管细胞死亡和AKI。然而,足细胞 或肾小管细胞中Wnt / β-catenin的异常激活可能加重蛋白尿,肾功能不 全和肾纤维化。此外,β-catenin可以调节髓系细胞的运动性和粘附性, 这有助于皮肤损伤后间充质细胞的积累。因此,有人推测在肾纤维化中, Wnt / β-catenin活化可能促进巨噬细胞迁移并促进其累积。最近据报道, β-catenin相关信号在肺部髓系细胞中的激活导致肺泡巨噬细胞亚型的分 化,其拮抗肺纤维化的消退。强制表达β-catenin变体能够促进巨噬细胞 分化。在这方面,Wnt / β-catenin信号可能调节巨噬细胞的积累和活化 并加重CKD中的肾纤维化。
丁苯酞通过下调NF-κB_信号通路抑制细胞焦亡减轻大鼠肾缺血-_再灌注损伤
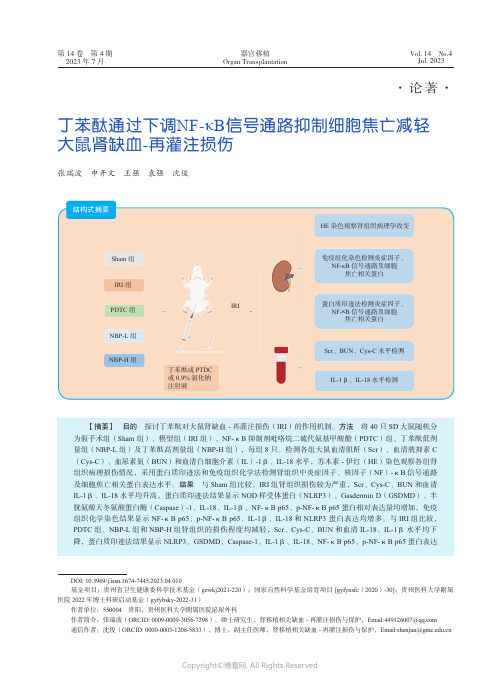
第14卷 第4期2023年7月Vol. 14 No.4Jul. 2023器官移植Organ Transplantation ·论著·丁苯酞通过下调NF-κB 信号通路抑制细胞焦亡减轻大鼠肾缺血-再灌注损伤张瑞波 申开文 王强 袁强 沈俊【摘要】 目的 探讨丁苯酞对大鼠肾缺血-再灌注损伤(IRI )的作用机制。
方法 将40只SD 大鼠随机分为假手术组(Sham 组)、模型组(IRI 组)、NF-κB 抑制剂吡咯烷二硫代氨基甲酸酯(PDTC )组、丁苯酞低剂量组(NBP-L 组)及丁苯酞高剂量组(NBP-H 组),每组8只。
检测各组大鼠血清肌酐(Scr )、血清胱抑素C (Cys-C )、血尿素氮(BUN )和血清白细胞介素(IL )-1β、IL-18水平,苏木素-伊红(HE )染色观察各组肾组织病理损伤情况,采用蛋白质印迹法和免疫组织化学法检测肾组织中炎症因子、核因子(NF )-κB 信号通路及细胞焦亡相关蛋白表达水平。
结果 与Sham 组比较,IRI 组肾组织损伤较为严重,Scr 、Cys-C 、BUN 和血清IL-1β、IL-18水平均升高,蛋白质印迹法结果显示NOD 样受体蛋白(NLRP3)、Gasdermin D (GSDMD )、半胱氨酸天冬氨酸蛋白酶(Caspase )-1、IL-18、IL-1β、NF-κB p65、p-NF-κB p65蛋白相对表达量均增加,免疫组织化学染色结果显示NF-κB p65、p-NF-κB p65、IL-1β、IL-18和NLRP3 蛋白表达均增多。
与IRI 组比较,PDTC 组、NBP-L 组和NBP-H 组肾组织的损伤程度均减轻,Scr 、Cys-C 、BUN 和血清IL-18、IL-1β水平均下降,蛋白质印迹法结果显示NLRP3、GSDMD 、Caspase-1、IL-1β、IL-18、NF-κB p65、p-NF-κB p65蛋白表达DOI: 10.3969/j.issn.1674-7445.2023.04.010基金项目:贵州省卫生健康委科学技术基金(gzwkj2021-220);国家自然科学基金培育项目 [gyfynsfc (2020)-30];贵州医科大学附属医院2022年博士科研启动基金(gyfybsky-2022-31)作者单位:550004 贵阳,贵州医科大学附属医院泌尿外科作者简介:张瑞波(ORCID: 0009-0009-3056-7298),硕士研究生,肾移植相关缺血-再灌注损伤与保护,Email:****************通信作者:沈俊(ORCID: 0000-0003-1208-5833),博士,副主任医师,肾移植相关缺血-再灌注损伤与保护,Email:***************.cn结构式摘要HE 染色观察肾组织病理学改变免疫组化染色检测炎症因子、 NF-κB 信号通路及细胞焦亡相关蛋白IRISham 组IRI 组PDTC 组NBP-H 组丁苯酞或PTDC 或0.9%氯化钠注射液NBP-L 组蛋白质印迹法检测炎症因子、 NF-κB 信号通路及细胞焦亡相关蛋白Scr 、BUN 、Cys-C 水平检测IL-1β、IL-18水平检测·540·第14卷器官移植肾脏缺血-再灌注损伤(ischemia-reperfusion injury ,IRI )通常由器官移植、肾部分切除手术、败血症等引起,如不及时采取有效措施加以预防,很容易发展为急性肾损伤,导致病死率上升[1-6]。
表没食子儿茶素没食子酸(EGCG)对肾缺血再灌注损伤的保护作用及

表没食子儿茶素没食子酸(EGCG)对肾缺血再灌注损伤的保护作用及其机制的研究进展发表时间:2018-12-05T15:15:59.563Z 来源:《医药前沿》2018年30期作者:周小园田梅(通讯作者)[导读] 继续深入研究EGCG与肾缺血再灌注损伤的关系,为临床治疗缺血性的肾脏疾病提供新思路和治疗策略。
(遵义医学院附属医院贵州遵义 563000)【摘要】缺血再灌注损伤(Ischemia Reperfusion Injury IRI)是指经历缺血的器官或组织在恢复供血和供氧后,器官或组织损伤反而加重,甚至出现损伤不可逆的现象,通常由炎症级联反应引发,包括活性氧(ROS)、活性氮(RNS),细胞因子、趋化因子、白细胞活化等。
肾缺血再灌损伤(Renal ischemia reperfusion injury,RIRI)是一个非常复杂的病理过程,其主要通过线粒体损伤、炎症、凋亡、氧化应激等途径造成肾脏损伤[1]。
研究表明[2-3]EGCG对RIRI具有保护作用,本文对近年来EGCG在防治RIRI中的运用及其作用机制的研究进展予以综述。
【关键词】缺血再灌注损伤;EGCG;炎症级联损伤;肾脏损伤【中图分类号】R285.5 【文献标识码】A 【文章编号】2095-1752(2018)30-0009-021.EGCG的结构及生物活性EGCG是含有4个闭合环的酚类物质,其分子结构如图1所示,其中B环是抗氧化作用的主要部位[4]。
图1 EGCG的化学分子结构朱宝和等[5]研究结果表明,EGCG不仅可抑制胃癌的生长也能减缓向其他器官转移的速度,平均抑制率达60.4%,显著抑制胃癌血管内皮生长因子(VEGF)蛋白mRNA的表达和VEGF的分泌。
Xie[6]等研究表明EGCG可有效减少人体脐静脉内皮细胞由尿酸引起的炎症和氧化应激,其作用机制是EGCG通过Notch-1信号通路下调Notch-1表达,抑制炎性细胞因子的表达。
丙酮酸干预小肠缺血再灌注损伤的研究进展

丙酮酸干预小肠缺血再灌注损伤的研究进展肠道缺血再灌注损伤一直是基础研究和临床实践中的重要问题。
近年来大量研究证实丙酮酸钠(NaPyr)中丙酮酸根[Pyr-]阴离子可改善心肌、肾脏以及肝脏器官损伤后引起的功能障碍[1]。
同时,丙酮酸对机体其他各脏器缺血再灌注损伤如小肠、脑、肺脏等具有保护作用,并且可以改善严重休克的预后[2,3]。
但这种保护机制尚不十分清楚,可能与丙酮酸具有抗氧化、抑制氧自由基,提供能量等有关。
本文重点阐述丙酮酸对小肠缺血再灌注损伤的保护作用及机制。
1.丙酮酸简介丙酮酸一种三碳化合物,是生物体内一种很弱的有机酸,在自然条件下无色,有刺激性臭味的液体,沸点为165℃,易溶于水,化学结构为CH3COCOOH,分子中同时具有羧基和羰基两个官能团,除具有羧酸和酮的性质外,还具有α-酮酸的性质,氧化脱羧时糖酵解的终产物。
在缺氧条件下,丙酮酸在细胞浆中转变成乳酸产生ATP,成为细胞主要的能量代谢来源;在有氧条件下,丙酮酸进入线粒体,氧化脱羧生成乙酰辅酶A,进入三羧酸循环氧化成二氧化碳和水,并产生ATP释放能量以维持细胞代谢的需要。
此外,在体内丙酮酸可通过乙酰辅酶A和三羧酸循环实现糖、脂肪和氨基酸间的互相转化。
因此,丙酮酸在三大营养物质的代谢联系中起着重要的枢纽作用[4,5],同时是所有生物细胞糖代谢及体内多种物质相互转化重要中间体,具有提供能量、调节代谢、抗氧化及细胞保护等多种生理功能。
丙酮酸钠作为丙酮酸盐之一,既往主要应用于食物添加剂、细胞培养基中替代碳源、腹膜透析液、器官保存液、体外循环机预充液及心跳停搏液等。
近年来,经多国科研人员研究,现已有大量实验[6-10]证明其在休克和细胞、器官损伤方面治疗的优点,对失血性休克、缺血再灌注的动物器官如脑、肠等器官功能起保护作用,特别是能抑制肺、脑细胞的凋亡和保护肠粘膜屏障功能。
Frank Petrat等[11]研究发现丙酮酸灌注对大鼠严重肠缺血再灌注损伤具有保护作用。
CD248在肾脏疾病中的研究进展

CD248在肾脏疾病中的研究进展作者:卢欣节尤燕舞来源:《右江医学》2024年第02期[专家介绍]尤燕舞,教授,主任医师,医学博士,留美博士后,博士/硕士生导师,广西壮族自治区人民医院肾内科学科带头人。
曾在美国洛杉矶Cedars Sinai医学中心担任博士后研究员。
主要从事慢性肾脏疾病基因、免疫及分子机制的研究。
现任中国侨联特聘专家、广西医学会肾脏病学分会常务委员、广西医师协会第一届肾脏内科医师分会常务委员、广西中西医结合肾脏病学会常务委员。
主持国家自然科学基金项目2项、广西自然科学基金项目4项、厅级科研项目多项;公开发表学术论文80多篇,其中以第一作者或通信作者发表SCI论文20篇、中文核心期刊论文16篇;先后获得广西科技进步二等奖、三等奖;系自治区卫生健康委广西医学高层次骨干人才“139”计划中青年学科骨干培养人选,获广西医师协会第一届“广西十佳青年医师”荣誉称号。
【摘要】肾纤维化是许多肾脏疾病的最终转归,因此,延缓肾纤维化过程对肾脏疾病的治疗尤为重要。
CD248是一种Ⅰ型跨膜糖蛋白,在肾纤维化中表达上调,通过敲除CD248可抑制肾纤维化,这表明CD248在肾纤维化过程中可能起到重要作用。
该文将对CD248在肾脏疾病中的相关作用进行综述。
【关键词】CD248;肾纤维化;表达;肾脏疾病中图分类号: R692文献标志码: ADOI: 10.3969/j.issn.1003-1383.2024.02.001Research progress of CD248 in renal diseasesLU Xinjie1, YOU Yanwu2【Abstract】 Renal fibrosis is the final outcome of many renal diseases, so delaying the process of renal fibrosis is particularly important for the treatment of renal diseases. CD248 is a type I transmembrane glycoprotein, which is up-regulated in renal fibrosis. The knockdown of CD248 can inhibit renal fibrosis, suggesting that CD248 may play an important role in the process of renal fibrosis. This article will review the relevant roles of CD248 in renal diseases.【Keywords】CD248; renal fibrosis; expression; renal disease近年来,慢性肾脏病(chronic kidney disease,CKD)的发病率不断上升,特别是在中、高等收入国家,CKD已成为全球日益重要的健康问题[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
·综述·巨噬细胞表型转换及其在肾缺血再灌注损伤中作用的研究进展
樊雪梅,容松(遵义医学院附属医院,贵州遵义563003)
摘要:肾移植术是治疗肾功能衰竭的重要方法,但移植后肾缺血再灌注损伤(RIRI)的发生又不可避免。研究发现,巨噬细胞与RIRI密切相关,在RIRI进程的炎症反应中发挥着重要作用。巨噬细胞极具可塑性和异质性,可极化为M1、M2两类亚型,分泌或促进多种细胞因子的生成以响应不同微环境的刺激。巨噬细胞及其表型转换在
RIRI过程中发挥损伤与修复的双重作用,通过促进炎症反应、修复、纤维化等机制参与RIRI。
关键词:肾缺血再灌注损伤;表型转换;巨噬细胞;M1巨噬细胞;M2巨噬细胞
doi:10.3969/j.issn.1002266X.2018.30.026 中图分类号:R692.9 文献标志码:A 文章编号:1002266X(2018)30008904
基金项目:国家自然科学基金资助项目(81160096)。通信作者:容松(Email:1409843531@qq.com)
肾移植术是治疗肾功能衰竭的重要方法。但移植后仍面临着与肾缺血再灌注损伤(RIRI)相关的术后感染、肾功能恢复延迟、移植肾失功能等难题,对短期和长期移植结果有重要影响[1,2]。巨噬细胞是极具异质性和可塑性的免疫细胞之一,研究发现,巨噬细胞与RIRI密切相关,在RIRI过程中发挥抗炎和促炎的双重作用。多种无菌缺血性肾损伤模型实验已证实,巨噬细胞参与了RIRI过程的所有阶段,包括初始损伤、后续修复及晚期纤维化。我们以巨噬细胞为切入点,对其表型转换及其参与RIRI机制的相关研究进行综述。1 巨噬细胞的起源和异质性 巨噬细胞在固有免疫、恶性肿瘤、代谢和繁殖等系统起关键作用,并以浸润巨噬细胞及组织固有巨噬细胞两种形式存在于体内[1]。前者由骨髓来源的未成熟单核细胞进入血液循环后移行至各组织分化而来,后者则广泛分布于全身各组织,因定居组织不同而命名不同,如分布在肝脏者称为Kupffer细胞,分布在皮肤者称为Langerhans细胞,分布在大脑者称为小胶质细胞。目前认为固有巨噬细胞有三种来源,由血液中造血前体细胞在组织局部分化而来[2]、源于卵黄囊[3]及源于胎肝组织[4]。自发现巨噬细胞以来,探索其在各种病理机制中发挥何种作用一度成为研究热点。大量研究已证实,巨噬细胞具有可塑性和异质性[5],被作为单核细胞-巨噬细胞谱系的标志。巨噬细胞具有多样性转录谱,可极化为不同亚型以响应微环境的动态变化,从而发挥不同的功能。
2 巨噬细胞的分型、表型转换及功能
目前多数文献将巨噬细胞分为M1、M2两类亚型:经典活化的巨噬细胞(M1)和替代活化的巨噬细胞(M2)。巨噬细胞在干扰素(IFN)、Toll样受体等信号刺激下发生表型转换,极化为M1,在IL4、IL
13等信号刺激下极化为M2,二者的平衡状态与肾
脏微环境相关,可能与巨噬细胞源性转化生长因子
β(TGFβ)抑制诱导型一氧化氮合成酶(iNOS)、刺
激精氨酸酶(Arg)及信号转导和转录激活(STAT)、
NFκB等信号通路的调节有关。然而,有学者提出
M1/M2分型方法并不严谨,M1、M2是巨噬细胞在不同微环境因素刺激下发生表型转换这一动态过程的两个极端,该分型方法并不能反映该过程的真实性。多项研究表明巨噬细胞发生表型转换是复杂连续的过程,并非直接由M1转变到M2。如:M2三种附加亚型的研究(М2a由IL4、IL13等诱导,发挥组织修复作用;M2b由免疫复合物等诱导,发挥免疫调节作用;M2c由IL10、TGFβ等诱导,发挥抗炎作用);Mantovani等[6]认为M2样巨噬细胞具有M2的部分表型特征而非全部特征;Malyshev等[7]提出
体内尚不存在纯粹的只表达M1或M2表面标记物的巨噬细胞,且发现巨噬细胞除M1、M2表型外,还
98
山东医药2018年第58卷第30期存在新的表型———M3转换表型[7]。可见,巨噬细胞的具体分型、表型转换等仍需更深入的研究。但目前广泛使用的是M1/M2分型方法,因其简化了巨噬细胞表型转换的复杂性,便于研究中的描述。M1、M2的表面标记物也尚未统一。TLR4、MARCO受体、CD25、CD80可作为M1的表型特征,甘露糖受体、CD163、CD209等可作为M2的表型特征。Sun等[8]报道CD16、IL1R、IL12等可为M1的表面标记,通过释放IL6、TNFα、IL1、ROS、iNOS、等炎性细胞因子及CXCL5、CXCL9等趋化因子以招募其他免疫细胞,发挥促炎作用;IL1R(M2a)、CD86(M2b)、CD150、CD163(M2c)可为M2各类附加亚型的表面标记,释放IL10、IL12、TGFβ、Arg1等因子,发挥抗炎、修复、促纤维化等作用。李康等[9]认为,iNOS、IL12、CDl6/32可用于鉴定M1;Arg1、CD206、Dectin1可用于鉴定M2。探究巨噬细胞表面标记物,以鉴定巨噬细胞亚型是研究其在病理过程中发挥何种功能的重中之重。关于M1、M2功能的研究已取得一定成果。Gordon等[10]认为,M1可清除入侵微生物及肿瘤细胞并促进Ⅰ型免疫反应,参与初始炎症反应;M2则主要参与碎片清除、血管生成、组织重塑及伤口愈合并促进Ⅱ型免疫反应,在炎症后期发挥重要作用。简言之,M1在组织损伤中发挥促炎作用,M2则参与抗炎、组织修复及纤维化。3 巨噬细胞在RIRI中的作用3.1 巨噬细胞促进RIRI的炎症反应 RIRI动物模型实验证实,受损肾小管和内皮细胞可分泌单核细胞趋化蛋白1(MCP1)、基质细胞衍生因子1、IL6和IL8等趋化因子及炎性细胞因子,引导巨噬细胞、淋巴细胞等向肾间质快速浸润[11]。巨噬细胞等免疫细胞通过其模式识别受体,识别病原体相关分子模式和损伤相关分子模式(DAMPs),以介导炎症反应。RIRI发生时,缺血受损的肾组织释放大量DAMPs[12],如高迁移率族蛋白B1(HMGB1)、热休克蛋白(HSPs)等,这些DAMPs与巨噬细胞表面受体结合(如Toll样受体TLRs),激活巨噬细胞,引发非感染性炎症,促进肾组织损伤[2,13],此期促炎性巨噬细胞占主导地位,肾小管细胞凋亡显著。Mulay等[14]认为炎症与肾脏损伤在自动放大循环中相互增强,细胞损伤释放DAMP等可通过TLRs激活浸润单核细胞为促炎表型,浸润活化的促炎性巨噬细胞又进一步分泌多种促炎细胞因子,导致坏死性炎症,而抑制这类巨噬细胞可减轻甚至阻止受损肾免疫病理学的进展。RIRI发生后,巨噬细胞是啮齿类动物肾小管周围聚集的主要细胞类型之一。研究发现,使用脂质体氯膦酸盐(LC)使巨噬细胞减少或缺失,可减轻肾形态学损伤及减少尿素氮和肌酐的增加,抑制细胞因子、预防或消耗巨噬细胞等炎性细胞归巢,可降低模型形态和功能的损伤。损伤肾中的巨噬细胞经历从M1到M2表型转换的动态变化。M1产生活性氧、氮中间体等效应分子,IL1β、TNF、IL6、IL12等炎性因子及MCP1、CCL2、CXCL10、CXCL11等趋化因子促进组织损伤,同时还高表达iNOS,以分解L精氨酸为瓜氨酸和NO,NO的大量聚集可致组织损
伤[15,16]。Inoue等[17]新近的研究认为,M1表达巨噬细胞诱导的C型凝集素(Mincle)可介导肾急性期损伤,Mincle的表达受TLR4/NFκB信号传导调节,它通过酪氨酸激酶(Syk)/NFκB信号通路维持M1的炎性表型,促进iNOS、MCP1、TNFα等炎性因子
的产生,最终导致肾损伤,而抑制Mincle的表达则有肾保护作用。因此,控制RIRI中M1介导的炎性反应,可为移植肾存活提供良好的微环境,是肾移植领域值得努力的方向。
3.2 巨噬细胞参与RIRI的修复 RIRI时肾小管受损,管状细胞显著增殖,修复过程即启动,于第3天达峰值,随后1周内缓慢下降。在此修复期研究
中发现,巨噬细胞经历了表型变化并发挥着保护和修复作用。Lin等[18]研究发现,巨噬细胞缺乏时肾上皮细胞中典型的Wnt通路反应减少,肾修复大大减弱;使用Wnt途径调节剂后修复增强,表明巨噬细胞源性Wnt7b(Wnt通路配体)在修复和刺激肾上皮细胞再生中起重要作用,印证了巨噬细胞参与受损肾的修复过程。进一步追踪荧光标记的促炎性
M1实验发现,修复期肾中的M1可转换为M2,巨噬细胞经历了促小管炎症损伤到支持小管修复的表型转换。相似地,Cao等[19]认为RIRI后M2可刺激肾小管上皮细胞在内的多种细胞增生,这可能与M2抑制M1、减少促炎因子及iNOS的产生有关。
M2还可表达高水平Arg1、甘露糖受体(MR)及
IL10等[20,21],Arg可与iNOS竞争性结合同一底物L精
氨酸,将其裂解为脯氨酸和多胺,促进细胞分裂和胶原形成,从而发挥其促修复作用,另外,多胺又可促进巨噬细胞向M2转换,进一步对损伤组织进行修复和重塑。IL10是公认的内源性抗炎因子代表之一,主要来源于巨噬细胞和Th细胞,也可以由损伤肾小管上皮细胞产生,一定浓度的IL10可抑制
MCP1、IL2、INFγ、IL8、IL1、TNFα
等炎性因子的
产生,发挥其抗炎促修复作用[22]。在RIRI修复期,
09
山东医药2018年第58卷第30期
