2012高考化学一轮复习课件:专题8第3单元 盐类的水解 知识研习(苏教版)
高考化学一轮复习 专题8《溶液中的离子反应》第3单元 盐类的水解课时训练 苏教版(1)
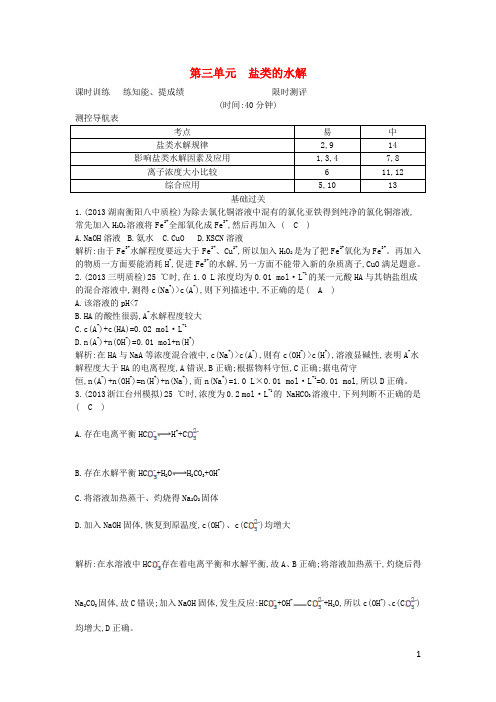
第三单元盐类的水解课时训练练知能、提成绩限时测评(时间:40分钟)考点易中盐类水解规律2,9 14 影响盐类水解因素及应用1,3,4 7,8离子浓度大小比较 6 11,12综合应用5,10 13基础过关1.(2013湖南衡阳八中质检)为除去氯化铜溶液中混有的氯化亚铁得到纯净的氯化铜溶液,常先加入H2O2溶液将Fe2+全部氧化成Fe3+,然后再加入 ( C )A.NaOH溶液B.氨水C.CuOD.KSCN溶液解析:由于Fe3+水解程度要远大于Fe2+、Cu2+,所以加入H2O2是为了把Fe2+氧化为Fe3+。
再加入的物质一方面要能消耗H+,促进Fe3+的水解,另一方面不能带入新的杂质离子,CuO满足题意。
2.(2013三明质检)25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,不正确的是( A )A.该溶液的pH<7B.HA的酸性很弱,A-水解程度较大C.c(A-)+c(HA)=0.02 mol·L-1D.n(A-)+n(OH-)=0.01 mol+n(H+)解析:在HA与NaA等浓度混合液中,c(Na+)>c(A-),则有c(OH-)>c(H+),溶液显碱性,表明A-水解程度大于HA的电离程度,A错误,B正确;根据物料守恒,C正确;据电荷守恒,n(A-)+n(OH-)=n(H+)+n(Na+),而n(Na+)=1.0 L×0.01 mol·L-1=0.01 mol,所以D正确。
3.(2013浙江台州模拟)25 ℃时,浓度为0.2 mol·L-1的 NaHCO3溶液中,下列判断不正确的是( C )A.存在电离平衡HC H++CB.存在水解平衡HC+H2O H2CO3+OH-C.将溶液加热蒸干、灼烧得Na2O2固体D.加入NaOH固体,恢复到原温度,c(OH-)、c(C)均增大解析:在水溶液中HC存在着电离平衡和水解平衡,故A、B正确;将溶液加热蒸干,灼烧后得Na2CO3固体,故C错误;加入NaOH固体,发生反应:HC+OH-C+H2O,所以c(OH-)、c(C)均增大,D正确。
新高考化学一轮复习盐类的水解课件(111张)

低,pH升高,A、C项错误,B项正确;在GHCl水溶液中存在电荷守恒:c(OH-)
+c(Cl-)=c(GH+)+c(H+),D项错误。
考题点睛
针对训练
1.(2020浙江卷,1)水溶液呈酸性的是(
)
A.NaCl 4
3
常加入少量盐酸
力强,使水中悬浮的颗粒沉降
Fe3++3H2O
H+可
Fe(OH)3+3H+,加入
抑制 Fe3+的水解
加入相应酸、碱 配制 Na2CO3 溶液时 CO2+H
O
HCO
+OH
,加入
OH
2
3
3
抑制水解
常加入少量 NaOH 可 抑制 CO23 的水解
盐类水解的应用 实例
水解的离子方程式或原理
由 MgCl2·6H2O 制无水
和解决生产、生活中有关电解质溶液的实际问题。
强基础 增分策略
一、盐类水解及规律
1.盐类的水解
2.盐类水解离子方程式的书写
(1)由于水解是微弱的反应,因而反应物与生成物用“
”连接,易挥发性物质
不标“↑”,难溶物不标“↓”,易分解的物质不拆开书写(相互促进水解者除外)。
如 NaHCO3(aq):
同理,强酸弱碱盐(如NH4Cl)的水解常数(Kh)与弱碱电离常数(Kb)之间的关
W
系: Kh= 。
b
易错辨析 判断正误:正确的画“√”,错误的画“×”。
(1)降低温度和加水稀释,都会使盐的水解平衡向正反应方向移动。
【优化方案】江苏专用高考化学总复习 专题8第三单元盐类的水解课件 苏教

(3)因Na2CO3价格便宜,有人建议用等物质的 量浓度和等体积的Na2CO3溶液代替NaHCO3 溶液,你认为此建议______(填“合理”或
“不合理”),理由是_____________________
_____________________________________。
(4)有人建议:把浓Al2(SO4)3溶液置于铁桶内, 而把固体NaHCO3置于玻璃瓶内,此建议 ________(填“妥当”或“不妥当”),其原因
据电荷守恒有c(Na+)+c(H+)=c(CH3COO-) +c(OH-),又c(H+)=c(OH-),则c(Na+)= c(CH3COO-);点③溶液中的溶质为0.002 mol CH3COONa , 离 子 浓 度 大 小 关 系 为 c(Na +)>c(CH3COO-)>c(OH-)>c(OH+)。 【答案】 D
•
(2)实验过程中发现烧瓶①中溶液红色变深, 烧瓶③中溶液红色变浅,则下列叙述正确的 是________(填字母)。 A.水解反应为放热反应 B.水解反应为吸热反应 C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1CH3COONa溶液中分别加入 少量浓盐酸、NaOH固体、Na2CO3固体、 FeSO4固体,使CH3COO-水解平衡移动的方 向分别为_________、_________、________、 _________(填“左”、“右”或“不移动”)。
•11、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。 •12、首先是教师品格的陶冶,行为的教育,然后才是专门知识和技能的训练。 •13、在教师手里操着幼年人的命运,便操着民族和人类的命运。2022/1/162022/1/16January 16, 2022 •14、孩子在快乐的时候,他学习任何东西都比较容易。 •15、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 •16、一个人所受的教育超过了自己的智力,这样的人才有学问。 •17、好奇是儿童的原始本性,感知会使儿童心灵升华,为其为了探究事物藏下本源。2022年1月2022/1/162022/1/162022/1/161/16/2022 •18、人自身有一种力量,用许多方式按照本人意愿控制和影响这种力量,一旦他这样做,就会影响到对他的教育和对他发生作用的环境。 2022/1/162022/1/16
高考化学总复习专题八第三单元盐类的水解教案苏教版
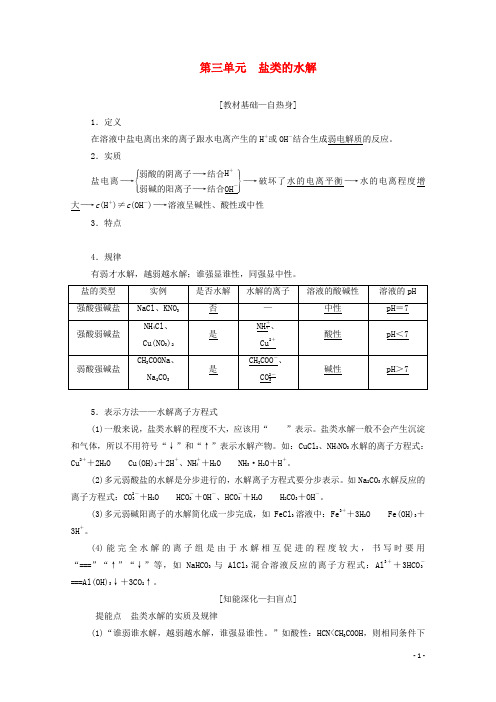
第三单元 盐类的水解[教材基础—自热身]1.定义在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合H +弱碱的阳离子―→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性3.特点 4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
5.表示方法——水解离子方程式(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如:CuCl 2、NH 4NO 3水解的离子方程式:Cu 2++2H 2OCu(OH)2+2H +、NH +4+H 2ONH 3·H 2O +H +。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na 2CO 3水解反应的离子方程式:CO 2-3+H 2OHCO -3+OH -、HCO -3+H 2OH 2CO 3+OH -。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl 3溶液中:Fe 3++3H 2O Fe(OH)3+3H +。
(4)能完全水解的离子组是由于水解相互促进的程度较大,书写时要用“===”“↑”“↓”等,如NaHCO 3与AlCl 3混合溶液反应的离子方程式:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑。
[知能深化—扫盲点]提能点 盐类水解的实质及规律(1)“谁弱谁水解,越弱越水解,谁强显谁性。
”如酸性:HCN<CH 3COOH ,则相同条件下碱性:NaCN>CH3COONa。
(2)强酸的酸式盐只电离,不水解,溶液显酸性。
如NaHSO4在水溶液中:NaHSO4===Na++H++SO2-4。
(3)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液显碱性。
2012苏教版化学反应原理课件--专题三第三单元第1课时盐类的水解反应及影响因素

• 知识点1 盐类的水解 • 1.盐类水解的实质 • 盐溶于水时电离产生的弱碱阳离子 ( 如 NH4 + 、 Al3+、Fe3+等)或弱酸阴离子(如CH3COO-、CO32 - 、 S2 - 等 ) 与水电离产生的 OH - 或 H + 结合生成 了难电离的弱碱或弱酸 ( 弱电解质 ) ,使水的电 离平衡发生移动,从而引起水电离产生的c(H+) 与c(OH-)的相对大小发生变化,导致溶液中的 c(H+)与c(OH-)不同,使溶液呈现一定的酸碱性。
• (2)盐类的水解是可逆反应,盐类水解的离子方 程式中一般不写生成符号而写可逆符号(发生强 烈双水解的盐除外)。 • (3)多元弱酸盐的水解是分步的,第一步较容易 发生,第二步比第一步难,以此类推,水解时 以第一步为主,可以只写第一步水解的离子方 程式,但不能将各步离子方程式加和成一个总 的水解方程式。例如Na2CO3水解的离子方程式 为(可以只写①,也可以分别写出①②): • CO32-+H2O HCO3-+OH- ①
• 1 .能使水的电离平衡正向移动,而且所得溶 液呈酸性的是( ) • A.将水加热到100 ℃时,水的pH=6 • B.向水中滴加少量稀H2SO4 • C.向水中加入少量NaHCO3 • D.向水中加入少量胆矾晶体
• 解析:B使水的电离平衡逆向移动,A、C、D使 水的电离平衡正向移动,但A仍为中性,C为碱 性,D为酸性。故应选D。 • 答案:D
• 3.盐类水解离子反应方程式的书写 • (1)一般盐类水解的程度很小,水解产物也很少, 通常不生成沉淀或气体,也不发生分解,在书 写盐类水解的离子方程式时一般不标“↓”或 “ ↑ ”,也不把生成物 ( 如 NH3·H2O 、 H2CO3 、 H2SO3)写成其分解产物的形式。例如NH4Cl水解 的离子方程式为: • NH4++H2O NH3·H2O+H+
化学课件《盐类的水解》优秀ppt62(9份打包) 苏教版

谢谢!
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
单元盐类的水解 盐类的水解反应
【复习与回顾】
加入强酸
加入弱酸 增大c(H+)
加入强酸的酸式盐
抑制水电离
加入强碱 增大c(OH-) 加入弱碱
促进水电离
降低温度 升高温度 减小c(H+) 减小c(OH-)
盐类的水解规律
使液【那思么滴用到考,底】方在是1盐酸呢.性溶酸干法?还解溶是:燥碱于液性水呈的直后酸,性接p所,H形碱把试成溶的液待纸水呈测溶碱上液性是,, 试跟否于呈 盐纸标2中 类.性 ,N上准a? 为2C什显比O么3俗出色叫称它“颜卡“纯纯碱色相碱””后对,?但马比它明上明属
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
高考化学总复习 8.3盐类的水解课件 苏教
与瓶口黏合而打不开,因此实验室盛放碳酸 钠的试剂瓶应用橡胶塞;⑤AlCl3溶液中存在 水解平衡:AlCl3+3H2O Al(OH)3+3HCl, 加热时,HCl挥发使平衡不断右移,最终得到 Al(OH)3固体(如果灼烧,会得到Al2O3固体)。
【答案】 D
【规律方法】 盐类水解的应用的复习不能死记
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显 红色的原因为_________________________。
(2)实验过程中发现烧瓶①中溶液红色变深, 烧瓶③中溶液红色变浅,则下列叙述正确的 是________(填字母)。 A.水解反应为放热反应 B.水解反应为吸热反应 C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
3.水解结果 水的电离平衡向_电__离__的方向移动,溶液中
c(H+)≠c(OH-),溶液呈现出一定的酸碱性。
4.水解特点 (1)一般来说,水解反应是_微__弱__的,存在 _水__解__平衡。 (2)是_中__和__反__应__的逆反应,因此水解反应是 _吸__热__反应。
5.水解规律 无弱不水解,谁弱谁水解,越弱越水解;谁强 显谁性,同强显中性。 思考感悟 1.同浓度的NaHCO3和CH3COONa溶液相比, 谁的pH较大?为什么?
CH3COOH+OH-为
思考感悟 2.(1)解释为什么热的纯碱液去油渍效果会更 好? (2)配制FeCl3溶液时,常加入少量的盐酸,为 什么?
【提示】 (1)纯碱溶液中存在 CO23-的水解平 衡:CO23-+H2O HCO- 3 +OH-,温度升高, 水解平衡右移,c(OH-)增大,去污能力增强。
+__O__H_-_(主要),HS-+H2O
H2S+OH-(次要)。
高三化学(苏教版)总复习 1-8-3盐类的水解
-
CH3COO-的水解,故 NaOH 满足要求。
[答案]B
必修部分
专题8 第三单元
高考化学总复习
6.如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L
-1CH 3COONa溶液,并分别放置在盛有水的烧杯中,然后
江 苏 教 育 版
向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体, 烧杯②中不加任何物质。
高考化学总复习
必修部分
江 苏 教 育 版
必修部分
专题8 溶液中离子的反应
高考化学总复习
江 苏 教 育 版
必修部分
专题8 溶液中离子的反应
高考化学总复习
第三单元
盐类的水解
江 苏 教 育 版
必修部分
专题8 第三单元
高考化学总复习
江 苏 教 育 版
必修部分
专题8 第三单元
高考化学总复习
1.理解盐类水解的实质,了解盐类水解的概念。
必修部分
专题8 第三单元
高考化学总复习
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的
原因为_________________________________________。 (2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中 溶液红色变浅,则下列叙述正确的是________。 A.水解反应为放热反应 B.水解反应为吸热反应 C.NH4NO3晶体溶于水时放出热量
[答案]B
- - - - - + +
江 苏 教 育 版
必修部分
专题8 第三单元
高考化学总复习
5.向CH3COONa稀溶液中加入(或通入)少许X物质,
其溶液中部分微粒浓度变化如下表所示(溶液温度不变):
