诊断试剂盒
牛结核病抗体检测试剂盒
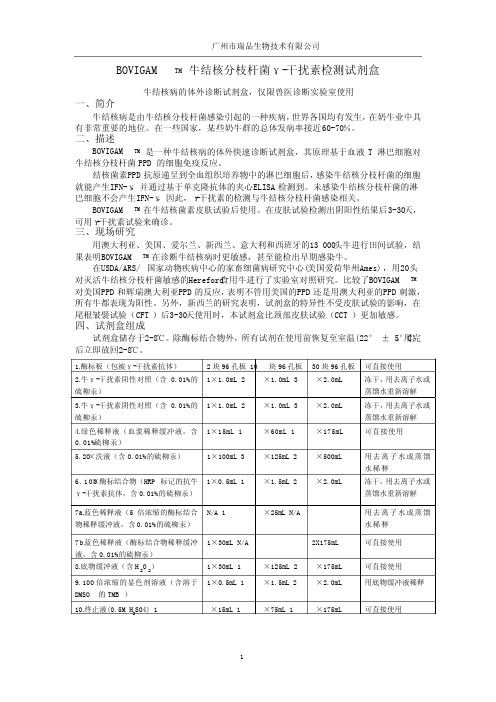
BOVIGAMTM牛结核分枝杆菌γ-干扰素检测试剂盒牛结核病的体外诊断试剂盒,仅限兽医诊断实验室使用一、简介牛结核病是由牛结核分枝杆菌感染引起的一种疾病,世界各国均有发生,在奶牛业中具有非常重要的地位。
在一些国家,某些奶牛群的总体发病率接近60-70%。
二、描述BOVIGAM TM 是一种牛结核病的体外快速诊断试剂盒,其原理基于血液T 淋巴细胞对牛结核分枝杆菌PPD 的细胞免疫反应。
结核菌素PPD 抗原递呈到全血组织培养物中的淋巴细胞后,感染牛结核分枝杆菌的细胞就能产生IFN-γ,并通过基于单克隆抗体的夹心ELISA 检测到。
未感染牛结核分枝杆菌的淋巴细胞不会产生IFN-γ,因此,γ-干扰素的检测与牛结核分枝杆菌感染相关。
BOVIGAM TM 在牛结核菌素皮肤试验后使用。
在皮肤试验检测出阴阳性结果后3-30天,可用γ-干扰素试验来确诊。
三、现场研究用澳大利亚、美国、爱尔兰、新西兰、意大利和西班牙的13 000头牛进行田间试验,结果表明BOVIGAM TM 在诊断牛结核病时更敏感,甚至能检出早期感染牛。
在USDA/ARS/国家动物疾病中心的家畜细菌病研究中心(美国爱荷华州Ames),用20头对灭活牛结核分枝杆菌敏感的Hereford 食用牛进行了实验室对照研究。
比较了BOVIGAM TM 对美国PPD 和辉瑞澳大利亚PPD 的反应,表明不管用美国的PPD 还是用澳大利亚的PPD 刺激,所有牛都表现为阳性。
另外,新西兰的研究表明,试剂盒的特异性不受皮肤试验的影响,在尾根皱襞试验(CFT )后3-30天使用时,本试剂盒比颈部皮肤试验(CCT )更加敏感。
四、试剂盒组成试剂盒储存于2-8℃。
除酶标结合物外,所有试剂在使用前恢复至室温(22° ± 5°C)。
用完后立即放回2-8℃。
1.酶标板(包被γ-干扰素抗体) 2块96孔板 10块96孔板30块96孔板 可直接使用2.牛γ-干扰素阳性对照(含0.01%的硫柳汞)1×1.0mL 2×1.0mL 3×2.0mL冻干,用去离子水或蒸馏水重新溶解 3.牛γ-干扰素阴性对照(含0.01%的硫柳汞)1×1.0mL 2×1.0mL 3×2.0mL冻干,用去离子水或蒸馏水重新溶解 4.绿色稀释液(血浆稀释缓冲液,含0.01%硫柳汞)1×15mL 1×60mL 1×175mL可直接使用5.20×洗液(含0.01%的硫柳汞) 1×100mL 3×125mL 2×500mL 用去离子水或蒸馏水稀释6.100×酶标结合物(HRP 标记的抗牛γ-干扰素抗体,含0.01%的硫柳汞) 1×0.5mL 1×1.5mL 2×2.0mL冻干,用去离子水或蒸馏水重新溶解 7a.蓝色稀释液(5倍浓缩的酶标结合物稀释缓冲液,含0.01%的硫柳汞) N/A 1×25mL N/A用去离子水或蒸馏水稀释 7b.蓝色稀释液(酶标结合物稀释缓冲液,含0.01%的硫柳汞) 1×30mL N/A2X175mL可直接使用8.底物缓冲液(含H 2O 2)1×30mL 1×125mL 2×175mL 可直接使用 9.100倍浓缩的显色剂溶液(含溶于DMSO的TMB )1×0.5mL 1×1.5mL 2×2.0mL用底物缓冲液稀释10.终止液(0.5M H 2SO4) 1×15mL 1×75mL 1×175mL可直接使用广州市瑞品生物技术有限公司 广州市瑞品生物技术有限公司 五、试剂盒未提供的材料A. 采血1. 肝素锂真空管 每头动物1支2. 18号针头-1寸 每头动物1支3. 针管 每位采血人员2-3支B. 血液培养1. 无菌的5或10mL移液器 每头动物1根2. 无菌的24孔组织培养板 每8头动物1块3. 分装用的枪头(5mL) 每群动物3支4. 无菌的磷酸盐缓冲液(0.01M pH7.2) 每头动物100µL5. Bovigam牛型提纯结核菌素(PPD) 150头动物1支6. Bovigam禽型提纯结核菌素(PPD) 150头动物1支C. 收获血浆1. 100-1000 µL枪头 每头动物3支2. 用于储存血浆的1mL离心管(放在96孔板架上)和盖子 每30头动物1个架子D. 牛γ-干扰素酶免疫试验1. 12道移液器吸头 每头动物3支2. 各种规格的聚丙烯管、酶免疫试验的试剂反应槽和枪头实验仪器1. 37℃培养箱2. 精密可调移液器(1mL)3. 1mL、5mL、10mL的移液器4. 100mL、1L、2L的量筒5. 6L去离子水或蒸馏水6. 12道移液器(50µL-300µL)7. 微量振荡器(可选)8. 洗板机9. 酶标仪(必须含450nm和620-650nm的滤光片)六、试剂配制1. 抗原Bovigam试剂盒在美国已被批准用于牛结核病的诊断。
胶体金检测试剂盒使用方法

胶体金检测试剂盒使用方法胶体金检测试剂盒是一种常用于生物医学研究和临床诊断中的实验试剂。
它利用胶体金颗粒与待检测物质发生特异性反应,通过观察胶体金颗粒的颜色变化来判断待测物质的存在与浓度。
下面将介绍胶体金检测试剂盒的使用方法。
1. 样品制备首先,我们需要准备待测样品。
具体制备方法根据不同的实验目的和待测物质而有所不同。
通常情况下,样品可以是血液、尿液、唾液等生物液体,或者是细胞培养上清液、细胞裂解液等。
2. 样品处理在使用胶体金检测试剂盒之前,需要对待测样品进行处理。
处理方法可以包括稀释、过滤、还原等步骤。
这些步骤的目的是为了提取和浓缩待测物质,同时排除其他干扰物质,以保证最终结果的准确性。
3. 试剂准备接下来,我们需要准备胶体金检测试剂盒的试剂。
试剂通常包括胶体金溶液、稀释缓冲液、控制品等。
根据试剂盒的要求,按照指定比例将试剂与样品混合。
4. 检测操作将混合好的样品和试剂溶液滴于胶体金检测试剂盒提供的检测条或孔板上。
确保每个样品和试剂的滴加顺序和时间相同,以保证结果的比较性。
5. 反应时间待检测物质与胶体金颗粒发生反应后,需要等待一定的时间让反应充分进行。
反应时间通常为几分钟到几十分钟不等,根据试剂盒的要求进行具体操作。
6. 观察结果观察胶体金颗粒的颜色变化。
正常情况下,胶体金颗粒呈现红色或紫色,与胶体颜色浓度成正比。
若待测物质存在,胶体金与待测物质发生特异性反应后,溶液颜色会发生变化,比如出现蓝色或者不规则沉淀。
7. 结果分析根据试剂盒上的说明书或者标准曲线,将观察到的颜色变化与已知浓度的标准物质进行比较,从而得到待测物质的浓度。
根据需要,还可以通过光密度计等仪器来量化测定。
总结:以上是胶体金检测试剂盒的使用方法。
使用者在操作过程中应当注意保持试剂的新鲜性和操作的准确性,避免与其他物质产生交叉反应,以确保检测结果的准确性和可靠性。
同时,还应当仔细读取试剂盒上的使用说明和注意事项,确保按照规定进行操作。
人类免疫缺陷病毒(HIV1+2)抗体诊断试剂盒(胶体金法)标准操作规程

人类免疫缺陷病毒(HIV1+2)抗体诊断试剂盒(胶体金法)标准操作规程一. 预期用途本试剂盒定性检测人血清、血浆或者全血样品中可能存在的HIV-1/HIV-2抗体,作为HIV感染的辅助诊断方法。
二. 检测原理本试剂盒利用免疫层析原理,采用双抗原夹心法检测,在硝酸纤维膜上的检测区域包被HIV-1和HIV-2区段抗原,用胶体金标记同样含有的HIV-1和HIV-2区段的标记抗原,用抗HIV抗体作为对照线原料包被到硝酸纤维膜上形成对照线。
检测时,如果样品内还有HIV抗体时,样品中的HIV抗体可与纸条前段的“胶体金-抗原”结合,形成免疫复合物,复合物由于层析作用沿膜带移动,并在包被了抗原的检测区形成一条红色线,判为阳性;如果样品内不含有HIV抗体,检测区不会形成红色线,判为阴性。
三. 试剂1.生产厂商:北京万泰生物药业股份有限公司2.规格: 1人份/袋 10人份/盒3.试剂组成:测试卡、铝箔袋、干燥剂、说明书、样品稀释液。
测试卡主要成分:塑料卡、塑料底板、吸水滤纸、硝酸纤维膜(包括包被有HIV-1和HIV-2抗原的检测线和包被有抗HIV抗体的对照线),金垫(附着有胶体金标记的HIV-1和HIV-2区段抗原)。
四. 仪器加样器五. 样品要求:1、本试剂检测人血清、血浆或全血2、血清、血浆样品3日内检测的,置2-8℃冰箱保存;超过3日不检测的样品,应低温保存。
3、全血样品建议在采血后立即检测,不可长期放置后检测。
六. 检验方法:1、检测血清或血浆样品,用加样器取80ul血清或血浆样品,缓慢滴加在测试卡加样端中心。
2、检测全血样品:在测试卡加样端中心滴加1滴(约40ul)全血样品,后立即滴加1-2滴(约40-80ul)样品稀释液。
七. 质量控制:出现阳性对照线实验结果有效,不出现阳性对照线实验结果无效。
八. 参考值:加样完毕,室温放置30分钟观察结果,出现两条红色线为阳性,只出现一条对照线为阴性。
九. 检验结果的解释阴性:只出现一条对照线阳性:出现两条红色线。
人类免疫缺陷病毒(HIV 1+2)抗体诊断试剂盒(酶联免疫法)

人类免疫缺陷病毒(HIV 1+2)抗体诊断试剂盒(酶联免疫法)说明书批准文号:国药准字S2*******本品系用HIV特异性抗原gp160和gp36等包被酶标反应板,用gp160和gp36标记辣根过氧化物酶,应用双抗原夹心法原理(ELISA)检测人血清或血浆中的HIV-1/HIV-2抗体。
【样本要求】人血清和血浆。
【使用方法】1、每次试验设阴性、阳性对照各两孔,分别加入阴性、阳性对照血清100μl,再设一孔空白对照,其余孔加入100μl被测样本,置37℃孵育30分钟。
弃去孔内样本,扣干。
2、用洗涤液注满每孔(至少300μl洗涤液/孔),勿溢出,静置5秒钟后扣干,重复5次。
3、每孔加酶结合物100μl(空白对照孔不加),置37℃孵育30分钟,同上法洗反应板5次。
4、每孔加显色剂A液、B液各50μl,轻轻振荡后,37℃避光静置15分钟。
5、每孔加入终止液50μl终止反应,以空白调零,在酶标仪中读取各孔OD450。
【结果判定】1、 实验设计要求阳性对照平均值大于1.20,阴性对照平均值小于0.10,阳性、阴性对照OD值之差应大于1.20,否则本次实验无效。
2、 若阴性对照读数小于0.05时,按0.05计算。
3、 临界值(Cut off value)=阴性对照平均值+0.10。
4、 测试样本的计算值小于Cut off value则为HIV抗体阴性。
5、 测试样本的计算值等于或大于Cut off value则为HIV抗体阳性。
(注意:初试阳性标本应重新取样进行双孔复试,复试阳性者应按“全国艾滋病检测管理规范”送HIV确认实验室进行确认实验)。
【注意事项】1、 本试剂的使用单位必须是经当地卫生行政部门批准的HIV初筛实验室。
2、 整个HIV检测必须符合《HIV实验管理规范和生物安全守则规定》,严格防止交叉感染。
操作时必须戴手套、穿工作衣,严格健全和执行消毒隔离制度。
3、 HIV抗体测定结果的判定必须以酶标仪读数为准。
胶体金法新冠检测试剂盒使用方法

胶体金法新冠检测试剂盒使用方法胶体金法是一种常用于新冠病毒检测的方法,也称为快速诊断试剂盒。
下面是关于胶体金法新冠检测试剂盒使用方法的详细说明。
1.准备工作:-将试剂盒从冰箱中取出,并放置于室温下30分钟,使其达到室温。
-检查试剂盒的包装是否完好,确认过期日期是否合适。
如有损坏或过期,禁止使用。
-打开试剂盒包装,取出所需试剂。
2.样本采集:-样本采集通常使用咽喉拭子或鼻液,在专业人员的指导下进行。
-拭子取自咽喉部或鼻腔,需尽量触及到炎症部位。
-将采集到的样本放入提供的稀释液中,确保充分混合。
3.样本处理:-取出试剂盒中的稀释液瓶,打开盖子,将稀释液倒入一个干净的容器中。
-取一部分样本,将其加入到稀释液中,并彻底混合。
-等待5分钟,让混合后的样本与稀释液充分反应。
4.贴膜处理:-把试剂盒中的膜杆取出,并将其贴在专门设计的试剂区域上,确保完全覆盖。
-注意避免触碰试剂区域,以免影响结果的准确性。
5.加样:-使用一次性移液器,将稀释液和样本混合液加入到试剂盒中,滴在贴膜的起始位置处。
-贴膜上的反应开始后,将试剂盒放置在水平位置,避免移动或振动。
6.结果读取:-等待10-15分钟,直到出现红色线条。
-结果有两种情况:一个红色测试线出现表示阴性,两个红色测试线出现表示阳性。
-如果没有任何红色线条出现,表示结果无效,需要重新进行检测。
7.结果判读:-阅读结果应该在规定的时间内进行,避免时间过长导致结果不准确。
-记录测试日期、时间以及结果,方便后续查询和分析。
8.结果初步判断:-阳性结果可能有不同程度的颜色深浅,颜色越深表示病毒载量越高。
-阴性结果表示在所使用的样本中未检测到新冠病毒。
9.结果确认:-由于胶体金法是一种初步筛查方法,为了确认结果的准确性,应当进行PCR检测等进一步的实验室测试。
总结:以上是胶体金法新冠检测试剂盒的使用方法的详细说明。
在进行检测前,请确保充分熟悉试剂盒的使用说明,并遵循相关操作规范。
人体免疫缺陷病毒抗体诊断试剂盒酶联免疫法

人类免疫缺陷病毒抗体诊断试剂盒酶联免疫法试剂厂家:检验原理:本产品系用纯化基因工程人类免疫缺陷病“1”型和“2”型(HIV-1/HIV-2)抗原包被的微孔板和酶标记的HIV-1/HIV-2抗原及其它试剂组成,应用双抗原夹心法原理检测人血清或血浆中的HIV-1/HIV-2抗体。
检验方法:1.加样:将预包被板条固定于板架。
每次检验设阴性对照3孔,抗-HIV-1阳性对照2孔,抗-HIV-2阳性对照2孔,分别加入阴性,阳性对照各50ul;设空白对照1孔,不加样品。
其余孔加入待测样品50ul.2.温育:置37±1℃温育60分钟。
3.洗涤:弃去孔内液体,将稀释后的洗液注满各孔,静置30-60秒,弃去孔内洗液。
重复洗6次后拍干。
4.加酶:空白对照孔不加酶标记物,其余孔加入酶标记物50ul.5.温育:置37±1℃温育30分钟。
6.洗涤:弃去孔内液体,将稀释后的洗液注满各孔,静置30-60秒,弃去孔内洗液。
重复洗6次后拍干。
7.显色:每孔加入底物缓冲液50ul,振荡混匀,置37±1℃温育30分钟。
8.终止:每孔加入终止液50ul,轻拍混匀。
9.读值“用酶标仪读值,在单波长450nm(须以空白对照孔校零)或双波长450nm/620nm-700nm下读取各孔A值。
参考值:1.试剂空白标准:试剂空白A值应﹤0.08(空白校零前)2.阴性对照标准:阴性对照A值应≤0.123.阳性对照标准:抗-HIV-1阳性对照A值应≥0.8抗-HIV-2阳性对照A值应≥0.8临界值(C.O.)计算:临界值(C.O.)=阴性对照平均A值+0.15备注:阴性对照平均A值小于0.08按0.08计算,大于0.08按实际值计算。
结果解释:样品A值≥临界值(C.O.)为HIV抗体阳性样品A值≤临界值(C.O.)为HIV抗体阴性备注:初次检验阳性者应重新取样进行双孔复试,如果复试中任何一孔为阳性样品视为HIV抗体阳性,对复试结果为阳性的样本请按《全国艾滋病检测技术规范》处理。
BP 180抗体检测试剂盒(ELISA) 说明书

BP 180抗体检测试剂盒(ELISA)说 明 书货号:7695E规格:48孔生产企业 经销企业株式会社医学生物学研究所(MBL) 北京博尔迈生物技术有限公司【产品名称】通用名称:BP180抗体检测试剂盒(ELISA ) 英文名称:MESACUP BP180 TEST【包装规格】48人份/盒【预期用途】BP180抗体检测试剂盒(ELISA )利用酶联免疫吸附法(ELISA ),定性测定人类血清中的BP180抗体,用于体外诊断,作为诊断类天疱疮的一种辅助诊断手段。
大疱性类天疱疮(BP )是一种慢性瘙痒性的大疱性皮肤病,主要发病人群为老年人,表现为红斑和紧张的水疱。
此类患者的血清中可检测到IgG 基底膜(BMZ )抗体,损伤部位的基底膜可检测到线性IgG 或C3沉积。
BP 患者血清中自身抗体的靶抗原是BP230和BP180,也称作BPAG1和BPAG2。
这两种抗原的分子量分别是230 kD 和180 kD 。
由于所在部位的原因,BP180被认为是自身抗体的直接靶点,而抗BP230自身抗体则被认为是其继发性产物。
BP180抗体被认为是致病源,因为注射兔抗小鼠NC16a 区域的BP180抗体可诱导新生小鼠产生类似于BP 的水疱。
BP180的主要表位位于接近细胞膜的区域,称为NC16a ,大多数患者的血清对重组的NC16a 蛋白起反应。
BP180抗体检测试剂盒(ELISA )能特异性地检测患者血清中的BP180自身抗体。
【检验原理】BP180抗体检测试剂盒(ELISA )利用ELISA 定性测定血清中的BP180抗体。
检测时,将标准血清和患者血清加入包埋BP180抗原的微孔条带,使BP180抗体与孔内固定的抗原发生反应(样品孵育)。
洗涤微孔条带,除去未结合的血清蛋白,然后加入标记了辣根过氧化物的人类IgG 抗体,并孵育(结合孵育)。
接着再次洗涤,然后加入过氧化物酶底物,并再次孵育一段时间(底物孵育),之后向每孔加入酸溶液,以终止酶反应,并稳定显色反应。
诊断试剂盒英文词汇整合版

司
产
品 Products page1
血清妊娠相关血浆蛋白A 梅毒螺旋体 癌抗原125 癌抗原19-9 前列腺特异性抗原 游离前列腺特异性抗原 新生儿血斑促甲状腺激素 泌乳素 促卵泡激素
公
司
产
品 Products
page2
透明质酸 心肌脂肪酸结合蛋白 胰岛素 C-肽 血清游离三碘甲状腺原氨酸 血清总三碘甲状腺原氨酸 血清总甲状腺素 血清游离甲状腺素 苯丙氨酸 艾滋病病毒 增强液 洗液 Eu标准液 校准品 缓冲液 酶联免疫吸附测定
公
司
产
品 Products
page2
Hyaluronic Acid(HA) Heart Fatty Acid Binding Protein(H-FABP) Insulin (INS) C-Peptide (C-P) free Triiodothyronine (FT3) in serum total Triiodothyronine (TT3) in serum total Thyroxine (TT4) in serum free Thyroxine (FT4) in serum phenylalanine (Phe) Human Immunodeficiency Virus (HIV) enhancement solution wash buffer Europium standard solution calibrator buffer Enzyme-Linked Immuno Sorbent Assay (ELISA)
Pregnancy-Associated Plasma Protein-A in serum (PAPP-A) Treponema Pallidum (TP) Cancer Antigen 125 (CA125) Cancer Antigen 19-9 (CA19-9) Prostate-Specific Antigen(PSA) free Prostate-Specific Antigen(fPSA) Thyroid-Stimulating Hormone (TSH) in dry blood spot of newborn prolactin (PRL) Follicle-Stimulating Hormone(FSH)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 结核性胸腔积液特异性诊断试剂盒的研制 一、项目可行性报告 (一)立项的背景和意义。 结核病(tuberculosis, TB)是由结核分枝杆菌(mycobacterium tuberculosis, MTB)引起的以呼吸道传播为主的慢性传染病,是当今世界由单一致病菌感染引起的死亡率最高的疾病,严重威胁着人类的健康。特别是近10年来由于人口剧增、耐药性的产生、人类免疫缺陷病毒感染流行、免疫抑制剂的使用等原因,结核病日益严重,全球结核病疫情骤然回升。据资料报道,当前全球1/3的人感染了结核杆菌,每年有800万至1000万新发结核病患者,有300万人死于结核病[1-4]。我国的结核病流行情况十分严峻,结核病人数位居世界第二位,约占全球结核病人的四分之一,是全球22个结核病高负担国家之一,每年由结核病带来的直接经济损失超过40亿。2000年在我国31个省、直辖市、自治区组织进行第四次全国结核病流行病学抽样调查,结果显示全国人口结核感染率为45%,高于WHO估计的1/3水平,估计全国结核菌感染者5.5亿。农村结核患病率高于城市,西部地区患病率高于东部地区。全国现有活动性肺结核病人451万,菌阳肺结核病人196万,每年死亡人数约13万,在传染病中居第一位,是其它各种传染病和寄生虫病死亡人数总和的2倍,结核病的发病数和死亡数自2005年初以来居27种甲乙类传染病首位,结核病已经超过肝炎一跃成为我国危害最严重的传染病。因此在全国范围内采取有效遏制结核病的策略刻不容缓[5-8]。 (二)国内外研究现状和发展趋势。 由于结核主要通过飞沫传播,因此结核病的早期诊断非常重要,利用简单、快速、准确的实验室检查尽早对结核病做出诊断对控制结核病疫情至关重要。然而目前,结核病的诊断现状不尽人意,体外分枝杆菌分离培养是诊断结核病的金标准,其缺点是:培养周期长(约6周),假阳性率高[9]。近年来应用于临床的Bactec分枝杆菌培养/鉴定/药敏系统可将阳性标本检出时间缩短至平均9天,鉴定、药敏试验时间平均为4天,然而Bactec仪器价格昂贵,需进口厂家的专利液体培养基,费用较高,且方法仍然建立在以细菌培养的基础之上,不管是检测菌体还是检测代谢产物,都要通过分枝杆菌的自然生长以积累菌量方能检出,而分枝杆菌的生长相对缓慢,因而它们都难以突破“慢”的限制[10]。结核病诊断的免疫学检测,目前仍普遍基于感染免疫学的概念检测结核菌抗原及其特异性抗体,国内外研究者采用脂阿拉伯甘露聚糖(LAM) 、脂多糖(LPS) 、结核菌重组蛋白相对分子量38 000 等或其他纯化蛋白作为抗原,以胶体金标记,建立简便、快速免疫学诊断方法,如分子量 2
38 000的金标渗滤试剂以及结核特异性抗原免疫印迹检测技术。但是,由于结核菌在属间和种间存有共同的抗原决定簇,加之其与体液免疫的相关性目前尚未得到充分的阐明,因而在综合提高实验的敏感性和特异性方面未能取得实质性的进展[11-13]。结核病免疫学检测,目前最常用的是PPD试验,以机体对注射的PPD 是否产生变态反应来判断机体曾否感染过结核菌而作为一项辅助诊断指标。但是,由于PPD中含有许多分支杆菌共同的抗原,如卡介苗接种者PPD 试验可呈现阳性结果,PPD皮试阳性并不能鉴别是因为结核分枝杆菌复合群感染还是接触环境中非结核分枝杆菌或卡介苗接种后造成的致敏。PPD皮试诊断的特异性差,用该方法进行结核病流行病学调查获得的结核分支杆菌感染率并不能真正反映人群中结核分支杆菌感染的实际状况。重症肺结核病人则往往因为机体免疫力低下而呈现阴性结果等情形,都大大降低了其临床价值[14]。另外,近年来发展起来的分子诊断技术如PCR、PCR-RFLP、real-time PCR以及基因芯片技术,大多数需要数小时才可以得到结果,且这些技术需要昂贵的仪器,存在假阳性和假阴性的问题,对实验室硬件和检测人员素质要求较高,故非常不适用于现场的快速检验、早期排查和诊断[4, 15, 16]。 时间分辨荧光分析法(time resolved fluoroimmunoassay, TRFIA)是近十年发展起来的一种微量分析方法,是目前最灵敏的微量分析技术,灵敏度完全可与放射免疫分析技术相媲美,甚至超过放射免疫分析的水平。时间分辨荧光分析法实际上是在荧光免疫分析(fluorescent immunoassay, FIA)的基础上发展起来的一种特殊的荧光分析。在通常的荧光分析中,由于测试样品中含有多种荧光成分,背景荧光(来自胶体颗粒和溶剂分子引起的散射光、血清蛋白质和其他化合物发出的非特异性荧光)强度大,干扰强,成为荧光分析法大范围推广使用的瓶颈。时间分辨荧光免疫分析法可以有效的解决这一难题。它的基本原理用镧系金属离子(如Eu3+、Sm3+、Tb3+、Dy3+)作为示踪物标记蛋白质、多肽、激素、抗体、核酸探针或生物活性细胞,镧系元素作为示踪剂有以下特点:①荧光物质激发光谱曲线的最大吸收波长和发射光谱的最大发射波长之间的差,称为Stokes位移。普通荧光物质荧光光谱的Stokes位移只有几十纳米,激发光谱和发射光谱通常有部分重叠,互相干扰严重。镧系元素Stokes位移达200nm,很容易分辨激发光和发射光,从而排除激发光干扰;②镧系元素与普通的荧光团比较,镧系元素离子螯合物荧光的衰变时间长,为传统荧光的103~106倍,镧系元素的荧光半衰期介于10~1 000μs之间。这样,用时间分辨荧光仪测量镧系元素的荧光时,在脉冲光源激发之后,可以适当的延迟一段时间,待血清、容器、样品管和其他成分的短半衰期荧光衰变后再测量,这时就只存镧系元素标记物的特异性荧光。通过时间延迟和波长分辨,极大地降低了本底荧光。待反应 (如抗原抗体免疫反应、 3
生物素亲和素反应、核酸探针杂交反应、靶细胞与效应细胞的杀伤反应等)发生反应后,用时间分辨荧光仪测定最后产物中的荧光强度,即可推测反应体系中分析物的浓度,达到定量分析的目的。TRFIA具有以下优点:①灵敏度高,检测下限为1pmol,达到或超过放射免疫分析水平;②线性范围宽,可达6个数量级,远远宽于ELISA的线性范围,也超过化学的线性范围;③不受样品中自然荧光干扰,背景低;④可多重标记(如两种不同的抗原可分别用Eu3+、Sm3+标记),一个试剂盒能够同时检测出两种或两种以上的项目;⑤操作简便、易自动化,标记物制备简便且稳定,无放射性污染。由于TRFIA技术集酶标记、同位素标记技术的优点于一身,同时又克服了它们的局限。因此,TRFIA是一种公认的继RIA、EIA之后最有发展前途、值得推广的非放射免疫标记技术,目前已经成为基础医学研究和临床治疗监测等方面的重要手段[17-19]。 近年来,人们对结核分枝杆菌培养的滤液进行了深入的研究,分离出了多种分泌蛋白,如MPT64、PT70、MPT63、MPT53、Ag85、CPF10和ESAT6[20]。其中,结核杆菌培养滤液蛋白10(culture filtrate protein 10, CFP10) 和早期分泌性抗原靶6(early secretory antigenic target-6, ESAT6)为结核分枝杆菌和牛结核分枝杆菌所特有,卡介苗(BCG)及非致病分枝杆菌缺乏。CFP10与ESAT6同属于ESAT6家族,且由同一操纵子调控,产生的蛋白能诱导机体产生强烈的免疫应答[21-24]。ESAT6分子量很小,仅6KD,难于用双抗夹心法进行检测。本研究采用时间分辨荧光免疫分析双抗夹心技术,建立了定量检测CFP10的方法,初步临床试验结果表明,CFP10用于结核患者血清检测敏感性较低,但用于结核性胸腔积液的诊断敏感性在80%以上,特异性达100%,是一个非常有开发潜力的结核病新型诊断试剂盒,可以有效地鉴别诊断结核性、癌性和其他感染性胸腔积液。
参考文献: [1] Miller TL, McNabb SJ, Hilsenrath P, et al. Personal and societal health quality lost to tuberculosis. PLoS ONE. 2009. 4(4): e5080. [2] Otero L, Krapp F, Tomatis C, et al. High prevalence of primary multidrug resistant tuberculosis in persons with no known risk factors. PLoS One. 2011. 6(10): e26276. [3] Luncă C, Enache E, Olaru SP, et al. Monitoring of Mycobacterium tuberculosis infections in Iasi County in 2009. Rev Med Chir Soc Med Nat Iasi. 2011 Jul-Sep;115(3):718-22. [4] Asiimwe BB, Joloba ML, Ghebremichael S,et al. DNA restriction fragment length polymorphism analysis of Mycobacterium tuberculosis isolates from HIV-seropositive and 4
HIV-seronegative patients in Kampala, Uganda. BMC Infect Dis. 2009. 9: 12. [5] 黄禹吉. 结核病现状及控制策略. 应用预防医学. 2008. 14(2): 1-4. [6] 郭凌, 范立东. 结核病发病率回升因素调查分析. 中国卫生检验杂志. 2008. 18(7): 1414-33. [7] 甄新安, 苏振修, 刘占峰, 等. 结核并艾滋病病毒感染患者的治疗管理效果分析. 临床荟萃. 2011. 26(17): 1514-15. [8] 董海燕, 张建中, 万康林, 等. 结核分枝杆菌毒力相关因子研究进展. 医学研究杂志. 2011. 40(6): 157-60. [9] 侯史文, 方宏安, 宋秀兰,等. 结核分枝杆菌培养及初始耐药监测. 浙江临床医学. 2008. 10(4): 552. [10] Sun JR, Lee SY, Perng CL, et al. Detecting Mycobacterium tuberculosis in Bactec MGIT 960 Cultures by Inhouse IS6110-based PCR Assay in Routine Clinical Practice. J Formos Med Assoc. 2009. 108(2):119-25. [11] Lagrange PH, Simonney N, Herrmann JL. New immunological tests in the diagnosis of tuberculosis. Rev Mal Respir. 2007. 24(4): 453-72. [12] Nicol MP, Pienaar D, Wood K, et al. Enzyme-linked immunospot assay responses to early secretory antigenic target 6, culture filtrate protein 10, and purified protein derivative among children with tuberculosis: implications for diagnosis and monitoring of therapy. Clin Infect Dis. 2005. 40(9):1301-8. [13] 王易伟. 结核分枝杆菌胶体金法快速鉴别试剂盒的临床应用观察. 中国防痨杂志. 2008. 30(5): 468-9. [14] 吴福玲, 马连美, 马永红. 1992—2005年PPD皮肤试验结果分析. 中国医院统计. 14(1): 22-4. [15] Van Soolingen D, Kremer K. Findings and ongoing research in the molecular epidemiology of tuberculosis. Kekkaku. 2009. 84(2):83-9. [16] Domínguez J, Blanco S, Lacoma A,et al. Utility of molecular biology in the microbiological diagnosis of mycobacterial infections. Enferm Infecc Microbiol Clin. 2008 Jul;26 Suppl 9:33-41. [17] Aceti A, Pennica A, Celestino D, et al. A new serological technique, time-resolved fluoroimmunoassay (TRFIA), for the immunological diagnosis of urinary schistosomiasis. Trans R Soc Trop Med Hyg. 1988. 82(3):445-7.
