吡仑帕奈片Perampanel Tablets详细说明书与重点
一种吡仑帕奈冻干口崩片及其制备方法[发明专利]
![一种吡仑帕奈冻干口崩片及其制备方法[发明专利]](https://img.taocdn.com/s3/m/e307bfef5122aaea998fcc22bcd126fff7055dbb.png)
(10)申请公布号(43)申请公布日 (21)申请号 201310692519.6(22)申请日 2013.12.12A61K 9/20(2006.01)A61K 47/26(2006.01)A61K 31/444(2006.01)A61P 25/08(2006.01)(71)申请人北京星昊医药股份有限公司地址100176 北京市大兴区北京经济技术开发区中和街18号(72)发明人张寒 颜克序 修勇(54)发明名称一种吡仑帕奈冻干口崩片及其制备方法(57)摘要本发明涉及一种吡仑帕奈冻干口崩片及其制备方法,该吡仑帕奈冻干口崩片包括:骨架支撑剂1~20重量份,粘合剂1~50重量份,冻干保护剂0.1~8重量份,吡仑帕奈2~12重量份。
本发明的吡仑帕奈冻干口崩片便于患者服用,提高了癫痫病人服药的顺应性,且其制备方法简单,用时短。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书6页(10)申请公布号CN 104706604 A (43)申请公布日2015.06.17C N 104706604A1/1页1.一种吡仑帕奈冻干口崩片主要由吡仑帕奈和基质组成,其特征在于,该冻干口崩片基质包括:骨架支撑剂1~20重量份,粘合剂1~50重量份,冻干保护剂0.1~8重量份;有效成分:吡仑帕奈2~12重量份。
2.如权利要求1所述的冻干口崩片,其特征在于吡仑帕奈的粒径小于等于10μm 。
3.如权利要求1所述的冻干口崩片,其特征在于骨架支撑剂选自:甘露醇、木糖醇、海藻糖中的一种或多种。
4.如权利要求1所述的冻干口崩片,其特征在于粘合剂选自:明胶、水解明胶中的一种或两种。
5.如权利要求1所述的冻干口崩片,其特征在于冻干保护剂为右旋糖酐。
6.如权利要求1所述的冻干口崩片,其特征在于吡仑帕奈的含量为:2mg 、4mg 、6mg 、8mg 、10mg 、12mg 中的任意一种。
7.如权利要求1~6任一项所述的冻干口崩片,其特征在于该冻干口崩片还含有矫味剂0~0.08重量份,矫味剂选自:三氯蔗糖、阿斯巴甜、香精中的一种或多种。
药物Perampanel(吡仑帕奈)合成检索总结报告
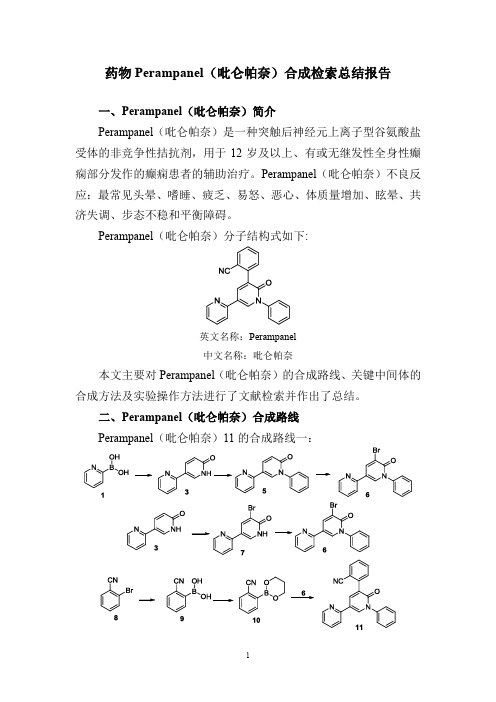
药物Perampanel(吡仑帕奈)合成检索总结报告
一、Perampanel(吡仑帕奈)简介
Perampanel(吡仑帕奈)是一种突触后神经元上离子型谷氨酸盐受体的非竞争性拮抗剂,用于12岁及以上、有或无继发性全身性癫痫部分发作的癫痫患者的辅助治疗。
Perampanel(吡仑帕奈)不良反应:最常见头晕、嗜睡、疲乏、易怒、恶心、体质量增加、眩晕、共济失调、步态不稳和平衡障碍。
Perampanel(吡仑帕奈)分子结构式如下:
英文名称:Perampanel
中文名称:吡仑帕奈
本文主要对Perampanel(吡仑帕奈)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、Perampanel(吡仑帕奈)合成路线
Perampanel(吡仑帕奈)11的合成路线一:
Perampanel(吡仑帕奈)11的合成路线二:Perampanel(吡仑帕奈)11的合成路线三:Perampanel(吡仑帕奈)11的合成路线四:
三、Perampanel(吡仑帕奈)合成检索总结报告(一) Perampanel(吡仑帕奈)中间体3的合成
(二) Perampanel(吡仑帕奈)中间体5的合成方法一
(三) Perampanel(吡仑帕奈)中间体5的合成方法二
(四) Perampanel(吡仑帕奈)中间体6的合成方法一。
吡哌酸片使用说明书

吡哌酸片使用说明书请仔细阅读说明书并在医师指导下使用吡哌酸片使用说明书【药品名称】通用名称:吡哌酸片英文名称:Pipemidic Acid Tablets汉语拼音:Bipaisuan Pian【成份】本品主要成份为:吡哌酸【性状】本品为淡黄色片。
【适应症】用于敏感菌革兰阴性杆菌所致的尿路感染、细菌性肠道感染。
【规格】(1)0.25g(2)0.5g【用法用量】口服成人一次0.5g一日1~2g。
【不良反应】本品毒性较低,不良反应主要为恶心、嗳气、上腹不适、食欲减退、稀便或便秘等胃肠道反应,皮疹或全身瘙痒少见;偶见眩晕、头痛、血清氨基转移酶一过性升高等。
上述不良反应均属轻微,停药后可自行恢复。
【禁忌】禁用于对本品和萘啶酸过敏的患者。
【注意事项】1.本品可与饮食同服,以减少胃肠道反应。
2.长期应用,宜定期监测血常规和肝、肾功能。
3.患中枢神经系统疾病者,如癫痫或癫痫病史者避免应用,确有指征应用时,宜在严密观察下慎用。
4.严重肝、肾功能减退者慎用。
【孕妇及哺乳期妇女用药】动物实验显示本品可抑制幼龄动物软骨发育。
孕妇、哺乳期妇女不宜应用。
【儿童用药】本品在婴幼儿及18岁以下青少年的安全性尚未确立。
但本品用于数种幼龄动物时,可引起关节病变。
因此不宜用于18岁以下小儿及青少年。
【老年用药】老年患者宜根据肾功能调整给药剂量。
【药物相互作用】1.丙磺舒可抑制本品的肾小管分泌,合用时后者血药浓度升高,半衰期延长。
2.本品可减少咖啡因自肝脏清除,使后者半衰期延长,需避免合用,或监测咖啡因血药浓度。
3.本品可显著降低茶碱的清除,致后者血药浓度升高,易于发生毒性反应,两者不宜合用,如需合用应监测茶碱浓度并调整给药剂量。
4.与庆大霉素、羧苄西林、青霉素等常具协同作用。
【药理毒理】本品为喹诺酮类抗菌药,通过作用于细菌DNA旋转酶,干扰细菌DNA的合成,从而导致细菌死亡。
对革兰阴性杆菌,如大肠埃希菌、肺炎克雷伯菌、产气肠杆菌、奇异变形杆菌、沙雷菌属、伤寒沙门菌、志贺菌属、铜绿假单胞菌等具抗菌作用。
盐酸丙哌维林片-详细说明书与重点

盐酸丙哌维林片英文名称: Propiverine Hydrochloride Tablets商品名称: 培宁【成分】本品主要成份为盐酸丙哌维林,化学名为1-甲基-4-哌啶基二苯基丙氧乙酸酯盐酸盐。
【性状】本品为白色片。
【适应症】解痉药物。
用于治疗合并有急(紧)迫性尿失禁、尿急、尿频等症状的膀胱过度活动症(OAB)。
【规格】10mg/片【用法用量】口服。
成人一般每日一次,每次20mg(2片),饭后服用。
每日最高服用量不得超过40mg。
【不良反应】(1)严重的不良反应①本药的不良反应A.青光眼急性发作:偶见眼内压增高,引起青光眼急性发作,眼痛、视力低下并伴有恶心、头痛,应注意观察。
出现以上症状要及时停药,给以适当处置。
B.尿闭:有时可引起尿闭,应注意观察,及时停药并给以适当处置。
C.麻痹性肠梗阻:偶见麻痹性肠梗阻,注意观察,出现明显便秘、腹部胀满应停药,进行适当处置。
D.幻觉、谵妄:偶引起幻觉、谵妄,注意观察,并及时停药。
②类似药的不良反应房室传导阻滞、室性心动过速:服用类似药盐酸双苯丁胺,有引起心动过缓、QT间期延长、房室传导阻滞的报导。
(2)其它不良反应①过敏反应:偶有瘙痒,荨麻疹、药疹发生,注意及时停药。
②循环系统:有时可引起心悸、偶见心动过缓、心律不齐、胸部不适,应注意观察,若发现异常,及时停药,并进行适当处理。
③神经系统:有时可引起眩晕、头痛、困倦、麻木等症状。
此外,偶见帕金森氏症的下肢僵直,小碎步行走,以及振颤等症状,若发现,应停药,进行适当处理。
④泌尿系统:有时可引起排尿困难、无尿意、尿液残留等现象。
⑤眼:有时可引起眼调节障碍。
⑥消化系统:口渴,有时可引起便秘、腹痛、恶心、腹泻、消化不良、呕吐、食欲不振。
⑦肝脏:有时可引起AST、ALT、ALP值升高。
⑧肾脏:有时可引起BUN、Cr值升高。
⑨血液:有时可引起白细胞减少。
⑩其他:有时可引起浮肿、倦怠、无力、腰痛、声音嘶哑、痰液粘稠。
【禁忌】(1)尿潴留、胃潴留、肠梗阻、未能控制的闭角型青光眼患者禁用。
新型抗癫痫药物吡仑帕奈相关问题解答

新型抗癫痫药物吡仑帕奈相关问题解答吡仑帕奈(perampanel)是由卫材制药公司(EISAIINC)开发的世界首例非竞争性α-氨基-3-羟基-5-甲基异恶唑-4-丙酸(AMPA)受体拮抗药,2012年7月和10月分别被欧洲药品监管局(EMA)和美国食品药品监督管理局(FDA)批准,用于对12岁及以上、伴有或不伴有继发性全身大发作的部分发作癫痫患者进行辅助治疗。
2015年6月22日,卫材公司宣布,美国FDA已批准扩大吡仑帕奈水合物(fycompa)的适应证,作为12岁及以上癫痫患者原发性全面强直-阵挛癫痫发作的辅助治疗用药。
吡仑帕奈为AMPA受体拮抗药,通过抑制突触后AMPA受体谷氨酸活性,减少神经元过度兴奋而发挥抗癫痫作用,是首个经FDA批准的AMPA受体拮抗剂类抗癫痫药物。
谷氨酸是中枢神经系统主要的兴奋性递质,涉及一系列过度兴奋的神经系统疾病。
谷氨酸受体分为两类:一类为离子型受体,包括N-甲基-D-天冬氨酸受体(NMDAR)、海人藻酸受体(KAR)和α-氨基-3羟基-5甲基4-异恶哇受体(AMPAR),它们与离子通道偶联,形成受体通道复合物,介导快信号传递;另一类属于代谢型受体(mGluRs),它与膜内G-蛋白偶联,这些受体被激活后通过G-蛋白效应酶、脑内第二信使等组成的信号转导系统起作用,产生较缓慢的生理反应。
吡仑帕奈的半衰期长达106小时,因此可每日服用一次,其中酶诱导剂可减少吡仑帕奈血浆浓度,降低其效力。
一项多中心的随机双盲安慰剂对照临床Ⅲ期试验已证实,吡仑帕奈作为辅助治疗可将局灶性癫痫发作减少23.3%~27.2%。
另一项临床Ⅲ期试验显示,吡仑帕奈可将全面强直-阵挛发作减少76.5%(安慰剂组为38.4%,P<0.0001),另外吡仑帕奈组患者13周无发作的比率为30.9%,远大于安慰剂组的12.3%。
口服吡仑帕奈后,药物迅速完全吸收,食物不会影响药物的吸收程度但会减慢吸收速度。
吡贝地尔缓释片(泰舒达)中文说明书

毗贝地尔缓释片(泰舒达)中文说明书毗贝地尔缓释片泰舒达PiribedilSustained-releaseTabletsPibeidi ,erHuanshipian【成分】化学名称为:I 此贝地尔[(亚甲二氯基-3,4节基)-4哌嗪基-l ]-2喀咤。
化学结构式:分子式:Ci 6Hi 8N 4O 2分子量:298.3【适应症】用于帕金森病的治疗:•可作为单药治疗:•或与左旋多巴联合用药。
【规格】50mg【用法用量】L 帕金森病的治疗•作为单药治疗:每日15Omg 到250mg,即每日3到5片,分3到5次服用。
•作为左旋多巴治疗的补充:每日1至U3片(每250mg 左旋多巴大约需50mg 毗贝地尔)。
剂量必须逐渐增加,每三天增加一片。
2 .治疗中止突然中止多巴胺药物给药可能引起神经阻滞剂恶性综合征。
为了避免这一风险,必须逐渐减少毗贝地尔的剂量,直至治疗完全终止。
3 .冲动控制障碍为了避免引起冲动控制障碍的风险,建议处方用量为最低有效剂量。
如果出现此类症状,应考虑进行剂量减少或逐渐终止治疗(见[注意事项])。
4 .肾或肝功能衰竭尚未在此类患者群体中对毗贝地尔进行研究。
建议在治疗这些患者中谨慎使用。
5 .用法口服。
药片应于进餐结束时用半杯水吞服,不能咀嚼。
或遵医嘱。
【不良反应】在使用毗贝地尔治疗期间已观察到下列不良反应,按以下发生频率排序:非常常见(N1/10),常见(21/100,<1/10),不常见(≥1/1000,<1/100),罕见(21/10000,<1/1000),非常罕见(Vl/10000),未知(无法根据已有数据估计)。
可能出现下列症状:1.胃肠道常见:(恶心、呕吐、胀气),症状可能消失,尤其在剂量进行个体化调整之后(通过逐步的滴定时=式剂量上调,如每周增加50mg,可使肠胃症状明显减少)。
【通用名称】 【商品名称】 【英文名称】 【汉语拼音】2.精神障碍:•常见:精神障碍,如意识混乱,幻觉或激越,这些症状可在停药后消失。
多奈哌齐片说明书

多奈哌齐片说明书【药品名称】通用名称:多奈哌齐片商品名称:_____英文名称:Donepezil Tablets【成份】本品主要成份为多奈哌齐。
【性状】本品为薄膜衣片,除去包衣后显白色或类白色。
【适应症】用于轻度或中度阿尔茨海默病症状的治疗。
【规格】_____mg/片【用法用量】口服。
初始剂量为一次 5mg(1 片),每日一次,睡前服用;至少维持 1 个月,以评价早期的临床反应,及达到稳态血药浓度。
之后可根据治疗效果增加剂量至一次 10mg(2 片),每日一次。
最大推荐剂量为 10mg/日。
大于 10mg/日的剂量未进行过临床研究。
【不良反应】常见的不良反应(发生率≥5%且≥安慰剂组)为腹泻、肌肉痉挛、乏力、恶心、呕吐和失眠。
较少见的不良反应(发生率 1% 5%)有头痛、头晕、精神错乱、幻觉、多汗、腹痛、食欲缺乏等。
需要注意的是,药品不良反应可能因个体差异而有所不同。
如果在用药过程中出现任何不适,应及时就医。
【禁忌】对多奈哌齐、哌啶衍生物或制剂中任何辅料过敏的患者禁用。
【注意事项】1、麻醉时可能会增强琥珀酰胆碱型药物的肌肉松弛作用。
2、病窦综合征或其他室上性心脏传导疾病患者需慎用。
3、有癫痫发作史的患者应慎用。
4、消化性溃疡或有胃肠道出血病史的患者应慎用。
5、中度肝肾功能不全患者应适当调整剂量。
6、应告知患者及家属,服用本药可能会出现困倦,驾驶或操作机器时应谨慎。
【孕妇及哺乳期妇女用药】孕妇使用多奈哌齐的安全性尚未确立,因此孕妇禁用本品。
哺乳期妇女应慎用本品,因为尚不清楚多奈哌齐是否通过乳汁分泌。
【儿童用药】儿童用药的安全性和有效性尚未确立,不推荐儿童使用。
【老年用药】老年患者无需调整剂量。
【药物相互作用】1、与拟胆碱药、β受体阻滞剂等有协同作用,合用时应注意观察。
2、与抗胆碱药、抗组胺药合用时,可能会降低多奈哌齐的药效。
3、与 CYP3A4 和 CYP2D6 同功酶的诱导剂和抑制剂合用时,可能会影响多奈哌齐的血药浓度。
国家药监局关于发布仿制药参比制剂目录(第三十九批)的通告

国家药监局关于发布仿制药参比制剂目录(第三十九
批)的通告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2021.03.01
•【文号】国家药品监督管理局通告2021年第20号
•【施行日期】2021.03.01
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局通告
2021年第20号
国家药监局关于发布仿制药参比制剂目录(第三十九批)的
通告
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十九批)。
特此通告。
附件:仿制药参比制剂目录(第三十九批)
国家药监局
2021年3月1日附件
仿制药参比制剂目录(第三十九批)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吡仑帕奈片Perampanel Tablets汉语拼音:Bi Lun Pa Nai Pian【成份】吡仑帕奈,化学结构式:【分子式】C23H15N3O • 3/4H2O【分子量】362.90(3/4水合物)349.38(无水物)【性状】本品为橙色(2mg规格)或红色(4mg规格)的薄膜衣片,除去包衣后显白色或类白色。
【适应症】成人和12岁及以上儿童癫痫部分性发作患者(伴有或不伴有继发全面性发作)的加用治疗。
【规格】(1)2mg(2)4mg【用法用量】成人和青少年必须按照患者个体应答滴定吡仑帕奈剂量,以优化疗效与耐受性的平衡。
本品应在睡前口服,每日一次。
部分性癫痫发作研究表明,吡仑帕奈4mg/日至12mg/日可有效治疗部分性癫痫发作。
本品治疗起始剂量为2mg/日。
可根据临床应答及耐受性以每次2mg的增量来增加剂量,每次加量间隔至少1周或2周(具体间隔按照下述合并药物半衰期考虑),使维持剂量达到4mg/日至8mg/日。
根据8mg/日剂量时个体临床应答及耐受性情况,剂量最高可增加至12mg/日。
每次加量间隔至少1周或2周(具体间隔按照下述合并药物半衰期考虑),每次增量为2mg。
如患者合并使用的药物不缩短本品的半衰期,则本品每次加量滴定间隔至少2周。
如患者合并使用的药物会缩短本品的半衰期,则间隔至少1周。
停药建议逐步减量至停药使癫滴复发的可能性降到最低。
但是,由于吡仑帕奈的半衰期较长且停药后血浆浓度下降缓慢,因此在必要时可立即停药。
漏服单次漏服:由于此仑帕奈半衰期长,患者应等待至预定时间服用下一次剂量。
如果多次漏服,但持续时间小于5个半衰期(未服用本品代谢诱导性抗癫痫药物的患者为3周,服用本品代谢诱导性抗癫糖药物的患者为1周),应考虑从末次剂量水平起重新开始治疗。
如果患者持续停用本品的时间超过5个半衰期,建议应遵循上文给出的推荐初始剂量重新滴定。
老年人(65岁及以上)此仑帕奈临床研究未纳入足够数量年龄≥65岁的受试者,不能确定该人群对药物的应答是否与年轻受试者不同。
对905名接受本品治疗的老年受试者的安全性信息进行分析(在非癫滴适应症中进行的双盲研究),结果显示无年龄相关的安全性特征差异。
结合本品无年龄相关的暴露差异,分析结果表明老年人无需调整剂量。
考虑到接受多药治疗的患者可能发生药物相互作用,因此本品应慎用于老年患者。
肾脏损害吡仑帕奈用于轻度肾脏损害患者时,不需要调整剂量。
不建议将本品用于中度或重度肾脏损害患者或接受血液透析的患者。
肝脏损害此仑帕奈用于轻度和中度肝脏损害患者时,剂量增加应基于临床应答及耐受性。
对于轻度或中度肝脏损害患者,可按2mg/日剂量开始滴定。
应根据患者耐受性和有效性,以2mg剂量,每2周或更长时间上调滴定剂量。
轻度和中度肝脏损害患者,本品剂量不应超过8mg/日。
不建议用于重度肝脏损害患者。
儿科人群尚未确定吐仑帕奈用于12岁以下儿童的安全性和疗效。
用法每日1次,睡前口服,空腹或与食物同服均可。
本品应整片吞服,切勿咀嚼、压碎或掰开。
由于药片无刻痕,所以本品不能均匀舞开。
【不良反应】全球数据安全性特征总结在对部分性癫痫发作患者进行的所有对照和非对照试验中,1,639名受试者接受了呲仑帕奈治疗,其中1,147名接受了为期6个月的治疗,703名接受了为期12个月以上的治疗。
不良反应导致停药:在部分性癫痫发作的3期对照临床试验中,随机分配到推荐日剂量4mg、8mg和12mg的吡仑帕奈的患者中,不良反应导致停药的发生率分别为1.7%、4.2%和13.7%,安慰剂组患者的发生率为1.4%。
最常见的导致停药的不良反应为头晕和嗜睡(总体吡仑帕奈组的发生率≥1%,高于安慰剂组)。
不良反应列表对吡仑帕奈临床研究的全部安全性数据库的回顾分析,确定了如下不良反应,并根据系统器官分类和频率列于表1。
按照通用的不良反应发生频率标准分类:十分常见(≥1/10)、常见(e1/100且<1/10)、偶见(≥1/1,000且<1/100)。
在每个频率组内,不良反应按严重性降序排列。
表1.对吡仑帕奈临床研究全部安全性数据库的回顾中确定的不良反应儿科人群部分性癫痈发作患者的双育研究中,143名服用吨仑帕奈的青少年临床试验数据库显示,除了比成年人更常出现攻击外,青少年的总体安全性特征与成年人相似。
中国数据335研究是一项双盲、安慰剂对照、平行组研究,评估吡仑帕奈作为加用治疗在难治性部分性癫痫发作受试者中的疗效和安全性。
335研究中的707名受试者,中国(大陆)有185名(26.2%)受试者参与(46名安慰剂受试者,139名吡仑帕奈受试者)。
中国人群中治疗中出现的不良事件(TEAE)、与治疗有关的TEAE、重度TEAE、严重TEAE和导致研究中断或停药的TEAE发生率与总体人群相似。
表2列出了常见的TEAE,即核心研究期间通过安全性分析集的首选术语报告的,总体吡仑帕奈组中发生率≥2%的TEAE。
包括了中国人群的亚组分析和整体分析。
在总体人群中,总体吡仑帕奈组最常报告(≥10%)的TEAE为头晕(31.3%)、嗜睡(17.1%)和鼻咽炎(13.2%),安慰剂组发生率分别为5.7%、13.1%和14.8%。
总体吡仑帕奈组易激惹的发生率为5%或更高,至少为安慰剂组中的2倍。
在中国人群中,总体吡仑帕奈组最常报告(≥10%)的TEAE为头晕(28.8%),而在安慰剂组其发生率则为0%。
中国人群中常见TEAE的发生率与总体人群相似。
表2按首选术语列示的在≥2%的受试者治疗中出现的不良事件(335研究,安全性分析集)百分比是基于相关治疗组中的受试者总人数。
对于每一行的分类,发生该类中2例或更多例TEAE的受试者仅计数一次。
注:仅TEAE发生在总体呲仑帕奈组中≥2%受试者中的PT包含在该表格中。
PT=首选术语,TEAE=治疗中出现的不良事件。
MedDRA:ICH监管活动医学词典【禁忌】对本品的活性成份或乳糖过敏者禁用。
因本品含乳糖,有罕见的遗传性半乳糖不耐受问题、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收不良的患者不应使用本品。
【注意事项】自杀观念曾在因多种适应症接受抗癫摘药治疗的患者中报告自杀观念和行为。
对于抗癫滴药随机、安慰剂对照试验所做的一项荟萃分析也显示,自杀观念和自杀行为的风险有小幅增加。
上述风险产生的机制不详,但是现有数据不能排除使用吡仑帕奈时上述风险增加的可能性。
因此,应对患者进行自杀观念和自杀行为迹象的监测,同时应考虑给予恰当的治疗。
应告知患者(及患者的护理者)如出现自杀观念或自杀行为迹象应就医。
各类神经系统疾病本品可能导致头晕和嗜睡,因此可能影响驾驶或机器操作的能力。
口服避孕药12mg/日剂量的吡仑帕奈可能降低含孕酮的激素避孕药的有效性;在该情况下,使用本品时建议采用其他非激素方法的避孕。
跌倒跌倒风险增加,尤其是老年患者;潜在原因尚不明确。
攻击在患者接受本品治疗过程中有攻击和敌对行为的报告。
临床试验吡仓帕奈治疗组的患者中,攻击、愤怒和易激惹在高剂量组中报告频率更高。
大部分事件为轻度或中度,均自愈或在剂量调整后痊愈。
但在一些患者(在此仑帕奈临床研究中<1%)中观察到伤害他人的想法、人身攻击或威胁行为。
如发现患者情绪或行为模式有明显变化,患者和照料者应立即提醒医疗人员。
如有这些症状出现,本品应减量,如症状加重应立即停止用药。
其他精神疾病症状本品可能导致异常行为、情绪改变、暴力相关症状。
社会环境本品可能导致人身攻击。
滥用可能性对于有药物滥用史的患者应谨慎用药,且应监测此类患者是否有呲仑帕奈滥用的症状。
合并使用CYP3A诱导性抗癫痫药品合并使用CYP3A酶诱导性抗癫痫药物(卡马西平、苯妥英、奥卡西平)的患者增加固定剂量吡仑帕奈后的应答率低于合并使用非酶诱导性抗癫病药物的患者。
从合并使用的非诱导性抗癫痫药物换为酶诱导性药物时应监测患者的疗效,反之亦然。
根据个体临床疗效及耐受性,可每次增加或减少2mg剂量。
其他合并使用的(非抗癫痫)细胞色素P450诱导或抑制性药品添加或去除细胞色素P450诱导剂或抑制剂时,应密切监测患者的耐受性和临床反应,因为吡仑帕奈血浆水平可能降低或升高;本品剂量也需相应调整。
药物反应伴嗜酸粒细胞增多症和全身性症状(DRESS)/多器官超敏反应在接受抗癫痫药物,包括吡仑帕奈治疗的患者中,报告有药物反应伴嗜酸粒细胞增多症和全身性症状(DRESS),也称为多器官超敏反应。
DRESS可能具有致死性或危及生命。
DRESS典型的但不完全的表现为发热,皮疹,淋巴结病,和/或面部肿胀,并伴有其他器官系统受累,如肝炎,肾炎,血液学异常,心肌炎,或肌炎,有时类似于急性病毒性感染。
常表现有嗜酸性粒细胞增多症。
由于该疾病的表现形式多变,其他未在此列出的器官系统也可能累及。
即使皮疹不明显,注意超敏反应的早期表现(如发热或淋巴结病)也是十分重要的。
如果存在这样的征象或症状,应当立刻对患者进行评估。
如果无法确定这些体征或症状是因为另外一种病因,那么应当停用本品。
【孕妇及哺乳期妇女用药】育龄妇女除非明确必要,不推荐本品用于未采取避孕措施的育龄妇女。
妊娠妊娠女性使用吡仑帕奈的数据量有限(少于300个妊娠结局)。
动物研究未显示吡仑帕奈对大鼠或兔有任何致畸作用,但在母体毒性剂量水平下,在大鼠体内观察到胚胎毒性。
不建议在妊娠期间服用本品。
哺乳对哺乳期大鼠的研究表明,吡仑帕奈和/或其代谢产物可分泌至乳汁内。
尚不清楚吡仑帕奈是否分浏至人乳中。
不能排除对新生儿/婴儿的风险。
应评估哺乳对儿童产生的获益及治疗对女性产生的获益,以决定停止哺乳或停止/避免吡仑帕奈治疗。
生育力在大鼠生育力研究中,最大剂量(30mg/kg)下观察到雌性的发情周期延长且不规则;但是,这些变化未影响生育力和早期胚胎发育。
对雄性生育力没有影响。
尚未确立本品对人生育力的影响。
【儿童用药】参见【用法用量】中的“儿科人群”项。
【老年患者用药】参见【用法用量】中的“老年人(65岁及以上)”项。
【药物过量】人体吡仑帕奈过量用药的临床经验有限。
在一份故意过量用药(剂量高达264mg)的报告中,患者发生了以下事件:精神状态改变、激越和攻击行为,最后患者恢复且无后遗症。
对于本品所产生的效应尚无特异性解毒剂。
应给予患者一般的支持护理,包括监测患者生命体征和观察临床状态。
考虑到本品较长的半衰期,本品产生的效应也可能持续较长时间。
由于肾脏清除率较低,因此特殊干预措施(例如强行利尿、透析或血液灌流)意义不大。
【临床试验】全球数据成人和青少年患者的3项19周随机、双盲、安慰剂对照、多中心加用治疗试验中确定了部分性癫病发作治疗药物吡仑的奈的疗效。
受试者存在伴或不伴继发性全面性癫痫发作的部分性癫痫发作,且接受1-3种合并AED的情况下未得到充分控制。
