第五章 重排反应
合集下载
第5章 重排反应(1)PPT课件
5.1.7 Favorskii重排
27
机理?
28
机理?
29
30
类Favorskii重排1:
31
类Favorskii重排2:
32
类Favorskii重排3:
33
5.1.8 Stevens重排
——重排到富电性碳?
34
35
36
Q&A
人人思考,大声说出
37
结束语
感谢参与本课程,也感激大家对我们工作的支持与积极 的参与。课程后会发放课程满意度评估表,如果对我们
课程或者工作有什么建议和意见,也请写在上边
38
最后、感谢您的到来
· 讲师: XXXX
· 时间:202X.XX.XX
39
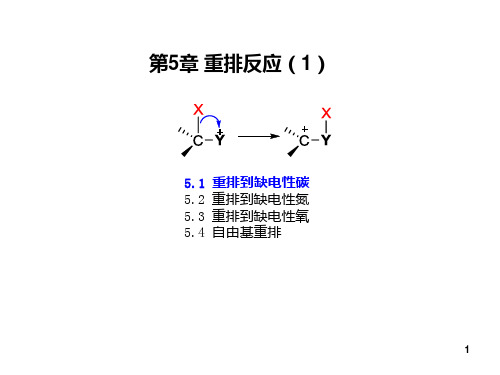
第5章 重排反应(1)
5.1 重排到缺电性碳 5.2 重排到缺电性氮 5.3 重排到缺电性氧 5.4 自由基重排
1
整体概述
概述一
点击此处输入
相关文本内容
概述二
点击此处输入
相关文本内容
概述三
点击此处输入
相关文本内容
2
5.1 重排到缺电子的碳原子上 5.1.1 Wagner-Meerwein 重排
3
StaudingerMeyer reaction
Wolff rearrangement
O
EtO2C
R1
N
Cቤተ መጻሕፍቲ ባይዱ
R2
CO2Et
R2 A
PPh3
R3 H B
R1
N
R3 H
aza-Wittig reaction
Ph3PO
D
R1
CO2Et
R2 N
重排反应 PPT课件

Z C C C
Z C
产物
自由基中迁移基团带着一个电子进 行迁移生成新的自由基
CH3 Ph C CH3 C CH3 C H2 CHO (t-BuO)2 H3C
Ph C CH3 CH2 Ph
CH3 C CH3 H C CH3 CH3
H3C
C H2
Ph
H3C
C H2
Ph
Cl Cl C CH=CH2 Cl
子生成重排消除产物(Ⅲ) 。 从而实现整个反应的完成。
Z C H C
E _ A —Y
Z C H C A:
重排
Z C H C
(Ⅱ)
A
:
Y
(Ⅰ)
Y C H
其中
Z A
Y
_
Z C H C
(Ⅱ)
—H +
C
A
Nu
_
Nu Z C H C A
Z = C、H、X、N、S、O, A = C、N、O。
Z C C A
在上述重排反应中,由于Z 是带着成键电子对(显示亲核性) 向相邻原子 A 上迁移,而A必须是一个缺电子的被进攻的中心, 故亲核重排反应又称为缺电子重排或称1,2-迁移重排。缺电子中 心可以是碳正离子、碳烯、氮烯以及氮正离子等,其中以形成碳 正离子和氮烯缺电子中心最为重要。
亲核重排反应一般都包含着基质分子中的一个基团从碳原子
上迁移到邻近仅有六个价电子的原子上的重排。 其反应过程包括下列三个步骤:
首先是反应基质在亲电试剂的作用下形成缺电子中心 (Ⅰ)
然后是该中心邻位碳原子上的基团带着成键电子对迁移到这 个缺电子中心上而形成新的并且比较稳定的缺电子中心(Ⅱ)
最后与反应体系的负性部分结合生成重排取代产物或失去质
第五章重排的反应

第五章 重排反应
重排反应: 在同一个有机分子中,由于试剂或介质的影响,一个基
团或原子从一个原子迁移到另一个原子上,形成的新分子 中,碳骨架发生了变化(其中氢的迁移不会改变碳骨架),这 种反应称为重排反应。
W
A
BC
D
1
2
3
4
A为迁移起点原子
W
A B C D AB为1,2重排
AC为1,3重排
1
2
3
4 AD为1,4重排
卤代物与此类似:
-Cl
Cl
Cl
Cl
Cl
碳正离子在环上,得缩环产品:
NaNO2/HOAc NH2 HNO2 (HONO)
-N2
碳正离子不在环上,得扩环产品:
CH2NH2 (HONO)
CH2
-N2
H2O
CH2OH
H2O
OH
1ቤተ መጻሕፍቲ ባይዱ形成C+ 形式
(1)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl
CC OH OH
4) 半频哪醇(semipinacol)
R2 R3 R1 C C R4
OH L
L = -X, -NH2,-SPh...
(1) 四取代邻乙二醇的重排 四取代连乙二醇中,如果R相同,反应简单,只得到
一种产物。 如果R不相同,反应复杂,产品取决于连乙二醇的结
构及迁移基团的能力。 X 对称的邻乙二醇的重排
(3) 羟基位于脂环上的连乙二醇的重排 重排时可引起环的扩大或缩小。两个羟基处于a或e
键不同时,产物不同。
OH OH
Ph Ph
H 2SO 4/Et2O r.t. 2 h
重排反应: 在同一个有机分子中,由于试剂或介质的影响,一个基
团或原子从一个原子迁移到另一个原子上,形成的新分子 中,碳骨架发生了变化(其中氢的迁移不会改变碳骨架),这 种反应称为重排反应。
W
A
BC
D
1
2
3
4
A为迁移起点原子
W
A B C D AB为1,2重排
AC为1,3重排
1
2
3
4 AD为1,4重排
卤代物与此类似:
-Cl
Cl
Cl
Cl
Cl
碳正离子在环上,得缩环产品:
NaNO2/HOAc NH2 HNO2 (HONO)
-N2
碳正离子不在环上,得扩环产品:
CH2NH2 (HONO)
CH2
-N2
H2O
CH2OH
H2O
OH
1ቤተ መጻሕፍቲ ባይዱ形成C+ 形式
(1)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl
CC OH OH
4) 半频哪醇(semipinacol)
R2 R3 R1 C C R4
OH L
L = -X, -NH2,-SPh...
(1) 四取代邻乙二醇的重排 四取代连乙二醇中,如果R相同,反应简单,只得到
一种产物。 如果R不相同,反应复杂,产品取决于连乙二醇的结
构及迁移基团的能力。 X 对称的邻乙二醇的重排
(3) 羟基位于脂环上的连乙二醇的重排 重排时可引起环的扩大或缩小。两个羟基处于a或e
键不同时,产物不同。
OH OH
Ph Ph
H 2SO 4/Et2O r.t. 2 h
第五章重排反应(3,4节)-1

烯丙基 HOMO
H[1,3]迁移 同面迁移, 对称性禁阻 异面迁移, 对称性允许
H3C
Ha Ha [1,5]
CH3 Ha Ha [1,5]
CH3 (+) Hb
Bu Hb [1,5]
Bu CH3 (-) Hb Bu
Bu Ha
在光照条件下:
烯丙基 HOMO H
H[1,3]迁移 同面迁移, 来自称性允许[小结]COCH3
三、Fischer吲哚合成法
醛或酮的苯腙和ZnCl2共热时,则 失去一分子氨而得到吲哚的反应称为
Fischer引哚合成法,是合成吲哚衍生
物的重要方法。
R' ZnCl2 N N C R H CH2R' N H + NH3 R
C C C C C C C C C C
1' 2' 3' 4' 5'
1
2
3
4
5
3'
4'
5'
2 1 1' 2' 3
[ 3, 3 ] 迁移
3'
迁移方式: 同面迁移——迁移基团在体系的同侧进行。 异面迁移——迁移基团在体系的两侧进行。
[1,5] A H B C 同面迁移 D A H A D H B C 异面迁移 D H C [1,5] B C A B D
OH CH3
CH3
CH3
二、Cope重排
1,5-二烯类化合物受热时发生[3,3]
键迁移重排,得到另一双烯丙基衍生物
的反应称Cope重排反应。
CH3 H3C COOEt COOEt 185℃ 2h CH3 COOEt COOEt
H3C
第5章 重排反应(2)

第5章 重排反应(2) 5.1 重排到缺电性碳 5.2 重排到缺电性氮 5.3 重排到缺电性氧
迁移到缺电子性的碳原子上
碱性条件下的驱动力:
5.2 重排到缺电子的氧原子上
5.2.1 Hock重排——过氧化氢异丙苯的重排
ቤተ መጻሕፍቲ ባይዱ 迁移能力: H > Ar > R
5.2.2 Baeyer-Villiger氧化
立体化学——构型保持
5.3.5 Lossen 重排
5.3.6 Curtius重排
5.3.7 Schmidt重排
重排到缺电性的氮原子上——总结:
离去基团的存在,N-LG键的极化使得N变成缺电子性。。。
羰基的存在使得酰胺上的质子具有一定的酸性; 羰基容纳电子的性质使得重排反应发生。
写出下列转化的机理:
Lewis酸
离去能力: POCl3 > OH-
5.3.2 Beckmann重排
离去能力: H2O > OH-
当底物是醛肟时,消除生成腈:
Second-order Beckmann rearrangement
5.3.3 Neber重排
-氨基缩酮
-氨基酮
-氨基缩酮
5.3.4 Hoffman降解
迁移能力 :Ar > R
迁移规律与Wagner-Meerwein碳正离子的迁移规律一致
立体化学——构型保持
5.2.3 Dakin氧化
给电子基
无水条件下可得到甲酸酯
当底物为间羟基苯甲醛时,氢优于芳基先迁移: -I
总结——重排到缺电性的氧原子上
5.3 重排到缺电子的氮原子上
5.3.1 Stieglitz重排
迁移到缺电子性的碳原子上
碱性条件下的驱动力:
5.2 重排到缺电子的氧原子上
5.2.1 Hock重排——过氧化氢异丙苯的重排
ቤተ መጻሕፍቲ ባይዱ 迁移能力: H > Ar > R
5.2.2 Baeyer-Villiger氧化
立体化学——构型保持
5.3.5 Lossen 重排
5.3.6 Curtius重排
5.3.7 Schmidt重排
重排到缺电性的氮原子上——总结:
离去基团的存在,N-LG键的极化使得N变成缺电子性。。。
羰基的存在使得酰胺上的质子具有一定的酸性; 羰基容纳电子的性质使得重排反应发生。
写出下列转化的机理:
Lewis酸
离去能力: POCl3 > OH-
5.3.2 Beckmann重排
离去能力: H2O > OH-
当底物是醛肟时,消除生成腈:
Second-order Beckmann rearrangement
5.3.3 Neber重排
-氨基缩酮
-氨基酮
-氨基缩酮
5.3.4 Hoffman降解
迁移能力 :Ar > R
迁移规律与Wagner-Meerwein碳正离子的迁移规律一致
立体化学——构型保持
5.2.3 Dakin氧化
给电子基
无水条件下可得到甲酸酯
当底物为间羟基苯甲醛时,氢优于芳基先迁移: -I
总结——重排到缺电性的氧原子上
5.3 重排到缺电子的氮原子上
5.3.1 Stieglitz重排
第五章 重排反应 5.2

CH2N2
RCOCHN2
aq. HBr
RCOCH2Br
Me
OCH3
Me RCOCH2 Me R O OCH3 N Me OCH3
Me N
OCH3
aq. Na2CO3
Stevens 重排
Br OCH3
1)H3 R OCH3
OCH3 R O OCH3
[H]
2011年10月22日星期六
Me
[3,3]迁移 迁
10
1 2 3
5.4.1 反应机理与立体化学
Claisen重排和 重排和Cope重排的化合物可看作 重排的化合物可看作1,5-二烯系统,其 二烯系统, 重排和 重排的化合物可看作 二烯系统 [3,3] σ键迁移可看作是两个烯丙自由基相互作用的结果,在 键迁移可看作是两个烯丙自由基相互作用的结果, 具有三个π电子的烯丙自由基中 两个电子占据成键轨道ψ 烯丙自由基中, 具有三个π电子的烯丙自由基中,两个电子占据成键轨道ψ1, 另一个占据非成键轨道ψ2。当两个基态烯丙自由基相互作用 另一个占据非成键轨道ψ 占据非成键轨道 无论按类船式和类椅式接近, 时, 即ψ1和 ψ‘1 , ψ2和ψ’2,无论按类船式和类椅式接近, 均是对称允许的。 均是对称允许的。
Y C H
Y C
Y C
Y = N,O,S...... , ,
5.3.1 Stevens 重排
季铵盐在强碱的作用下,先生成内翁盐过渡态, 季铵盐在强碱的作用下,先生成内翁盐过渡态, 然后季氮上的一个烃基重排到邻位的碳负例子上, 然后季氮上的一个烃基重排到邻位的碳负例子上, 生成叔胺的反应,称为Stevens 重排 生成叔胺的反应,称为
2011年10月22日星期六 1
R1 R2 N CH2 Z R3
重排反应 PPT

R1 R3
H
R2 C C R4
OH OH
R1 R2 C C R4
R3 O
二、频纳醇重排(Pinacol)
机理:
RR R C C R H+
OHOH
RR RCCR
OH
R RCCR
OHR
R R CCR
OHR
R -H+
RCCR OR
二、频纳醇重排(Pinacol)
1 四取代乙二醇 (a)四个取代基相同,重排反应简单、单一产物
(b)含-NH2,重氮化放 氮
( C H 3 ) 3 C - C H 3 N H 2 N H a N C O l2( C H 3 ) 3 C - C H 2 N 2 C l - △ N 2( C H 3 ) 3 C - C H 2
一、Wangner-Meerwein重排
(c) -OH, 加 H+ (-H2O)
CH3
HNO2
H 3 C
H 3 CCC H 2 C H 3
H 3 CCC H 2 C H 3 C H 3
H 3 CCC H C H 3 C H 3
Ag+
H3C C CH2Cl H+ CH3
H3CCCH2 CH3
H3C C CH2 CH3
H H3C C CH2
CH3
CH3
H
△
Ph C C OTs
CH3 H
Ph C C O Ts
HH H3C C C Ph
CH3 CH3
CH3CH3
CH3CH3
苯的迁移速度为甲基的3000倍
二、频纳醇重排(Pinacol)
二 Pinacol 邻二醇(或邻二官能团)合成酮的方法
中南大学有机合成--第5章----重排反应

• The Lossen rearrangement is the chemical reaction of a hydroxamic acid 1 with a dehydration agent (such as tosyl chloride) to form the O-derivative 2, which spontaneously rearranges to form an isocyanate 3.
O H N H +
O H 2 + R
R
N
N H 2 O
N
R N H
R R ' R R '
R ' + H 2 O R ' O R '
2021/4/9
15
Beckmann Rearrangement of Oximes under Very Mild Conditions L. De Luca, G. Giacomelli, A. Porcheddu, J. Org. Chem., 2002, 67, 6272-6274
2021/4/9
3
实例
O H P h M e
O HH + H +
O
P h P h M e
O H
P h M e
O H -H + P h
M e
O
O OH
H2SO4
HO
2021/4/9
4
补充:Wagner—Meerwein重排
例1
例2
2021/4/9
5
例3 例4
2021/4/9
6
二、呐咵重排和反呐咵重排(碳正离子)
• 3-氨基-2,3-二甲基-2-丁醇与亚硝酸作用
O H N H +
O H 2 + R
R
N
N H 2 O
N
R N H
R R ' R R '
R ' + H 2 O R ' O R '
2021/4/9
15
Beckmann Rearrangement of Oximes under Very Mild Conditions L. De Luca, G. Giacomelli, A. Porcheddu, J. Org. Chem., 2002, 67, 6272-6274
2021/4/9
3
实例
O H P h M e
O HH + H +
O
P h P h M e
O H
P h M e
O H -H + P h
M e
O
O OH
H2SO4
HO
2021/4/9
4
补充:Wagner—Meerwein重排
例1
例2
2021/4/9
5
例3 例4
2021/4/9
6
二、呐咵重排和反呐咵重排(碳正离子)
• 3-氨基-2,3-二甲基-2-丁醇与亚硝酸作用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(CH3)3C-CH2OH (CH3)3C-CH2=CH2
H+ -H2 O H+
(CH3)3C-CH2 (CH3)3C-CH-CH3
2.迁移基团迁移顺序
OCH3 Cl
>
>
> R3C- > R2CH-
> RCH3- > CH3- > H-
Ag+ H3C C CH2Cl CH3 H3C C C H H3C C CH2
4. Semipinacol重排 凡能生成相同β位碳正离子中间体的叔醇类化合物,均 β 可进行类似的pinacol重排,得到酮类化合物,这类重排称 为Semipinacol重排。
R R C OH R C L R -L R R C OH R C R R C O R C R R
OH Br Cl C Ph OH Cl C Ph CH Ph Cl O C CH Ph Ph CH Ph AgNO2/EtOH r.t.
R1 R4 R2 C R3 C R5 OH H+(-H2O) R1 R4 R2 C C R3 R5
重排
R1 R2
R4 C C R5 R3
H2O(-H ) R1
R2
+
OH C
R4 C R5 R3
何时重排?醇或卤代烃在酸催化下进行亲核取代或消除反 应时、烯烃进行亲电加成反应时发生的重排。
CH3 H3C C CH3 CH2Br AlBr3 -AlBr4 H3C CH3 C CH3 Br -AlBr4 H3C C CH3 CH2CH3 -H H3C H3C C CH3 C CH3 CH CH3 CH2CH3 CH2 1, 2-烷基迁移
RCONH2
O R C NH2
NaOX or X2/NaOH
RNH2
O Br2 RCONHBr OH R C N : Br
OH /H2O R N C O R1OH R1NH2
RNH2 RNHCO2R1 O
RNH
C
NHR1
2. 主要影响因素 ① 酰胺的结构 酰胺真正的重排产物是异氰酸酯,具光学活性的酰胺重排 后并未消旋,仍保持其立体构型。
H3C
CH2 CH2Br
H3C
CH2 CH2
H3C
CH CH3
H3C
CH3
H O CH2OH O CH2 O
H3C H C CH3 OH
O
CH3 C C CH 3 H3C
61%
(H3C)3C
△
(H3C)3 C C H
CH3
(H3C)2 C CH(CH3)2
H3C H3C
CH C H3C
CH2
31%
C H CH2
当溶剂中含有亲核性化合物或溶剂本身为亲核性化合物 (如醇、酚、硫醇、胺或叠氮、偏磷酸酯)时,重排中间体 与其结合得到相应化合物,而不能异构化成酰胺。
OR2 R2OH R2SH R1 C N OH (EtO)3P R R HA 重排 R C N R1 R R2NH2 R R C SR2 C N NHR2 R1 N R1
C N R1 PO(OEt)2 C N R1
③ 酮肟的结构 贝克曼(Beckmann)重排具有立体专一性,与氮上的羟 基处于反位的烃基才发生迁移。因此,在不发生异构化的重 排条件下,从酮肟的结构就能预测其重排主要产物。
O N NBS CH3 Ph Me C NHPh O
O O
N S H2SO4/NaN3/CHCl3 0~50℃ N OH O O
N
S
N H
O
O CH3 H2NOH
HO N CH3 H
O NH CH3
但芳醛肟在不同的反应条件下可得到芳酰胺或苯晴。
O ZnCl2 MW, 20min, 140℃ PhCH=NOH AlCl3/MeCN PhCN Ph C NH2
二、Hofmann重排 氮上无取代基的酰胺用卤素(溴或氯)及碱处理,脱羧 生成伯胺的反应称Hofmann重排,又称Hofmann降解反应。 1. 通式: 机理:
HO
CH2NH2 HNO3
HO CH2 O
三、二苯基乙二酮-二苯基乙醇酸型重排 1. 通式:
O Ar C O C Ar OH O KOH
△
Ar
C Ar
C
OK
机理:
O Ar C O C Ar
O OH Ar C
O C Ar OH 慢
O Ar C Ar
O C OH Ar
OH O C Ar C O
该重排是制备二芳基乙醇酸的常用方法,所用原料-芳二 酮是由芳醛经安息香缩合,并进一步氧化制备。
NBS/CH3COOAg/DMF CONH2 C11H23COCH3 r.t.
NaOBr H2O
C
O
H NaOBr PhHC C CONH2 H2O
O PhHC C H CONH2 PhH2C
OH OH
R R C CH R2 R1SO2Cl R
R C CH R2 B
OH OH R R C O CH R2 -R1SO2O
OH OSO2R1
R
C O
CH R
R2
OSO2R1
3. 羟基位于脂环上的邻二叔醇重排 羟基位于脂环上的邻二叔醇化合物在酸或Lewis酸的催化 下发生重排,生成三类酮:即扩环脂肪酮、螺环酮或与骨 架结构相对应的酮。
HO N Lewis酸 CHMe 2
Me
若酮肟结构中含有酸敏感基团时,可选用酰氯、吡啶 (或三乙胺)或Lewis酸催化剂进行下列重排。
Me O Me O N OH
CH3SO2Cl/Et3N
Me O
H N O
BF3-Et2O/Cl2CHCHCl2 Me 110℃
O
② 溶剂 重排反应中的溶剂,在反应过程中既起到反应介质的作 用,也起催化剂的作用,其催化作用与溶剂的质子亲和力呈 正相关。在极性质子性溶剂中,若用质子酸催化,常使不对 称肟发生异构化,重排后得酰胺混合物。
O 2ArCHO NaCN/EtOH/H2O pH7~8, Ar C OH [O] CH Ar Ar C C Ar O O
2. 影响因素 ① 碱:主要是无机碱醇溶液,若用有机碱(如醇钠或钾) 易得酯。
OH O Ar C Ar C OR
若用醇盐需满足两个条件 a、羟基α位不宜有氢原子,以避免该醇盐提供氧负离子将 芳基乙二酮还原成α-羟基酮类。
O Ar C O C Ar R2CH O R2C=O Ar O C O CH Ar
b、不能使用酚盐(ArOM),因为其碱性不足以使α-芳二 酮发生重排。
② α-二酮的结构 a、对称芳基乙二酮进行重排,产品比较单一。
H3CO OCH3 C O C O KOH/EtOH/H2O OCH3 OH C COOH OCH3
CONH2 NaOCl H3C N O H3C
磺胺类药磺胺甲恶唑中间体
NH2
N O
NOH
H2SO4
NH O
抗高血压药胍乙啶中间体
第一节
从碳原子到碳原子的重排
一、Wagner-Meerwein重排 Wagner-Meerwein重排:在质子酸或Lewis酸催化下生成的 碳正离子中,烷基、芳基或氢从一个原子通过过度态,迁 移至相邻带正电荷碳原子的反应称。
(H3C)3C
3%
H3C OH C A H3CO B D NH2 NaNO2/HOAc H3CO H
A
B
H
CH2 CH3 TsOH CH3 H 3C C 6H 6
CH3 CH3 H 3C CH3 H 3C
H 3C
CH3
H 3C
二、Pinacol重排(邻二醇合成酮的方法) 通式: R R R H+ R C C R R C C R O R OH OH 机理:
CH3 CH3 Ph C C Ph PPSE >80℃ OH OH H3C C O 主
CH3 C Ph Ph Ph C O
CH3 C CH3 次 Ph
(c)不对称的邻二叔醇重排 碳正离子的稳定性:叔碳>仲碳>伯碳。
CH3 Ph H3 C C C Ph H -H2O OH OH H3 C
CH3 Ph C OH CH3 Ph H3 C C C OH Ph C Ph -H H3C
O C
Ph C CH3 Ph
Ph MeO
2
C
C
Ph
H2SO4
MeO
2
C
C
Ph
OH OH
Ph O
2. 三取代邻二叔醇重排 三取代邻二叔醇在酸性条件下重排时,叔羟基先质子化 后离去,仲碳上所连的氢原子或基团发生迁移。
Ph Ph CH C CH3 HCl(g) 25℃, 3h Ph C O C H CH3 (90%) Ph
R1 C N OH R HA 重排 R C N OH R1 H2O -H R C N R1 R O C NHR1
2. 主要影响因素 ① 催化剂 酮肟重排常用的催化剂有:质子酸、Lewis酸、氯化剂或 酰氯等,它们的作用是使肟羟基转变成活性离去基团,以利 于氮-氧键的断裂。
O NH CHMe 2 质子酸 Me Me O NH CHMe2 Me NH O CHMe2
1.形成C+ 形式 (a)卤代烃 Ag+
(CH3)3C-CH2Cl
AlCl3
Ag (AgNO3)
(CH3)3C-CH2+AgCl
(b)含-NH2,重氮化放氮
(CH3)3C-CH3NH2
NaNO2 HCl
(CH3)3C-CH2N2Cl
-N2
△
(CH3)3C-CH2
(c)-OH, 加 H+ (-H2O)
O O SeO2
Z
HO HOOC
