结直肠癌肝转移外科治疗争议与共识
结直肠癌肝转移的局部治疗选择

结直肠癌肝转移的局部治疗选择引言对于结直肠癌肝转移来说,肿瘤的生物学行为非常重要,其次则是患者的治疗选择。
治疗选择包括两方面,一方面是围手术期综合治疗,另一方面是局部治疗。
今天的分享主要包括以下三部分内容:局部治疗的发展与变迁;不同局部治疗方法的作用;如何选择不同的局部治疗法律。
一、局部治疗的发展与变迁局部治疗的方法包括外科切除(肝切除、肝移植)、消融(冷/热消融)、立体定向放疗(SBRT)、肝动脉灌注化疗(HAI)。
需要说明一点的是,尽管HAI是一种局部治疗手段,但往往达不到上述手段的根治性效果,因此不在本次讨论的范畴中。
整个局部治疗的发展,和治疗认识的进步是密切相关的。
随着结直肠癌生物学行为认识的深入,我们在不断反思,肝转移到底是一种全身性疾病,还是一种限局性疾病,这是值得讨论的。
临床中见到大部分患者病变仅仅局限于肝脏,并非全身广泛的转移,并可以通过局部治疗取得良好的效果。
也因此,在不断地实践中,大家对局部治疗的态度变得越来越积极。
此外,随着新的局部治疗手段不断涌现,局部治疗选择面临个体化的问题。
△CRLM局部治疗的变迁在1986年瑞典学者提出的可切除肝转移的标准下,符合可切除的比例不足10%;直到2005年John Hopkins的研究发现,只需要保留1mm 切缘患者就能够得到生存获益,按照这一R0手术标准,可切除的比例提高到20%;其后随着化疗与靶向药物的发展,转化治疗的有效性明显增加,再一次提高了手术切除率;近年来随着外科理念进一步更新,在原有R0手术的基础上,接纳了R1手术给部分患者带来生存获益的理念,并且在手术基础上联合了消融、SBRT等局部治疗手段,不断地提高可局部治疗患者比例至50%左右。
取得进步的同时往往也伴随着更多的疑惑,是不是诸多局部治疗手段的疗效一样?是不是诸多局部治疗手段的适应症没有差别?临床上如何选择这些局部治疗手段?每种局部治疗手段的最佳应用的时机是什么?下面先从不同局部治疗手段谈起。
2020版:中国结直肠癌肝转移诊断和综合治疗指南(最全版)

2020版:中国结直肠癌肝转移诊断和综合治疗指南(最全版)中国结直肠癌肝转移诊断和综合治疗指南(最全版)关键词:结直肠肿瘤;肝转移;诊断;综合治疗;指南肝转移是结直肠癌治疗的难点之一,其中80%~90%的患者无法获得根治性切除。
肝转移是结直肠癌患者最主要的死亡原因,未经治疗的患者中位生存时间仅为6.9个月。
然而,肝转移灶能完全切除的患者的中位生存时间为35.0个月,5年生存率可达30%~57%。
因此,制订个性化治疗目标,开展相应综合治疗,可以预防结直肠癌肝转移的发生,并提高肝转移灶手术切除率和5年生存率。
为提高我国结直肠癌肝转移的诊断和综合治疗水平,中华医学会外科学分会胃肠外科学组和结直肠外科学组、XXX自2008年开始联合编写《结直肠癌肝转移诊断和综合治疗指南》。
该指南于2010、2013年进行修订,2016年修订后进一步与XXX、XXX结直肠肿瘤专业委员会、XXX肿瘤转移委员会联合共同修订。
2020年再与XXX结直肠肿瘤学组、XXX 等联合,总结国内外先进经验和最新进展修订《中国结直肠癌肝转移诊断和综合治疗指南(2020版)》。
该指南提出了诊断、预防、外科手术和其他综合治疗的建议,各地医院应根据实际情况予以应用。
推荐级别、循证医学证据分类的界定详见附录1.1.结直肠癌肝转移的诊断与随访1.1结直肠癌肝转移的定义根据国际共识,同时性肝转移是指在结直肠癌确诊前或确诊时发现的肝转移,而结直肠癌根治术后发生的肝转移则称为异时性肝转移。
本指南将分别阐述这两种情况以便于诊断和治疗策略的制订。
1.2结直肠癌确诊时合并肝转移的诊断常规对已确诊结直肠癌的患者,除了进行血清CEA、CA19-9等肿瘤标志物检查和病理学分期评估外,还应常规进行肝脏超声和腹部增强CT等影像学检查,以筛查和诊断肝脏转移瘤。
如果超声或CT影像学检查高度怀疑但不能确诊,可以加行血清AFP、肝脏超声造影和肝脏MRI平扫及增强扫描检查。
在病情需要时,可以进行肝脏细胞特异性造影剂增强MRI检查。
CSCO同时性转移性结肠癌的治疗主要内容
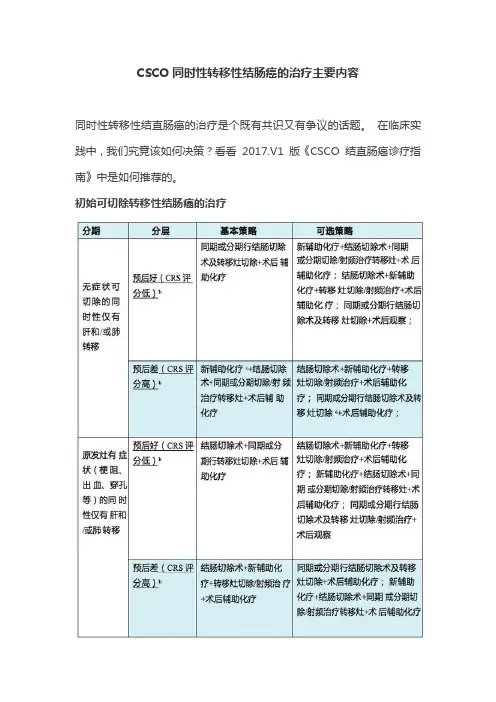
CSCO同时性转移性结肠癌的治疗主要内容同时性转移性结直肠癌的治疗是个既有共识又有争议的话题。
在临床实践中,我们究竟该如何决策?看看2017.V1 版《CSCO 结直肠癌诊疗指南》中是如何推荐的。
初始可切除转移性结肠癌的治疗注:(1)复发风险评分(CRS)的五个参数:原发肿瘤淋巴结状态,无病生存时间,肝转移肿瘤数目>1 个,术前CEA 水平>200 ng/ml 和转移肿瘤最大直径>5 cm,每个项目为1 分。
如果CRS 评分越高,围手术期化疗越有获益。
如肝脏转移灶数目大于5 个,请参见初始不可切除结肠癌部分。
(2)新辅助化疗可减小术前肿瘤的体积及降低体内微小转移的发生,可提高手术根治性切除率。
为了限制药物性肝损害发生, 新辅助化疗的疗程一般限于2~3 个月。
新辅助化疗方案根据患者个体情况可选择奥沙利铂为基础的方案(FOLFOX/CapeOx)或伊立替康为基础的方案(FOLFIRI)。
初始不可切除转移性结肠癌的治疗1. 潜在可切除组的治疗2. 姑息治疗组的一线方案3. 姑息治疗组的二线方案4. 姑息治疗组的三线方案注:(1)对于潜在可切除的患者:应选用5-FU/LV(或卡培他滨)联合奥沙利铂或伊立替康的方案加分子靶向治疗,或高选择性患者可谨慎使用强力的FOLFOXIRI±贝伐珠单抗方案。
转化成功获得原发灶和转移灶R0 切除的患者,一般建议术后继续辅助化疗完成围手术期总共半年的治疗。
(2)转化治疗应密切评估转移灶可切除性,建议每6~8 周行一次影像学评估,如转移灶转变成可切除时,即予以手术治疗。
(3)维持治疗:潜在可切除组如果接受转化治疗超过半年后转移灶仍无法R0 切除,姑息治疗组一线治疗4~6 个月后疾病有效或稳定但仍然没有R0 手术机会者,可考虑进入维持治疗(如采用毒性较低的5-FU/LV 或卡培他滨单药联合靶向治疗[贝伐珠单抗的数据比较完善])或暂停全身系统治疗,以降低持续高强度联合化疗的毒性反应。
2022年结直肠癌肝转移治疗进展(全文)
2022年结直肠癌肝转移治疗进展(全文)结直肠癌肝转移诊疗路径:结直肠癌肝转移(CRLM)是结直肠癌患者最主要的死亡原因:初诊时合并有肝转移的结肠癌和直肠癌患者的中位OS分别为10个月和13个月[3],肝转移患者的预后次于肺转移,但好于其他部位转移[4],详见图1。
对于肝转移病灶无法切除的患者,5年生存率<5%,而肝转移灶完全切除患者的中位生存期为35个月,5年生存率为30%~57%[5]。
以上生存结果提示,为结直肠癌肝转移患者提供正确的诊疗路径,能使患者获得更好的生存获益。
图1.比较结直肠癌单个部位转移病变的OS分析[4]ESMO结直肠癌肝转移治疗策略建议治疗目标应达到“无疾病证据(NED)”状态,治疗原则推荐为全身治疗联合局部治疗[6]。
COLLISION研究组专家共识针对结直肠癌单纯合并有肝转移的患者提出了明确的诊疗路径:①从患者特征出发[7],易于切除/消融的IVa期CRLM以及部分难以切除/消融的IVb期CRLM,推荐根治性切除和/或消融且不需要接受辅助化疗;而对于部分IVb期、全部的IVc期和IVd期CRLM患者,需依据化疗是否获益、早期异时性、肝脏转移病灶数量和大小、残余肝体积以及是否适合肝移植等角度综合判断,选择根治性切除和/或消融,或全身姑息治疗,详见图2。
②从肿瘤特征出发[7],依据肿瘤大小、解剖学位置、手术/消融禁忌选择不同的治疗方法,详见图3。
图2.结直肠癌肝转移可切除性和消融性标准——患者特征[7]图3.结直肠癌肝转移可切除性和消融性标准——肿瘤特征[7]《中国结直肠癌肝转移诊断和综合治疗指南(2020)》[8]建议依据结直肠癌确诊时合并肝转移病灶是否可切除,选择不同治疗方式:①肝转移病灶可切除时,在同步或分阶段切除肝转移病灶的同时,选择对晚期结直肠癌肝转移有效的化疗方案、或肝动脉灌注治疗±全身化疗。
②肝转移病灶不可切除时,通过全身治疗尝试进行转化治疗,当仍不可切除时考虑全身系统治疗。
结直肠癌肝转移的外科治疗

结直肠癌肝转移的外科治疗【摘要】结直肠癌是最常见的恶性肿瘤之一,将近一半会进展为肝转移,治疗方案包括手术治疗、化疗(全身静脉化疗和介入治疗) 和局部治疗(射频消融、激光消融、无水酒精注射和冷冻切除术)、基因治疗等,手术治疗是目前唯一有效的治愈手段,20% ~30% 的结直肠癌肝转移患者能够从手术中获益,5年生存率为36% ~58%。
结直肠癌肝转移患者的治愈率有望获得提高。
【关键词】结直肺癌;肝转移;治疗肝转移占结直肠癌患者初诊病例的15~25% [1],是目前困扰结直肠癌治疗的一大难点和热点。
而手术治疗目前则是结直肠癌及肝转移唯一可能获得治愈希望的治疗手段,切除结直肠癌和肝转移病灶术后5年生存率可达34% ~38%[2]。
但超过85%的初诊患者无法接受手术切除,由于新化疗药物和方案、生物治疗、分子靶向治疗、射频及冷冻凝固等,提高结肠直肠癌肝转移的整体疗效。
结直肠癌肝转移的肝叶切除术是治疗结直肠癌肝转移最主要的手段之一,肝叶切除是对肝转移癌最有效的治疗方法,是获得治愈的首选治疗手段,有文献报道术后5年生存率达36%~45%,手术死亡率在5%以下[3]。
综合分析资料发现,结直肠癌肝转移手术治疗的5年生存率已提高到46% ,可以认为结直肠癌肝转移是可治愈的,肝转移癌切除是安全及最有效的治疗手段。
目前比较认同的结直肠癌肝转移手术切除的选择标准为:①肝转移灶或复发灶为孤立单灶、局限于一叶内或半肝内的多结节灶而未累及门静脉、肝静脉或下腔静脉;②转移癌切除后肝脏能维持正常功能;③全身情况可耐受麻醉和手术,无重要脏器严重功能损害;④原发灶可根治性切除或切除后无局部复发。
大多数认为异时性肝转移癌预后较同时性肝转移癌佳。
手术适应征可适当放宽。
手术切除的方式有解剖性切除和非解剖性切除两种。
基于肝转移癌周围少有卫星癌灶,故多行楔形切除,但须强调应用术中B超检查明确肿瘤的大小个数及分布部位以决定是否选用肝段或肝叶切除。
分析发现在肿瘤复发率以及切除率、生存时间上,解剖性切除组并不优于楔形切除组。
结直肠癌肝转移外科治疗的研究进展分析

结直肠癌肝转移外科治疗的研究进展分析肝脏作为结直肠癌主要转移的器官,受到癌症细胞的严重损害。
目前,治疗结直肠癌肝转移的主要方法为手术治疗方法,通过手术切除治疗能够彻底治愈。
随着医疗技术的不断进步,手术指征范围愈加广泛,通过多学科综合治疗的方案,能够更有效的改善患者的预后情况和提高患者的生存率。
本文主要对结直肠癌肝转移外科治疗的研究进展进行综述和分析。
标签:结直肠癌;肝转移;外科治疗结直肠癌属于全世界范围内的恶性肿瘤之一,具有极高的发病率,近年来我国的结直肠癌发病率正在不断上升。
肝脏是结直肠癌主要转移的部位,据报道25%患者在结直肠癌手术后发生肝转移。
目前,根治结直肠癌的治疗方式是手术切除治疗。
但是手术治疗给患者造成一定的手术创伤,术中出血量较大,对患者的预后情况造成不良的影响。
为了探讨改善手术患者预后的有效方法,本文主要对结直肠癌肝转移外科治疗的研究文献进行总结和分析。
1 结直肠癌肝转移手术适应症与手术时机根据张宇研究,其对57例结直肠癌肝转移患者的临床资料进行回顾性分析,研究发现57例患者中19例同期切除,28例分期切除,4例通过肝动脉结扎加无水乙醇注射,6例通过肝动脉结扎加化学药物治疗泵灌注化疗6个月获得二期手术切除肝转移灶.手术方式:行肝不规则切除40例,右半肝切除8例,左半肝切除9例,术后1、3、5年存活率分别为85%、52%、23%,平均生存30.7个月。
其认为,正确把握手术时机,掌握手术适应症,合理选择手术方式,正确使用治疗措施,能有效提高手术的成功率和患者的生存率。
李思荣等回顾性分析40例结直肠癌肝转移患者的临床资料,其中13例进行同期切除,19例分期切除,5例通过肝动脉结扎辅以化疗,泵注化疗6个月后获得二期肝转移病灶,剩余3例通过肝动脉结扎辅以无水乙醇注射治疗.手术方式:肝不规则切除26例,右半肝切除7例,左半肝切除7例.40例患者平均生存时间为(32.8±6.5)个月,其中同期手术的生存时间显著短于分期手术(P<0.05),研究证明对于结直肠癌肝转移患者必需把握手术时机,掌握手术适应症,并选择合理的手术方式和治疗手段,以延长患者的生存期。
结直肠癌肝转移诊治完整版
结直肠癌肝转移诊治完整版结直肠癌是常见消化道恶性肿瘤之一。
我国结直肠癌发病率和死亡率呈逐年上升趋势。
根据国家癌症中心统计的数据显示,2022年中国恶性肿瘤新发病例估计为482.47万(男性253.39万,女性229.08万),其中约51.71万为结直肠癌,发病率高居恶性肿瘤第2位。
肝脏是结直肠癌最常见转移部位,肝转移是导致结直肠癌患者死亡最重要的原因,因此也是临床治疗的难点和热点。
如何通过MDT的综合治疗提高结直肠癌肝转移手术切除率、减少手术损伤、延长总生存期和提高患者生活质量是结直肠癌临床治疗的重要问题。
近日,中国医疗保健国际交流促进会转移肿瘤治疗学分会联合中国医疗保健国际交流促进会肝脏肿瘤学分会、中国医疗保健国际交流促进会放射治疗学分会、中国医疗保健国际交流促进会消化肿瘤综合诊疗学分会、中国医疗保健国际交流促进会肿瘤免疫治疗学分会、中国医疗保健国际交流促进会神经内分泌肿瘤学分会,再次总结国内外最新进展,汇聚领域专家的意见,求同存异,修订形成《结直肠癌肝转移MDT 诊治中国专家共识(2024版)》。
一、MDT的重要性共识1:结直肠癌肝转移患者需要在MDT指导下进行诊治。
(Ⅰ级推荐,1A类证据)二、结直肠癌肝转移的影像学检查共识2:肝脏磁共振成像(magnetic resonance imaging,MRI)检查用于肝转移癌评估,推荐肝脏特异性造影剂增强MRI扫描作为首选影像学检查方法,用于肝转移癌基线和局部治疗前评估。
对无法行肝脏特异性造影剂增强MRI扫描者,肝脏MRI检查应至少包括T2WI/FS和DWI序列。
(Ⅰ级推荐,2A类证据)共识3:对既往诊治过程中没有接受肝脏MRI检查的患者,推荐肝脏局部治疗前行肝脏MRI扫描,优选肝脏特异性造影剂增强MRI扫描。
(Ⅰ级推荐,1A类证据)共识4:腹盆腔增强CT联合CT结肠仿真内镜(CT colonography,CTC)作为结直肠肿瘤定位诊断和结肠肿瘤分期的首选检查。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国实用外科杂志2011年11月第31卷第11期专家论坛文章编号:1005-2208(2011)11-0991-03
结直肠癌肝转移外科治疗争议与共识
许剑民,钟芸诗中图分类号:R6文献标志码:A
【摘要】外科手术是目前治愈结直肠癌肝转移的最佳方法,但有些方面仍存在争议,如术前新辅助治疗的选择、肝转移灶不可切除的原发灶处理、直肠癌伴肝转移的处理、微创治疗的选择以及肝外转移灶的处理等,这些争议的焦点是使更多结直肠癌肝转移病人获得治愈希望。【关键词】结直肠癌;肝转移中图分类号:R6文献标志码:ASurgicaltreatmentoflivermetastasesofcolorectalcancer:agreementandcontroversyXUJian-min,ZHONGYun-shi.ZhongshanHospital,FudanUniversity;EndocopicResearchInstitute,FudanUniversity,Shanghai200032,ChinaCorrespondingauthor:XUJian-min,E-mail:xujmin@yahoo.com.cnAbstractSurgeryisthebesttreatmentforlivermetastasesofcolorectalcancer,buttherearesomecontroversy,suchas:neoadjuvantchemotherapyforresectablecases,treatmentofcolorecalcancerforunresectalelivermetastasescases,livermetastasesofrectalcancer,microinvasivesurgeryandextra-hepaticmetastases.Thefocusofthecontroversyisthehopethatmorelivermetastasesofcolorectalcancercanbecured.Keywordscolorectalcancer;livermetastasis完全切除肝转移灶仍是目前治愈结直肠癌肝转移的最佳方法,但初诊病人适合手术治疗的比例仅为10%~15%,通过多学科团队的综合诊疗、最佳化疗和靶向治疗方案的选择、残肝容积扩增等手段,使更多的结直肠癌肝转移病人转化为可切除,获得了治愈希望[1]。本文就结直肠癌肝转移外科治疗的相关热点进行阐述。1可切除、潜在可切除和不可切除肝转移灶定义文献[2]报道2010年中国版结直肠癌肝转移诊疗指南指出,结直肠癌肝转移外科治疗的指征包括:(1)能够或已经根治性切除的结直肠癌原发灶。(2)根据肝脏解剖学基础和病灶范围可完全(R0)切除的肝转移灶,且要求保留足够的肝脏功能,肝脏残留容积≥30%~50%。(3)病人全身状况允许,没有不可切除的肝外转移病变。不符合上述指征者,均称为“不可切除病人”。而在那些具有手术指征的病人中,又分为两类[3]:可切除病人(切除肝转移灶后预后较好)和潜在可切除病人(可切除肝转移灶但术后预后较差)。可切除病人包括延时性肝转移、肝转移时间>12个月、仅累及一侧肝叶、病灶≤4个、最大病灶直径<5cm和没有血管侵犯者。对此类病人,治疗策略建议直接手术切除肝转移灶,术后接受辅助化疗,术后5年存活率49%、10年存活率31%。潜在可切除病人包括累及肝实质容积>50%、累及两侧肝叶、病灶数>4个、最大病灶直径≥5cm、可切除的血管侵犯和肝转移病灶。对于此类病人建议先行化疗,视病人对于化疗的反应后再决定是否手术。即使此类病人对化疗反应良好,接受了肝转移灶的手术切除,其5年存活率也仅为30%、10年存活率18%,明显低于第一类病人[4]。
2可切除病人的治疗热点2.1肝转移灶先行处理模式对于肝转移灶可切除直肠癌原发灶不可切除的病人,有作者提出了一个新概念,先切除肝转移灶,然后再对直肠癌原发灶行放化疗,最后处理原发灶的颠倒模式。Pool等报道57例直肠癌同时行肝转移(2000-2007),29例接受传统模式治疗,即先切除原发灶,3个月后切除转移灶;8例接受同步原发灶和转移灶切除;20例先切除转移灶,接着放化疗,如无另外转移灶最后切除原发灶。并发症发生率24%,无住院死亡病人。平均住院时间明显短于传统治疗。5年存活率38%,中位生存期47个月。Verhoef等[5]报道23例先切除肝转移灶,然后行直肠癌放化疗,再切除直肠原发灶。平均随访19(7~56)个月,4例转移复发,2例肝转移复发行射频治疗,无病生存20和35个月,2例出现不可切除的肝或肺转移,继续化疗并存活。2010年Brouquet[6]报道142例结直肠癌同时性肝转移
基金项目:2009-2012卫生部临床重点学科项目“规范化结直肠癌肝转移模式的推广和创新”;2009年国家自然科学基金项目(30973416)作者单位:复旦大学附属中山医院普外科,上海200032通讯作者:许剑民,E-mail:xujmin@yahoo.com.cn
··991中国实用外科杂志2011年11月第31卷第11期病人的治疗结果。72例接受传统模式(先肠后肝)、43例接受混合模式(肠肝同时切除)、27例接受颠倒模式(先肝后肠)治疗。三组围手术期病死率(3%、5%、0,P>0.05),累计并发症发生率(51%、47%、31%,P>0.05),5年存活率(48%、55%、39%,P>0.05),3种治疗效果一致,对于无症状原发灶并伴有进展的肝转移灶病人可选择颠倒模式治疗。目前仍缺少关于直肠癌肝转移各种治疗模式的高级别临床证据,存在相当大的争议,尚须进一步临床实践验证。2.2微创治疗由于肝脏与结直肠解剖位置的关系,尤其在直肠癌肝转移病人,腹腔镜手术的优势得到了显示,可避免腹部两个巨大切口,显著缩短由于腹部巨大切口而造成的住院时间延长,降低医疗费用[7]。Nguyen等[8]报道109例结直肠癌肝转移病人接受腹腔镜手术的回顾性分析资料,乙状结肠、直肠占51%,右半结肠占25%,左半结肠占13%;11%接受了同时性肝转移灶和结直肠原发灶切除。肝转移灶手术包括节段切除(34%)、左肝外叶切除(27%)、右半肝切除(28%)、左半肝切除(9%)、扩大右半肝切除(0.9%)和尾状叶切除(0.9%)。切缘阴性率94.4%,无围手术期死亡,并发症发生率12%,平均住院4d,较常规手术明显缩短。术后1、3、5年存活率88%、69%和50%,1、3、5年无病存活率65%、43%和43%。目前仍缺乏有关腹腔镜手术与传统开腹手术比较的前瞻性随机对照研究。机器人手术近年来逐步兴起,国外关于机器人肝转移灶手术的报道逐渐出现,多为个案报道[9]。Giulianotti等[9]报道1例接受机器人乙状结肠癌手术和右半肝切除,结肠手术耗时120min,右半肝手术耗时330min,无严重并发症,术后随访26个月,无复发。2.3可切除的肝外转移灶可切除的肝外转移灶应分为两类:肺转移和非肺转移。对于肝转移合并可切除的肺转移病人,仍首选手术治疗,但其预后较单纯肺转移灶手术疗效差,且同时发生可切除肝、肺转移灶病人的预后较转移灶切除术后再发肺、肝转移者差[10]。对于非肺转移灶(如腹膜等)是否手术治疗,Adam等[11]报道840例结直肠癌肝转移手术病例,其中186(22%)例伴有可切除的肝外转移灶:即使接受了手术治疗,5年存活率明显低于无肝外转移的病人(28%vs.55%,P=0.02)。影响预后的独立因素包括:非肺转移灶、肝外转移灶伴肝转移复发、癌胚抗原(CEA)>10μg/L、肝转移灶≥6个和右半结肠癌。具有3个以上危险因素者的5年存活率为0,而没有以上任何危险因素者为64%。因此,对于具有3个以上危险因素的病人,开展肝外转移灶的手术治疗,需要十分谨慎。3潜在可切除病人的诱导化疗文献[12]提出,对于此类病人的化疗须明确以下目的:第一,随着使用药物剂量的增加,化疗药物对于肝脏的毒性作用明显增加,应谨慎选择多药联合。首先推荐以5-氟脲嘧啶/亚叶酸钙+奥沙利铂(FOLFOX),奥沙利铂联合卡培他滨(XELOX)或5-氟脲嘧啶/亚叶酸钙+依立替康(FOL-FIRI)化疗方案再联合一种靶向治疗药物。第二,此类病人化疗不是以完全缓解为目的,化疗周期>5次,其肝脏毒性会明显增加。因此,此类病人在接受化疗过程中需要密切观察,若反应良好,需要及时接受手术,一般不宜>3~6个化疗周期。一项Ⅱ期临床研究显示,FOLFOX-4联合西妥西单抗对于潜在可切除病人有效率为72%,R0切除率21%[13]。CELIM研究则显示,FOLFOX或FOLFIRI联合西妥西单抗,R0切除率则高达34%[14]。虽然贝伐单抗应用后需要8周后才能接受肝转移灶手术治疗,在与奥沙利铂联合应用后仍可获得满意疗效,且可增加细胞凋亡率、减少肝窦状核变性发生率[15]。意大利的GONO研究显示,三药联合的强烈化疗方案(FOLFIRINOX)可将R0切除率提高到36%,西班牙的TTD研究则显示FUOXIRI方案的R0切除率为40%;但三药联合后,化疗药物的毒性反应明显增加,可能会对手术产生不利影响。此外,病人若在诱导化疗期间出现疾病进展,则需更换化疗方案而放弃手术治疗。对于诱导化疗期间肿瘤病灶完全消失的病人,仅是“影像学消失”,非真正的“治愈”,由于缺乏有效的定位,手术治疗不是最佳选择。此时,观察和等待是首选方法,一旦影像学出现“病灶”,则再次选择手术治疗[16]。
4不可切除的肝转移灶对于肝转移灶不可切除的病人,初次制定治疗方案必须由外科医生、肿瘤科医生在内的多学科诊疗团队(MDT)共同完成。若同时性肝转移结直肠癌原发灶伴有出血或梗阻等症状,可选择切除原发灶或放置支架治疗缓解梗阻,而对于结直肠癌原发灶没有任何症状的病人,是先化疗还是先手术切除原发灶,目前仍存在争议。2009年美国斯隆-凯特林纪念癌症中心在美国临床肿瘤年会上报道了一组无出血、梗阻,但肝转移灶无法切除的结直肠癌病人资料,结果显示处理这类病人应先选择化疗而不是切除原发灶[17]。但最近一些大宗病例研究则显示不同结果:2010年Aslam等[18]报道了一组920例无法切除转移灶的Ⅳ期结直肠癌病人的10年随访资料,原发灶切除组中位生存期14.5个月,明显高于原发灶未切除病人的5.83个月(P<0.005)。多因素分析显示高龄病人、原发灶固定和伴有淋巴结转移是预后不佳的因素。2010年另一项荟萃分析共纳入了8项回顾性研究1062例病人,结直肠癌原发灶切除较单纯化疗病人中位生存期明显延长6个月(P<0.001),一般经过7次化疗后结直肠原发灶将出现出血、梗阻等并发症(P=0.008)[19]。2011年欧洲一项多中心研究报道了一组208例转移灶无法切除的Ⅳ期结肠癌病人随访分析,85例接受结肠癌原发灶切除的病人预后明显优于123例先接受化疗的病人[20]。Lin等[21]在2011年ASCO年会上分析了1989-2008年间美国加州癌症注册中心登记
