甲烷、乙烯、苯专题复习
2023年人教版新教材安徽省高中化学学业水平考试复习第七单元 有机化合物 课件

(2)将C上H3面CH两2O式H合在一并定得条:件下可被O2氧化为乙醛: 2CH3CH2OH+O2――C△u→2CH3CHO+2H2O。
考点梳理
二、乙酸的组成和主要性质 1.乙酸的分子组成与结构:
(1)将 A 通入溴水中,观察到的实验现象是
,A 分子中官能团是
。
(2)写出 CH3CH2OH 与 CH3COOH 反应生成 B 的化学方程式
。
(3)写出乙醇的一种用途 。
真题演练
5、(2016年·安徽)44.(5 分)乙烯、乙醇和乙酸是重要的有机物。回答下列
问题:
(1)将乙烯通入溴的四氯化碳溶液中,观察到的实验现象是
写出苯的燃烧、卤代、硝化、加氢反应方程式。
真题演练
1、(2020年·安徽)28.下列各组物质互为同分异构体的是( )
真题演练
2、(2019年·安徽)27.下列各组物质互为同分异构体的是( )
真题演练
3、(2018年·安徽)28.下列各组物质互为同分异构体的是( ) A.CH3CH=CH2和CH3C≡CH B.CH3CHBrCH2Br和CH2 BrCHBrCH3 C.CH3CH2CHO和 CH3OCH2CH3
考点梳理
2.有机化合物的同分异构现象 化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象,
具有同分异构现象的化合物互称为同分异构体,
例如CH3CH2CH2CH3与
互为同分异构体。
考点梳理
二、甲烷、乙烯和苯的主要性质
1.甲烷:CH4与Cl2发生取 代反应需要光照条件,CH4 分子中的氢原子可被氯原 子逐一替代,依次生成四 种有机物:
第十五讲 烃——甲烷、乙烯、苯

必修部分高中学业水平测试·化学第十五讲烃——甲烷、乙烯、苯一、单选题考点一有机物特点与同分异构体1.用于制造隐形飞机的某种物质具有吸收微波的功能,其化学式为C6H4S4,它属于()A.有机物B.碳氢化合物C.硫化物D.无机物解析:解题的主要依据是给定物质与所给选项中每类物质概念是否吻合。
碳氢化合物只含碳、氢两种元素;硫化物一般是指含两种元素且其中一种为硫元素的化合物;无机物一般是指不含碳元素的化合物。
答案:A2.(双选)下列物质不属于烃的有机物是()A.CH4B.CH3OCH3C.C2H4D.HCHO解析:烃只含有C、H元素。
答案:BD3.下列说法正确的是()A.有机物是从动植物体中提取的有生命的化合物B.有机物是指含碳元素的化合物9.甲烷在氧气中燃烧后生成二氧化碳和水,从该实验事实可以得出的结论是()A.甲烷的分子式为CH4B.甲烷气体中含碳元素和氢元素C.甲烷分子中只含碳元素和氢元素D.甲烷的化学性质比较稳定解析:二氧化碳和水中含有碳元素和氢元素。
答案:B10.下列物质在一定条件下可与CH4发生化学反应的是() A.氯气B.溴水C.硫酸D.酸性KMnO4溶液答案:A考点三乙烯11.下列物质中,不能和乙烯发生加成反应的是()A.H2B.H2O C.KMnO4D.Br2解析:C项是发生氧化反应。
答案:C12.苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。
”按照现代科技观点,该文中的“气”是指()A.脱落酸B.乙烯C.生长素D.甲烷解析:乙烯可以催熟水果。
答案:B13.能证明乙烯分子里含有一个碳碳双键的事实是()A.乙烯分子里碳氢原子个数比为1∶2B.乙烯完全燃烧生成的CO2和H2O的物质的量相等C.乙烯容易与溴水发生加成反应,且1 mol乙烯完全加成消耗1 mol溴单质D.乙烯能使酸性KMnO4溶液褪色解析:环烷烃分子里碳氢原子个数比也是1∶2,环烷烃燃烧时生成的CO2和H2O的物质的量也相等,故A、B两项错;含有不饱和健(双键或三键)的物质也可能使酸性KMnO4溶液褪色,D项错。
高考理综高三一轮高考化学复习 第9章 第1讲 甲烷、乙烯、苯 煤、石油、天然气的综合利用
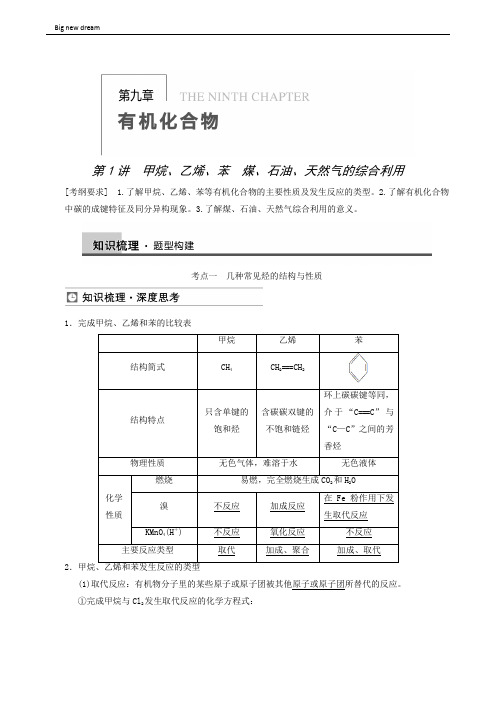
第1讲甲烷、乙烯、苯煤、石油、天然气的综合利用[考纲要求] 1.了解甲烷、乙烯、苯等有机化合物的主要性质及发生反应的类型。
2.了解有机化合物中碳的成键特征及同分异构现象。
3.了解煤、石油、天然气综合利用的意义。
考点一几种常见烃的结构与性质1.完成甲烷、乙烯和苯的比较表2(1)取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
①完成甲烷与Cl2发生取代反应的化学方程式:②完成下列关于苯的取代反应的化学方程式(2)加成反应①定义:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
②乙烯与溴水、H 2、HCl 、H 2O 反应的化学方程式分别为③加聚反应:合成聚乙烯塑料的化学方程式为n CH 2===CH 2――→一定条件CH 2CH 2 。
深度思考1.怎样用实验证明甲烷是由碳、氢两种元素形成的?答案 在空气中点燃甲烷,在火焰的上方罩一个干燥、洁净的烧杯,发现烧杯内壁有水珠凝结,证明甲烷中有氢元素,然后迅速将烧杯倒转过来,向烧杯中滴入少量澄清石灰水,石灰水变浑浊,证明甲烷中含有碳元素。
借题发挥 燃烧法不仅能检验有机物中含有C 、H 元素,还能通过计算确定其是否含有其他元素。
2.乙烯使溴水、酸性KMnO 4溶液褪色的原理是否相同?能否用酸性KMnO 4溶液鉴别CH 4和CH 2===CH 2? 答案 褪色原理不相同,前者是发生了加成反应,后者是被酸性高锰酸钾溶液氧化。
由于CH 4与酸性KMnO 4溶液不发生反应,而CH 2===CH 2能使酸性KMnO 4溶液褪色,因此可以用酸性KMnO 4溶液鉴别二者。
3.结合苯的物理性质探究如何用简单实验来证明分液漏斗内苯与水的混合物中哪一层为苯层?答案取分液漏斗内下层液体适量于一小试管中,然后向小试管中加入少量水,若液体不分层,证明分液漏斗中下层液体为水,上层液体为苯,若液体分层,则分液漏斗内下层液体为苯。
题组一利用教材习题,回扣烃的性质1.(必修2P64-2改编)下列物质在一定条件下,可与CH4发生化学反应的是( )①氯气②溴水③氧气④酸性KMnO4溶液A.①③ B.②③ C.②④ D.①④答案 A2.(必修2P72-5)能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( ) A.苯B.氯化铁C.乙烷D.乙烯答案 D3.(必修2P72-6)利用下列反应不能制得括号中纯净物质的是 ( ) A.乙烯与氯气加成(1,2二氯乙烷)B.乙烯与水加成(乙醇)C.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)D.氯气与苯用氯化铁作催化剂反应(氯苯)答案 C题组二烃的反应类型面面观4.(必修2P72-7改编)下列过程中所发生的化学变化属于取代反应的是( )①光照射甲烷与氯气的混合气体②乙烯通入溴水中③在镍作催化剂的条件下,苯与氢气反应④苯与液溴混合后撒入铁粉A.①② B.①③ C.②④ D.①④答案 D5.(必修2P85-6)某有机物的结构简式为HO—CH2CH===CHCH2—COOH,该有机物不可能发生的化学反应是( )A.水解B.酯化C.加成D.氧化答案 A6.有机化学中的反应类型较多,将下列反应归类。
甲烷乙烯苯知识点总结

专题复习16--甲烷乙烯苯知识点总结核心知识图1.烃的分类、通式和主要化学性质氧化:燃烧饱和烃:烷烃C n H2n+2(n≥1) 甲烷取代结构:链状、碳碳单键裂解链烃氧化:燃烧、使KMnO4(H+)褪色(脂肪烃) 烯烃C n H2n(n≥2) 乙烯加成:H2、X2、HX 、H2O等结构:链状、碳碳双键加聚氧化:燃烧、使KMnO4(H+)褪色炔烃C n H2n-2(n≥2) 乙炔加成不饱和烃结构:链状、碳碳叁键加聚氧化:燃烧、使KMnO4(H+)褪色烃二烯烃C n H2n-2 (n≥3) 1,3—丁二烯加成:1,2加成、1,4加成结构:链状、两个碳碳双键加聚饱和环烃:环烷烃C n H2n (n≥3)结构:环状、碳碳单键氧化:燃烧、不能使KMnO4(H+)褪色,不能因反应使反应使溴水褪色苯加成环烃取代:卤代、硝化、磺化苯及其同系物C n H2n-6 (n≥6)结构:环状、大 键不饱和环烃:芳香烃氧化:燃烧、使KMnO4(H+)褪色稠环芳烃:萘、蒽甲苯取代加成甲烷的化学性质通常情况较稳定,与强酸、强碱、KMnO4等均不反应。
(1)氧化反应甲烷燃烧的热化学方程式为:(2)取代反应①定义:有机物分子里的某些被其他所替代的反应。
②甲烷与Cl2反应乙烯烯烃知识点总结一、乙烯的组成和结构乙烯分子的结构简式:CH2〓 CH2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
人教高中化学考点规范练26 甲烷、乙烯、苯(含答案)

考点规范练26甲烷、乙烯、苯选择题1.下列关于石油和石油化工的说法错误的是()。
A.石油是由各种碳氢化合物组成的混合物B.石油分馏得到的各馏分是由各种碳氢化合物组成的纯净物C.石油裂解的主要目的是为了得到重要产品乙烯D.实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油2.对下列有机反应类型的认识中,错误的是()。
A.+HNO3+H2O;取代反应B.CH2CH2+Br2CH2Br—CH2Br;加成反应C.2CH3CH2OH+O22CH3CHO+2H2O;取代反应D.CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;取代反应3.(2021浙江宁波高三模拟)下列说法正确的是()。
A.属于烃,其一氯代物有2种B.与溴水加成的产物只有2种C.现代工业中,芳香烃主要来源于煤的干馏D.食物中的淀粉物质,通过人体中的酶的催化作用可转化为酒精4.(2021河北石家庄高三考试)下列有关说法正确的是()。
A.乙烯、氯乙烯、聚氯乙烯均可使酸性高锰酸钾溶液褪色B.至少有15个原子共平面C.甲苯苯环上的一个氢原子被—C3H6Cl取代,形成的同分异构体有9种D.经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此化合物中碳的质量分数为84%5.下列反应中前者属于取代反应,后者属于加成反应的是()。
A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷C.苯与浓硝酸和浓硫酸的混合液加热反应生成油状液体;乙烯与水反应生成乙醇D.乙烯与溴水反应;乙酸与乙醇的酯化反应6.下列说法正确的是()。
A.氯乙烯、聚乙烯都是不饱和烃B.聚苯乙烯的结构简式为C.氯乙烯制取聚氯乙烯的化学方程式为D.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应7.物质A的分子式为C12H12,结构简式如右图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的同分异构体有()。
高一(下)期末复习系列——第三章《烃—甲烷、乙烯、苯》学案

高2013级高一(下)期末复习《烃—甲烷、乙烯、苯》学案编写:邓纯江一、有机化学的一些基本概念1有机物的结构特点:①在有机物中,由于碳原子半径小及最外层有______个价电子,碳原子形成______个共价键。
②碳原子之间.....可以相互形成共价键,可形成________键、_______键和_______键。
③碳原子之间可形成碳链或碳环的连接方式。
2 多数..有机物的性质特点:○1溶解性:______溶于水,易溶于_____。
○2燃烧:易○3熔点:低○4电离情况非电解质,难电离○5反应特点:慢,副反应多。
3有机物种类繁多的原因:4、○1分子式:○2最简式:○3结构式:○4结构简式:5 “基”:分子中一类不带电荷....不能独自稳定存在的原子或原子团。
(如CH3CH2CH3分子中有两个甲基、一个乙基、一个丙基。
乙二醇分子由两个羟基和一个烃基构成)“根”即离子。
它带电荷,能稳定存在。
(无机化学中的概念)烃基:烃分子去掉氢原子后的剩余部分一价基用-R 表示烷基:烷烃分子去掉氢原子后的剩余部分一价烷基的通式-C n H2n+1(熟记:丙基C3H7—有2种,丁基C4H9 --有4种)6同系物:有机物是划分为“同系物”进行研究的,结构相似的划分为一个“系列”。
元素是划分为“族”进行研究的。
有机物的“同系”相当于元素的“同族”。
如:烃划分为“烃烷”、“烯烃”、“炔烃”、“苯的同系物”等系列。
定义:________________________________________________________。
结构相似的含义.........都相同。
.......:碳原子之间的价键..情况相同,官能团的种类、数目同系物理解为:分子式不同的,属于同一最小类别(官能团的种类、数目都相同)的物质。
通俗的说,就是从结构上看,只相差几个CH2原子团,其余部分完全相同的物质。
特点:通式相同,结构与化学性质相似,分子式不同。
邳州市第二中学高三化学复习第九章第1讲甲烷乙烯苯石油天然气的综合利用课件
基础再现·深度思考
第1讲
(4)化学性质:与 CH4 相似。 (5)习惯命名法 ①当碳原子数 n≤10 时,用 甲、乙、丙、丁、戊、己、
庚、辛、壬、癸
表示;若 n>10 时,用汉字数字表示。
如:C8H18 命名为 辛烷 ,C18H38 命名为 十八烷 。 ②当碳原子数 n 相同时,用正、异、新来区别。 如:CH3CH2CH2 CH2CH3 称为 正戊烷 称为异戊烷 , , 称为
完全相同,可用邻位二取代物没有同分异构体来证明。
基础再现·深度思考
第1讲
深度思考 11.结合苯的物理性质探究如何用简单实验来证明分液漏斗 内苯与水的混合物中哪一层为苯层?
基础再现·深度思考
第1讲
基础再现· 深度思考
考点一 甲烷的结构与性质 1.组成和结构
正四面体形
CH4
基础再现·深度思考
z.x.xk
第1讲
2.物理性质 颜色 状态 溶解性 密度
无 色 气 态 极难溶于水 比空气 小
基础再现·深度思考
3.化学性质
第1讲
稳 ——稳定性:性质稳定,与 强酸 、 强碱 、高锰酸钾等
基础再现·深度思考
第1讲
考点二
同系物、同分异构体
1.同系物
结构 相似,在分子组成上相差一个或若干个 CH2 (1)定义:
原子团的物质互称为同系物。 (2)注意:①结构相似,并不是完全相同,如 CH3CH2CH3 (无支链)与 (有支链)是同系物。②通式相同,
但符合同一通式的不一定是同系物, 如羧酸和酯(烷烃例外)。
(3)常见几种烷烃基的同分异构体: ①—C3H7:2 种,结构简式分别为 CH3CH2CH2—、 ; ②—C4H9:4 种,结构简式分别为 CH3—CH2—CH2—CH2—, ,
烃的复习
烯烃、炔烃
CH3
碳的饱和程度不同!
基团间 相互影响!
苯的同系物 的化学性质
CH3
被酸性高锰酸钾溶液氧化
COOH 酸性高锰酸钾溶液
CH2CH3 酸性高锰酸钾溶液
COOH
烷烃、苯不能使酸性高锰酸钾溶液褪色
5.能用于鉴别甲烷和乙烯的试剂是 ( AB ) A.溴水 B.酸性高锰酸钾溶液 C.苛性钠溶液 D.四氯化碳溶液
6、CH4中混有C2H4, 欲除去C2H4得到CH4, 最好 依次通过哪一组试剂 ( C ) A. 澄清石灰水、浓硫酸 B. KMnO4酸性溶液、浓硫酸 C. Br2水、浓硫酸 D. 浓硫酸、KMnO4酸性溶液
7
B
7
C C
各类烃与Br2水及酸性KMnO4溶液混合时的现象
现象
烷
烯
炔 褪 色 褪 色
×
褪色
CH2=CH2 CH≡CH 不饱和C
加成 (加聚) 取代 加成
褪色
CH3
独特的C
×
褪色
萃取
高三化学组
烃的复习
【变式训练6】已知C-C可以绕键轴旋转,对下列结 构简式的烃,下列说法正确的是( )
A.该烃是苯的同系物 B.该烃分子中的所有原子有可能处于同一平面内 C.该烃的一氯代物最多有4种 D.该烃分子中至少有9个碳原子处于同一平面上
据此下列说法不正确的是 ( C
A.1mol =3的不饱和链烃再结合6molH即达到饱和
B.C10H8的 =7
C.C4H8的不饱和度与C3H6、C2H4的不饱和度不相同 D.CH3CH2CH=CH2与环丁烷的不饱和度相同
高三化学组
烃的复习
2、下列各组液体混合物,能用分液漏斗分离的( A、溴苯和溴 B B 、正己烷和水 C、苯和硝基苯 D 、苯和酒精
2022届一轮复习人教版-甲烷-乙烯-苯-煤和石油-课件(55张)
键
独特化学键
无色气体,难溶于
无色有特殊气味液体,
物理性质
无色气体,难溶于水
水
密度比水小,难溶于水
2.甲烷和烷烃 (1)甲烷的化学性质 ①稳定性:与强酸、强碱和强氧化剂等一般不发生化学反应。
点燃 ②燃烧反应的化学方程式为 CH4+2O2――→ CO2+2H2O。 ③取代反应:在光照条件下与 Cl2 反应生成一氯甲烷的化学方程式为
4.下列实验能获得成功的是( A ) A.用溴水可鉴别苯、CCl4、己烯 B.加浓溴水,然后过滤可除去苯中少量己烯 C.苯、溴水、铁粉混合制成溴苯 D.可用分液漏斗分离己烷和苯的混合物
[解析]溴水分别与苯、CCl4 混合,不发生反应,静置后分层,苯在上层, 呈橙红色,CCl4 在下层,呈橙红色,溴水与己烯发生反应而褪色,A 项正确; 溴水和己烯发生加成反应生成的二溴己烷可溶于苯中,无法用过滤分离,B 项错误;制溴苯需用苯和液溴反应,C 项错误;己烷和苯互溶,不能用分液 法分离,D 项错误。
[解析]煤中不含苯和甲苯且煤是通过干馏获得苯、甲苯等。
2.下列生活用品中主要由合成纤维制造的是( A )
A.尼龙绳
B.宣纸
C.羊绒衫
D.棉衬衣
3.下列过程与加成反应有关的是( B ) A.苯与溴水混合振荡,水层颜色变浅 B.乙烯与溴水混合振荡,水层颜色变浅 C.乙烯与高锰酸钾溶液混合振荡,溶液颜色变浅 D.甲烷与氯气混合光照,气体颜色变浅 [解析]A 中变化是萃取,C 中变化是发生了氧化反应,D 中变化是发生 了取代反应。
浓硫酸
b.硝化反应:化学方程式为
+HNO3(浓) ―△ ―→
+
H2O。 ③加成反应:苯和 H2 发生加成反应的化学方程式为
高考化学甲烷乙烯苯复习教案
适用精选文件资料分享2012 届高考化学甲烷、乙烯、苯复习教学设计2012 届高考化学第一轮复习必修部分讲义第九单元第1 讲甲烷、乙烯、苯解读与阐释考大纲求威望解读 1. 认识有机化合物中碳的成键特色。
认识有机化合物的同分异构现象。
2 .认识甲烷、乙烯、苯等有机化合物的主要性质。
3 .认识乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
常有的考察形式:①以碳原子的四价及甲烷的立体构造切入,考察碳的成键特色及常有烃类物质的构成、构造和性质;②取代、加成反响的观点及判断;③同系物、同分异构体的观点及判断。
梳理与整合一、甲烷的构造和性质导学诱思以下说法正确的选项是__________。
①甲烷是平面正方形构造;②甲烷能够用排水集气法采集;③甲烷是最简单的烷烃;④甲烷与 Cl2 的混淆气为浅绿色,在光照的条件下颜色渐渐变浅;⑤甲烷的化学性质很稳固,不可以与氧气、KMnO4酸性溶液、强酸、强碱等反响;⑥“西气东输”输送的气体的主要成分是甲烷。
教材回归1.烃仅由____、____两种元素构成的有机物称为烃。
2 .甲烷的分子构成及构造名称分子式电子式构造式构造简式空间构型CH43.甲烷的物理性质颜色:______。
状态:______。
溶解性:________。
密度比空气 ____。
4 .甲烷的化学性质往常状况下较稳固,与______、______、__________等均不反响。
(1) 氧化反响甲烷的焚烧热为890 kJ?mol-1,甲烷焚烧的热化学方程式为。
(2) 取代反响①定义:有机物分子里的某些原子或原子团被其余______________所代替的反响。
②甲烷与氯气的取代反响反响的现象为试管内气体颜色渐渐______,试管壁出现 __________,试管中有少许 ______。
反响方程式为CH4+C l2? D? D→光 CH3Cl+HCl( 第一步 ) CH3Cl +Cl2? D? D→光CH2Cl2+HCl CH2Cl2+Cl2? D? D→光 CHCl3+HCl CHCl3+Cl2? D? D→光 CCl4+HCl 甲烷的 4 种氯代物均不溶于水,常温下除__________是气体外,其余 3 种产物都是 ______________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题复习 甲烷、乙烯、苯 一.甲烷、乙烯、苯知识回顾及比较 甲烷 乙烯 苯 结构简式
结构特点 碳原子的化合价已达到( ),( )形分子,碳原子与任意2个氢原子处在( ),但不在( ),键角( ),碳碳键键长( ) 碳原子的化合价未达到( ),( )形分子,碳原子与任意4个氢原子处在( ),但不在( ),键角( ),碳碳键键长( ) 苯环中的碳碳键是( ),( )形分子,碳原子与任意6个氢原子处在( ),键角( ),碳碳键键长( )
物理性质 活泼性
氧化反应 ( )使酸性KMnO4溶液褪色,燃烧火焰( )并呈( )色 ( )使酸性KMnO4溶液褪色,燃烧火焰( ),并带有( ) ( )使酸性KMnO4溶液褪色,燃烧火焰( ),并带有( )
取代反应 与( )在( )下发生卤代 不能发生取代反应 能与( )和( )发生取代反应
加成反应 不能发生加成反应 能与( )等发生加成反应 能与( )等发生加成反应 【及时突破】 1.下列有关乙烯和乙烷的说法中错误的是 ( ) A.乙烯是平面分子,乙烷分子中所有的原子不可能在同一平面内 B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和乙烷 C.溴的四氯化碳溶液和酸性KMnO4溶液都可以除去乙烷中混有的乙烯 D.乙烯的化学性质比乙烷的化学性质活波 2.下列物质中所有的原子都有可能在同一平面上的是 ( )
二.烃的燃烧计算规律 等物质的量和等质量的不同烃完全燃烧时耗氧量及生成物(CO2、H2O)量的比较,分析烃类完全燃烧时耗氧量及产物量大小时,一定要仔细分清前提。“等物质的量”和“等质量”两种情况下判断的依据是不同的。
1.等物质的量的烃完全燃烧 (1).规律:每摩烃完全燃烧时耗氧量相当于每摩烃中碳元素和氢元素分别燃烧时耗氧量之和(x +y/4);当 的值越大,耗氧量越大。且x为主要决定因素,一般x越大,耗氧量越大,生成的CO2量也越大;当y越大时,生成的水量也越大。 (2).方法:当x、y均不同且一多一少时,则可以按1个碳原子与4个氢原子的耗氧量相当的原理对分子式进行适当变形,转换成碳或氢原子个数相同后再进行比较即可。例如等物质的量的C2H6和C3H2耗氧量相当,则比较C2H6和C3H4的耗氧量,相当于比较C3H2和C3H4,从而可以快速得出结论。 (3).注意:等物质的量的不同有机物燃烧时: 燃烧情况 产生CO2的量相等 产生H2O的量相等 产生CO2、H2O的量均相等 需满足条件 不同的分子式中含C原子个数须相等 不同分子式中含H原子个数须相等 不同分子式中含C、H原子个数相等 第三种情况下的CO2、H2O的量均相等时,对烃来说即要求不同物质互为同分异构体 例1. 1 mol CxHy(烃)完全燃烧需要5 mol O2,则X与Y之和可能是 ( ) A. X+Y=5 B. X+Y=7 C. X+Y=11 D. X+Y=9 例2. 常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是 ( ) A. 甲烷 B.乙烷 C. 乙炔 D. 乙烯 例3. 等物质的量的CH4 ,C2H4,C6H6,分别在足量氧气中完全燃烧,以下说法正确的是( ) A.C6H6含碳量最高,燃烧生成的CO2最多 B.C6H6燃烧时火焰最明亮 C.CH4含氢量最高,燃烧生成的水最多 D.CH4 、C2H4燃烧生成的水质量不同,消耗的氧气不同。 2.等质量的不同烃完全燃烧 规律:1mol的C(12g)消耗1mol O2,而4mol的H(4g)也消耗1molO2,故质量相等的不同烃完全燃烧时,氢元素的质量分数H%越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数C%越大,消耗O2越少,产生的CO2则越多。或者说等质量的烃完全燃烧时,消耗氧气的量取决于CxHy中y/x的值,此值越大,耗氧量越多。 例4. 等质量下列各类烃:1. C6H6、2. C7H8、3. C4H10、 4. C3H8,分别完全燃烧时,其耗氧量由大到小的顺序排列的是 ( ) A.1234 B.4321 C.2134 D.3412 [注意] 最简式相同,质量相等的两种烃完全燃烧时消耗氧气相等,产生CO2和H2O的总量也相等。 例5. 下列各组烃的混合物,只要总质量一定,无论它们按什么比例混合,完全燃烧后生成二氧化碳和水都为恒量的是 ( ) A.C2H2 C2H6 B.C2H4 C3H8 C.C2H2 C6H6 D.C3H4 C3H6 3. 烃燃烧前后气体体积变化规律及应用
(1) 气态烃(CxHy)在100℃及其以上温度完全燃烧时,H2O为水蒸气: △V = V后-V前 = y/4 - 1
气体体积变化规律与氢原子个数有关 ①若y=4,燃烧前后体积不变,△V=0 ②若y>4,燃烧前后体积增大,△V>0 ③若y<4,燃烧前后体积减少,△V<0 例6. 两种气态烃以任意比例混合,在105 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是 ( ) (A)CH4 C2H4 (B)CH4 C3H6 (C)C2H4 C3H4 (D)C2H2 C3H6 例7. 室温时20mL某气态烃与过量氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到室温,气体体积又减少了50mL,剩余气体再通过苛性钠溶液,体积又减少了40mL,求气态烃的分子式 4. 巧解含烃的混合气体计算题
(1) 守恒法:此法在化学计算中应用很广泛,用此法可求元素的相对原子质量、物质的相对分子质量、分子式、混合物的组成以及进行溶解度、溶液浓度等方面的计算 例8. 把m mol C2H4和n mol H2混合于密闭容器中,在适当的条件下,反应达到平衡时生成p mol C2H6,若将所得平衡混合气体完全燃烧生成二氧化碳和水,则需要氧气多少摩尔 (2).方程式叠加法 例题:将x mol氧气,y mol甲烷和z mol过氧化钠放入密闭容器中,在150℃条件下用点火花引发,恰好完全反应后,容器内压强为0,通过计算确立x、y和z之间的关系式: [解析]:根据反应后气体压强等于0,所以可将以下反应方程式: 2CH4+4O2→2CO2+4H2O 2CO2+ 2Na2O2 →2Na2CO3+O2 2H2O+ 2Na2O2→4 NaOH+O2相加消去气体,得: 2CH4+O2+ 6Na2O2→8NaOH+2Na2CO3 所以x:y:z=1:2:6 练习1. 若要使 mol CH4完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为多少摩尔
(3).十字交叉法:十字交叉法一般只适用于两种已知成分组成的混合体系,解题关键往往在于求平均值。其广泛应用于有关同位素、相对原子(分子)质量、溶质质量、二组分混合物质量分数、化学反应中的物质的量、体积、电子转移数及反应热等方面的计算。 例题:CH4和C2H4混合气体,其密度是同温同压下乙烷的2/3,求混合气体中甲烷的质量分数。 [解析]:相同状况下气体密度之比等于相对分子质量之比:M=2/3×M(C2H6)=20,由十字交叉法得: CH4 16 8 20 =2:1 C2H4 28 4 混合气体中甲烷的质量分数为2×16/(2×16+1×28)×100%=53.3% 练习2.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同。将1体积这种混合气体在氧气中充分燃烧,生成2体积的二氧化碳和体积的水蒸气(气体体积均在相同状况下测定)。则混合气中烷烃和烯烃的体积比为多少
练习3.在?105 Pa,120℃时,1 L的A、B两种烷烃组成的混合气体,在足量的氧气中充分燃烧后,得到同温同压下的二氧化碳和 的水蒸气,且A分子中比B分子中少2个碳原子,确定A、B的分子式及体积比
三.有机物分子中原子共线、共面的判断方法 首先要几种典型结构、借助C—C单键可以旋转而 、不能旋转的特点,以及立体几何知识,各种与此有关的题目均可迎刃而解,现举例如下: 1.甲烷的正四面体结构 甲烷分子为空间正四面体结构。其中四个氢原子位于正四面体的顶点,碳原子位于正四 面体的中心。甲烷分子中的所有原子不可能共面,位于正四面体中心的碳原子至多能与任意两个氢原子共面。即甲烷分子中最多有三个原子共平面。当有其它原子或原子团取代甲烷中的氢原子时,可把它看作是占据原来氢原子的位置。 【延伸】分子结构中出现甲基时,所有原子不可能共平面,但甲基中的碳原子和另外两 个与之直接相连的原子有可能共平面。 2.乙烯的平面结构 ①乙烯分子中的所有原子都在同一平面上,当乙烯分子中的氢原子被其它原子或原子 团取代时,取代该氢的原子也一定在乙烯的平面内。 【延伸】分子结构中出现双键时,双键两端的碳原子和与之直接相连的四个原子一定在同一个平面上。 ②乙烯分子中碳碳双键和碳氢键之间的夹角为120°即乙烯分子中碳碳双键和任意一个碳氢键均不在同一条直线上。 3.苯的平面结构 苯分子中所有原子在同一平面内,键角为120°,当苯分子中的氢原子被其他原子或原子 团取代时,取代该氢的原子也一定在苯分子所决定的平面上。 【延伸】分子结构中出现苯环时,苯环上的碳原子和与之直接相连的六个原子一定在同一 平面上,而且苯分子的对位以及对位所连的原子在一条直线上。 [理解提高] 例1、在 中,处于同一平面上的原子最多可能有( )
A、12个 B、14个 C、18个 D、20个 例2、下列分子中14个碳原子不可能处于同一平面上的分子是:( )
A. B. C. D.
