免疫定性项目性能验证报告-正本
临床免疫定性检测的性能验证

9,500
500
4,500
85,500
95%
1%感染率
检出(+) 未检出(-)
950
50
4,950 94,050
95%
95%
95%
950/[950+4950]=16% 9500/[9500+4500]=67.9%
85500/[85500+500]=99.4 94050/[94050+50]=99.9% %
样本的采集和保存:采集时间、保存方式 等必须保证一致性。
CLSI EP12-A2 User Protocol for Evaluation of Qualitative Test Performance; Approved Guideline
Clinical Laboratory and Standards Institute (CLSI)
路漫漫其悠远
性能验证前的准备
应熟悉待验证的试剂或系统 进行必要的培训,包括样本的处理和储存、
试剂的处理和储存、合理的检测方案、对结 果合理的解释以及系统的质量控制等。 制定质量保证计划 确定患者样本的数量及强弱(评价重复性) 确定比较的方法
CLSI EP12-A2 User Protocol for Evaluation of Qualitative Test Performance; Approved Guideline
路漫漫其悠远
性能验证的合格标准从何而来?
试剂盒说明书 国际和/或国际标准
路漫漫其悠远
性能验证前样本的准备
质控品:使用商品化质控物进行,包括阴 性和阳性。
筛查试验:临床上筛查方法通常用于检测整个人
群(或者人群中的特定部分)中特定指标的情况 。例如对需输血患者样本做HIV血清学试验。
【免疫学性能及质控】27肌酸激酶性能验证评价报告
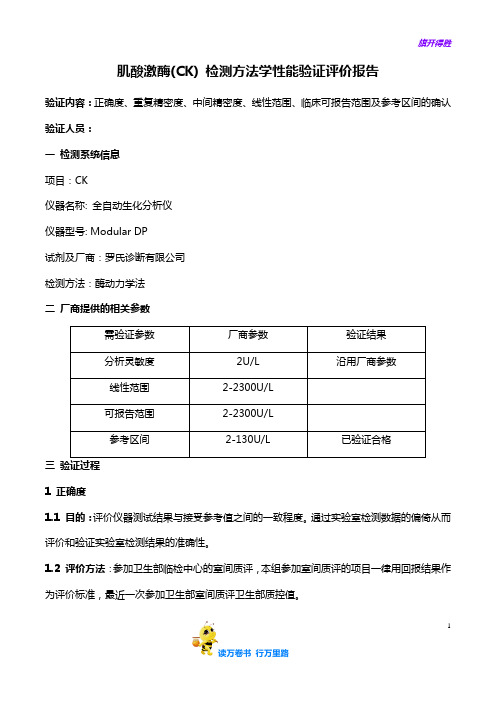
肌酸激酶(CK) 检测方法学性能验证评价报告验证内容:正确度、重复精密度、中间精密度、线性范围、临床可报告范围及参考区间的确认验证人员:一检测系统信息项目:CK仪器名称: 全自动生化分析仪仪器型号: Modular DP试剂及厂商:罗氏诊断有限公司检测方法:酶动力学法二厂商提供的相关参数三验证过程1 正确度1.1 目的:评价仪器测试结果与接受参考值之间的一致程度。
通过实验室检测数据的偏倚从而评价和验证实验室检测结果的准确性。
1.2 评价方法:参加卫生部临检中心的室间质评,本组参加室间质评的项目一律用回报结果作为评价标准,最近一次参加卫生部室间质评卫生部质控值。
11.3 结果判断方式:<1/3 CLIA’88正确度验证试验数据记录表22 精密度2.1 重复精密度2.1.1 目的:考察仪器检测方法的随机误差2.1.2 原理:在检测系统处于优良的条件下,连续测定20个结果,判断这20个独立结果间的一致程度2.1.3 方法:选择新鲜混合血清标本(病人高值、低值)各20份,测量前先定标,再做质控,质控结果在控制范围内,连续重复测定20次,计算SD,CV,得到重复性精密度。
2.1.4 标本来源:高、低值标本均为混合血清。
2.1.5 结果判断方式:<1/4CLIA’ 88 7.5%重复性精密度验证试验数据记录表342.2 中间精密度:2.2.1 目的:考察目前实验室检测方法中间精密度。
2.2.2 原理:在检测系统处于优良的条件下,连续测定20天,取得20个结果,判断这20个独立结果间的一致程度。
2.2.3 方法:取一个月的室内质控值(高值、低值)计算CV、SD,得到批间精密度。
2.2.4 结果判断方式:<1/3 CLIA’ 88 10%中间精密度验证试验数据记录表53 线性范围(Linearity range, AMR)3.1 目的:在确定某项目检测上限的同时检测其上下限是否呈线性关系,从而保证该浓度范围检测结果的准确性。
定性免疫学检验的性能验证与质量控制

25
辽宁中医药大学附属医院临床检验中心
ISO15189实验室认可系列培训讲座
临床特异性和临床敏感性
临床敏感性:在患有明确临床疾病的患者中,其检 测结果呈阳性或者超过正常值范围的比率 (即出现 阳性结果和确定患者患病)。
临床特异性:在没有特定临床疾病的患者中,其检 测结果呈阴性或者在正常值范围内的比率。
ISO15189实验室认可系列培训讲座
二、检验结果质量的保证-----室内质控 质控品的来源
第三方质控品 检测系统配套质控品 自制质控品
32
辽宁中医药大学附属医院临床检验中心
ISO15189实验室认可系列培训讲座
质控物的选择
基质:应尽量选择人血清基质,动物源性的基质由 于人体内有大量的异嗜性抗体的存在引起假失控。稀 释液也应用人血清,冻干品复溶可以使用生理盐水。
阳性符合率和阴性符合率的计算
待评价试剂与已验证方法相比较进行阳性符合率和阴性符合率的计算
待评价试剂的检测结果 +
已验证方法
+
-
a
b
共计
c
d
a+c
b+d
阳性符合率= a/(a+c) ×100%。 阴性符合率= d/(b+d) ×100%。 总符合率=(a+d)/(a+b+c+d)×100%。
31
辽宁中医药大学附属医院临床检验中心
22
辽宁中医药大学附属医院临床检验中心
ISO15189实验室认可系列培训讲座
(二)检出限的验证
检测限(limit of detection)是指检测方法可检 测 出 的 最 低 被 测 量 浓 度 , 也 称 检 测 低 限 ( lower limit of detection ) 或 最 小 检 出 浓 度 ( minimum detectable concentration),有时也称为分析灵敏 度(analytical sensitivity)。 如前所述,分析物浓度位于C5-C95区间之外(小于 C5或大于C95)时,候选方法对同一样本的重复性检 测将得到相同结果。因此,C95代表了某一试剂可以 测出的最低被测量浓度。
医院免疫检验报告单

医院免疫检验报告单检测单位:XXX医院检测科室:免疫检验科报告日期:XXXX年XX月XX日尊敬的患者:您好!感谢您选择XXX医院进行免疫检验。
根据您的检测样本,我们已完成相关检测,并为您提供本次免疫检验的报告单。
报告编号:XXXXX患者姓名:XXX年龄:XX岁性别:XX一、免疫检验项目:1.总IgE水平检测:检测结果:XX IU/ml结果评价:您的总IgE水平为XX IU/ml,属于正常范围内。
总IgE是指机体本身产生的IgE抗体的总量,正常范围在XXX IU/ml。
2.特异性IgE检测:特异性IgE是对特定抗原产生的IgE抗体,针对不同的抗原进行检测,可以帮助判断您对一些过敏原的敏感性。
-对XXX过敏原的特异性IgE检测:检测结果:阳性/阴性结果评价:阳性表示您对XXX过敏原存在过敏反应的可能性较高,我们建议您进一步了解相关过敏原并采取相应的防护和治疗措施。
-对XXX过敏原的特异性IgE检测:检测结果:阳性/阴性结果评价:阳性表示您对XXX过敏原存在过敏反应的可能性较高,我们建议您进一步了解相关过敏原并采取相应的防护和治疗措施。
总结:根据本次免疫检验结果,您的总IgE水平在正常范围内,但特异性IgE检测中可能存在对一些过敏原的过敏反应,需要进一步了解具体的过敏原并采取相应的预防和治疗措施。
二、检测建议:1.如果您对特定过敏原的特异性IgE检测结果为阳性,请尽量避免接触该过敏原,以预防过敏反应的发生。
2.如果您有过敏症状或疑似过敏病史,请及时就诊,接受相关的过敏性疾病检查和治疗。
3.如果您对一些过敏原的特异性IgE检测结果不确定或阴性,但仍有相关过敏症状出现,请及时就诊,我们的医生将根据您的具体情况进行综合判断和诊疗。
三、注意事项:2.免疫检验结果可能受到多种因素的影响,如检验时间、个体差异等,请综合考虑其他临床病史和检查结果。
此致敬礼!XXX医院免疫检验科。
定性试验性能验证报告

AAA医院性能验证报告性能验证报告(定性类)单位名称:AAA医院科室名称:检验科实验室:临床微生物与病原学实验室验证人员:审核人:批准人:验证日期:2012年8月10日—2012年9月10日检测方法分析性能验证报告1.方法名称:细菌鉴定1.1.仪器名称:VITEK 2全自动微生物鉴定/药敏分析系统1.2.试剂名称: GN鉴定卡、GP鉴定卡、YST鉴定卡1.4.1 在进行实验前,根据作业指导书由仪器责任人和仪器工程师共同对仪器进行全面的保养、维护和核查,以使仪器达到一个良好的工作状态。
1.4.2 试剂耗材准备无菌比浊管、无菌棉签、比浊仪、定量加样器、载卡架等。
1.4.3标本的准备菌种的复苏:根据鉴定卡要求结合实验室现有菌种储备,选用菌株如下:1.4.4 菌悬液制备1.4.4.1 比浊仪校准:采用标准比浊管0.5麦氏进行测定,连续测定三次,要求每次结果在控。
1.4.4.2 选取洁净比浊管,加入适量的无菌盐水,挑取新鲜菌落2-3个,充分研磨,混匀。
1.4.4.3 比浊:按照标准操作规程。
配制浓度0.5~0.63麦氏的菌悬液。
1.4.4.4上机操作。
1.4.4.5 上机完成时将剩余细菌悬液转种至血平板,过夜培养,检查其纯度。
1.5.结果1.5.1 正确度验证结果:2010年,参加全国卫生部质控共3次,参加山东省临检中心质控共2次。
共鉴定细菌26例,其中革兰阳性细菌占7例,鉴定正确7例,正确度为100%;革兰阴性细菌占15例,鉴定正确15例,正确度为100%;未检出致病菌占1例,正确度为100%。
真菌4例,正确度为100%。
1.5.2 符合率验证结果:对标准菌株上机鉴定,比较细菌鉴定的百分率及其生化反应的符合率,见表1。
1.5.2 重复性验证结果:留取部分标准菌株及临床分离株,隔日重新上机,比较两次鉴定结果,见表2。
1.6结果判读符合率试验:最好试验结果和预期结果完全符合;要求鉴定菌种正确,生化反应不符合项数不超过一项。
定性免疫学检验的性能验证与质量控制

ISO15189实验室认可系列培训讲座
结果判断-4
用该方法检测,C50-20%的样本检测结果一致,C50+20%的样本不一定能得到一致 结果;需要用高于C50更大百分率浓度的样本(如+30%)进行补充试验。
xx
ISO15189实验室认可系列培训讲座
检出限的验证
n检测限(limit of detection)是指检测方法可检 测 出 的 最 低 被 测 量 浓 度 , 也 称 检 测 低 限 ( lower limit of detection ) 或 最 小 检 出 浓 度 ( minimum detectable concentration),有时也称为分析灵敏 度(analytical sensitivity)。 n如前所述,分析物浓度位于C5-C95区间之外(小于 C5或大于C95)时,候选方法对同一样本的重复性检 测将得到相同结果。因此,C95代表了某一试剂可以 测出的最低被测量浓度。
xx
ISO15189实验室认可系列培训讲座
筛查试验
n筛查试验用于检测整个人群或部分人群中分析物的 存在情况。
n一般而言,筛查试验应当具有较高的临床敏感性( 即临床检出率大于95%),对其特异性的要求(和阳 性预测值)则取决于对各种因素的综合考虑。
如粪便隐血检测
xx
ISO15189实验室认可系列培训讲座
n这里的C50指的是一个处于试剂检测临界点的样本浓 度,其一旦确定,是不变的。 n试剂盒CUT-OFF值指的是一个判断某一次测定结果的 由阴性和阳性对照信号值按一定公式计算出来的信号 值,每次测定都会有所差异。
xx
ISO15189实验室认可系列培训讲座
C5 浓度的定义
n一份样本,在多次重复实验中有95%的几率获得阴性 结果时该分析物的浓度。
定性免疫学检验的性能验证与质量控制
检出限的验证方法
样本选择:评估试剂分析灵敏度所使用的样本,如 检测项目有国家参考品,则可使用国家参考品或经国 家参考品标化的参考品进行检测,如没有国家参考品 ,则使用可以溯源或量化的样本,如国际标准物质, 或与国际标准物质溯源的样本。 验证方法:处于测定下限浓度( C95 )的样本,重 复检测20次,应至少有18次以上为阳性反应。
精密度评估的基本原则(2)
评估精密度时,应至少评估两个浓度水平样本的精 密度。 所选样本浓度应在测量范围内有医学意义,即至少 有一个浓度在医学决定水平左右,在定性测定,即为 接近临界水平的浓度。
批内精密度的评估
评估方法:三个不同浓度的样本,在一个测试批内 重复进行至少20次检测,计算所得S/CO值的均值和SD ,计算批内CV%。 质量控制:检验时应同时至少测一个质控品。 判断结论:应≤试剂说明书所标明的批内变异。 ELISA的批内变异CV%应≤10%。
(三)准确度验证
验证方法及指标: 以与临床诊断、金标准方法和标准血清盘的检 测比较来评价,常以敏感性(包括临床敏感性)/ 特异性(包括临床特异性)和阳性符合率/阴性符 合率来表示。
临床特异性和临床敏感性
临床敏感性:在患有明确临床疾病的患者中,其检 测结果呈阳性或者超过正常值范围的比率 (即出现 阳性结果和确定患者患病)。 临床特异性:在没有特定临床疾病的患者中,其检 测结果呈阴性或者在正常值范围内的比率。
(一)不精密度的验证
纯定性试验:采用浓度接近临界值的分析物作为检 测材料,不宜采用阴性低值或强阳性样本来评价定性 检测方法的不精密度。 量值化定性试验:以COI(cut-off Index)或S/CO 比值作为分析方法的精密度评价指标。
纯定性测定不精密度的评估方法
医院性能验证报告模板
性能验证报告单位名称:喀什市第二人民医院仪器名称:I200-干式荧光免疫分析仪序列号:011800K0600009生产厂家:深圳微点生物技术股份有限公司实验日期:2019年11月依据CNAS-CL02:《医学实验室质量和能力认可准则》(ISO 15189:2007)对医学实验室检测系统性能评价的相关要求,结合NCCLS发布的EP-5、EP-9的性能评价相关标准、制造商试剂说明书,验证以下内容:精密度、正确度、线性范围。
1 目的按照《免疫室性能验证程序》的要求,对免疫检测项目进行性能验证。
2 验证内容2.1 精密度验证2.2 正确度验证2.3 线性范围验证3 操作要求1)测试环境温度:20~25℃,湿度:<80%2)测量前,应根据厂家说明书规定的方法进行校准。
3)熟悉仪器的原理、操作、设定、保养、定标、故障处理及评价方案。
4)试剂和校准物整个实验过程中必须使用同一试剂批次及校准物,确认各种试剂批号已知并记录。
5)时间及期限对于全部标本,均应在两小时内测定完毕。
6)测量的最后进行质量控制一次。
4 性能验证4.1 精密度验证:1)实验方案a)样本选择采用微点公司标准品(高低水平评价物)进行检测。
使用两个浓度(测量区间内的中高值水平),每个浓度水平都是独立进行精密度的评价,选择接近实验室内“医学决定水平”的浓度,选择与性能要求相对应的浓度。
b)样本测定将高低水平的标准品,在微点I200-干式荧光免疫分析仪上连续运行两个水平评价物各5次,记录原始数据,并计算精密度的SD和CV值。
如因质控或操作困难而被拒绝,则需在找到并纠正引起问题的原因之后进行更多一个批次。
c)数据处理离群值判断标准:单次测量数据超出总均值±4SD。
数据剔除量:小于总测量数据量的5%。
d)结果判读批内精密度CV值低值L1为2.23%,高值L21.68%,均小于10%。
该项目达到检测要求。
与厂家说明书标示的一致,详情见表1。
表1:精密度验证结果4.2正确度验证:1)实验方案a)样本选择采用微点公司标准品(高低水平评价物)验证厂家的声称。
免疫组-感染检测系统性能验证报告
感染检测系统/方法分析性能验证评估报告检验科生化免疫组-感染检测依据CNAS-CL02:《医学实验室质量和能力认可准则》(ISO 15189:2007)对医学实验室检测系统性能评价的相关要求,对1台ARCHITECT i2000 SR全自动免疫化学发光分析仪、1台全自动时间分辨荧光分析仪性能评价,定量项目主要从以下几个方面进行:精密度、符合率、分析测量范围、生物参考区间等。
定性项目主要从以下几个方面进行:精密度、符合率、灵敏度、特异性、检出限、生物参考区间等。
具体实施方案如下:1目的对1台ARCHITECT i2000 SR全自动免疫化学发光分析仪、1台全自动时间分辨荧光分析仪性能评价,结果与生产厂家给出的性能指标进行比较,来验证生产厂家给出的性能指标是否能满足检验科的要求。
若无厂家性能指标则与CLIA’88规定的标准或卫生部室间质评计划表提供的标准比较,判断仪器的性能是否符合要求。
2 验证周期2.1 新开展的项目,在临床应用前应进行评价。
2.2 已开展的项目至少应每年进行验证评价一次。
2.3 检测项目更换检测系统或仪器进行比较大的维修或维护时,需要进行验证评价。
3验证内容3.1定量项目主要从以下几个方面进行:精密度、符合率、分析测量范围、生物参考区间等。
3.2定性项目主要从以下几个方面进行:精密度、符合率、灵敏度、特异性、检出限、生物参考区间等。
4 验证程序4.1 定量项目系统验证一、精密度精密度分别要验证批内及日间精密度。
批内和日间精密度均应小于该项目方法学或医学上的最大允许CV%。
以不超过CLIA’88允许最大误差的1/3或以卫生部室间质评的允许偏倚的1/3为判断依据。
批内精密度以不超过CLIA’88允许最大误差的1/4或以卫生部室间质评的允许偏倚的1/4为判断依据。
1、批内分析:对两个浓度水平的验证材料在一个批次内分别连续进行20次检测,计算均数、标准差和变异系数百分比。
2、日间分析:采用2个浓度的样本(质控物,非常规工作使用的质控物、标准品、已分析过的患者标本以及厂家用于精密度实验的物质都可使用),每天分析1批,每批对2个浓度样本重复测定3次,连续测定5天。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫定性项目性能验证报告 单位名称:河北省儿童医院 科室名称:检验科 实验室:免疫实验室 仪器名称:STAR-FAME全自动酶免分析系统 型号规格:STAR LET8CH-FAME 24/30 仪器编号: 验证人员:闫红 刘雪超 审核人员:郭映辉 批准人:李贵霞 验证日期:2016年4月19日-2016年4月24日 性能验证结果 ................................................................ 1 1、 基本信息 .......................
..
3 2、 正确度验证 ..................... ................. 错误!未定义书签。
3、 精密度验证 .....................
..
5 4、 检出线验证 .....................
..
9 5、 阴阳性符合率 .................. ................. 错误!未定义书签。 1基本信息
仪器名称:STAR-FAME全自动酶免分析系统 试剂: 项目 试剂产家 试剂批文 试剂批号 失效期
HBsAg 英科新创 国药准字S 43 2016-12-09
HBSAb 英科新创 国食药监械(准)字2013 第 3401320号 02 2017-01-17 抗-HCV 英科新创 国药准字S 24 2016-11-30
质控品: 项目 生产厂家 批文 浓度 批号 失效期
HBsAg 北京康彻思 坦生物 国制标物号号 ml 2 HBSAb 北京康彻思 坦生物 国制标物号号 30mlU/ml 1 抗-HCV 北京康彻思 坦生物 国制标物号号 ml 5 2正确度验证
以卫生部临床检验中心室间质评结果为准;成绩在 80%者即为验证通过。附件:卫 生部临检中心室间质量评价成绩表 标本来源:卫生部临检中心 批号: 1521 1522 1523 1524 1525 1531 1532 1533 1534 1535 1611 1612 1613 1614 1615
项目名称:HBsAg 结果 卫生部临检中心
阳性 阴性 合计 本室阳性 6 0 6
本室阴性 0 9 9
合计 6
9 15
符合率: 100% 100%
项目名称:HBsAb 结果 卫生部临检中心
阳性 阴性 合计 本室阳性 4 0 4
本室阴性 0 11 11
合计 4 11 15
符合率: 100% 100% 项目名称:抗-HCV 结果 卫生部临检中心
阳性 阴性 合计 本室阳性 5 0 5
本室阴性 0 10 10
合计 5 10 15
符合率: 100% 100%
3精密度验
批内精密度: 3.1.1实验方案:选择低值、中值质控品,连续检测 20次,记录并保存原始检测
数据,计算SD CV值。 3.1.2检测要求:批内精密度<15%。
3.1.3结果
HBsAg批内精密度
样本号 低值0D值 检测结果 样本号 中值OD值 检测结果
1 阳性 21 阳性
2 阳性 22 阳性 3 阳性 23 阳性 4 阳性 24 阳性
5 阳性 25 阳性
6 阳性 26 阳性 7 阳性 27 阳性
8 阳性 28 阳性
9 阳性 29 阳性
10 阳性 30 阳性 11 阳性 31 阳性 12 阳性 32 阳性 13 阳性 33 阳性
14 阳性 34 阳性 15 阳性 35 阳性 16 阳性 36 阳性 17 阳性 37 阳性
18 阳性 38 阳性 19 阳性 39 阳性
20 阳性 40 阳性 低值样本X= s= cv=%
中值样本X= s= cv=%
HBsAb批内精密度
样本号 低值0D值 检测结果 样本号 中值0D值 检测结果
1 阳性 21 阳性 2 阳性 22 阳性 3 阳性 23 阳性
4 阳性 24 阳性
5 阳性 25 阳性
6 阳性 26 阳性 7 阳性 27 阳性
8 阳性 28 阳性
9 阳性 29 阳性
10 阳性 30 阳性 11 阳性 31 阳性 12 阳性 32 阳性 13 阳性 33 阳性 14 阳性 34 阳性 15 阳性 35 阳性
16 阳性 36 阳性 17 阳性 37 阳性
18 阳性 38 阳性 19 阳性 39 阳性
20 阳性 40 阳性 低值样本X= s= cv=% 中值样本X= s= cv=%
HCV批内精密度
样本号 低值0D值 检测结果 样本号 中值0D值 检测结果
1 阳性 21 阳性 2 阳性 22 阳性 3 阳性 23 阳性
4 阳性 24 阳性
5 阳性 25 阳性
6 阳性 26 阳性
7 阳性 27 阳性
8 阳性 28 阳性
9 阳性 29 阳性
10 阳性 30 阳性 11 阳性 31 阳性
12 阳性 32 阳性 13 阳性 33 阳性
14 阳性 34 阳性 15 阳性 35 阳性
16 阳性 36 阳性 17 阳性 37 阳性
18 阳性 38 阳性 19 阳性 39 阳性
20 阳性 40 阳性 低值样本X= s= cv=%
中值样本X= s= cv=%
批间精密度: 321实验方案:选择低值、中值质控品,每天重复测定 5次,连续进行4 天,记录并保存原始检测数据,计算 SD CV值。 3.2.2检测要求:批间精密度20%
3.2.3结果
HBsAg批间精密度
日期 低值OD值 中值OD值 日期 低值OD值 中值OD值 4月20日 4月22日
4月20日 4月22日
4月20日 4月23日
4月20日 4月23日
4月21日 4月23日
4月21日 4月23日
4月21日 4月24日
4月21日 4月24日
4月22日 4月24日
4月22日 4月24日
低值样本X= s= cv= HBsAb批间精密度
日期 低值0D值 中值0D值 日期 低值0D值 中值0D值
4月20日 4月22日
4月20日 4月22日
4月20日 4月23日
4月20日 4月23日
4月21日 4月23日
4月21日 4月23日
4月21日 4月24日
4月21日 4月24日
4月22日 4月24日
4月22日 4月24日
低值样本X= s= cv= 中值样本X= s= cv=
HCV批间精密度
日期 低值0D值 中值0D值 日期 低值0D值 中值0D值 4月20日 4月22日
4月20日 4月22日
4月20日 4月23日
4月20日 4月23日
4月21日 4月23日
4月21日 4月23日
4月21日 4月24日
4月21日 4月24日
4月22日 4月24日
4月22日 4月24日
低值样本X= s= cv=
中值样本X= s= cv=
4检出限验证
中值样本X= s= cv=
