37种脂肪酸甲酯DB-23
中链脂肪酸甘油三酯
在治疗方面,三中链脂肪酸甘油酯可作为营养剂。由于三中链脂肪 酸甘油 酯比长 链甘 油三 酯更容 易吸 收,它 可以 用在 脂肪吸 收较 差的疾 患,如组织囊纤维化的治疗,每克三中链脂肪酸甘油酯可提供 35kJ (8.3kcal)的热量。
虽然三中链脂肪酸甘油酯与长链甘油三酯相类似,但它在药物制剂 中的应用具有独特的优点。例如在皮肤表面易于涂抹,不阻碍皮肤的通 气,穿透性好,具有良好的润肤性和美容效果,在皮肤表面不形成可见 的薄膜,相容性和溶解性好,抗氧性稳定。[1]
Detection Flame ionisation. Split ratio 1:100. Composition of the fatty acid fraction of the substance: —caproic acid: maximum 2.0 per cent, —caprylic acid: 50.0 per cent to 80.0 per cent, —capric acid: 20.0 per cent to 50.0 per cent, —lauric acid: maximum 3.0 per cent, —myristic acid: maximum 1.0 per cent. Chromium Maximum 0.05 ppm, if intended for use in parenteral nutrition.
B. It complies with the test for saponification value (see Tests). C. It complies with the test for composition of fatty acids (see Tests). D. Evaporate 10 ml of the alcoholic mixture obtained in identification test A to dryness on a water-bath. Transfer the residue into a test-tube, add 0.3 ml of sulphuric acid R and close the test-tube with a stopper through which a U-shaped glass tube is inserted. One end of the U-tube is dipped into 3 ml of a 10 g/l solution of tryptophan R in a mixture of equal volumes of sulphuric acid R and water R. Heat the test-tube in a silicone-oil bath at 180 °C for 10 min and collect the liberated fumes in the tryptophan reagent. Heat the tryptophan reagent on a water-bath for 1 min. A violet colour develops. TES TS Appearance The substance to be examined is clear (2.2.1) and not more intensely coloured than reference solution Y3 (2.2.2, Method I). Alkaline impurities Dissolve 2.00 g in a mixture of 1.5 ml of alcohol R and 3.0 ml of ether R. Add 0.05 ml of bromophenol blue solution R. Not more than 0.15 ml of 0.01 M hydrochloric acid is required to change the colour of the indicator to yellow. Relative density (2.2.5) 0.93 to 0.96. Refractive index (2.2.6) 1.440 to 1.452. Viscosity (2.2.9) 25 mPa·s to 33 mPa·s.
脂肪酸检测--

生物样品中脂肪酸检测--科标技术科标技术分析中心简称“科标技术”,是青岛科标(检测)研究院旗下的专业分析研发品牌,由科标技术研发中心(青岛)有限公司独立运营。
科标技术依托科标检测品牌旗下的技术、设备、人员、平台等优势资源,地处化工行业产学研示范基地,可利用资源包括气相色谱质谱联用仪、液相色谱仪、ICP-OES等200余台/套先进的研发分析配套设备、5000平方米的实验室,保证分析的精度,为客户提供一站式的分析技术服务和整套解决方案。
科标技术作为“科标检测”品牌重点投资建设的专业研发品牌,可共享科标检测品牌旗下的优势团队资源。
专业研发团队150余人,其中教授(高级工程师、研究员)共9人,研究生以上学历共90余人,专业实验人员60余人。
科标品牌的发展得到了国家、省、市的大力支持与认可,是国家化工行业产学研示范基地分析研发板块支撑单位、科技部中小企业公共分析检测与科研创新资源共享服务平台、青岛市技术转移服务机构、青岛市名牌单位、青岛市“专、精、特、新”计划单位。
科标技术专业提供生物、环境、药品、精细化工、能源、材料等领域分析研发技术服务,专业解决国内外企业、高校院所、科研机构的分析方法开发与优化、课题外包、项目攻关等服务,致力于为客户提供最专业的分析研发解决方案,支撑科技进步,成为社会尊重、客户信赖的研究型分析研发机构。
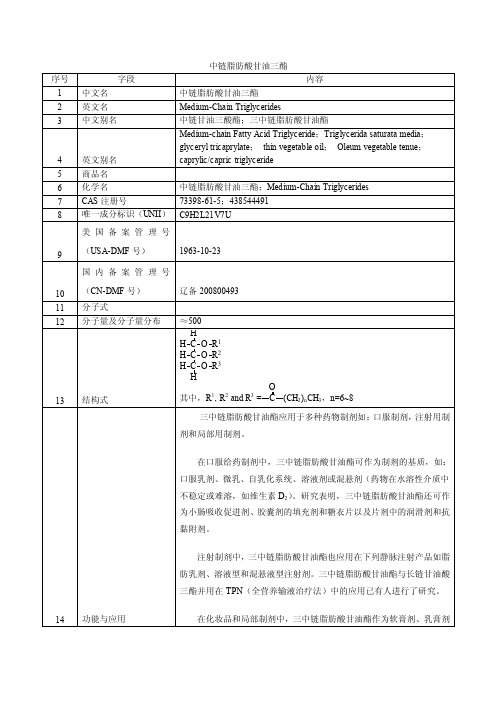
科标技术始终引领分析研发行业的科学化、标准化发展,秉承“敢为人先、开拓创新、同心协力、勇承重载”的科标精神,以服务赢得信任,以品质铸就辉煌。
科标技术——“让研发更简单”。
脂肪酸在生物中广泛存在,脂肪酸的检测是生物研究者常做项目,我中心利用GC-MS联用技术开发了脂肪酸检测方法,该方法比同行中常用的方法存在以下优势:需要样品量较少、灵敏度高、检出限低、可用于微量或痕量分析、数据准确。
脂肪酸检测(气相色谱质谱联用法)一、实验原理科标技术研发中心参照国标及各种文献将脂肪酸衍生化成脂肪酸甲酯,使用十九酸内标,用正己烷提取后稀释后用气相色谱质谱联用仪,外标法结合内标法定量分析。
气相色谱法测定动物油脂中反式脂肪酸

气相色谱法测定动物油脂中反式脂肪酸作者:黄向荣绪红霞陈秀华王冬究计文芳来源:《中国实用医药》2014年第06期【关键词】反式脂肪酸;动物油脂;气相色谱反式脂肪酸是一类不饱和脂肪酸,许多研究表明,反式脂肪酸对机体的生物学作用主要表现在对机体多不饱和脂肪酸代谢的干扰,对血脂和脂蛋白的影响及对胎儿生长发育的抑制作用[1]。
目前,关于有关脂肪酸分析的报道较多,而对动物油脂中反式脂肪酸的报道却较少。
本文用毛细管气相色谱法测定动物油脂中的反式脂肪酸,获得较满意的结果,现报告如下。
1 材料与方法1. 1 仪器 Agilent 6890型气相色谱仪;7683自动进样器;HP Chemstation 化学工作站(美国安捷伦公司);HWS26型电热水浴锅:上海一恒科技有限公司。
1. 2 试剂和样品 37种脂肪酸甲酯混合标准品、三氟化硼-甲醇,均为Sigma公司产品;正己烷;甲醇、氢氧化钠、无水硫酸钠:均为分析纯;样品选用猪油、牛油、羊油、鸡油、鸭油5种,均保存于4℃冰箱待检。
1. 3 色谱条件色谱柱:SP-2560毛细管柱(100.0 mm×0.25 mm×0.20 μm);分流比25:1;柱温:程序升温:初始温度140℃,保持5 min,以3.00℃/min升至230℃,保持10 min;进样口温度:250℃;检测器:氢火焰离子化检测器(FID)温度为260℃;载气:高纯氮;柱流速:1.0 ml/min(恒流);氢气流速:40 ml/min;空气流速400 ml/min;进样量1.0 μl。
1. 4 样品甲酯化[2] 取熔融后的油脂样品3~4滴于50 ml三角烧瓶中,加5 ml 4 mol/L氢氧化钠-甲醇溶液,使之溶解。
于80℃水浴加热皂化回流30 min后加入12%~15%的三氟化硼-甲醇溶液2 ml,再回流。
冷却至室温后加入正己烷和少量饱和氯化钠溶液并轻摇三角烧瓶数次,静置分层。
取上清液GC测定。
气相色谱-质谱法测定土壤中的磷脂脂肪酸

气相色谱-质谱法测定土壤中的磷脂脂肪酸张丽萍;王川;周巧红;王亚芬;吴振斌【摘要】采用气相色谱-质谱法测定土壤中的磷脂脂肪酸.土壤样品加入氢氧化钾的甲醇溶液中,其中的磷脂脂肪酸经甲酯化后,用正已烷萃取.萃取液采用Agilent DB-5MS色谱柱分离,质谱分析中选用全扫描和选择离子监测模式.26种脂肪酸甲酯的质量浓度在一定范围内与峰面积呈线性关系,检出限(3S/N)在0.001 2~0.295 9 mg·L-1之间.加标回收率在108%~115%之间,测定值的相对标准偏差(n=7)在3.2%~6.4%之间.【期刊名称】《理化检验-化学分册》【年(卷),期】2015(051)010【总页数】5页(P1353-1357)【关键词】气相色谱-质谱法;磷脂脂肪酸;土壤【作者】张丽萍;王川;周巧红;王亚芬;吴振斌【作者单位】中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉430072;中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉430072;中国科学院大学,北京100049;中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉430072;中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉430072;中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉430072【正文语种】中文【中图分类】O657.63磷脂脂肪酸(PLFA)是构成活体细胞膜的重要组分,存在于所有生物细胞膜中。
在细胞死亡后,PLFA很快被降解,可以代表微生物群落中“存活”的群体。
不同种类的微生物群落之间体内PLFA的组成和含量有显著的差异,可以用来评价微生物的生物量及群落结构[1]。
磷脂脂肪酸生物标记法[2-4]近年被广泛地应用于土壤微生物多样性研究,并作为土壤微生物种群变化的监测指标。
土壤微生物多样性,既代表着土壤的生物活性,也反映了土壤生态胁迫机制对其微生物群落的影响[5-6],其研究对于探索自然生命机制、开发超常生物资源、应对全球气候变化、治理各类环境污染、维持生态服务功能及促进土壤持续利用等方面具有重要意义[7]。
气相色谱法分析胡麻油中脂肪酸组成

气相色谱法分析胡麻油中脂肪酸组成牛艳;吴燕;陈翔;杨静【摘要】通过对前处理方法的摸索及仪器条件的优化,建立了气相色谱分析胡麻油中脂肪酸组成的方法,该方法可快速、准确地对胡麻油中脂肪酸组成进行检测.【期刊名称】《宁夏农林科技》【年(卷),期】2018(059)003【总页数】3页(P45-47)【关键词】气相色谱法;胡麻油;脂肪酸【作者】牛艳;吴燕;陈翔;杨静【作者单位】宁夏农林科学院农产品质量监测中心,宁夏银川 750002;宁夏农林科学院农产品质量监测中心,宁夏银川 750002;宁夏农林科学院农产品质量监测中心,宁夏银川 750002;宁夏农林科学院农产品质量监测中心,宁夏银川 750002【正文语种】中文【中图分类】O657.7+1;TS207.3亚麻籽(Flaxseed或Linseed)又称胡麻子[1],是我国5大油料作物之一,具有耐寒、怕高温的生物学特性,主要分布在东北、华北及西北地区。
胡麻油含有丰富的亚麻酸和各种不饱和脂肪酸,具有预防心血管疾病、促进大脑发育、抵制疾病基因等重要作用[2-3],长期以来胡麻油被用作高档的食用保健油。
国内外有对胡麻油脂肪酸检测方法的研究[4-6],但是检测方法比较复杂,分析耗时较长。
笔者比较研究了气相色谱法分析胡麻油中脂肪酸组成前处理条件及仪器优化,该方法具有快速、准确的特点,可以一次性完成胡麻油中脂肪酸的定性定量检测。
1 材料与方法1.1 仪器设备与试剂岛津2010Plus气相色谱仪(配FID检测仪),电子天平(精度0.000 1 g,AL102型,瑞士梅基特勒仪器有限公司),电热鼓风干燥箱(DHG-9240A型,上海恒一科学仪器有限公司),水浴锅(DK-S22型,上海精宏仪器有限公司),厚壁耐压瓶(中国欣维尔公司)。
37种脂肪酸甲酯(美国Sigma公司)、纯胡麻油、氢氧化钠(分析纯)、甲醇(色谱纯)、三氟化硼甲醇溶液(阿拉丁公司)、氢氧化钾(分析纯)、硫酸(分析纯)、正庚烷(色谱纯)、氯化钠(分析纯)。
脂肪酸甲酯加工工艺

脂肪酸甲酯及酸化油甲酯的生产工艺
一:将脂肪酸或酸化油加热到120度真空脱水半30分钟
二:按油重量的1%添加催化剂。
三:甲醇按油重量的1:1准备,从反应斧底部用定量泵加入,加入时间为2小时。
上部冷凝回收甲醇,不回流。
将酸价
降到2个以内停止甲醇的加入,并回收甲醇30分钟
四:粗甲酯经过滤后,将甲酯温度从120度降至80度,按油重量的10%---15%加入90度的热水水洗30分钟后静止一
小时后,放出下部水杂,甲酯可以直接蒸馏。
五:如酸化油需要进行酯交换。
将酸化油酸价降到2个以内后,水洗去除催化剂及杂质后真空干燥半小时。
将油重量的
0.8%—1%的氢氧化钾溶到油重量的20%的甲醇中。
将油温
降至60—65度,将醇碱溶液由下部加入并搅拌2小时。
80度真空脱醇30分钟后静止2小时放出甘油及杂质后再
蒸馏。
六:加工过程中必须专人看护,不得离岗,全程监护,严防意外,车间一级防火
1。
211188561_三种淡水鱼不同部位中甘油三酯脂肪酸的位置分布

李金林,胡祥飞,万亮,等. 三种淡水鱼不同部位中甘油三酯脂肪酸的位置分布[J]. 食品工业科技,2023,44(10):290−296. doi:10.13386/j.issn1002-0306.2022070175LI Jinlin, HU Xiangfei, WAN Liang, et al. Positional Distribution of Fatty Acids in Triglycerides from Different Parts of Three Freshwater Fish[J]. Science and Technology of Food Industry, 2023, 44(10): 290−296. (in Chinese with English abstract). doi:10.13386/j.issn1002-0306.2022070175· 分析检测 ·三种淡水鱼不同部位中甘油三酯脂肪酸的位置分布李金林1,3,胡祥飞2,万 亮3,梁庆喜2,彭 斌1,王 辉2,涂宗财1,2,*(1.江西师范大学生命科学学院国家淡水鱼加工技术研发中心,江西南昌 330022;2.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;3.南昌市检验检测中心,江西南昌 330012)摘 要:为分析淡水鱼不同部位中甘油三酯脂肪酸的含量与位置分布,本文以草鱼、青鱼、鲫鱼等淡水鱼为代表,经过固相萃取、专一性脂肪酶酶解,再利用气相色谱法测试了四个不同部位(头部、尾部、背部、内脏)中脂肪酸在甘油三酯Sn-1,2,3上的含量及位置分布。
结果显示:三种淡水鱼共检测到21种脂肪酸,单不饱和脂肪酸(monounsaturated fatty acids ,MUFAs )含量在29.58%~49.48%,除草鱼和青鱼内脏外,三种鱼类其余各部位甘油三酯Sn-1,3位置上MUFAs 的含量显著高于Sn-2位(P <0.05);多不饱和脂肪酸(polyunsaturated fatty acids ,PUFAs )含量范围为17.51%~46.55%,除草鱼背、尾部以及青鱼头、内脏,其他样品中甘油三酯Sn-2位置上PUFAs 的含量显著高于Sn-1,3位(P <0.05);三种淡水鱼中,花生四烯酸(arachidonic acid ,ARA )在甘油三酯上位置分布均匀,二十碳五烯酸(eicosapentaenoic acid ,EPA )主要分布于Sn-1,3位上,二十二碳五烯酸(docosapentaenoic acid ,DPA )和二十二碳六烯酸(docosahexaenoic acid ,DHA )主要分布于Sn-2位上。
食用木薯粉脂肪酸组成分析及贮藏时间对其影响

王琴飞,余厚美,吴若娜,等. 食用木薯粉脂肪酸组成分析及贮藏时间对其影响[J]. 食品工业科技,2023,44(23):229−237. doi:10.13386/j.issn1002-0306.2022040068WANG Qinfei, YU Houmei, WU Ruona, et al. Analysis of the Composition of Fatty Acids and the Effect of Storage Time on the Fatty Fcids in Edible Cassava Flour[J]. Science and Technology of Food Industry, 2023, 44(23): 229−237. (in Chinese with English abstract).doi: 10.13386/j.issn1002-0306.2022040068· 分析检测 ·食用木薯粉脂肪酸组成分析及贮藏时间对其影响王琴飞1,余厚美1,吴若娜1,林立铭1,谭婉碧1,2,张振文1, *,羊贤月1(1.中国热带农业科学院热带作物品种资源研究所/国家薯类加工技术研发分中心,海南海口 571101;2.武汉轻工大学食品科学与工程学院,湖北武汉 430023)摘 要:木薯粉的脂肪酸组成和含量对其营养品质和贮藏期都有着重要的影响。
实验以食用木薯粉为试材,通过优化脂肪酸甲酯化方法和气相色谱条件,建立了食用木薯粉中脂肪酸的定性定量检测方法,并对不同品种(系)、不同贮藏时间木薯粉中脂肪酸进行分析检测。
结果表明:气相色谱法可准确对木薯粉中多种脂肪酸进行定性定量分析,棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸浓度在20.0~1000.0、4.0~400.0、30.0~1500.0、10.0~500.0和2.0~100.0 μg/mL 的范围内线性关系良好,决定系数(R 2)在0.9992~0.9999之间;样品重复性相对标准偏差(RSD )在0.5%~3.2%之间;样品在室温下放置24 h 浓度变化的RSD 在0.7%~1.1%之间;5种脂肪酸样品加标平均回收率在88.0%~105.4%之间,平均回收率RSD 在3.4%~10.4%之间,证明样品稳定性、方法重复性和准确度较好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验
样品: 含有37 个组分的混合物(Supelco #18919),这是一个含有100 mg 纯净物质的混合 物,包含C4.C24 的FAME(相对浓度为2%.4%)。使用前所有样品在10 mL 己烷中 稀释(每种FAME 最后的浓度= 0.2.0.4 mg/mL)。
分析条件: 仪器:配备 FID 或Agilent MSD的Agilent 7890 GC. 色谱柱: 60 m x 0.25 mm ID,0.15 μm DB-23(J&W 122-2361) 详细色谱条件见各章节
典型谱图:
备注:
氦气为载气的GC-FID方法除检测器外色谱条件与GC-MS方法完全一致,使用本方法 整个分析时间为25min, 37个脂肪酸甲酯达到的基线分离, C22:1N9, C20:3n3, C20:4n6 三个脂肪酸甲酯完全分离.使用氦气为载气可满足客户对高分离度的要求.
3.GC-FID分析方法(氮气为载气):
分流比:
1/60
载气:
氮气
柱头压力:
242.3 kPa 恒压(在50 °C,38 cm/s)
柱箱温度:
检测器温度: 检测器气体:
典型谱图:
50 °C,1 min,25 °C/min 到175 °C,3.5 °C/min 到230 °C, 5 min。 280 °C
氢气: 40 mL/min; 空气450 mL/min; 尾吹气: 30 mL/min。
37种脂肪酸甲酯DB-23分析应用报告
前言
FAME 的分析用于食品中脂类部分含量的表征,也是食品分析中极为重要的一项 内容,脂类主要包括甘油酸酯,它们是一个甘油分子和三个脂肪酸分子的酯,绝大 多数食用脂肪和油主要含有的脂肪酸是从月桂酸(十二碳酸)到花生酸(二十碳 酸),除直链饱和脂肪酸外,也有支链脂肪酸、单不饱和脂肪酸、双不饱和脂肪酸 以及多不饱和脂肪酸。本应用使用DB-23柱(60m, 0.25mm, 0.15u, PN: 122-2361 ),在 angilent应用报告5989-3760CHCN的基础上, 面向客户需求和仪器配置开发GC-MS, GC-FID(氦气和氮气为载气)的37种脂肪酸甲酯分离分析解决方案
总结:
以上实验结果表明使用DB-23柱能满足37个脂肪酸甲酯的分离分析要求.使用氦气作 为载气(包括GC-MS和GC-FID)能够达到最佳的柱效和分离,37个脂肪酸甲酯都能达 到基线分离. 使用氮气作为载气时,柱效和分离有所降低,经调整色谱条件可使35个成
分达到基线分离, C22:2与C23:0的分离度也达到了1.3.用户可根据自身需求和实际条 件选择分析方法.
备注:
氮气为载气的GC-FID方法与氦气作为载气的方法相比,由于柱效有所降低,需要在色 谱条件上做出一些调整以到达最优化的分离:
1. 载气线速度由33cm/s调整为38 cm/s (相应的柱头压也由230kpa调整为242.3 kPa).较高的流速有助于C22:2与C23:0的分离(见图中标注).
2. 从175°C 到230°C的升温速率由4 °C/min 调整到3.5°C/min以提高C22:2 与C23:0的分离.
2.GC-FID分析方法(氦气为载气):
实验条件:
色谱系统:
Agilent 7890 GC
进样口:
分流/不分流
检测器:
氢火焰离子化检测器(FID)
自动进样器: Agilent 自动进样器
衬管:
分流衬管
色谱柱: 进样口温度: 进样体积: 分流比: 载气: 柱头压力: 柱箱温度:
60 m x 0.25 mm ID,0.15 μm DB-23(J&W 122-2361) 250 °C 1 μL
3. 分流比做了微调,由50:1调整为60:1. 使用本方法整个分析时间为25min, 37个脂肪酸甲酯达到的基线分离, C22:1N9, C20:3n3, C20:4n6 三个脂肪酸甲酯完全分离. 最难分离物质对C22:2与C23:0的分离 度为1.3, 进一步提高C22:2与C23:0的分离度会降低C24:1与C22:6等其他峰的分离度.
常见脂肪酸及其缩写。 脂肪酸通俗名称缩写 丁酸丁酸C4:0 己酸甲酯(C6:0)Methyl hexanoate 辛酸甲酯(C8:0)Methyl octanoate 癸酸癸酸C10:0 十一烷酸甲酯(C11:0)Methyl undecanoate 十二烷酸月桂酸C12:0 十三烷酸甲酯(C13:0)Methyl tridecanoate 十四烷酸肉豆蔻C14:0 肉豆蔻脑酸甲酯(C14:1)Methyl myristoleate 十五烷酸甲酯(C15:0)Methyl pentadecanoate 顺-10-十五碳烯酸甲酯(C15:1)Methyl cis-10-pentadecenoate 十六烷酸棕榈酸C16:0 十六烷烯酸棕榈油酸C16:1 十七烷酸甲酯(C17:0)Methyl heptadecanoate 顺-10-十七碳烯酸甲酯(C17:1)Methyl cis-10-heptadecenoate 十八烷酸硬脂酸C18:0 顺-9-十八烯酸油酸C18:1- cis (n9) 反-9-十八烯酸反油酸C18:1- trans (n9) 全顺-9, 12-十八碳二烯酸亚油酸C18:2 - cis (n6) 全反-9, 12-十八碳二烯酸反亚油酸C18:2 - trans (n6) 全顺-9, 12, 15-十八碳三烯酸α-亚油酸C18:3 (n3) 全顺-6, 9, 12-十八碳三烯酸γ- 亚油酸C18:3 (n6) 二十烷酸花生酸C20:0 顺-11-二十碳烯酸C20:1 (n9) 全顺-11, 14-二十碳二烯酸C20:2 (n6) 全顺-11, 14, 17-二十碳三烯酸C20:3 (n3) 全顺-8, 11, 14-二十碳三烯酸Dihomogammalinolenic acid C20:3 (n6) 全顺-5, 8, 11, 14-二十碳四烯酸花生四烯酸C20:4 (n6) 全顺-5, 8, 11, 14, 17-二十碳戊烯酸EPA C20:5 (n3) 二十一烷酸甲酯(c21:0)Methyl heneicosanoate 二十二碳酸山芋酸C22:0 顺-13-二十二碳烯酸芥酸C22:1 (n9) 顺-13,16-二十二碳二烯酸甲酯(C22:2)cis-13,16-Docosadienoic acid methyl ester 全顺-4, 7, 10, 13, 16, 19-二十二碳己烯酸DHA C22:6 (n3) 二十三碳酸甲酯(C23:0)Methyl tricosanoate 二十四烷酸二十四酸C24:0 顺-15-二十四碳烯酸神经酸C24:1 (n9)
1/50 氦气 230 kPa 恒压(在50 °C,33 cm/s) 50 °C,1 min,25 °C/min 到175 °C,4 °C/min 到230 °C,5
min。 检测器温度280 °C 检测器气体: 氢气: 40 mL/min; 空气450 mL/min; 尾吹气: 30 mL/min。
结果
1.GC-MS分析方法:
实验条件:
色谱系统:
Agilent 7890 GC
进样口:
分流/不分流
检测器:
Agilent MSD
transfer line 温度 :280°C,
scan: 40-450 amu 离子源: EI
自动进样器: Agilent 自动进样器
衬管:
分流衬管
色谱柱:
60 m x 0.25 mm ID,0.15 μm DB-23(J&W 122-2361)
实验条件:
色谱系统: Agilent 7890 GC
进样口:
分流/不分流
检测器:
氢火焰离子化检测器(FID)
自动进样器: Agilent 自动进样器
衬管:
分流衬管
色谱柱:
60 m x 0.25 mm ID,0.15 μm DB-23(J&W 122-2361)
进样口温度: 250 °C
进样体积:
1 μL
进样口温度: 进样体积:
ห้องสมุดไป่ตู้
250 °C 1 μL
分流比: 载气: 柱头压力: 柱箱温度:
1/50 氦气 230 kPa 恒压(在50 °C,33 cm/s) 50 °C,1 min,25 °C/min 到175 °C,4 °C/min 到230 °C,5 min。
典型谱图:
备注:
使用本方法整个分析时间为25min, 37个脂肪酸甲酯达到的基线分离, C22:1N9, C20:3n3, C20:4n6 三个脂肪酸甲酯完全分离.
