九年级科学物质的分类4
九年级化学物质的组成与分类

物质的简单分类•混合物、纯净物、单质、化合物的概念:(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。
从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
•混合物、纯净物、单质、化合物的概念:(1)混合物:由两种或多种物质混合而成的物质混合物没有固定的组成,一般没有固定的熔沸点常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质(1)金属单质:如Fe、Al、Cu等(2)非金属单质:如Cl2、O2、S等(4)化合物:由不同种元素组成的纯净物。
从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物①酸:电离理论认为电解质电离出阳离子全部是H+的化合物常见的强酸:HClO4H2SO4HCl HNO3等常见的弱酸:H2SO3H3PO4HF H2CO3CH3COOH等②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物常见强碱:NaOH KOH Ba(OH)2Ca(OH)2等常见弱碱:NH3·H2O Al(OH)3Fe(OH)3等③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐a正盐:Na2SO4Na2CO3(NH4)2SO4等b酸式盐:NaHCO3NaHSO4NaH2PO4Na2HPO4等c碱式盐:Cu(OH)2CO3Mg(OH)2CO3等d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等(6)氧化物:由两种元素组成,其中一种元素是氧的化合物①按组成分:金属氧化物:Na2O Al2O3Fe3O4等非金属氧化物:NO2SO2CO2等②按性质分:不成盐氧化物:CO NO等酸性氧化物:CO2SO2等碱性氧化物:Na2O CuO等两性氧化物:Al2O3ZnO等过氧化物:Na2O2H2O2等超氧化物:KO2等•特殊例子提醒:(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
物质的组成和分类
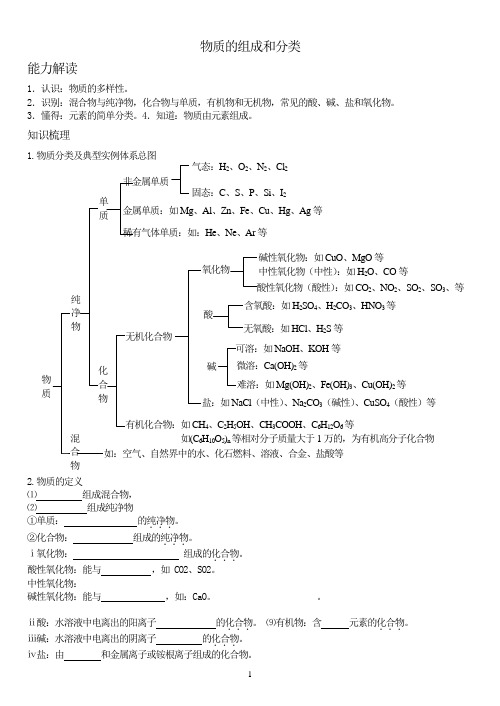
物质的组成和分类能力解读1.认识:物质的多样性。
2.识别:混合物与纯净物,化合物与单质,有机物和无机物,常见的酸、碱、盐和氧化物。
3.懂得:元素的简单分类。
4.知道:物质由元素组成。
知识梳理1.物质分类及典型实例体系总图2.物质的定义⑴ 组成混合物,⑵ 组成纯净物①单质: 的纯净物...。
②化合物: 组成的纯净物...。
ⅰ氧化物: 组成的化合物...。
酸性氧化物:能与 ,如 CO2、SO2。
中性氧化物:碱性氧化物:能与 ,如:CaO 。
。
ⅱ酸:水溶液中电离出的阳离子 的化合物...。
⑼有机物:含 元素的化合物...。
ⅲ碱:水溶液中电离出的阴离子 的化合物...。
ⅳ盐:由 和金属离子或铵根离子组成的化合物。
非金属单质 稀有气体单质:如:He 、Ne 、Ar 等 金属单质:如Mg 、Al 、Zn 、Fe 、Cu 、Hg 、Ag 等气态:H 2、O 2、N 2、Cl 2 固态:C 、S 、P 、Si 、I 2 物质 纯净物 如:空气、自然界中的水、化石燃料、溶液、合金、盐酸等 单质 化合物 无机化合物 有机化合物:如CH 4、C 2H 5OH 、CH 3COOH 、C 6H 12O 6等 如(C 6H 10O 5)n 等相对分子质量大于1万的,为有机高分子化合物 碱 盐:如NaCl (中性)、Na 2CO 3(碱性)、CuSO 4(酸性)等 酸碱性氧化物:如CuO 、MgO 等 酸性氧化物(酸性):如CO 2、NO 2、SO 2、SO 3、等 含氧酸:如H 2SO 4、H 2CO 3、HNO 3等 无氧酸:如HCl 、H 2S 等 可溶:如NaOH 、KOH 等 难溶:如Mg(OH)2、Fe(OH)3、Cu(OH)2等 微溶:Ca(OH)2等 中性氧化物(中性):如H 2O 、CO 等 混合物3.混合物:分散系:的体系,叫分散系。
分散质:(可以是气体、液体、固体)分散剂:(可以是气体、液体、固体)1.种类:溶液、胶体、浊液外观特征能否通过滤纸有否丁达尔效应实例分散质粒子大小/nm溶液NaCl、蔗糖溶液胶体有浊液泥水2.溶液的配制步骤:3.胶体的性质:4.分离提纯方法:练习1.现有C、H、O、Na、Cu、S六种元素,从中选出相关元素组成下列类别物质的化学式:(每类各写两例)⑴单质⑵酸⑶碱⑷盐⑸氧化物⑹有机物2.下面是物质分类图,请将“氧化物”、“化合物”、“单质”、“纯净物”、“盐”等名词填写在适当的方框中:3.化学来自于生活,用于生活,下表是生活中常用物质溶液的PH值及主要成分的化学式:编号①②③④⑤名称食醋白酒白糖水石灰水纯碱溶液主要成分CH3COOH C2H5OH C12H22O11Ca(OH)2Na2CO3溶液PH 3 7 7 11 10 试回答:⑴将上表①~⑤中主要成分进行分类(填序号,下同):属于酸的是__________;属于碱的是_________;属于盐的是__________;属于有机物的是__________。
物质的组成性质和分类

物质的组成性质和分类.第1讲物质的组成、性质和分类(建议2课时完成)[考试目标]1.了解化学的特点是在原子、分子水平上认识物质,了解化学可以识别、改变和制造分子2.了解分子、原子、离子等概念的含义、原子团的定义。
3.理解物理变化与化学变化的区别与联系。
4.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
5.理解酸、碱、盐、氧化物的概念及其相互联系。
[要点精析]一、化学的研究对象和内容、特征1、化学的研究对象化学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
是一门以实验为基础的自然科学。
化学的特征是认识分子、制造分子。
化学是具有创造性的、实用的科学,它帮助我们发现、认识、提取、制造自然界已有的物质,根据我们的需要,设计、创造自然界不存在的物质,为人类的生产、生活提供了功能各异的大量的物质基础。
通过化学家们的努力,现在发现和创造的化合物已经超过3500万种。
化学还为充分有效地利用能源、资源、保护环境,为解决人类饥饿、贫穷、疾病,为改善和丰富人类生活的各个方面作出了重要贡献,化学已深入到人类生活的各个方面,可以这样说,没有化学,就没有现代人类生活。
2、物质的性质物理性质:不需要发生化学反应所表现出来的性质,如:颜色、状态、气味、熔点、沸点、硬度、密度、导电、导热、溶解性等。
化学性质:在化学反应中所表现出来的性质。
如:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性等。
物理变化与化学变化的本质区别是前者没有新物质生成,后者生成了新的物质。
从微观的角度看,前者构成物质的分子本身没有发生变化,只是分子之间的距离发生了改变,后者构成物质的分子本身发生了变化,生成了新的分子,但原子和元素的种类并不发生变化。
两者的关系是:物质发生物理变化时不一定发生了化学变化,但发生化学变化时一定伴随着物理变化。
二、物质的分类为了认识自然和科学研究的方便,我们通常按一定的规则给物质分类,如:按组成元素分类有机物(由碳、氢为主要元素组成):烃、醇、醛、酸、酯、卤代烃、油脂等。
化学的分类知识点总结

化学的分类知识点总结一、物质的分类物质是宇宙中存在的基本实体,根据其化学性质的不同,可以将物质分为单质和化合物两大类。
1. 单质单质是由同一种元素组成的物质,例如金属铁、非金属碳、气体氧等等。
单质是由同一种原子构成,因此具有特定的化学性质。
2. 化合物化合物是由两种或两种以上不同元素化合而成的物质,例如氧化铁、水、二氧化碳等等。
化合物的化学性质取决于其组成元素的种类和数量,会显现出新的性质。
二、根据状态的分类物质的存在状态可以分为固体、液体和气体三大类。
1. 固体固体是物质的一种状态,在固体状态下,原子或分子之间的相互作用力比较大,分子排列有序。
固体的形状和体积都稳定不变,例如金属、盐类、晶体等都是固体。
2. 液体液体是物质的一种状态,在液体状态下,分子间的相互作用力较弱,分子排列松散,能流动而不固定形状。
例如水、酒精、汽油等都是液体。
3. 气体气体是物质的一种状态,气体的分子之间几乎没有相互作用力,能够自由运动并填满容器。
例如空气、氢气、氧气等都是气体。
三、根据物质成分的分类根据物质的成分,可以将物质分为混合物、元素和化合物三大类。
1. 混合物混合物是由两种或两种以上的纯物质以任意比例混合而成的,其中每种纯物质仍保持着其原有的化学性质,混合物的成分可以发生变化。
例如空气是由氧气、氮气、二氧化碳等气体按一定比例混合而成。
2. 元素元素是由同一种原子构成的物质,不能通过化学方法分解成其他物质。
元素是构成一切物质的基本成分,例如氢元素、氧元素、铁元素等。
3. 化合物化合物是由两种或两种以上不同元素按一定的化学结构和化学键结合而成的物质。
化合物的化学成分和比例是固定的,通常可以通过化学方法分解成其他物质。
四、根据化学性质的分类根据物质的化学性质,可以将物质分为酸、碱、盐等不同类别。
1. 酸酸是一类具有酸性的化合物或溶液,它们能够与碱中和并产生盐和水。
酸具有酸味和腐蚀性,能够蚀坏金属,变红蓝色的石蕊试纸。
人教版(五四学制)九年级化学复习:物质的分类教案

物质的分类教学设计教学目标:知识与技能:能根据物质的组成和性质对物质进行分类,同时知道分类的多样性。
知道交叉分类法和树状分类法,能根据需要选择并制作分类图。
知道四大反应的特征并进行区分和举例说明。
过程与方法:从学生所遇见的一些常见的分类事例入手,采用合作学习的方式,让学生将所学过的化学知识从自己熟悉的角度进行分类,将不同的知识通过某种关系联系起来,从而加深对知识的理解与迁移。
通过探究活动,学习与他人合作交流,共同研究、探讨科学问题。
情感态度与价值观:初步建立物质分类的思想,体会掌握科学方法能够有效提高学习效率和效果,体验活动探究的喜悦,感受化学世界的奇妙与和谐,增强学习化学的兴趣,乐于探究物质变化的奥秘。
教学方法与学习方式:活动探究式教学合作探究式学习教学重点:能根据物质的组成和性质对物质进行分类,建立分类思想,体会分类方法对于化学科学研究和化学学习的重要作用,体会合作探究学习方式。
熟悉四大基本反应并能相应的进行判断。
体会不同反应之间的联系和区别。
教学过程思考与交流我们学过哪些分类概念呢?混合物、纯净物、单质、化合物、无机物、有机物、氧化物、酸、碱、盐等分类概念的掌握纯净物和混合物纯净物:由同一种物质组成(如:H2、CO2、KMnO4)混合物:由两种或两种以上的物质物质混合而成,彼此间不发生化学反应(如:空气、碘酒)区别宏观:含物质的种类微观:含分子的种类(分子构成的物质)联系几种纯净物可以组成混合物,混合物可以分离成纯净物单质和化合物单质:由同种元素组成的(如:O2、Cu、He)化合物:由不同种元素组成的纯净物(如:H2O、CO、KMnO4)相同点均为纯净物区别宏观:含元素的种类微观:含原子的种类联系单质可以化合为化合物,化合物可以分解成单质,通过化学反应氧化物:是指两种元素组成且其中一种是氧元素的化合物(CaO, CuO, H2O, CO2)另一种若为金属元素,则为金属氧化物(CaO,CuO);另一种若为非金属,则为非金属氧化物(H2O,CO2)。
物质的组成、构成、分类

稀 有 气 8(He 体 元 素 是2个)
金属元 素 非金属 元 素 切
稳定
稳定
不变
不稳定结 易失电子、电子层改 <4 构 活泼 变 电子层不 易得电子、 ≥4 不稳定 变 活泼 元素的化学性质主要决定于最外层电子 记 数。而元素的种类取决于质子数
元素与原子的比较
元素 联系 区分
具有相同核电荷数的一类原子的总称。
2.有下列物质:①镁条②液态氧③氯酸钾④冰水混合物
⑤五氧化二磷⑥食盐水⑦氖气⑧空气
将它们的序号填入相应的横线上:
属于混合物的是 ⑥ ⑧ ;属于单质是 ① ② ⑦ ; 。 属于氧化物的是 ④ ⑤ ;属于化合物的是 ③ ④ ⑤
3.人们常说豆制品中富含蛋白质,菠菜中含丰富的铁质, 元素 这里的“铁质”指的是铁 。(用元素、单质、原 子、分子回答)
练习一
从Fe 、C 、 S 、H 、O 、N六种元素 中选择适当的元素按要求填空。 2个氧原子_____;2个氢分子________; 氧化铁中铁元素显+3价________;2个 硫酸根离子 。
练习二 从Na 、C 、 S 、H 、O 、N六种元素 中选择适当的元素按要求填空。 写出符合下列要求的物质的化学式: ①充入食品包装袋中可防腐的单质 是 ;②最简单的有机物是 ; ③汽水中含有的酸是 ; ④用于造纸、玻璃、印染、洗涤剂的盐 是_____________。
3.(2010· 泰州)下列物质中,由分子构成的是( B ) A.金刚石 B.氧气 C.氯化钠晶体 D.铜
5.(2010· 聊城)下列物质由原子直接构成的是( ) C A.空气 B.水 C.汞 D.氧气
6.(2010· 河南)下列变化能证明分子可以再分的是( D ) A.水蒸发 B.石蜡熔化 C.干冰升华 D.水通电分解
初三化学物质的组成和分类
第五讲:考点 1 物质的组成和分类知识要点1. 物质的组成和构成( 1) 物质的宏观组成:物质由同种或不同种的元素组成。
( 2) 物质的微观组成:物质由粒子构成。
分子:保持物质化学性质的粒子。
原子:化学变化中的最小粒子。
离子:带电的原子或原子团。
3) 物质组成与构成简图:宏观元素 物质(组成)微观 分子 原子 构成) 离子原子的结构:质子( +) 原子核原子中子 核外电子(—) 同种元素: ①核电荷数相同,核外电子数相同。
②核电荷数相同,核外电子数不同。
物质、元素、分子、原子的联系2. 物质的分类 金属: Cu 、 Fe 、 Zn 稀有气体: He 、Ne 、 Ar 非金属于: C 、 S 、P碱性氧化物: Na 2O 、Fe 2O 3 酸性氧化物:CO 2、 SO 2混合物元素 原子 分子物质 相同核电荷物质化合物 酸HCl H 2SO 4、 碱NaoH Ca(OH)2 盐NaCl Na 2CO 3构成物质的粒子分子 原子 离子4) 5) 6) 单质 纯净物考题例析[例 1] (北京市)下列关于水的组成,叙述正确的是 A. 水由氢气和氧气组成 B. 水由氢分子和氧原子组成 C. 水由氢元素和氧元素组成 C. 水由两个氢原子和一个氧原子组成 [例 2] (天津市)日常生活里用到的下列物质属于纯净物的是A. 调味用的食盐B. 取暖用的煤C. 降温用的冰水混合物D. 炒菜用的铁锅 [例 3] (河南省)下列各组物质按化合物,混合物顺序排列的是 A. 食盐、干冰 B. 胆矾、石灰石 C. 红磷、烧碱 D. ( 水银、 ) 生理盐水 精练 () B. 保持水的化学性质的粒子是水分子 D. 在化学反应分子可分而原子不可分 ,下列说法不正确的是 ( 1. 下列有关分子和原子的说法中,错误的是 A. 原子是由原子核和核外电子构成的C.分子的质量总比原子的质量大 2. 化学知识中有许多“相等” A.参加化学反应物质的总质量等于反应生成的物质的总质量 B.化合物中元素化合价的正价总数与负价总数的数值相等。
第一节物质的分类教学设计
第一节物质的分类教学设计
【课标要求】
对于本节,新课标的要求;。
编写《物质分类》一节课的教学设计方案,要求包含:
1.引入新课的情景片断。
2.体现物质分类的价值。
第一节物质的分类教学设计
【课标要求】
对于本节,新课标的要求是1:初步认识物质的科学分类方法,“能根据物质组成和性质对物质进行分类”,学会从不同角度对化学物质及物质之间的转化进行分类的基本方法。
2.了解常见物质及变化的分类方法。
3.感受分类法对于化学科学研究和化学学习的重要作用。
【教学目标】
知识与技能:
1.学会从多种角度、依据不同标准对物质进行分类。
2.知道“交叉分类法”和“树状分类法”这两种常用的分类方法。
3.能够根据反应物、生成物的种类和类别把化学反应分为:化合反应、分解反应、置换反应、复分解反应。
过程与方法:通过思考、讨论和交流等学习方式对信息进行加工处理。
情感、态度与价值观:学会运用比较、分类的方法,感悟分类法是一种行之有效的、简单易行的科学方法,体会到在对化学物质和化学反应分类的基础上来进一步学习高中阶段的化学知识会更简单、更加事半功倍。
【教学重点】物质分类。
【教学难点】物质之间的转化关系
【教学方法】讲授、讨论、实验探究、总结。
【教学用品】多媒体设备,投影仪。
【教学过程】。
九年级科学上知识点总结(最全)
九上第一章 知识要点一、酸的通性1、酸能使紫色石蕊变 红 色,不能使无色酚酞变色。
2、酸 + 碱 --- 盐 + 水(复分解反应)①用胃舒平中和过多胃酸 3HCl + Al(OH)3 ==== AlCl 3 + 3H 2O 。
②硫酸和氢氧化铜反应 Cu(OH)2 + H 2SO 4 === CuSO 4 + 2H 2O 。
3、金属氧化物 +酸 ---- 盐 + 水 (复分解反应)①用盐酸除铁锈 Fe 2O 3 + 6HCl === 2FeCl 3 + 3H 2O②变黑的铜丝和稀硫酸反应 CuO + H 2SO 4 ==== CuSO 4 + H 2O4、金属单质 + 酸 ---- 盐 + 氢气 (置换反应)①生锈铁钉在足量盐酸中产生气泡 Fe + H 2SO 4 = FeSO 4 + H 2↑②实验室制氢气 Zn + H 2SO 4 = ZnSO 4 + H 2↑5、酸 + 盐 ----- 另一种酸 + 另一种盐(复分解反应)①检验氢氧化钠已变质(加盐酸) Na 2CO 3 + 2HCl === 2NaCl + H 2O + CO 2↑②检验盐酸中的氯离子 HCl + AgNO 3 === AgCl ↓ + HNO 3③检验硫酸中的硫酸根离子 H 2SO 4 + BaCl 2 ==== BaSO 4 ↓+ 2HCl二、碱的通性1、碱能使紫色石蕊变 蓝 色,使无色酚酞变 红 色。
2、酸 + 碱 -----盐 + 水(复分解反应)①用烧碱中和石油中的硫酸 H 2SO4 + 2NaOH ==== Na 2SO4 + 2H 2O3、非金属氧化物 +碱 --- 盐 + 水①氢氧化钠放在空气中变质 2NaOH + CO 2 == Na 2CO 3 + H 2O②用烧碱溶液吸收工厂二氧化硫 2NaOH + SO 2 == Na 2SO 3 + H 2O4、碱 + 盐 ----另一种碱 + 另一种盐(复分解反应)①配制的波尔多液农药不能久置 Ca(OH)2 + CuSO 4 ==== Cu(OH)2↓ + CaSO 4②氯化铁与烧碱反应 3NaOH + FeCl 3 ==== Fe(OH)3↓ + 3NaCl三、金属的性质1、金属活动性顺序 K Ca Na Mg Al 、Zn Fe Sn Pb (H)、 Cu Hg Ag Pt Au2①2、金属单质 + 酸①镁带与稀硫酸反应 Mg+ H 2 SO 4 === Mg SO 4 + H 2↑小结:金属与酸反应条件是:金属活动顺序表排在H 前的金属才能置换出酸中的氢3、金属单质 + 盐(溶液)--- 另一种金属 + 另一种盐(置换反应)①湿法炼铜 Fe + CuSO 4 === FeSO 4 + Cu②红色铜丝放入硝酸银溶液 Cu + 2AgNO 3=== Cu(NO 3)2 + 2Ag小结:金属与盐反应的条件 金属加溶盐 强进弱出 。
九年级化学第四单元知识点总结
九年级化学第四单元知识点总结
化学是自然科学的一个重要分支,是研究物质的组成、构造、性质、变化及其规律性的学科。
在九年级化学中,第四单元主要涉及了有机化合物及其衍生物的性质和应用方面的知识。
一、有机化合物的特点
1.含碳元素
2.共价键的成键方式:杂化及构形
3.碳原子的电性
4.官能团的特征
二、有机化合物的命名
1.烷基、烯基和炔基
2.取代基的命名
3.环烷化合物的命名
4.醇、醚、羧酸及其衍生物的命名
5.芳香族、脂环族、螺环族及其衍生物的命名
三、有机化合物的分类
1.脂肪族化合物:烷烃、卤代烷、醇等
2.芳香族化合物:苯及其衍生物
3.酯类
4.羧酸及其衍生物
5.氨基酸及其衍生物
6.卤代烃
四、有机化合物的反应
1.取代反应:卤代反应、烷基化反应和烯烃加成反应等
2.加成反应:烯烃加成反应和芳香族化合物加成反应等
3.消除反应:脱水反应和脱卤反应等
4.氧化反应:1-级、2-级、3-级醇的氧化等
5.还原反应:烯烃的还原反应和醛酮的还原反应等
五、常见有机物的应用
1.石油化工
2.精细化工
3.医药、农药
4.橡胶、塑料
5.日用品
有机化学是一个相对特殊的学科,它涉及到的知识点比较多且晦涩难懂,同时许多重要的应用也需要结合具体的实例来深入理解。
因此,在学习过程中需要多做笔记、理解和实践,不断丰富自己的有机化学知识,提高自己的实际操作能力,才能更好地掌握其中的知识。
