实验二十一 可溶性总糖的测定(地衣酚 硫酸法)
实验8-可溶性总糖的测定(蒽酮法)

实验8-可溶性总糖的测定(蒽酮法)实验目的:2. 了解可溶性总糖在不同食品中的含量。
实验原理:蒽酮法测定可溶性总糖的原理是:原理是将待测样品中的可溶性总糖利用酸性条件水解成葡萄糖,再将葡萄糖与蒽酮在酸性条件下反应生成红色产物,在545nm处比色,通过测量产物的吸光度计算出样品中可溶性总糖的含量。
实验步骤:1. 预处理样品称取25g待测样品,加入100mL蒸馏水,加热煮沸5min,冷却至室温,定容到500mL。
2. 酸水解取10mL待测样品,加热至沸腾,加入10mL 0.6mol/L HCl,再加入2mL 66% L-酒精溶液,沸腾10分钟,冷却至室温。
3. 测定葡萄糖含量取上述溶液10mL,加入20mL 蒸馏水,加入0.5g硫代硫酸钠,加1mL4%酚酞酸指示剂,用0.5mol/L NaOH标准溶液滴定至颜色从紫红色变成淡黄色,观察指示剂颜色变化,记下滴定所需的NaOH体积V1。
4. 去色取剩余的水解溶液(约50mL),加45mL蒸馏水,加入0.5g氯化钠,用3.48×10^-3mol/L 二硫代磺酸钠溶液滴定至橙色转变为淡黄色(V2)。
5. 比色取2mL去色溶液,加0.50mL 1%蒽酮溶液,加0.50mL 4%氢氧化钠溶液,加入烧杯中,隔水加热沸腾5分钟,冷却后用0.5mol/L HCl标准溶液掉定至颜色由深红色变成粉色(V3)。
6. 计算结果计算样品中可溶性总糖的含量(y):y=(V1-V2)×1000/6.9×V3 (单位:g/100g或mg/L)实验提示:1. 为了减小误差,应使用称量精度较高的电子天平。
2. 滴定时应慢慢加入标准溶液,用玻璃棒搅拌均匀,直到指示剂颜色变化停止。
3. 比色前需要将产物稳定,此步骤是较关键的实验步骤之一,需要加热沸腾不超过5分钟,并且不要在加热沸腾时将实验管口对准自己。
实验结果:利用蒽酮法测定了不同食品中的可溶性总糖的含量,样品1(西瓜)为0.58g/100g,样品2(草莓)为0.67g/100g,样品3(苹果)为0.49g/100g,样品4(香蕉)为0.59g/100g。
植物与青贮饲料中可溶性糖的提取与测定

植物与青贮饲料中可溶性糖的提取与测定原理:单糖类遇浓硫酸时,脱水生成糠醛衍生物,后者可与蒽酮缩合成蓝绿色的化合物,当糖的量在20-200mg范围内时,其呈色强度与溶液中糖的含量成正比,故可用比色定量。
材料:过40目的植物或青贮饲料粉末(70度烘干48小时后,粉碎过筛)试剂:1)葡萄糖标准溶液:0.1000g葡萄糖(分析纯)溶于20ml蒸馏水中,定容于100ml.制标准曲线时,吸1ml此溶液,稀释10倍(密度为100ug/ml)2)蒽酮硫酸指示剂:称0.2000g蒽酮溶于100ml浓H2SO4(1.84)中,当日配制使用.步骤:1)样品中可溶性糖的提取:称取约0.3-0.5g(精确到0.0001g)样品倒入25ml试管中,再加15ml煮沸的蒸馏水,塞上塞子,在90度水浴中振荡提取40分钟,过滤,并用少量蒸馏水洗滤纸上的残渣,使WSC全部流到滤液中;对滤液再加入少许(约0.010g)活性碳,90度脱色30min,过滤, 并用少量蒸馏水洗滤纸上的残残渣,将滤液用蒸馏水定容至50ml(视材料而定也可以是100ml或500ml).取1ml此糖提取液,加入4ml蒽酮硫酸试剂,在冰水中冷却(加盖防止蒸发).再在100度沸水中提取,当沸水重新沸起后,准确煮沸10分钟后取出,用流水冷却后,放置10分钟,在620nm下比色,测吸光值.2)标准曲线制作:取6只大试管,配制不同浓度的葡萄糖溶液3)在支试管加入蒽酮硫酸试剂4.0ml,在冰水中冷却(加盖防止蒸发). 再在100度沸水中提取,当沸水重新沸起后,准确煮沸10分钟,用流水流水冷却后,放置10分钟,在620nm下比色,测吸光值.最后以葡萄糖含量为横坐标,以吸光度为纵坐标,作出标准曲线.结果处理:样品中含糖量(%)=测出的糖量(ug)×稀释倍数×100/样品重量/1000000注意:试管与离心管,溶量瓶一定要洗干净;加热,比色时间要准确.。
总糖的测定实验报告

总糖的测定实验报告总糖的测定实验报告引言:总糖是指食物中所有可溶性糖类的总和,包括单糖、双糖和多糖。
在食品工业中,准确测定食物中的总糖含量对于产品质量的控制和消费者的健康至关重要。
本实验旨在通过一系列实验步骤,测定某种食品中的总糖含量,并探讨不同测定方法的准确性和可行性。
实验原理:总糖的测定方法有很多种,常用的有显色法、酶解法和高效液相色谱法。
本实验采用显色法进行总糖的测定。
该方法是利用总糖与酚酞反应,生成红色络合物,通过比色测定络合物的吸光度来确定总糖的含量。
实验步骤:1. 样品制备:将待测样品加入适量的蒸馏水中,充分溶解。
2. 酚酞溶液制备:将适量的酚酞溶解于蒸馏水中,制备成0.5%的酚酞溶液。
3. 反应体系制备:取适量的样品溶液和酚酞溶液混合,加入适量的硫酸,使反应体系呈酸性。
4. 反应与显色:将反应体系加热至沸腾,保持沸腾2-3分钟,使反应充分进行。
然后冷却至室温,观察溶液颜色的变化。
5. 吸光度测定:使用分光光度计,在波长为520nm处测定反应体系的吸光度。
6. 标准曲线绘制:取一系列不同浓度的葡萄糖溶液,按照上述步骤进行显色反应,并测定吸光度。
根据吸光度与浓度的关系,绘制标准曲线。
7. 总糖含量计算:根据样品的吸光度值,利用标准曲线得出样品中总糖的含量。
结果与讨论:通过实验测定,得到了待测食品中总糖的含量为X g/100g。
这个结果表明该食品中含有较高的总糖含量,可能对于某些人群来说,摄入过多的该食品可能会导致健康问题。
总糖的测定方法中,显色法是一种简便、快速的方法。
然而,该方法对于一些特殊的食品样品可能会产生干扰,导致测定结果不准确。
因此,在实际应用中,需要根据不同的食品样品选择合适的测定方法。
此外,本实验中使用了葡萄糖作为标准物质,绘制了标准曲线。
标准曲线的制备对于准确测定样品中总糖的含量至关重要。
在实际应用中,可以根据需要选择其他合适的标准物质,并制备相应的标准曲线。
结论:通过本实验,我们成功测定了某种食品中的总糖含量,并探讨了不同测定方法的准确性和可行性。
实验八 可溶性总糖的测定

实验八可溶性总糖的测定食品中的总糖通常是指具有还原性的糖(葡萄糖、果糖、乳糖、麦芽糖等)和在测定条件下能水解为还原性单糖的蔗糖的总量。
总糖是食品生产中常规分析项目。
它反映的是食品中可溶性单糖和低聚糖的总量,其含量高低对产品的色、香、味、组织形态、营养价值、成本等有一定影响。
总糖是麦乳精、糕点、果蔬罐头、饮料等许多食品的重要质量指标。
一、实验目的掌握食品中可溶性总糖的测定方法。
二、实验原理样品经处理除去蛋白质等杂质后,加入盐酸,在加热条件下使蔗糖水解为还原性单糖,以直接滴定法测定水解后样品中的还原糖总量。
三、仪器试剂及玻皿配置1. (1+1)盐酸溶液。
2. 0.1%甲基红乙醇溶液:称取0.1g 甲基红,用70%乙醇溶解并定容到100mL。
3. 30%氢氧化钠溶液。
4. 0.1%转化糖标准溶液:准确称取105℃烘干至恒重的纯蔗糖1.0526g 于锥形瓶中,用100mL 水溶解后,加(1+1)盐酸5mL,在68~70℃水浴中加热15min,取出于流动水下迅速冷却,加甲基红指示剂 2 滴,用30%NaOH 溶液中和至中性,转移至1000mL 容量瓶中,加水至刻度,混匀。
此溶液每毫升含转化糖1mg。
5. 其他试剂、仪器及玻皿配置(同直接滴定法测定还原糖)。
四、测定方法1.样品处理:同直接滴定法测定还原糖。
2.测定:称取一定量样品,按直接滴定法中的样品提取方法处理,吸取处理后的样液50mL,放入100mL 容量瓶中。
加入5mL(1+1)盐酸溶液,置68~70℃水浴中加热15min,取出迅速冷却至室温,加2 滴甲基红指示剂,用30% NaOH 溶液中和至中性,加水至刻度,混匀。
然后按直接滴定法测定还原糖含量。
五、结果计算式中:F——10mL 酒石酸钾钠铜溶液相当的转化糖的质量,mg;V1——样品溶液定容体积,mL;V2——测定时消耗样品水解液的体积,mL;m——样品质量,g;六、说明与讨论1. 总糖测定结果一般以转化糖计,但也可以以葡萄糖计,要根据产品的质量指标要求而定。
总糖的测定

一. 总糖的测定食品中的总糖主要指具有还原性的葡萄糖,果糖,戊糖,乳糖和在测定条件下能水解为还原性的单糖的蔗糖(水解后为1分子葡萄糖和1分子果糖),麦芽糖(水解后为2分子葡萄糖)以及可能部分水解的淀粉(水解后为2分子葡萄糖)。
还原糖类之所以具有还原性是由于分子中含有游离的醛基(-CHO)或酮基(=C=O)。
测定总糖的经典化学方法都是以其能被各种试剂氧化为基础的。
这些方法中,以各种根据斐林氏溶液的氧化作用的改进法的应用范围最广。
在这里我们主要给大家介绍铁氰化钾法,蒽铜比色法,斐林氏容量法。
斐林氏容量法由于反应复杂,影响因素较多,所以不如铁氰化钾法准确,但其操作简单迅速,试剂稳定,故被广泛采用。
蒽铜比色法要求比色时糖液浓度在一定范围内,但要求检测液澄清,此外,在大多数情况下,测定要求不包括淀粉和糊精,这就要在测定前将淀粉,糊精去掉,这样就使操作复杂化,限制了其广泛应用。
(一)铁氰化钾法1.原理样品中原有的和水解后产生的转化糖都具有还原性质,在碱性溶液中能将铁氰化钾还原,根据铁氰化钾的浓度和检验滴定量可计算出含糖量。
其反应为下:C6H12O6+6K3[Fe(CN)6] + 6KOH →(CHOH)4·(COOH)2 + 6K4[Fe(CN)6]+ 4H2O滴定终了时,稍过量的转化糖即将指示剂次甲基兰还原为无色的隐色体。
2.试剂1)1%的次甲基兰指示剂2)盐酸(水解作用)3)10%和30%的NaOH溶液4)1%铁氰化钾(贮存特色瓶,临用前标定)3.标定步骤称蔗糖1.0000g→定容500ml→取此液50ml→于100ml容量瓶→加hcl5ml→摇匀→65-7 0℃水裕15分钟→取出冷却→用30%NaOH中和→加水于刻度→倒入滴定管中→取10ml1%铁氰化钾于锥形瓶中→加10%NaOH2.5ml加12.5ml的水加玻璃珠颗粒→加热至沸→保持一分钟→加次甲基兰1滴→立即以糖液滴足至蓝色退去为止,记录用量。
水稻可溶性总糖测定
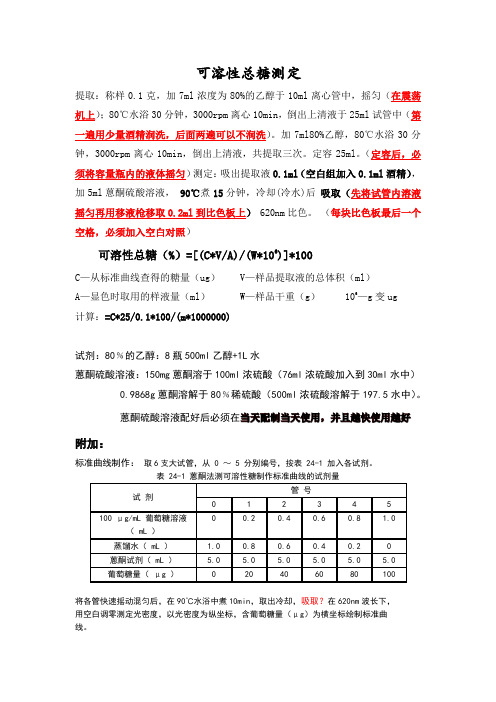
可溶性总糖测定提取:称样0.1克,加7ml浓度为80%的乙醇于10ml离心管中,摇匀(在震荡机上);80℃水浴30分钟,3000rpm离心10min,倒出上清液于25ml试管中(第一遍用少量酒精润洗,后面两遍可以不润洗)。
加7ml80%乙醇,80℃水浴30分钟,3000rpm离心10min,倒出上清液,共提取三次。
定容25ml。
(定容后,必须将容量瓶内的液体摇匀)测定:吸出提取液0.1ml(空白组加入0.1ml酒精),加5ml蒽酮硫酸溶液,90℃煮15分钟,冷却(冷水)后吸取(先将试管内溶液摇匀再用移液枪移取0.2ml到比色板上)620nm比色。
(每块比色板最后一个空格,必须加入空白对照)可溶性总糖(%)=[(C*V/A)/(W*106)]*100C—从标准曲线查得的糖量(ug) V—样品提取液的总体积(ml)A—显色时取用的样液量(ml) W—样品干重(g) 106—g变ug计算:=C*25/0.1*100/(m*1000000)试剂:80﹪的乙醇:8瓶500ml乙醇+1L水蒽酮硫酸溶液:150mg蒽酮溶于100ml浓硫酸(76ml浓硫酸加入到30ml水中)0.9868g蒽酮溶解于80﹪稀硫酸(500ml浓硫酸溶解于197.5水中)。
蒽酮硫酸溶液配好后必须在当天配制当天使用,并且越快使用越好附加:标准曲线制作:取6支大试管,从 0 ~ 5 分别编号,按表 24-1 加入各试剂。
表 24-1 蒽酮法测可溶性糖制作标准曲线的试剂量将各管快速摇动混匀后,在90℃水浴中煮10min,取出冷却,吸取?在620nm波长下,用空白调零测定光密度,以光密度为纵坐标,含葡萄糖量(μg)为横坐标绘制标准曲线。
葡萄糖溶液:0.1g葡萄糖(105℃,6h)定容至1L。
常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为1.84g·cm-3,其物质的量浓度为18.4mol·L-1。
硫酸苯酚法测定糖
硫酸苯酚法测定糖
原理:
植物体内的可溶性糖主要是指能溶于水及乙醇的单糖和寡聚糖。
苯酚法测定可溶性糖的原理是:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10-100mg范围内其颜色深浅与糖的含量成正比,且在490nm波长下有最大吸收峰,故可用比色法在此波长下测定。
苯酚法可用于甲基化的糖、戊糖和多聚糖的测定,方法简单,灵敏度高,实验时基本不受蛋白质存在的影响,并且产生的颜色稳定160min以上。
试剂:
1、80%苯酚储备液:称取80g苯酚(AR),加蒸馏水20mL溶解,在室温下可保存数月;
2、8%苯酚溶液,
每次测定前取适量80%苯酚溶液稀释至8%浓度;
3、浓硫酸;
4、葡萄糖标准液:用电子天平称取约1g葡萄糖,准确记录重量,定容至1L。
步骤:
1、标准曲线制作:取50ml比色管6只,从0-5编号,0号管作为空白,
在1-5号管中分别加入1、2、3、4、5ml葡萄糖标准液。
定容至50ml
刻度,则1-5号管中溶液浓度依次为20,40,60,80,100mg/L。
2、测定:将样品稀释至浓度在0-100mg/L,然后取2ml稀释液,1ml8%
苯酚溶液,5ml浓硫酸至10ml的Hach管中,将葡萄糖溶液进行同
样操作,拧上盖子待温度降至室温后用分光光度计在490nm处波长
测定其吸光度。
3、按照葡糖糖溶液的吸光度做出标准曲线,然后由样品的吸光度求得
其浓度,再乘以稀释倍数得到最终浓度,检验样品重复性,三次平
行样相对误差应小于5%,若超过需要重新测定。
植物组织可溶性糖的测定
植物组织中可溶性糖与淀粉的测定植物体内的碳素营养状况以及农产品的品质性状,常以可溶性糖和淀粉的含量作为重要指标,本实验学习几种定量测定可溶性糖和淀粉的方法。
一、苯酚法测定可溶性糖【原理】植物体内的可溶性糖主要是指能溶于水及乙醇的单糖和寡聚糖。
苯酚法测定可溶性糖的原理是:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10~100Mg范围内其颜色深浅与糖的含量成正比,且在485nM波长下有最大吸收峰,故可用比色法在此波长下测定。
苯酚法可用于甲基化的糖、戊糖和多聚糖的测定,方法简单,灵敏度高,实验时基本不受蛋白质存在的影响,并且产生的颜色稳定时间在160Min以上。
【仪器与用具】分光光度计;电炉;铝锅;20Ml刻度试管;刻度吸管5Ml 1支,1Ml 2支;记号笔;吸水纸适量。
【试剂】90%苯酚溶液:称取90g苯酚(AR),加蒸馏水10Ml溶解,在室温下可保存数月;9%苯酚溶液:取3Ml 90%苯酚溶液,加蒸馏水至30Ml,现配现用;浓硫酸(比重1.84);1%蔗糖标准液:将分析纯蔗糖在80℃下烘至恒重,精确称取1.000g。
加少量水溶解,移入100Ml容量瓶中,加入0.5Ml浓硫酸,用蒸馏水定容至刻度;100μg/L蔗糖标准液:精确吸取1%蔗糖标准液1Ml加入100Ml容量瓶中,加水定容。
【方法】1.标准曲线的制作取20Ml刻度试管11支,从0~10分别编号,按表1-1加入溶液和水,然后按顺序向试管内加入1Ml 9%苯酚溶液,摇匀,再从管液正面以5~20s时间加入5Ml浓硫酸,摇匀。
比色液总体积为8Ml,在恒温下放置30Min,显色。
然后以空白为对照,在485nM波长下比色测定,以糖含量为横坐标,光密度为纵坐标,绘制标准曲线,求出标准直线方程。
表1-1各试管加入溶液和水的量试管 1 2 3 4 5 6100ug/L蔗糖液(ml)0 0.2 0.4 0.6 0.8 1.0水(ml) 2.0 1.8 1.6 1.4 1.2 1.0苯酚(ml) 1.0 1.0 1.0 1.0 1.0 1.0浓硫酸(ml) 5.0 5.0 5.0 5.0 5.0 5.0蔗糖量(μg)0 20 40 60 80 1002.可溶性糖的提取取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.10~0.30g,共3份,分别放入3支刻度试管中,加入5~10Ml蒸馏水,塑料薄膜封口,于沸水中提取30Min(提取2次),提取液过滤入25Ml容量瓶中,反复冲洗试管及残渣,定容至刻度。
总糖的测定方法
总糖的测定方法
总糖的测定是食品分析中的重要内容,不同的食品中总糖的含量也会有所不同。
因此,正确、准确地测定总糖的含量对于食品质量的控制和评价具有重要意义。
下面将介绍几种常用的总糖测定方法。
首先,常用的总糖测定方法之一是菲林法。
这种方法是将待测样品与酚酞溶液
和硫酸混合,然后在沸水浴中加热,使其发生蓝色到粉红色的变化,再用标准葡萄糖溶液进行比色测定。
菲林法操作简便,结果准确,因此被广泛应用于食品分析领域。
其次,还有硫酸酚法。
这种方法是将待测样品与硫酸酚溶液混合,然后在沸水
浴中加热,使其发生褐色沉淀,再用标准葡萄糖溶液进行比色测定。
硫酸酚法操作简单,结果准确,适用于各种食品样品的总糖测定。
另外,还有氧化还原滴定法。
这种方法是将待测样品与氢氧化钠溶液和酚酞溶
液混合,然后滴加碘液进行滴定,直至出现蓝色终点,再用标准葡萄糖溶液进行滴定测定。
氧化还原滴定法操作简单,结果准确,适用于各种食品样品的总糖测定。
最后,还有高效液相色谱法。
这种方法是利用高效液相色谱仪对待测样品进行
分离和检测,通过测定色谱图谱中总糖峰的面积来计算总糖的含量。
高效液相色谱法操作复杂,但结果准确,适用于各种复杂食品样品的总糖测定。
总之,不同的总糖测定方法各有优缺点,具体选择应根据实际情况和要求进行。
在进行总糖测定时,需严格按照操作规程进行,以确保测定结果的准确性和可靠性。
希望本文介绍的总糖测定方法能够对您有所帮助。
总糖的测定实验报告
总糖的测定实验报告一、实验目的总糖是指样品中还原糖和非还原糖的总和。
本次实验的目的是掌握总糖测定的原理和方法,学会使用相关仪器和试剂进行准确的测定,并通过实验数据的处理和分析,得出样品中总糖的含量。
二、实验原理总糖的测定通常采用蒽酮比色法。
糖类在浓硫酸的作用下,可脱水生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色复合物。
在一定范围内,颜色的深浅与糖的含量成正比,通过比色法可以测定出样品中总糖的含量。
三、实验仪器与试剂1、仪器分光光度计恒温水浴锅电子天平容量瓶(100ml、50ml、25ml)移液器移液管(1ml、2ml、5ml、10ml)具塞刻度试管(25ml)玻璃棒漏斗滤纸2、试剂蒽酮试剂:称取 02g 蒽酮溶于 100ml 浓硫酸中,当日配制使用。
葡萄糖标准溶液(100μg/ml):准确称取 01g 无水葡萄糖,用蒸馏水溶解并定容至 1000ml。
样品溶液:将待测样品经过适当处理后,制成一定浓度的溶液。
四、实验步骤1、葡萄糖标准曲线的绘制取 6 支 25ml 具塞刻度试管,分别编号为 0、1、2、3、4、5。
按表 1 加入葡萄糖标准溶液和蒸馏水。
|试管编号|0|1|2|3|4|5||||||||||葡萄糖标准溶液(ml)|0|02|04|06|08|10||蒸馏水(ml)|10|08|06|04|02|0||葡萄糖含量(μg)|0|20|40|60|80|100|向各试管中迅速加入 5ml 蒽酮试剂,摇匀后立即放入沸水浴中加热10min,取出后用流水冷却至室温,在 620nm 波长下,以 0 号管为空白对照,测定各管的吸光度值。
以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
2、样品溶液的制备称取适量的样品,经过粉碎、研磨等处理后,用蒸馏水溶解并定容至一定体积。
若样品溶液中含有较多杂质,可先用滤纸过滤。
3、样品溶液的测定吸取 1ml 样品溶液于 25ml 具塞刻度试管中,加入 4ml 蒸馏水,再迅速加入 5ml 蒽酮试剂,摇匀后立即放入沸水浴中加热 10min,取出后用流水冷却至室温。
