高二化学选修四第三章第二节练习
2021高二化学选修四同步:第三章 水溶液中的离子平衡 综合训练

常数) B.常温下,由水电离出的 c(H+)=10-12mol·L-1 的溶液的 pH 可能为 2 或 12 C.已知 Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有 Cl-、CrO42-且浓度均为 0.010mol·L-1 溶液中逐滴加入 0.010mol·L-1 的 AgNO3 溶液时,CrO42-先产生沉淀 D.常温下 pH=7 的 CH3COOH 和 CH3COONa 混合溶液中,c(Na+)=c(CH3COO-) 11.中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化 还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点。 下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时溶液颜色的判 断不正确的是( ) A.用标准酸性 KMnO4 溶液滴定 Na2SO3 溶液以测量其浓度:KMnO4——浅红色 B.利用 Ag++SCN- AgSCN,用标准 KSCN 溶液测量 AgNO3 液浓度:Fe(NO3)3——红色 C.利用 2Fe3++2I- I2+2Fe2+,用 FeCl3 液测量 KI 样品中 KI 的百分含量:淀粉——蓝色 D.利用 OH-+H+ H2O 来测量某盐酸的浓度:酚酞——浅红色
3. 0.1mol L-1 的 8 种物质的溶 液:① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤NaOH⑥ CH3COONa ⑦KCl⑧ NH4Cl ,
其溶液的 pH 由小到大的顺序是( ) A.③⑧②①⑥⑤⑦④ B.②①③⑧⑦⑥⑤④ C.②③⑧①④⑦⑥⑤ D.①②③⑧⑦④⑥⑤ 4.在不同温度下,水溶液中[H+]与[OH-]有如图所示关系。下列关于离子共存的说法正确的是( )
2012级化学选修四《4.3.2电解池》练习案
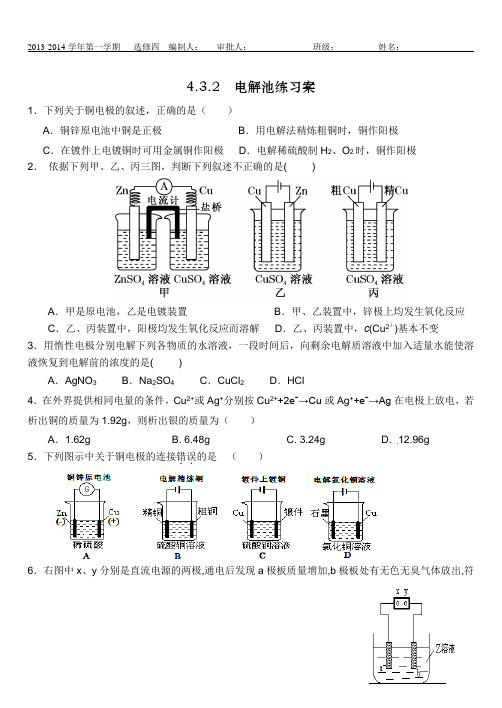
4.3.2 电解池练习案1.下列关于铜电极的叙述,正确的是()A.铜锌原电池中铜是正极B.用电解法精炼粗铜时,铜作阳极C.在镀件上电镀铜时可用金属铜作阳极D.电解稀硫酸制H2、O2时,铜作阳极2.依据下列甲、乙、丙三图,判断下列叙述不正确的是( )A.甲是原电池,乙是电镀装置B.甲、乙装置中,锌极上均发生氧化反应C.乙、丙装置中,阳极均发生氧化反应而溶解D.乙、丙装置中,c(Cu2+)基本不变3.用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前的浓度的是( )A.AgNO3B.Na2SO4C.CuCl2D.HCl4.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2eˉ→Cu或Ag++eˉ→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为()A.1.62g B. 6.48g C. 3.24g D. 12.96g5.下列图示中关于铜电极的连接错误..的是()6.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )7.电解原理在化学工业中有广泛应用。
右图表示一个电解池,装有电解液a ;X 、Y 是两块电极板, 通过导线与直流电源相连。
请回答以下问题:⑴若X 、Y 都是惰性电极,a 是饱和MgCl 2溶液,则① 电解池中X 极上的电极反应式是 。
在X 极附近观察到的现象是 。
② Y 电极上的电极反应式是 ,检验该电极反应产物的方法是 。
⑵如要用电解方法在铁上镀银,电解液a 选用 溶液,则①X 电极的材料是 ,电极反应式是②Y 电极的材料是 ,电极反应式是8.如图:1、2为石墨电极,3、4为铂电极, 5、6为铜电极,通电5min 后,电极5质量增加2.16g ,试回答:(1)电源:a 为 极,C 池为 池A 池电极反应:①、 ,②、 。
C 池电极反应:⑤、 ,⑥、 。
(2)若B 槽中共收集到224mL 气体(标况), A B C 且溶液体积为200mL (设电解过程中溶液体积不变),则通电前溶液中的Cu 2+物质的量浓度为 。
高二化学选修4练习题及答案

⾼⼆化学选修4练习题及答案 勤做练习题是⾼⼆化学⽣活中最重要的学习⽅法之⼀,也是提⾼⾼⼆化学成绩的唯⼀可⾏⽅法。
下⾯是由店铺带来的⾼⼆化学选修4练习题及答案,做完记得及时校对答案。
⾼⼆化学选修4练习题 可能⽤到的相对原⼦质量: H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 ⼀、单项选择题(本题包括9⼩题,每⼩题3分,共27分。
每⼩题只是⼀个选项符合题意) 1、在25℃、101 kPa下,1 g甲醇燃烧⽣成CO2和液态⽔时放热22.68 kJ,下列热化学⽅程式正确的是( ) A.CH3OH(l)+ 3/2 O2(g)===CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol 2、已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OH¯(aq)==H2O(l);ΔH=-57.3 kJ/mol 下列结论正确的是 A.碳的燃烧热⼤于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应⽣成1 mol⽔,放出57.3 kJ热量 3、将a g块状碳酸钙跟⾜量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所⽰。
在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所⽰)正确的是( ) A.达到化学平衡时,4v正(O2) = 5v逆(NO) B.若单位时间内⽣成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 C.达到化学平衡时,若增加容器体积,则正反应速率减⼩,逆反应速率增⼤ D.化学反应速率关系是:2v正(NH3) = 3v正(H2O) 6.若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则⼆者物质的量浓度之⽐应为( )A.10∶1B.5∶1C.1∶1D.1∶10 7、有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,⽤去酸的体积分别为V1、V2、V3,则三者的⼤⼩关系正确的是( )A. V3>V2>V1B. V3=V2=V1C. V3>V2=V1D. V1=V2>V3 8.将纯⽔加热⾄较⾼温度,下列叙述正确的是( )A ⽔的离⼦积变⼤、pH变⼩、呈酸性B ⽔的离了积不变、pH不变、呈中性C ⽔的离⼦积变⼩、pH变⼤、呈碱性D ⽔的离⼦积变⼤、pH变⼩、呈中性 A.加⼊⽔时,平衡向逆反应⽅向移动 B.加⼊少量NaOH固体,平衡向正反应⽅向移动 C.加⼊少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减⼩ D.加⼊少量CH3COONa固体,平衡向正反应⽅向移动 ⼆、不定项选择题(本题包括10⼩题,每⼩题3分,共30分。
高二化学选修4第三章测试

高二化学选修4 第三章测试本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
共150分,考试时间90分钟。
第Ⅰ卷(选择题共88分)一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意)1、关于强、弱电解质的叙述不正确的是()A. 强电解质在溶液中完全电离,不存在电离平衡B. 同一弱电解质溶液,温度不同时,导电能力不同C. 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱D. 强电解质在固态或液态时,可能不导电2、下列电离方程式中,正确的是()A、CH3COOH = CH3COO- + H+B、NaOH = Na+ + OH-C、KClO3K+ + ClO3-D、BaSO4 = Ba2+ + S2- +4O2-3、下列化合物属于弱电解质的是()A. HClO4B. Ba(OH)2C. CO2D. HF4、在100ml下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是()A. 0.5mol/L的HClB. 0.5mol/L的CH3COOHC. 蒸馏水D. 0.5mol/L的氨水5、用蒸馏水稀释0.1mol/L的CH3COOH时,始终保持增大趋势的是()A.c(CH3COOH)B. c(H+)C. c(OH-)D. c(CH3COO-)6、同体积的1mol/L的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg。
下列叙述中正确的是()A. HNO3、HCl、H2SO4中放出H2的速率相同B. HCl、HNO3中放出H2的量相等C. HCl、CH3COOH中放出H2的量相等D. H2SO4中放出H2的量最多,其余的相等7、100℃时,水的离子积为1×10-12,若该温度下某溶液中的H+ 浓度为1×10-7mol/L则该溶液是()A. 酸性B. 碱性C. 中性D. 无法判断8、pH值相同的下列溶液,其物质的量浓度最大的是()A. HClB. H2SO4C. CH3COOHD. H3PO49、250C时,某溶液中由水电离出的c(OH—)=1×10—13 mol/L,该溶液中一定不能大量共存的离子组是()A. NH4+ 、Fe3+ 、SO42—、Cl—B. CO32—、PO43—、K+ 、Na+C. Na+ 、SO42—、NO3—、Cl—D. HPO42—、Na+ 、 HSO3—、K+10、把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。
2017-2018学年高中化学选修四文档:第三章 复习课 Word版含答案

本章复习课练基础落实1.已知一种c(H+)=1×10-3 mol·L-1的酸溶液和一种c(OH-)=1×10-3 mol·L-1的碱溶液等体积混合后,溶液呈酸性,其原因可能是()A.浓的强酸和稀的强碱溶液反应B.浓的弱酸和稀的强碱溶液反应C.等浓度的强酸和弱碱溶液反应D.生成了一种强酸弱碱盐答案 B解析酸和碱混合前已经电离出的H+和OH-恰好以等物质的量中和。
混合后的溶液呈酸性,说明反应后溶液中c(H+)>c(OH-)。
为什么有这种现象发生呢?一种可能是酸为弱酸,存在着电离平衡。
随着H+的反应,弱酸会电离出更多的H+使溶液呈酸性。
混合前的弱酸电离出和强碱中OH-相等浓度的H+,但弱酸的物质的量浓度要比强碱大得多。
因此,该题应是浓的弱酸和稀的强碱反应,生成的是弱酸强碱盐。
2.下列说法正确的是()A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色B.Al3+、NO-3、Cl-、CO2-3、Na+可以大量共存于pH=2的溶液中C.乙醇和乙酸都能溶于水,都是电解质D.分别与等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同答案 A解析Na2CO3溶液中存在CO2-3的水解CO2-3+H2O HCO-3+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,A正确;B选项中pH=2的溶液显酸性,弱酸根阴离子CO2-3不能存在;C选项中的乙醇不是电解质,乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1∶2。
3.下列说法不正确的是()A.K sp只与难溶电解质的性质和温度有关B.由于K sp(ZnS)>K sp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀C.其他条件不变,离子浓度改变时,K sp不变D.两种难溶电解质作比较时,K sp小的,溶解度一定小答案 D解析K sp只与难溶电解质自身的性质和温度有关,与沉淀的量和离子的浓度无关,A、C正确;相同类型的难溶电解质,沉淀向着溶解度减小的方向转化,B正确;只有相同类型的难溶电解质,K sp小的,溶解度一定小,D错误。
高中化学选修4第三章【精编】

高中化学选修4第三章
3、电解质导电的原因
在水溶液或熔融状态下 电离出自由移动的带电微粒(离子)
高中化学选修4第三章
什么是弱电解质? 在水中只能部分电离的电解 既然是部分电离以CH3COOH为例 在水中都存在哪些离子
CH3COOH
H+ + CH3COO—
高中化学选修4第三章
电离:电解质,溶于水或熔融状态下 离解出自由移动离子的过程
(4) 属于弱电解质的有
f ijlo
高中化学选修4第三章
单 质
纯 净 物
化 物合 质物
电解质
非电解质 混 合 物
高中化学选修4第三章
为什么有强酸,弱酸? 为什么有强碱,弱碱?
高中化学选修4第三章
2、强弱电解质
①强电解质 在水中能够全部电离的电解质 强酸 强碱 大多数盐
②弱电解质 在水中只能部分电离的电解质 弱酸 弱碱 水
H2CO3 HCO3 —
H+ + HCO3 — 主 H+ + CO32 —
K1
c(HC3O )•c(H) c(H2CO3)
=4.4×10—7
K2 c(Cc(OH 32C )•3cO()H) =4.7×10—11
K1>>K2,因此以第一步电离为主
高中化学选修4第三章
在醋酸溶液中,存在如下电离平衡:
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
高中化学选修4第三章
一、强弱电解质
1、电解质与非电解质
①电解质 在水溶液中或熔化状态下能导电的化合物 范围: 化合物 前提: 水溶液 或 熔化状态 自身 导电 常见的电解质:酸 碱 盐 金属氧化物 水
化学选修4第三章巩固练习
(一)1、下列说法正确的是()A. 强电解质溶液的导电能力一定比弱电解质溶液的强B. 氨气是弱电解质,铜是强电解质C. 氧化钠是强电解质,醋酸是弱电解质D. 硫酸钠是强电解质,硫酸钡是弱电解质2、下列说法中,正确的是()A. 强电解质溶液的导电能力不一定比弱电解质强。
B. 冰醋酸是弱电解质,液态时能导电。
C. 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱。
D. 相同温度下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大3、已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH 3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是()A. 加少量烧碱溶液B. 升高温度C. 加少量冰醋酸D. 加水4、pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是()A.11∶1 B.9∶1 C.1∶11 D.1∶95、在25℃时,100mL 0.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH值为()A.6 B.5 C.12 D.136、在Cl-、NH4+、HSO4-、Na+、HCO3-五种离子中,既不能电离又不能水解的离子是______,只能水解不能电离的离子是_______,只能电离不能水解的离子是________,既能电离又能水解的离子是_________。
7、在200 mL氢氧化钡溶液中含有1×10-3 mol的钡离子,溶液的pH值为__________。
将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是________。
(二)1、关于小苏打水溶液的表述正确的是()A.c (Na+)=c (HCO3-) + c (CO3 2-) + c (H2CO3)B.c (Na+) + c (H+) =c (HCO3-) + c (CO32-) +c (OH-)C.HCO3-的电离程度大于HCO3-的水解程度D.存在的电离有:NaHCO3=Na++HCO3-,HCO3+ +CO32-,H2++OH-2.室温下,在pH=12的某溶液中,由水电离的c(OH-)为()A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-13. 下列离子方程式错误的是()A. NaHS溶于水: NaHS==Na++HS-HS-+H 2O H3O++S2-B. Al(OH)3电离: H2O+AlO2-+H+==Al(OH)3==Al3++3OH-C. (NH 4)2SO4溶于水:(NH4)2SO42NH4++SO42-D. HF溶于水:HF+H 2O H3O++F-4、把0.05 mol NaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是()A. 自来水B. 0.5 mol•L-1盐酸C. 0.5mol•L-1醋酸D. 0.5 mol•L-1氯化铵溶液5. 已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2NaNO2+HF==HCN+NaF NaNO2+HF==HNO2+NaF 由此可判断下列叙述中正确的是A. HF的电离常数是①B. HNO2的电离常数是①C. HCN的电离常数是②D. HNO2的电离常数是③6.醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是①醋酸与水能以任意比互溶②醋酸溶液能导电③醋酸溶液中存在醋酸分子④0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸pH大⑤醋酸能和碳酸钙反应放出CO2⑥0.1 mol·L-1醋酸钠溶液pH=8.9 ⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢A.②⑥⑦B.③④⑤⑥C.⑨④⑥⑦D.①②7、在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是(三)1.在pH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3它们之间的关系是()A.C1<C2<C3B.C1=C2>C3 C、C1>C2>C3D.无法判断2.25℃时,水的电离达到平衡:H2O H++OH--;ΔH>0,下列叙述正确的是A 向水中加人稀氨水,平衡逆向移动,c(OH―)降低B 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变C 向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低D 将水加热,Kw增大,pH不变3、已知酸式盐NaHB在水溶液中存在下列反应:①NaHB == Na+ + HB-,②HB-H++B2-,③HB-+H 2O H2B+OH-且溶液中c(H+)>c(OH-),则下列说法一定正确的是A.NaHB为强电解质B.H2B为强酸C.H2B为弱电解质D.HB-的电离程度小于HB-的水解程度4、已知甲酸钠(HCOONa)溶液呈碱性。
高中化学选修四第三章第二节完整ppt课件
精选PPT课件
12
例题
⑴﹑0.1mol/L的盐酸溶液中水电离出 的C(H+ )和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1=1×10-13mol/L
= C(H+ )
⑵﹑0.1mol/L的NaOH溶液中水电离出 的C(H+)和C(OH-)是多少?
水电离出的C(H+)=1×10-14/0.1=1×10-13mol/L
KW 叫做水的离子积常数,简称水的离子积。 2)影响KW的因素 KW只与温度有关(与浓度无关):温度升高,KW增大
如: 25℃ KW=10-14
100℃ KW=10-12
注:常数无单位
精选PPT课件
6
1、水的电离过程为H2O
H+ + OH-,在不同温度下
其离子积为KW25℃=1×10-14, KW35℃ =2.1 ×10-14。则下
3)某温度下,某液体c(H+)= 10-7mol/L,则
该溶液一定是纯水。 ×
精选PPT课件
8
讨论:
对常温下的纯水进行下列操作,完成下表:
酸碱性
水的电离平 衡移动方向
加 热
中中性性
→→
加 HCl
酸性
←
加NaOH 碱性 ←
C(H+)
↑
C(OH-)
C(H+) 与C(OH-) 大小关系
↑
=
↑↓
>
↓↑
<
Kw变化
第三章 水溶液中的离子平衡
2 水的电离和溶液的酸碱性
精选PPT课件
1
思考:
灵敏电流 计
灯泡
如何用实验证明水是一种极弱的电解质?
1.实验
人教版高中化学选修四课件:第三章 第二节 第2课时pH的计算
激趣诱思
测量和调控溶液的 pH 对工农业生产、科学研究以及日常生活 和医疗保健都具有重要意义。医疗上,当体内的酸碱平衡失调时,血 液的 pH 是诊断疾病的一个重要参数,而利用药物调控 pH 则是辅助 治疗的重要手段之一。 生活中人们洗发时用的护发素,其主要功能也 是调节头发的 pH,使之达到适宜的酸碱度。环保领域中,酸性或碱性 废水的处理常常利用中和反应,在中和处理的过程中可用 pH 自动测 定仪进行检测和控制。 对于实际问题,我们虽然通过仪器测定了溶液 的 pH,但是具体配制溶液的过程中,往往涉及不同 pH 的溶液的混合, 这就涉及溶液 pH 的计算,本课时我们将从实际需要,解决有关 pH 的 测定和 pH 的计算问题。
3.单一溶液的 pH 计算 pH 计算公式:pH=-lgc(H+);计算的关键:计算溶液中的 c(H+)。 (1)强酸: ①计算思路:c(酸) c(H+) pH。 ②举例:HnA,设浓度为 c mol· L-1,则有 c(H+)=nc mol· L-1, pH=-lgc(H+)=-lg(nc)。 (2)强碱: ①计算思路:c(碱) c(OH-) c(H+) pH。 ②举例:B(OH)n,设浓度为 c mol· L-1,则有 c(OH-)=nc mol· L1
+
������W
������(OH )
-
,pH=14+lg(nc)。
+ + ������ ( H ) ������ + ������ ( H )������2 1 1 2 (1)强酸与强酸混合:c(H+)= , ������1 +������2
2.混合溶液(体积变化忽略不计)
pH=-lgc(H+)。 (2)强碱与强碱混合:
人教版高中化学选修四高二化学第三章选择题 .docx
高中化学学习材料唐玲出品高二化学选修4第三章选择题单项选择题(1-20题)1.化学中常用图像直观地描述化学反应的进程或结果。
下列图像描述正确的是 反应物%甲乙时间/min 导电性(I )新加入物质的量①②③00.5n (Br -)n (Cl 2)n (CO 2)n (HCl)④2 A .图①表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强大B .图②表示向乙酸溶液中通入氨气至过量的过程,溶液导电性的变化C .图③表示在1 L 1 mol/L FeBr 2溶液中通入Cl 2时Br -的量的变化D .图④表示一定浓度Na 2CO 3溶液中滴加盐酸,生成CO 2与滴加盐酸的物质的量的关系2.实验证明:若用电解熔融KCl 制钾,发现钾熔于熔融KCl 中难分离,且电解过程中容易发生爆炸反应等。
因而工业不用电解熔融KCl 制钾,而用金属钠与KCl 共熔置换制钾: Na(l)+KCl(l)NaCl(l)+K(g) △H >0 。
下面是四种物质的熔沸点: K Na KCl NaCl熔点(℃) 63.6 97.8 770 801沸点(℃) 774 882.9 1500 1413根据平衡移动原理,可推知用Na 与KCl 反应制取金属钾的适宜温度是( )A .低于770℃B .约850℃C .高于882.9℃D .1413~1500℃3.右图是温度和压强对X+Y 2Z 反应影响的示意图。
图中纵坐标表示平衡混合气体中Z 的体积分数。
下列叙述正确的是A .X 、Y 、Z 均为气态B .恒容时,混合气体的密度可作为此反应是否达到化学平衡的判断依据C .升高温度时v 正增大,v 逆减小,平衡向右移动D .使用催化剂Z 的产率增加4.一定条件下,溶液的酸碱性对TiO 2光催化染料R 降解反应的影响如图所示。
下列判断正确的是( )A . 在0~50 min 之间,pH =2和pH =7时R 的降解百分率相等B .溶液酸性越强,R 的降解速率越小C .R 的起始浓度越小,降解速率越大D .在20~25 min 之间,pH =10时R 的平均降解速率为0.04 mol ·L -1·min -10 0 1.55.在体积恒定的密闭容器中,一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃发生反应2SO2+O2催化剂加热2SO3ΔH<0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 化学作业六 第三章第二节练习 一、单项选择题(每小题3分,共45分) 1、25 ℃时,水的电离达到平衡:H2O H+ + OH- ΔH > 0 ,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 C.向水中加入少量盐酸 ,平衡逆向移动,c(H+)降低 D.将水加热,Kw增大,pH不变 2、将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是( ) A.①③⑦ B.②④⑦ C.①⑥ D.②④⑥⑧ 3、下列溶液肯定呈碱性的是( ) A.溶液中c(OH-)>c(H+) B.溶液中含OH-离子 C.滴加甲基橙后溶液显红色 D.滴加甲基橙后溶液显黄色 4、室温下,在pH=12的强碱溶液中,由水电离出的c(OH-)为( ) A. 1.0×10-7 mol•L-1 B.1.0×10-6 mol•L-1 C. 1.0×10-2 mol•L-1 D. 1.0×10-12 mol•L-1 5、25℃时,pH为9的NaOH溶液和pH为5的HCl溶液中,水的电离程度的大小关系是( ) A.前者大 B.两者相等 C.后者大 D.无法确定 6、99 mL 0.5 mol/L硫酸跟101 mL 1 mol/L氢氧化钠溶液混合后,溶液的pH值为( ) A.0.4 B.2 C.12 D.13.6 7、 25℃时,5 mL O.1 m01/l的 H2S04和15 ml O.1 mol/lNa0H溶液相混合并稀释至500 ml,所得溶液的pH为 ( ) A.12.3 B.11 C.3 D.1.7 8、pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是( ) A.11∶1 B.9∶1 C.1∶11 D.1∶9 9、在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( ) ① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- A.①③ B.③⑤ C.③④ D.②⑤ 10、重水D2O的离子积为1.6×10-15,可用pH一样的定义来规定pD= -lgc(D+),以下关于pD的叙述正确的是 ( ) A.中性溶液中pD=7 B.在1L D2O中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12 C.在1L D2O中溶解 0.01mol DCl(设溶液的体积为1L),其中pD=2 D.在100mL 0.25mol・L-1的NaOD重水溶液中加入50mL 0.2mol・L-1DCl的的重水溶液,其中pD=1 2
11、 用pH试纸测定某一溶液的pH时,规范的操作是( ) A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 B.将溶液倒在pH试纸上,跟标准比色卡比较 C.用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 D.在试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 12、某学生的实验报告所列出的下列数据中合理的是( ) A.用10mL量筒量取7.13mL稀盐酸 B.用pH计测得某稀盐酸的pH为1.54 C.用碱式滴定管量取20.3 mL烧碱溶液 D.用托盘天平称得某物质的质量为13.15g 13、有一支20mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( ) A. a mL B.(20―a)mL C. 大于(20―a)mL D. 大于a mL 14、用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是 A.用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 C.用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点 D.用碱式滴定管取10.00mLNaOH溶液放入洗净的锥形瓶中,加入适量蒸馏水后,再进行滴定 15、下列有关滴定操作的顺序正确的是 ①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面(记录初读数) ⑤取一定体积的待测液于锥形瓶中 ⑥滴定操作 A. ①③②④⑤⑥ B. ①②③④⑤⑥ C. ②③①④⑤⑥ D. ④⑤①②③⑥
二、双项选择题(每小题5分,共25分) 16、现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( ) A.加入10mL 的水进行稀释 B.加水稀释成100mL C.加入45mL 0.01mol/L的NaOH溶液 D.加入10mL 0.01mol/L的盐酸溶液 17、下列说法正确的是( ) A.pH=2和pH=1的硝酸中c(H+)之比为1:10 B.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 C.室温时,0.1mol/L 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 D.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH- 数目为0.2NA 3
18、常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是( ) A.同物质的量浓度的三种溶液的pH:a>b>c B.同pH时,三种溶液稀释相同倍数后,pH:a=b<c C.同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c 19、H+浓度均为0.01mol/L的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是 A.醋酸与锌反应放出氢气多 B.盐酸和醋酸分别与锌反应放出的氢气一样多 C.醋酸与锌反应速率大 D.盐酸和醋分别与锌反应的速度一样大 20、室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 A. 加水稀释2倍后,两溶液的pH均减小 B. 使温度都升高20℃后,两溶液的pH均不变 C. 加适量的醋酸钠晶体后,两溶液的pH均增大 D. 加足量的锌充分反应后,醋酸产生的氢气比盐酸多
班级:______________姓名:_______________座号:_______________ 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案
三、填空题(共30分) 21、(10分)为了证明一水合氨是弱电解质,甲、乙、丙三同学分别选用下列试剂进行实验探究。 可能用到的试剂是:0.10 mol·L-1氨水,0.1mol·L-1 NH4Cl溶液,NH4Cl晶体,酚酞试剂,pH试纸,蒸馏水等。回答以下问题: (1)甲用pH试纸测出0.10mol·L-1氨水pH为10,则认定一水合氨是弱电解质,你认为这一方法_________(填是、否)正确,说明你的理由是_________________________________________ 。 (2)乙取出10 mL 0.10 mol·L-1 氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足的关系是________________(用等式或不等式表示)。 (3)丙取出10 mL 0.10 mol·L-1 氨水,滴入 2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是______________,你认为这一方法______(填能、否)证明一水合氨是弱电解质。 4
22、(10分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。 (1)滴定:①用_______式滴定管盛装c mol/L盐酸标准液。右图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积__________mL。 ②下表是4种常见指示剂的变色范围: 指示剂 石蕊 甲基橙 甲基红 酚酞 变色范围(pH) 5.0—8.0 3.1—4.4 4.4—6.2 8.2—10.0 该实验应选用________作指示剂; ③有关数据记录如下:
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL) 滴定前 滴定后 消耗的体积 1 V 0.50 25.80 25.30 2 V 3 V 6.00 31.35 25.35 (2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简) c = ______________________________。 (3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”) a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________; b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________; c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________; d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。
23、(10分)已知水在25℃和95℃时,其电离平衡曲线如右图所示: (1)则25 ℃时水的电离平衡曲线应为 (填“A”或“B”), 请说明理由 (2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合, 若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为 (3)95℃时,若100体积 pH1=a 的某强酸溶液与1体积 pH2=b的某强碱溶液混合后 溶液呈中性,则混合前,该强酸的 pH1与强碱的 pH2之间应满足的关系是 (4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:
A B 10-7 10-6 c(H+)
c(OH―)
10-7
10-6
