酪氨酸酶抑制剂筛选
SymWhite 377 0706CHI

Protein Biosynthesis Melanosome Tyrosinase Melanin
Proliferation Differentiation Melanin Synthesis Dendritogenesis
[BH4 ] Tyrosine
Melanocyte
158281 SymWhite® 377
158281 SymWhite® 377
体外美白效果 – 3
皮肤模型
为了证实SymWhite377的美白效果不是由于细胞毒性引起的,在 MelanoDermTM 皮肤模型 ( IV类皮肤)培养过程中(0.1%的 SymWhite377),第7天和第14天分别测定 MTT指标。
结果表明
=> 细胞仍然表现为100 % 活性
OH O HO H OH
HO O
OH R O OH
O
功效差 /极其昂贵 浓缩品
Symrise, always inspiring more… 5
HO OMe
HO
OH
O
158281 SymWhite® 377
新型美白剂的筛选 蘑菇酪氨酸酶抑制剂
磷酸盐缓冲液 (pH 6.8) + 蘑菇酪氨酸酶 +测试 物(梯度浓度) 小孔板培养
Pinus sylvestris
HO HO
unstable
银松素
Hydrogenation
OH OH
stable, but difficult to synthesize
二氢银松素
IC50 rel. to Kojic Acid: 1
158281 SymWhite® 377
IC50 rel. to Kojic Acid: 10
酪氨酸酶

酪氨酸酶概念:酪氨酸酶(EC 1.14.18.1)是一种含铜的氧化还原酶,它与生物体合成色素直接相关.(长的黑有很大的一部分原因在自己)在人体中,它与色素障碍性疾病及恶性黑色素肿瘤的发生与治疗有关(酪氨酸酶的分布与动物的生理功能息息相关,不同动物的酪氨酸酶在体内分布的部位不同.多数昆虫在正常生理状态下,酪氨酸酶以酶原的形式存在,不同类型的酪氨酸酶存在于昆虫的特定部位,以完成特定的生理功能.美洲蜚蠊存在于血红细胞内,而麻蝇则仅存在于血浆中,并且在表皮中主要以活化形式的酪氨酸酶存在.昆虫酪氨酸酶除参与黑色素的形成外还是唯一参与角质硬化的酶.昆虫高度硬化的角质能阻断微生物和异物的入侵,并为柔软的元脊椎动物身体提供了保护.在节肢动物中,酪氨酸酶还参与其他两种重要的生理过程——防御反应和伤口愈合.哺乳动物酪氨酸酶催化产生的黑色素被分泌进入到表皮和毛发的角质细胞中,使体表着色,从而起保护皮肤和眼睛、抵御紫外线的辐射和防止内部组织过热等作用.哺乳动物酪氨酸酶常见于黑素细胞中,黑素细胞是存在于皮肤,发囊和眼睛中并产生色素的高度特异性的细胞[1“].酪氨酸酶功能减退或缺失时,即会影响黑色素代谢,从而发生疾病如白癫疯和白化病.动物与人的常染色体隐性疾病也与酪氨酸酶的缺失或活性下降有关.)作用机制:酪氨酸酶主要参与两个反应过程:催化L.酪氨酸羟基化转变为L-多巴和氧化L-多巴形成多巴醌,多巴醌经一系列反应后,形成黑色素,与人体雀斑、褐斑等黑色素过度沉积等疾病的发生有关,并与昆虫的蜕皮(蝉蜕可以入药)和(苹果)果蔬的褐化有很大关系(黑色素生物合成过程可大体分为两个阶段,第一阶段是由酪氨酸酶催化酪氨酸被羟化反应形成L_3,4一二羟基丙氨酸(L_多巴)(单酚酶活性),并进步将L_多巴氧化生成多巴醌(二酚酶活性)。
这两步反应都是由酪氨酸酶催化的,酪氨酸酶在这里显示了独特的双重催化功能.第二阶段从多巴醌(DOPAqui—non)为原料从两个不同途径分别生成真黑素和褪黑素的过程.真黑素生成,多巴醌经多聚化反应等一系列反应生成无色多巴色素,极不稳定的无色多巴色素被另一分子多巴醌氧化为多巴色素,多巴色素经异构、脱羧生成5,6一二羟基吲哚(DHI),5,6一二羟基吲哚(DHI)由酪氨酸酶催化氧化为真黑色素的前体吲哚一5,6一醌(IndQu);褪黑素生成,多巴醌(DOPAquinon)与半胱氨酸(Cys)反应生成产生5-Cys一多巴及5-Cys一多巴醌,然后成环、脱羧变成苯肼噻嗪的衍生物,最后形成褪黑素.在第二阶段,只有少数几步反应由酪氨酸酶、异构酶或金属离子催化,大部分反应都是自发的,因此酪氨酸酶是整个黑色素生成反应的限速酶,第一阶段的两步反应是限速步骤.)活性中心:酪氨酸酶的活性中心是由两个含铜离子位点构成.在催化过程中,双核铜离子位点以3种形态存在,分别是氧化态、还原态和脱氧态.研究表明与酪氨酸酶结合的双核铜离子活性中心与在血蓝蛋白中发现的活性中心非常相似、白化病概念:白化病是由黑色素合成相关基因突变导致黑色素沉着减少或缺失引起的一类遗传性疾病的总称。
小分子靶向治疗药物简介
化学抗肿瘤药物经过半个多世纪的发展,已经进入靶向治疗药物时代。
小分子靶向药物在临床上的应用日益增多,在一些肿瘤类别中已经进入一线用药地位,比如肾癌、慢粒白、多发性骨髓瘤等。
本文对小分子靶向治疗药物做一综述。
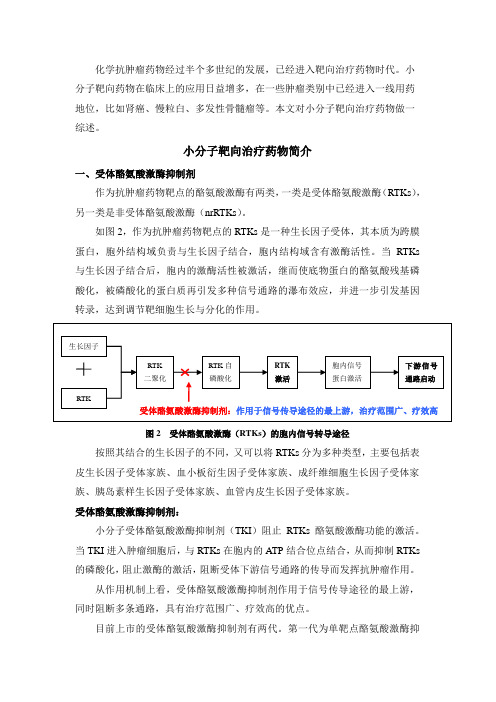
小分子靶向治疗药物简介一、受体酪氨酸激酶抑制剂作为抗肿瘤药物靶点的酪氨酸激酶有两类,一类是受体酪氨酸激酶(RTKs),另一类是非受体酪氨酸激酶(nrRTKs)。
如图2,作为抗肿瘤药物靶点的RTKs是一种生长因子受体,其本质为跨膜蛋白,胞外结构域负责与生长因子结合,胞内结构域含有激酶活性。
当RTKs 与生长因子结合后,胞内的激酶活性被激活,继而使底物蛋白的酪氨酸残基磷酸化,被磷酸化的蛋白质再引发多种信号通路的瀑布效应,并进一步引发基因转录,达到调节靶细胞生长与分化的作用。
图2 受体酪氨酸激酶(RTKs)的胞内信号转导途径按照其结合的生长因子的不同,又可以将RTKs分为多种类型,主要包括表皮生长因子受体家族、血小板衍生因子受体家族、成纤维细胞生长因子受体家族、胰岛素样生长因子受体家族、血管内皮生长因子受体家族。
受体酪氨酸激酶抑制剂:小分子受体酪氨酸激酶抑制剂(TKI)阻止RTKs酪氨酸激酶功能的激活。
当TKI进入肿瘤细胞后,与RTKs在胞内的ATP结合位点结合,从而抑制RTKs 的磷酸化,阻止激酶的激活,阻断受体下游信号通路的传导而发挥抗肿瘤作用。
从作用机制上看,受体酪氨酸激酶抑制剂作用于信号传导途径的最上游,同时阻断多条通路,具有治疗范围广、疗效高的优点。
目前上市的受体酪氨酸激酶抑制剂有两代。
第一代为单靶点酪氨酸激酶抑制剂,如吉非替尼、厄洛替尼。
表已上市的酪氨酸激酶抑制剂注:EGFR:表皮生长因子受体,属HER家族;VEGFR:血管内皮生长因子;PDGFR:血小板衍生因子;HER2:HER家族的一种受体;Abl-Bcr:一种非受体酪氨酸激酶;Raf:酪氨酸激酶的下游信号通路中的一种蛋白;Flt-3:Src:一种非受体酪氨酸激酶;c-kit:Ret:胶质细胞源性神经营养因子的受体吉非替尼为EGFR酪氨酸激酶抑制剂,主要用于非小细胞肺癌,对酪氨酸激酶基因编码区突变型肿瘤的有效率高达80%以上。
小分子抑制剂 化学生物学

小分子抑制剂化学生物学【实用版】目录一、什么是小分子抑制剂二、小分子抑制剂的分类三、小分子抑制剂的应用四、总结正文一、什么是小分子抑制剂小分子抑制剂是一种具有抑制生物体内某些特定分子活性的化合物,通常用于治疗疾病。
它们能够与目标分子结合,从而阻止其发挥作用,进而达到治疗目的。
在生物医学领域,小分子抑制剂的研究和应用正逐渐成为药物研发的热点之一。
二、小分子抑制剂的分类根据作用机制和靶点不同,小分子抑制剂可分为以下几类:1.受体酪氨酸激酶抑制剂:这类抑制剂主要针对受体酪氨酸激酶(RTK),如表皮生长因子受体(EGFR)等。
RTK 在细胞生长、分化和侵袭过程中发挥重要作用,因此这类抑制剂常用于治疗癌症等疾病。
2.非受体酪氨酸激酶抑制剂:这类抑制剂作用于非受体酪氨酸激酶,如 Src 家族激酶、JAK 家族激酶等。
它们在细胞内参与多种信号传导过程,与多种疾病的发生发展密切相关。
3.丝氨酸/色氨酸激酶抑制剂:这类抑制剂主要针对丝氨酸/色氨酸激酶,如蛋白激酶C(PKC)等。
丝氨酸/色氨酸激酶在细胞内调控多种生物学过程,与肿瘤、炎症等疾病有关。
三、小分子抑制剂的应用小分子抑制剂在医学领域具有广泛的应用前景,部分已成功上市并应用于临床治疗。
例如:1.伊马替尼(Imatinib):是一种针对 BCR-ABL 融合基因的酪氨酸激酶抑制剂,用于治疗慢性髓系白血病(CML)等疾病。
2.贝伐珠单抗(Bevacizumab):是一种针对血管内皮生长因子(VEGF)的受体酪氨酸激酶抑制剂,用于治疗多种肿瘤,如结直肠癌、肺癌等。
3.托珠单抗(Tocilizumab):是一种针对白介素 -6(IL-6)受体的单克隆抗体,用于治疗风湿性关节炎等疾病。
总之,小分子抑制剂作为一种新型药物,在生物医学领域具有广泛的研究价值和应用前景。
第1页共1页。
Src蛋白酪氨酸激酶抑制剂在骨质疏松症中的研究进展

Src蛋白酪氨酸激酶抑制剂在骨质疏松症中的研究进展
刘宝成;屈孝东;常彦海;杨波
【期刊名称】《临床医学进展》
【年(卷),期】2022(12)5
【摘要】骨质破坏发生在衰老和许多疾病中,其中最常见的是骨质疏松。
骨质疏松症(Osteoporosis, OP)是中国中老年患者最常见且发病率高的全身代谢性骨病,其发生是多种因素造成人体骨密度及骨质量下降,骨骼微小结构破坏,骨骼易脆性增高,导致老年人更容易在日常活动中发生骨折。
Src蛋白酪氨酸激酶抑制剂能够抑制Src蛋白酪氨酸激酶活性,对于骨质疏松的靶向治疗具有精准、稳定性强、副作用小,可直接进入病灶、无明显毒副作用等特点。
本文就Src蛋白酪氨酸激酶抑制剂在骨质疏松症中的研究进展做一综述。
【总页数】7页(P3827-3833)
【作者】刘宝成;屈孝东;常彦海;杨波
【作者单位】西安医学院西安;陕西省人民医院西安
【正文语种】中文
【中图分类】R73
【相关文献】
1.Src酪氨酸激酶抑制剂对人胃癌细胞SGC7901上皮-间质转变相关基因的作用及机制
2.Src酪氨酸激酶抑制剂逆转人胃癌顺铂耐药细胞SGC7901/DDP的作用及机制
3.Src 酪氨酸激酶抑制剂Ⅱ对膀胱移行细胞癌T24细胞生长、增殖的影响
4.
体外Src蛋白酪氨酸激酶抑制剂筛选模型的建立5.神经胶质瘤中受体酪氨酸激酶信号传导系统及酪氨酸激酶抑制剂的研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
色氨酸抑制酪氨酸酶的原理

色氨酸抑制酪氨酸酶的原理
酪氨酸酶是一种重要的酶,它能够催化酪氨酸的氧化反应,将其转化为多巴胺和其他生物活性物质。
这些物质在人体中起着重要的生理作用,如调节情绪、控制运动等。
然而,当酪氨酸酶活性过高时,会导致多巴胺等物质的过度分泌,从而引发一系列疾病,如帕金森病、精神分裂症等。
因此,抑制酪氨酸酶活性成为了一种重要的治疗策略。
以色氨酸是一种必需氨基酸,它在人体内可以被转化为5-羟色胺,这是一种重要的神经递质,能够调节情绪、睡眠等。
此外,色氨酸还可以被转化为色氨酸酶抑制剂,从而抑制酪氨酸酶的活性。
色氨酸酶抑制剂是一种天然的药物,已被广泛应用于治疗多种疾病,如帕金森病、抑郁症等。
色氨酸酶抑制剂的作用机制是通过竞争性抑制酪氨酸酶的活性。
当色氨酸酶抑制剂与酪氨酸酶结合时,它们会竞争性地占据酪氨酸酶的活性中心,从而阻止酪氨酸的氧化反应。
这样一来,多巴胺等物质的分泌就会减少,从而达到抑制酪氨酸酶活性的目的。
除了色氨酸酶抑制剂外,还有其他一些化合物也可以抑制酪氨酸酶的活性,如苯丙氨酸、酪氨酸等。
这些化合物的作用机制与色氨酸酶抑制剂类似,都是通过竞争性抑制酪氨酸酶的活性。
以色氨酸抑制酪氨酸酶的原理是通过竞争性抑制酪氨酸酶的活性,
从而减少多巴胺等物质的分泌,达到治疗相关疾病的目的。
这种治疗策略已被广泛应用于临床实践中,为相关疾病的治疗提供了一种有效的手段。
蛋白磷酸化方法

蛋白质磷酸化对于许多生物现象的引发是很必要的,包括细胞生长、增殖、泛素(ubiquitin)介导的蛋白降解等过程。
特别是酪氨酸磷酸化,作为细胞信号转导和酶活性调控的一种主要方式,通常通过引发蛋白质之间的相互作用,进而介导生长因子、荷尔蒙和细胞因子等对细胞膜上受体的信号调控。
然而,酪氨酸磷酸化在细胞的所有磷酸化修饰中所占的比例却非常低。
大概10%的细胞蛋白会受到磷酸化共价修饰,但每100次蛋白的磷酸化修饰中仅有1次酪氨酸基团的修饰。
与大部分细胞中的丝氨酸和苏氨酸磷酸化水平相比,酪氨酸磷酸化的水平估计要低2000倍。
正是由于细胞中酪氨酸磷酸化的水平相当低,才能保证细胞在内外信号的刺激下,作出灵敏的反应,所以研究酪氨酸的磷酸化对于细胞信号的调控和许多重要生物现象的研究具有极为重要的意义,而对发生酪氨酸磷酸化的蛋白质的识别及磷酸化位点的鉴定对揭示细胞过程的调控和药物的作用位点起到非常重要的作用。
研究蛋白质磷酸化的相关方法:磷酸化Western Blot对于信号转导科研来说,抗酪氨酸磷酸化抗体的出现是一个意义重大的事件。
在没有抗酪氨酸磷酸化抗体之前,蛋白质和酶的酪氨酸磷酸化只能通过非常危险的并且很费时的放射性实验来检测。
而利用抗酪氨酸磷酸化抗体,则可以通过Western Blot或其它免疫学方法轻松地检测到磷酸化信号。
常规的检测方法包括:用抗酪氨酸磷酸化抗体在Western Blot上检测内源或外源表达的磷酸化蛋白。
如果目标蛋白的含量较低,也可利用免疫沉淀的方法先富集发生磷酸化的酪氨酸蛋白,再检测目标蛋白的水平。
抗酪氨酸磷酸化抗体也常用于检测在不同处理的条件下,细胞内总的酪氨酸磷酸化水平的变化情况,作为许多细胞生物现象的一个重要指标。
我们都知道如果需要检测某一个目标蛋白的某一特定位点的磷酸化状态,可以选用该蛋白特定位点的磷酸化特异性抗体。
但由于我们研究的通常是新的磷酸化位点,或者这些蛋白特定位点的磷酸化抗体效果不够好,我们不得不自己制备磷酸化抗体。
希美替尼结构式-概述说明以及解释

希美替尼结构式-概述说明以及解释1.引言1.1 概述希美替尼(Imatinib)是一种广泛应用于白血病和其他恶性肿瘤治疗的靶向治疗药物。
它是第一代酪氨酸激酶抑制剂,通过抑制异常的酪氨酸激酶活性,阻止了癌细胞的生长和扩散。
希美替尼已被证明在治疗慢性髓性白血病(CML)、急性淋巴性白血病(ALL)和一些消化道肿瘤等疾病中具有显著的疗效。
随着对希美替尼的深入研究,人们对其治疗机制和潜在的临床应用也有了更深入的了解。
本文将着重介绍希美替尼的化学结构、药理作用以及临床应用,以期为读者提供更全面的了解和认识。
1.2 文章结构文章结构部分主要是说明整篇文章的结构安排,帮助读者更好地理解文章的内容组织。
本文的结构分为引言、正文和结论三个部分。
引言部分主要包括概述、文章结构和目的三个方面。
在概述部分,会简要介绍希美替尼这种药物的背景和重要性。
文章结构部分即是本段,将会介绍整篇文章的结构安排。
目的部分则明确了本文撰写的目的和意义。
正文部分包括了希美替尼的化学结构、药理作用以及临床应用三个方面,分别介绍了这种药物的化学成分、作用机制以及临床使用的情况。
结论部分则对全文的内容进行总结,强调希美替尼的重要性和未来发展的展望。
同时,通过结论部分可以让读者更清晰地理解全文的核心意义和价值。
最后,结尾的结束语也是文章的收尾部分,可以对全文进行一个简短的总结或思考。
整个文章结构分明,逻辑清晰,能够很好地引导读者了解希美替尼这一药物的相关知识和重要性。
1.3 目的:本文的主要目的是详细介绍希美替尼这一药物的化学结构、药理作用以及临床应用,以便读者能够更全面地了解这一重要药物。
通过对希美替尼的研究和分析,可以帮助读者更好地认识并理解希美替尼在临床上的作用机制和应用领域,为医学研究和医疗实践提供参考和指导。
希美替尼作为一种重要的药物,对于肿瘤治疗以及其他相关疾病的治疗具有重要的意义,因此深入了解和研究希美替尼,可以为临床医生和研究人员提供更多选择和参考,有助于促进医疗领域的发展和进步。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
记录每分钟
含底物缓冲液+
不同浓度的抑制剂
+ 酶液
的OD值
30度水浴10min
对酪氨酸酶单酚酶(二酚酶)影响
以OD值—时间作图
曲线的切线反向延长与X轴相交点 即为—延滞时间 若均相交于一点—抑制剂对延滞 时间没有影响 若不交于一点—抑制剂对延滞时 间有影响 曲线1为无抑制剂的对照组 曲线2—7抑制剂浓度由低到高 切线斜率即为酶活
酪氨酸酶抑制性实验
酪氨酸酶
底物
酪氨酸酶
产物(++++++)多
底物
抑制剂
产物 (++)少或无
EC是各种酶的编号 可在The Comprehensive Enzyme Information System(BRENDA)数据库 中找到对应的酶信息
Enzyme-Ligand Interactions
酶信息
实验原理
酪氨酸酶催化的反应为:
475nm
酶活的定义
1.酪氨酸酶的酶活定义: 以每分钟催化生成1umol多 巴色素的酶量为一个活力单位。 通过测定酶催化反 应体系OD475随时间的增长曲线, 从曲线斜率即可得 到酶活=106kv/ε (k斜率 v体积l ε消光系数) 酶比活=106 kv/εm(k斜率,v体积L,ε消光系数,m酶质量 mg ) 2.剩余酶活%=Kt/K ×100 % 3.抑制酶活% (被抑制的活力)=(K-Kt)/K ×100 % Kt=有抑制剂的曲线的斜率 K=没有抑制剂的曲线的斜率
酶活的推导
1.Beer定律A=kbc,公式A=kbc kbc εc 我们测得的动力学曲线斜率△A/t= ε△c/t= ε△M/tV △M/t=△A V /tε △M/t = kv/ε
△M/t:每分钟多巴色素的生成(mol/min),等同 于每分钟的分解量
酶活测量步骤
1.抑制剂对酪氨酸酶单酚酶(二酚酶)影响
Substrate/Product Inhibitors KM Value Ki Value IC50 Value pH Optimum
酪氨酸酶概述
• 酪氨酸酶(TYR)含铜酶是黑素代谢和儿茶酚胺的 关键酶。酪氨酸酶活性高,黑色素生成增多。因 此,抑制酪氨酸酶活性是有效减少黑色素生成的 一种途径
• 研究酪氨酸酶抑制剂主要运用于美容行业,防止 植物水果的褐变症。 • 酪氨酸酶结构中心的两个Cu+是活性中心
可逆性抑制作用
1.曲线1-5代表不同浓度(有低到高) 的抑制剂,曲线1不加抑制剂的对照组 Y轴是酶活活力,是剩余酶活。所以酶活 达不到100 2.该图是可逆型的Байду номын сангаас酶活随抑制剂浓度 上升而下降 3.Vm值不变 Km值随浓度上升而上升
上图即为可逆型抑制
不可逆性抑制作用
Km值不变, Vm值与抑制剂量成反比,增大抑制剂量可使反 应速度变为0
非竞争性
1. 非竞争性抑制作用:抑制剂不能与游离酶 结合,但可与ES复合物结合并阻止产物生成, 使酶的催化活性降低 2. 特点为:a.抑制剂与底物可同时与酶的不同 部位结合;b.必须有底物存在,抑制剂才能对 酶产生抑制作用;c.动力学参数
非竞争性
抑制剂既于酶又与底物结合 Ki Kis
非竞争: 两线K相交于(-1/Km,0)
竞争性图
抑制剂只与酶结合 Ki 竞争: 两线K相交于(0 ,1/Vm) 曲线相交一点且在Y轴上 Vm值不变,Km值随浓度 上升而变大 以抑制剂浓度—该抑制剂曲线的截 距作图,该图的斜率即为Ki
2.非竞争性
• 非竞争性抑制剂和底物可能分别与酶的不 同部位结合。抑制剂与酶的结合并不妨碍 酶再与底物结合,但所形成的酶—底物—抑 制剂复合
抑制类型的判断
• • • • 可逆型抑制类型分为 1.竞争性抑制 2.非竞争性抑制 3.反竞争性抑制
三种类型图示
使1/ v(酶速度)对1/S(酶浓度)作图,可 以获得一条直线。
抑制常数: 1.Km为米氏常数 2.Ki为与酶结合的抑制常数 3.Kis为与酶底物复合物的抑制常数
Km值测定: 米氏双倒数作图法
抑制剂种类
1.含酚基的化合物 与酪氨酸酶的双铜离子活性中心结合, 大多数是酪氨酸酶的竞争性抑 制剂. 2.芪类及其类似物 只有一个羟基取代基时, 该羟基芪没有抑制酪氨酸酶的活性; 当结构 中有两个羟基时, 对酪氨酸酶的抑制活性显著增强 3.黄酮类物质 螯合酶活性中心的铜来抑制酶活力. 4. 醛类化合物 羰基与酪氨酸酶活性中心周围的亲核基团, 形成稳定的螯合配体结构 (席夫碱结构), 生成的产物在酪氨酸酶的疏水性环境中能稳定存在, 并在活 性中心周围形成空间位阻, 阻止底物与活性中心作用, 从而抑制酪氨酸酶 的催化活性, 抑制黑色素的合成.
零级反应
混合级反应
½ Vmax
一级反应
Km
一级反应中可求反应初速度
一、酶活力测定— 酶反应初速度的测定:
常用单位时间内、产物的浓度增加量表示。
Product Concentration
A =εC d
: 3600 M-1cm-1 d: 1cm
确定酶反 应时间!
Time
v= dC /dt
返回
1.竞争性抑制
• 抑制剂和底物在结构上有某些相似之处, 二者可能竞争与酶分子的同一部位结合。
竞争性抑制
一.特点:抑制剂与底物竞争酶的活性部位, 当抑制剂与酶的活性部位结合后,底物就不 能再与酶结合,同样反之。 二.竞争性抑制的机理 1 抑制剂与底物在结构上有类似之处 2 可能结合在底物所结合的位点(如结合基 团)上,从而阻断了底物和酶的结合 3 降低酶和底物的亲和力。
• 对酶活性的一种抑制作用,其特征是反应 的最大速度比未加抑制剂时反应的最大速 度低,当以速度的倒数相对底物浓度的倒 数作图,所得图线与未被抑制反应的图线 平行 • 抑制剂只与酶-底物复合物结合,而不与游 离酶结合的一种酶促反应抑制作用。
反竞争性图
抑制剂只与酶底物复合物结合 Kis 反竞争: 两线K相差0.01 截距相差0.1 Km值变小,Vmax值变小,但 Vmax/Km值不变 以抑制剂浓度—该抑制剂曲线的截 距作图,该图的斜率即为Kis
特殊抑制类型
混合型的抑制:曲线相交与一点但该点不在X或Y轴上, 一般在第二或三象限
混合型 抑制剂既于酶又与底物结合 Ki Kis
特殊抑制类型
混合型的Ki Kis值与非竞争性计算方式一样 切记:两个数值不一样
总结性图表
抑制剂对单酚酶,多酚酶作用图示
谢谢
米氏方程
Vmax [S] v K m [S]
延滞时间的原理(多巴为例)
对酪氨酸酶单酚酶(二酚酶)影响
抑制剂浓度—延滞时间 作图 抑制剂浓度—Vss 作图
IC50
Vss为酶的活力百分比=Vt/V ×100 % IC50即为酶失去一半活力时的抑制剂
结论
• • • • • 上述三个图标我们可以得出几点结论 1.抑制剂浓度对酶的延滞时间是否有影响? 2.计算出酶的活力(酶的剩余活力) 3.计算酶的抑制酶活 4.酶的IC50
酶在不同浓度抑制剂下的作用
该次的测量主要断定此抑制是否可逆? 酶浓度 抑制剂浓度 OD值 A E 对照 AE AF AG AH B F BE BF BG BH C G CE CF CG CH D H DE DF DG DH
酶在不同浓度抑制剂下的作用
• 以酶浓度—OD值作图 转换
酶浓度—酶活力(剩余活力)
曲线1-5抑制剂浓度逐渐上
升(曲线1为对照品) 曲线相交一点且在X轴上 Km值不变,Vm值随浓度 上升而变小
非竞争性图
1.以抑制剂浓度—该抑制剂曲线的斜率作图,该图的斜率即 为Ki 2.以抑制剂浓度—该抑制剂曲线的截距作图,该图的斜率即 为Kis 3.非竞争抑制中Ki,Kis的值是一致的
3.反竞争性
