2013年高考化学大题冲关滚动练:速率、平衡图表类综合题
2009-2013年高考化学试题分类汇编:化学反应速率和化学平衡
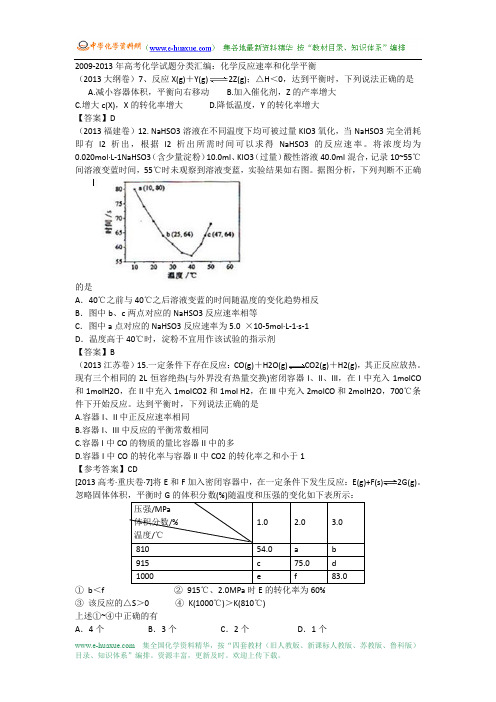
2009-2013年高考化学试题分类汇编:化学反应速率和化学平衡(2013大纲卷)7、反应X(g)+Y(g)2Z(g);△H<0,达到平衡时,下列说法正确的是A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大【答案】D(2013福建卷)12. NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。
将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。
据图分析,下列判断不正确的是A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反B.图中b、c两点对应的NaHSO3反应速率相等C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1D.温度高于40℃时,淀粉不宜用作该试验的指示剂【答案】B(2013江苏卷)15.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。
现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO 和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。
达到平衡时,下列说法正确的是A.容器I、II中正反应速率相同B.容器I、III中反应的平衡常数相同C.容器I中CO的物质的量比容器II中的多D.容器I中CO的转化率与容器II中CO2的转化率之和小于1【参考答案】CD。
[2013高考∙重庆卷∙7]将E和F加入密闭容器中,在一定条件下发生反应:忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:①b<f③该反应的△S>0 ④K(1000℃)>K(810℃)上述①~④中正确的有A.4个B.3个C.2个D.1个答案:A【解析】同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>75.0>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0,所以①正确;在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得2ax/(a-ax+2ax)=75%,解得x=0.6,②正确;该题是气体体积增大的反应,因此为熵增反应,③正确;结合前面分析知升温平衡正向移动,则平衡常数增大,④正确,故正确答案为:A。
高考化学复习高考大题冲关滚动练:速率、平衡图表类综合题

大题冲关滚动练之七——速率、平衡图表类综合题1.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe 2O3(s)+3CO(g)2Fe(s)+3CO2(g)。
已知该反应在不同温度下的平衡常数如下表:温度/℃ 1 000 1 150 1 300平衡常数64.0 50.7 42.9请回答下列问题:①该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”)。
②在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。
求该时间范围内反应的平均反应速率v(CO2)=____________________,CO的平衡转化率为________。
③欲提高②中CO的平衡转化率,可采取的措施是________________________________________________________________________。
A.减少Fe的量B.增加Fe2O3的量C.移出部分CO2D.提高反应温度E.减小容器的容积F.加入合适的催化剂(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。
(3)写出氢氧化铝在水中发生酸式电离的电离方程式:________________________________________________________________________。
欲使上述体系中Al3+浓度增加,可加入的物质是________________________________________________________________________。
2.在2 L容积不变的密闭容器内,800 ℃时反应2NO(g)+O 2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:t/s 0 1 2 3 4 5n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007(1)用O2的反应速率表示0~2 s内该反应的平均反应速率v=________________。
2013年高考化学 艺术生提分秘籍 专题七化学反应速率和化学平衡

2013年高考化学艺术生精品提分秘籍专题七化学反应速率和化学平衡第I卷(选择题)一、选择题(本题包括17小题,每小题3分,共51分,每题只有1个选项是正确的)1.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是vvvv(Z) 3(X)B.2(W)=3=(Z) .Avvvv(X)=(W)(Y) D.C.23(X)=2(g) 2SO(g)+O是制备硫酸的重要反应。
下列叙述正确的是 2.2SO(g)322A.催化剂VO不改变该反应的逆反应速率52B.增大反应体系的压强,反应速率一定增大C.该反应是放热反应,降低温度将缩短反应达到平衡的时间ttcctt内,生成SO(g)SO(g)的浓度分别是~、D.在的平、,则时间间隔时刻,33121212cc-12v均速率为=tt-123.下列说法不正确的是A.反应物分子(或离子)间的每次碰撞是反应的先决条件B.反应物的分子的每次碰撞都能发生化学反应C.活化分子具有比普通分子更高的能量D.活化能是活化分子的平均能量与普通反应物分子平均能量之差,如图所示正反应的EE活化能为-14.人体血液内的血红蛋白(Hb)易与O结合生成HbO,因此具有输氧能力。
CO吸入肺中22K的浓度达。
220+HbCO,37 ℃时,该反应的平衡常数HbCO=发生反应:CO+HbOO220.02倍,会使人智力受损。
据此,下列结论错误的是到HbO浓度的2cc2K=反应的平衡常数A.CO 与HbO2cc2越少CO越多,与血红蛋白结合的OB.人体吸入的2时,人的智力才会受损O浓度之比大于或等于0.02C.当吸入的CO与2中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动.把COD (g)5O 反应方程式为:4NH(g)+5.工业制硝酸的其中一步反应为氨气的氧化,23H等物质生成。
有关ON、O(g) +6HΔN=-1 025 kJ/mol,氧化过程中还伴随有4NO(g)222该反应的说法不正确的是cccc O) (NO)·(H.反应处于平衡状态时,A)·(NHO()=223vv O) =2(H)(NH.反应达到平衡后,B323正逆 C.体系的总压强不变,说明反应已达平衡 1D.体系的温度不再变化,说明反应已达平衡。
全国高考化学化学反应速率与化学平衡的综合高考真题汇总含详细答案
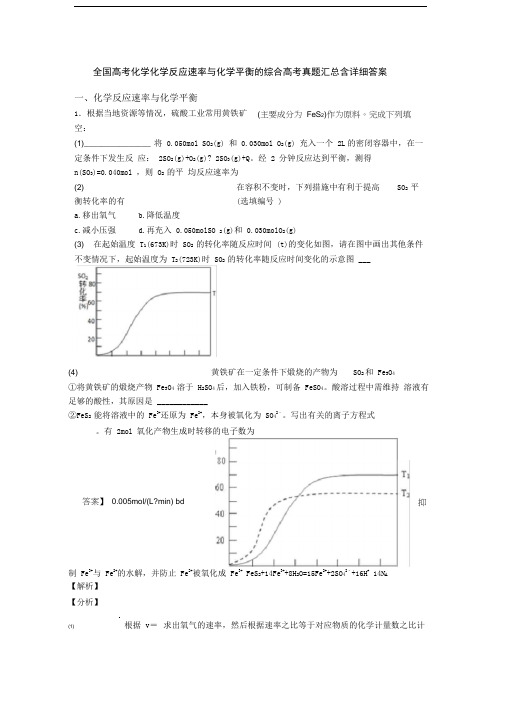
全国高考化学化学反应速率与化学平衡的综合高考真题汇总含详细答案一、化学反应速率与化学平衡1.根据当地资源等情况,硫酸工业常用黄铁矿空:(1) _______________ 将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)? 2SO3(g)+Q。
经 2 分钟反应达到平衡,测得n(SO3)=0.040mol ,则O2 的平均反应速率为(2) 在容积不变时,下列措施中有利于提高SO2 平衡转化率的有(选填编号)a.移出氧气b.降低温度c.减小压强d.再充入0.050molSO 2(g)和0.030molO2(g)(3) 在起始温度T1(673K)时SO2 的转化率随反应时间(t)的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2 的转化率随反应时间变化的示意图___(4) 黄铁矿在一定条件下煅烧的产物为SO2和Fe3O4①将黄铁矿的煅烧产物Fe3O4 溶于H2SO4后,加入铁粉,可制备FeSO4。
酸溶过程中需维持溶液有足够的酸性,其原因是____________②FeS2 能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42﹣。
写出有关的离子方程式。
有2mol 氧化产物生成时转移的电子数为制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+ FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+ 14N A【解析】【分析】c(1)根据v=求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计(主要成分为FeS2)作为原料。
完成下列填答案】0.005mol/(L?min) bd 抑算;(2)反应放热,为提高SO2 平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SO2 平衡转化率,由此分析解答;(3)反应是放热反应,温度升高,平衡逆向进行,二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;3+与Fe2+易水解,Fe2+易被氧化成Fe3+;②根据氧化还原反应中的反应物和生成物几何电(4)① Fe子守恒来配平化学方程式,结合方程计算转移电子数。
第七章 大题冲关滚动练之七 速率、平衡图表类综合题

大题冲关滚动练之七——速率、平衡图表类综合题1.一定条件下铁可以和CO 2发生反应:Fe(s)+CO 2(g) FeO(s)+CO(g) ΔH >0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO 2气体,反应过程中CO 2气体和CO 气体的浓度与时间的关系如图所示。
(1)该反应的平衡常数表达式K =__________。
(2)下列措施中能使平衡时K 增大的是________(填序号)。
A .升高温度 B .增大压强 C .充入一定量CO D .降低温度(3)8分钟内,CO 的平均反应速率v (CO)=________mol·L -1·min -1。
(4)1 100 ℃时,2 L 的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:A .2c 1=3c 2B .φ1=φ2C .p 1<p 2D .α1=α2②求c 1=____________、φ1=________、α2=__________。
答案 (1)c (CO)/c (CO 2) (2)A (3)0.062 5 (4)①BC ②0.67 mol·L -1 33.3% 33.3%解析 (1)平衡常数表达式中不能出现固体物质的浓度。
(2)平衡常数只受温度的影响,由于该反应为吸热反应,所以升温,增大平衡常数。
(3)求平均反应速率时,应用浓度的变化值除以时间,即v (CO)=0.50 mol·L -18 min=0.062 5mol·L -1·min -1。
(4)由图像可计算平衡常数,K =c (CO )c (CO 2)=0.500.25=2。
①当乙中CO 为2 mol 时,c 1=c 2,为3 mol 时,c 1<c 2;由于该反应为等体积反应,改变CO 或CO 2的浓度,相当于改变压强,平衡不移动,所以φ1=φ2;因为乙中气体分子数多,所以p 1<p 2;D 项,由于平衡是从不同途径建立的,所以α1+α2=1,B 、C 两项正确。
高考化学《化学反应速度 化学平衡》专题复习与练习题(含答案

2.一定条件下反应C(s)+CO2(g)
2CO(g) ΔH>0,在体积不变的密闭
容器中达到平衡,按要求回答下列问题: (1)平衡常数表达式是_K__=__cc_2C_C_OO_2_ ____。
(2)若升高温度,反应速率___增__大___(填“增大”、“减小”或“不变”,
下同),平衡常数K__增__大____,平衡向正__反__应__方向移动。
(3)若再通入一定量的CO2气体,反应速率_增__大___,平衡常数K_不__变_____, 平衡向_正__反__应___方向移动,CO2的转化率_减__小___。 (4)若再充入一定量的N2,反应速率_不__变__,平衡常数K_不__变___,平衡 __不___移动。
答案
3.正误判断,正确的打“√”,错误的打“×”。 (1)在其他条件不变时,使用催化剂,正反应速率和逆反应速率同等倍 数加快,平衡不移动( √ ) (2)当某反应达到限度时,反应物和生成物的浓度一定相等( × ) (3)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,达 到平衡时N2、H2、NH3三者共存( √ ) (4)当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相 等且都等于0( × )
(4)改变压强可以改变有气体参加或生成的化学反应的速率,但压强对化
学反应速率的影响是通过改变物质浓度产生的。无气体的反应,压强变
化对反应速率无影响。
(5)纯液体和固体浓度视为常数,它们的量的改变不会影响化学反应速率。
但固体颗粒的大小导致接触面的大小发生变化,故影响反应速率。
3.稀有气体对反应速率的影响 (1)恒容:充入“惰性气体”―引―起→总压增大―――――→物质浓度不变(活化分子 浓度不变) ―――――→反应速率不变。 (2)恒压:充入“惰性气体”―引―起→ 体积增大引起,物质浓度减小(活化分 子浓度减小) ―引―起→ 反应速率减小。
化学反应速率和化学平衡高考题集
化学反应速率和化学平衡高考题汇编叙永二中.高二备课组(课改2011级用)2013.03.161. [12·江苏14]温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)PCl3(g)+Cl2(g)经一段时间后达到平衡。
反应过程中测定的部分数据见下表:t/s下列说法正确的是A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%2. [12·江苏10]下列有关说法正确的是()A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈C.N2(g)+3H2(g)2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应3. [12·安徽9]一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2+2CO 催化剂加热2CO2+S(l) △H<若反应在恒容的密闭容器中进行,下列有关说法正确的是()A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其它条件不变,分享出硫,正反应速率加快、C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其它条件不变,使用不同催化剂,该反应的平衡常数不变4. [12·福建12]一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如右图所示。
2013速率与平衡
2013年高考化学试题分类汇编——选择题部分(9.水溶液)备注:2013年高考化学或者理科综合(化学)试题统计及顺序(共15套,31地区)1、(1套)大纲版全国卷(广西)2、(1套,9地区)新课标全国卷I(内蒙古、宁夏;黑龙江、吉林、河南、河北、山西、陕西、湖南、江西)3、(1套,7地区)新课标全国卷II(西藏,新疆;青海、甘肃、贵州、云南、辽宁)4、(4套,4地区)4个直辖市各一套:北京、天津、上海、重庆5、(8套,8地区)独立命题省份:安徽,山东,四川,江苏,浙江,福建,广东,海南。
12、右图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是A.两条曲线间任意点均有c(H+)×c(OH-)=KwB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=7【答案】D。
【试源】2013高考全国大纲版(广西)理综综合化学10.【题文】银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。
根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的的银器浸入该溶液中,一段时间后发现黑色会褪去。
下列说法正确的是()A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al + 3Ag2S = 6Ag + Al2S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl【答案】B【试源】2013年高考新课标Ⅰ卷化学试题11.【题文】某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()A. C1-、Br-、CrO42-B. CrO42-、Br-、C1-C. Br-、C1-、CrO42-D. Br-、CrO42-、C1-【答案】C【试源】2013年高考新课标Ⅰ卷化学试题13. 【题文】室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol·L-1时,溶液的pH等于()A.11()2bgaB.11()2agbC.14+11()2agbD.14+11()2bga【答案】C【试源】2013年高考新课标Ⅱ卷化学试题11.【题文】下列有关电解质溶液的说法正确的是()A.在蒸馏水中滴加浓H2SO4,K W不变B.CaCO3难溶于稀硫酸,也难溶于醋酸C.在Na2S 稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)D.NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同【答案】C。
【免费下载】化学平衡高考题
2013年化学反应速率与化学平衡高考题集1、(2013福建)7.NaHSO 3溶液在不同温度下均可被过量KIO 3氧化,当NaHSO 3完全消耗即有I 2析出,根据I 2析出所需时间可以求得NaHSO 3的反应速率。
将浓度均为0.020mol·L -1NaHSO3(含少量淀粉)10.0ml 、KIO 3(过量)酸性溶液40.0ml 混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。
据图分析,下列判断不正确的是()A .40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反B .图中b 、c 两点对应的NaHSO 3反应速率相等C .图中a 点对应的NaHSO 3反应速率为5.0 ×10-5mol·L -1·s -1D .温度高于40℃时,淀粉不宜用作该试验的指2、(2013安徽)12. 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO :MgSO 4(s) + CO(g) MgO(s) + CO 2(g) + SO 2(g) ¦¤H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x 的值,重新达到平衡后,纵坐标y 随x 变化趋势合理的是( )3、(2013北京)20.下列实验事实不能用平衡移动原理解释的是()4、(2013全国)30.反应X(g)+Y(g)2Z(g)<0,达到平衡时,下列说法正确是( )A.减小容器体积,平衡向右移动B.加入催化剂,Z 的产率增大C.增大c(X),X 的转化率增大 D .降低温度,Y 的转化率增大5、(2013)35.右图表示溶液中c(H +)和c(OH -)的关系,下列判断错误的是( ) A.两条曲线间任意点均有c(H +)×c(OH -)=Kw选项xyA 温度容器内混合气体的密度B CO 的物质的量CO 2与CO 的物质的量之比C SO 2的浓度平衡常数KDMgSO 4的质量(忽略体积)CO 的转化率807570656055 I10 20 30 40 50时间/sB.M 区域内任意点均有c(H +)<c(OH -)C.图中T 1<T 2D .XZ 线上任意点均有pH =76、(2013四川)47. 在一定温度下,将气体X 和气体Y 各0.16 mol 充入10 L 恒容密闭容器中,发生反应X (g )+ Y (g )−−→←−−2Z (g ) △H < 0,一段时间后达到平衡。
2013年高考化学试题分类解析(大纲版)考点3 化学反应速率和化学平衡
温馨提示:
此题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,关闭Word文档返回原板块。
考点3 化学反应速率和化学平衡
选择题
(2013·大纲版全国卷·7)反应X(g)+Y(g)2Z(g);ΔH<0,达到平衡时,下列说法正确的是()
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
【解题指南】解答本题时应分析清楚此反应的特点:即气态反应物、生成物反应前后总物质的量不变;反应为放热反应。
熟练运用平衡移动原理。
【解析】选D。
该反应气态物质反应前后总物质的量不变,减小体积平衡不移动,A 项错误;催化剂不影响平衡移动,产率不变,B项错误;增大X物质浓度,平衡正向移动,但X的转化率减小,C项错误;降低温度,平衡正向移动,Y的转化率增大,D项正确。
闭Word文档返回原板块。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大题冲关滚动练之七——速率、平衡图表类综合题1.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
O3(s)+3CO(g)2Fe(s)+(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe3CO2(g)请回答下列问题:①该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”)。
②在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。
求该时间范围内反应的平均反应速率v(CO2)=____________________,CO的平衡转化率为________。
③欲提高②中CO的平衡转化率,可采取的措施是________________________________________________________________________。
A.减少Fe的量B.增加Fe2O3的量C.移出部分CO2D.提高反应温度E.减小容器的容积F.加入合适的催化剂(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。
(3)写出氢氧化铝在水中发生酸式电离的电离方程式:________________________________________________________________________。
欲使上述体系中Al3+浓度增加,可加入的物质是________________________________________________________________________。
(g) 2NO2(g)体系中,n(NO)2.在2 L容积不变的密闭容器内,800 ℃时反应2NO(g)+O(1)用O2的反应速率表示0~2 s内该反应的平均反应速率v=________________。
若上述反应在850 ℃下进行,反应2 s时n(NO)=0.009 mol,并且不再随时间而改变,则该反应是__________热反应。
(2)图中表示NO2浓度变化的曲线是__________(填字母)。
(3)能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2)B.容器内的压强保持不变C.v逆(NO)=2v正(O2)D.容器内气体密度保持不变(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。
A.及时分离出NO2B.适当升高温度C.增大O2的浓度D.选择高效催化剂3.在100 ℃时,将0.40 mol的二氧化氮气体充入2 L真空的密闭容器中,每隔一段时间就(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为________ mol·L-1·s-1。
(2)n3__________n4(填“>”、“<”或“=”),该反应的平衡常数为________(保留小数点后一位)。
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是________ mol·L-1,假设在80 s时达到平衡,请在图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线。
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g) N2O4(g)的平衡常数将________(填“增大”、“减小”或“不变”)。
(5)达到平衡后,如向该密闭容器中再充入0.32 mol氦气,并把容器体积扩大为4 L,则平衡将______(填“向左移动”、“向右移动”或“不移动”),其理由是________________________________________________________________________ ________________________________________________________________________________________________________________________________________________。
4.已知下列两个反应:(g)+H2(g) CO(g)+H2O(g)ΔH1反应Ⅰ:COO(g) CO2(g)+H2(g)ΔH2反应Ⅱ:CO(g)+H(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2,那么K1·K2=________。
(2)反应Ⅰ的化学平衡常数K1和温度T的关系如表一:表一则ΔH1________0(选填“>”、“=”或“<”)。
(3)如果上述反应Ⅰ以CO和H2O(g)为起始反应物,在T ℃时CO和H2O浓度变化如图所示,且密闭容器的容积为1 L。
那么0~4 min的平均反应速率v(CO2)=mol·L-1·min-1,对照“表一”可知T=℃。
(4)某温度下,反应Ⅰ的化学平衡常数为2.25。
在该温度下,向甲、乙、丙三个恒容密闭容器中通入CO2(g)和H2(g),这两种物质的起始浓度如表二:表二反应速率最快的是________(填“甲”、“乙”或“丙”),平衡时,H2转化率最大的是________(填“甲”、“乙”或“丙”),丙中H2的转化率为________。
5.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)4CO(g)+2NO2(g)===4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+HO(g) CO2(g)+H2(g)ΔH<0。
820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
①该反应的平衡常数表达式为________________________________________________________________________。
②平衡时,甲容器中CO的转化率是________。
比较下列容器中CO的转化率:乙________甲;丙________甲(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度________(填“升高”或“降低”),平衡常数K______(填“增大”、“减小”或“不变”)。
答案1.(1)①c3(CO2)/c3(CO)<②0.006 mol·L-1·min-160%③C(2)b(3)Al(OH)3H++AlO-2+H2O盐酸(合理即给分)2.(1)0.001 5 mol·L-1·s-1放(2)b(3)BC(4)C3.(1)0.002 5(2)= 2.8(3)0.10如图(4)减小(5)向左移动氦气是惰性气体,不参与反应;扩大体积的瞬间,c(NO2)和c(N2O4)都降低为原来的一半,使c(N2O4)/c2(NO2)增大,并大于该温度下的平衡常数K,平衡会向左移动(或氦气是惰性气体,不参与反应,扩大体积相当于减小压强,平衡向左移动)解析根据反应速率的定义不难解答问题(1)。
根据已知表中的数据可知60~80 s反应达到平衡,故n3=n4。
由方程式2NO2(g)N2O4(g)及平衡常数公式可计算出其平衡常数约为2.8。
因温度、体积不变,故达到等效平衡时需要N2O4的起始物质的量为0.20 mol,即浓度为0.10 mol·L-1。
由于再充入0.32 mol氦气时对平衡无影响,但容器体积扩大为4 L时相当于给原平衡减压,故平衡逆向移动。
4.(1)1(2)>(3)0.03850(4)丙乙60%解析(1)反应Ⅰ和反应Ⅱ互为逆反应,而且温度相同,故K1与K2互为倒数关系。
(2)由“表一”中温度与化学平衡常数的关系可知,温度越高,化学平衡常数越大,即升高温度,平衡向正反应方向移动,故正反应为吸热反应,ΔH1>0。
(3)v(CO2)=v(H2O)=0.30 mol·L-1-0.18 mol·L-14 min=0.03 mol·L-1·min-1。
4 min时,c(H2O)=0.18 mol·L-1,c(CO)=0.08 mol·L-1,c(H2)=0.12 mol·L-1,c(CO2)=0.12 mol·L-1,所以化学平衡常数K1=0.18×0.080.12×0.12=1,查“表一”可知K1=1对应的温度为850 ℃。
(4)丙中的CO2(g)和H2(g)浓度都最大,而三个容器反应温度都相同,故丙中反应速度最大。
甲、丙为等效平衡,而乙中CO2(g)的起始浓度大于H2(g)的起始浓度,故乙中H2转化率最大。
设丙中平衡时CO(g)的浓度为x mol·L-1,那么CO2(g)的浓度为(0.02-x) mol·L-1,H2(g)的浓度为(0.02-x) mol·L-1,H2O(g)的浓度为x mol·L-1,所以K=x2/(0.02-x)2=2.25,解得x=0.012,即平衡时H2(g)的浓度为0.008 mol·L-1,故丙中H2的转化率为(0.02 mol·L-1-0.008 mol·L -1)/0.02 mol·L-1×100%=60%。
5.(1)乙(2)①K=c(CO2)·c(H2)c(CO)·c(H2O)②50%>=③降低增大解析通过温度对平衡移动的影响能够判断化学平衡的图像问题;通过温度对放热反应的影响可判断化学平衡常数的变化,同时可由化学平衡常数计算某反应物的变化量,从而得出该物质平衡时的转化率。
(1)4CO(g)+2NO2(g)===4CO2(g)+N2(g)ΔH<0,该反应是放热反应,当升高温度时,正、逆反应速率都增大,甲中正反应速率在T2时没有增大,故错误;升高温度,化学平衡逆向移动,CO的浓度增大,CO的体积分数增大,故丙不正确。
(2)根据反应的平衡常数为1.0可以得出c(CO2)·c(H2)=c(CO)·c(H2O),反应前后气体体积不变,可得出n(CO2)·n(H2)=n(CO)·n(H2O)。
