滚动小专题(二)溶解度和溶质的质量分数.ppt
中考化学专题复习课件溶解度和溶质的质量分数的关系总结与训练精品课件

公
式 : 溶 质 的 质 量 分 数 = 溶液 质量 × 100% =
溶质 质量 溶质 质量+ 溶剂 质量×100%。
变形公式:①溶质质量= 溶液质量×溶质的质量分数
。
溶质质量
②溶液质量= 溶质的质量分数
。
12.能正确表示下列反应的离子方程式的是( )
A、石灰石是碳酸钙,不能做干燥剂,A错误;B、氨气是非电解质,B错误;C、氮氧化物、二氧化硫、PM2.5均是空气质量检测物质,C正确;D、一氧化碳不是酸性氧化物,与碱
x
4.9 g
液分别降温至 t ℃,甲溶液中的溶质质量一定小于乙 (2)41.8 装置内残留有CO2(或混有空气或氯化氢气体)
3.A [解析] 图甲中转化1是水与二氧化1碳的反应,反应的化学方程式为 CO2+H2O H2CO3,不是酸雨形成的主要原因。
9.A [解析] 溶解时,应在烧杯中进行,不能在量筒内进行。
(二)分解2反、应 相同量溶质的不同物质饱和溶液
中:S越大,则溶剂质量越小,溶液质量越小; 2.A [解析] 人体所需的六大营养素是蛋白质、糖类、油脂、维生素、无机盐和水。人体摄入的营养素必须要均衡,图中的食品标签中有糖类(精制面粉和白砂糖)、蛋白质(牛肉)、油
脂(食用油)、无机盐(碳酸氢钠和氯化钠),缺少维生素。
E.t2 ℃时,乙饱和溶液的溶质的质量分数一定大于甲溶液的溶质的质量分数 F.t1℃时甲乙丙三种物质的饱和溶液升温到 t2 ℃时,三种溶液的溶质质 量分数的大小关系是乙>甲=丙
1.(2019·唐山路北区二模)如图是 A、B、C 三种物质的溶解度曲线,下
列分析正确的是( B ) A.20 ℃时 A、B、C 三种物质的饱和溶液升温到 50 ℃时,三种溶液 的溶质质量分数的大小关系是 B>A=C B.50 ℃时把 50 gA 放入 50 g 水中能得到 A 的饱 和溶液,其中溶质与溶剂的质量比为 1∶2 C.20 ℃时 A、C 两物质的饱和溶液中含溶质的 质量相等 D.50 ℃时 A、B、C 三种物质的饱和溶液各蒸发 10 g 水,析出晶体的 质量相等
溶解度和溶质质量分数

溶解度、溶质质量分数知识点复习一、溶液二、1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。
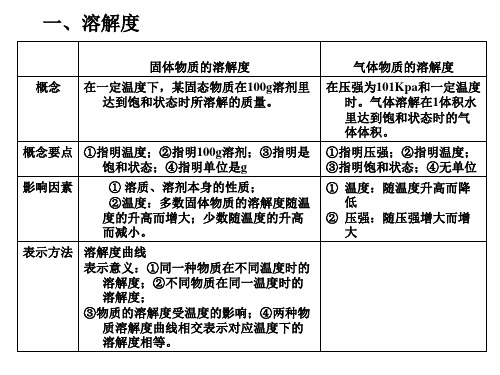
2,溶液的特征(1)均一性(2)稳定性三、二、、饱和溶液与不饱和溶液四、1、概念:五、(1)饱和溶液:六、(2)不饱和溶液:七、2、饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,当温度、溶剂的量发生改变时,两者之间可以相互转化:不饱和溶液饱和溶液三、固体物质的溶解度以及溶解度曲线四、1、概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
2、表达式:溶解度=溶质质量/溶剂质量*1003、3、影响固体溶解度大小的因素(1)溶质、溶剂本身的性质(2)温度4、物质的溶解性跟溶解度的关系溶解度是物质溶解性的量度5、溶解度曲线(1)溶解度曲线的意义:①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时溶液必定是饱和溶液③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。
在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液。
(2)溶解度曲线变化的规律:大多数固体物质的溶解度随温度的升高而增大,如硝酸钾;少数固体物质的溶解度受温度的影响较小,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,如熟石灰。
四、溶质质量分数(1)概念:(2)表示方法:(3)溶解度与溶质质量分数的比较在饱和溶液中:溶质质量分数=溶解度/(100g+溶解度)*100%五、结晶的方法:六、(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
溶解度ppt课件

溶解度单位
01
02
03
质量百分比
以溶质质量与溶液质量之 比表示,常用于固体溶解 度。
摩尔浓度
以溶质的摩尔数与溶液体 积之比表示,常用于气体 溶解度。
其他单位
如ppm(百万分之一)、 g/L(克每升)等。
溶解度影响因素
在一定温度和压力下,溶质在溶剂中的最大溶解量。
影响溶解度的因素
02
溶质和溶剂的性质、温度、压力等。
溶解度与溶解速率的关系
03
溶解度大不一定溶解速率快,溶解速率与溶质颗粒大小、溶剂
温度等因素有关。
溶解度研究前沿动态
超临界流体溶解度研究
利用超临界流体作为溶剂,研究不同物质在其中的溶解度,为化 工、医药等领域提供新的分离和纯化方法。
温度
一般来说,随着温度升高,溶解 度增大。但某些物质(如气体和 某些盐)的溶解度可能随温度降
低而增大。
压力
对于气体溶解度,压力增大通常会 使溶解度增大。
溶质与溶剂的性质
不同溶质在同一种溶剂中的溶解度 可能相差很大,这与溶质和溶剂分 子间的相互作用力有关。
CHAPTER 02
固体溶解度
固体溶解度定义
定义
指在一定温度和压力下,某固态物质在100g溶剂中达到溶解平衡时所溶解的质 量。
单位
通常用g/100g溶剂表示。
固体溶解度测定方法
静态法
在一定温度下,将过量的溶质加入一 定量的溶剂中,搅拌并静置,测定上 层清液中溶质的质量,计算溶解度。
动态法
通过测定溶质在不同温度下的溶解度 ,绘制溶解度曲线,利用曲线推算出 其他温度下的溶解度。
溶质的质量分数培训课件(ppt 30张PPT)

解:
设:稀释后溶液的质量为x 50g× 98% = X × 20%
稀释后溶液中溶质质量
稀释前溶液中溶质质量
X=245g 需要水的质量为:245g-50g=195g 答:需要水的质量为195g。
练习 某工厂化验室配制5000g20%的盐酸, 需要38%的盐酸(密度为1.19g/mL)的盐酸多 少毫升?
请问溶质的质量分数与溶 解度有什么区别?
溶质的质量分数36% 是指: 100g溶液中含有36g溶质。 溶质T0C时溶解度36g是指:在t0C 时,100g水最多 溶解该溶质36g。溶液质量应该为136g
浓度与溶解度的比较
溶质质量分数 溶 解 度
意 义
温 度
表示溶液中溶质 质量的多少
表示物质 溶解性的强弱 一 定 100g 必须饱和 质量单位(g)
0.5g 10.5g 1g 11g
4.8% 9.1% 13%
1.5g 11.5g
100mL中有 某物质多少 mg (多见于 各种饮料)
某物质含量为X%
溶质的质量分数:表示溶液组成的一种方法 定义:溶质质量与溶液质量之比 ω(溶质) 溶质的质量分数表达式: 千万别丢下我啊! m(溶质) ×100% 拜托了! m(溶液) m(溶质) × 100% m(溶质)+m(溶剂)
课题 3
溶质的质量分数
第一课时
Hale Waihona Puke 无水硫酸铜实验9--5
水
在三支试管中各加入10mL水,然后分别加 入约0.5g、1g、1.5g固体硫酸铜。比较三种溶 液的颜色。
试管 溶液颜 溶 剂 溶 质 溶 液 溶质质量 编号 色比较 质量/g 质量/g 质量/g 分数
初三化学下学期溶解度与溶质质量分数计算(PPT)5-2
溶液中溶质的质量分数?
练习3 右图是 A、B、C三种物质的溶解度曲线。请回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 C、B、A;
由该溶解度曲线,你还能获取哪些信息,请说出两条:
、
。
(2)当A中混有少量B时,可用__降__温__结__晶_____方法提纯A。
问题:已知第3题中t1℃时A物质的溶解度为4度
在一定温度下,某固态物质在100g溶剂里 达到饱和状态时所溶解的质量。
概念要点 ①指明温度;②指明100g溶剂;③指明是 饱和状态;④指明单位是g
影响因素
① 溶质、溶剂本身的性质;
②温度:多数固体物质的溶解度随温 度的升高而增大;少数随温度的升高 而减小。
表示方法 溶解度曲线
① 温度:随温度升高而降 低
② 压强:随压强增大而增 大
名蠢人(骂人的话)。 【笨活儿】名笨重的工作;粗活儿。 【笨口拙舌】嘴笨;没有口才。也说笨嘴拙舌。 【笨鸟先飞】比喻能力差的人做事时,恐怕落 后,比别人先行动(多用作谦辞)。 【笨手笨脚】形容动作不灵活或手脚不灵巧。 【笨头笨脑】①形容人不聪明,反应迟钝。②形容式样蠢笨:皮鞋做得~ 的,我不喜欢。 【笨重】形①庞大沉重;不; 口才加盟品牌前十名 口才加盟品牌前十名 ;灵巧:~家具|身体~。②繁重而费力:用机 器代替~的体力劳动。 【笨拙】形笨;不聪明;不灵巧:动作~|笔法~。 【笨嘴拙舌】笨口拙舌。 【伻】〈书〉①使;令。②使者。 【祊】①古代宗庙 门内设祭的地方。②古代在宗庙门内举行的祭祀。 【崩】①动倒塌;崩裂:山~地裂。②动破裂:把气球吹~了◇两个人谈~了。③动崩裂的东西击中:炸 起的石头差点儿把他~伤了。④〈口〉动毙。⑤君主时代称帝王死:驾~。 【崩溃】动完全破坏;垮台(多指国家政治、经济、军事等):敌军全线~|该 国经济濒临~。 【崩裂】动(物体)猛然分裂成若干部分:轰隆一声,山石~。 【崩龙族】名德昂族的旧称。 【崩盘】∥动指、期货等市场由于行情大跌而 彻底崩溃。 【崩塌】动崩裂而倒塌:江堤~。 【崩坍】动悬崖、陡坡上的岩石、泥土崩裂散落下来;崩塌:山崖~。 【绷】(綳、繃)①动拉紧:把绳
溶解度ppt课件

24
Q P
A的 不饱和溶液,ω(C)= 20g/120g×100%
20 15
B ② 在t2℃时,将25gA放入到100g
C 水中,充分溶解后得到的是A物质
的 饱和 溶液,ω(A)=20g/120g×100%
0
t1 t2 t3 温度/℃
③ t3℃时,C物质的饱和溶液的溶质质量分数是: 15g/115g×100% 在230gB物质的饱和溶液中含有B 物质__3_0___g
采取措施
降低温度
升高温度 恒温蒸发溶剂或加入溶质 加入溶剂 升高温度同时加溶质
70 KNO3饱和溶液的W/%
60 M
50
40
N P
30
Q
Y 20
10 温度/℃
10 20 30 40 50 60 70 80
⑥沿曲线向下移动
降低温度
如上的六种操作中,能从溶液中析出固体的是第⑥种情况。
如何使溶液 从P点Q点?
D
大册P17 基础测评 1.2.3
D A C
大册P18 基础测评 4.5.6
A
C C
大册P18 拓展提升7
AB D B
C 不能
大册P18 自主梳理
大册P19 合作探究 问题1
31.6
100
131.6
饱和
C
(1)已知20℃时,S(蔗糖)=204g,将200g蔗糖放入100g水 中,充分溶解后得到的是蔗糖的 不饱和 溶液,其ω= 66.7%。 (2)已知20℃时,S(氢氧化钙)=0.2g,将1gCa(OH)2放入100g 水中,充分溶解后得到的是Ca(OH)2的 饱和 溶液,其ω= 0.2%。 (3)已知20℃时,S(氢氧化钙)=0.2g,将0.15gCa(OH)2放入100g 水中,充分溶解后得到的是Ca(OH)2的不饱和 溶液,其ω=0.15。% (4)已知75℃时,S(氢氧化钙)=0.1g,将0.1gCa(OH)2放入100g 水中,充分溶解后得到的是Ca(OH)2的 饱和 溶液,其ω=0.1%。
《溶质的质量分数说》课件
案例分析
• 以某种药物在水中的溶解度为例,探讨 温度对溶解度的影响。
• 通过实验数据和数据分析,得出结论并 提供建议。
总结讨论
• 总结溶质的质量分数的重要性和作用。 • 讨论溶解度曲线和共沸现象对实际应用
的影响。 • 提出对进一步研究的建议。
2
应用范围
质量分数被广泛应用于化学、生物、医药等领域的实验研究和工业生产中。
3
示例
例如,药物的质量分数决定了药物的浓度和药效。
溶解度曲线和共沸现象
溶解度曲线
溶解度曲线是通过实验测量在 不同温度下溶液中溶质的溶解 度而得到的曲线。
共沸现象
互溶性
共沸是指在一定压力下,由于 溶液中溶质的存在,溶液沸腾 温度高于溶剂的纯净沸腾温度。
1 概念
质量分数是指溶质在溶液中的质量与溶液总质量的比值。
2 计算方法
质量分数 = (溶质的质量 / 溶液总质量) × 100%。
3 示例
例如,如果溶液中含有10克溶质,溶液总质量为50克,则质量分数为 (10 / 50) × 100% = 20%。
质量分数的作用和应用范围
1
作用
质量分数用于描述溶液中溶质的含量和浓度,对溶液的性质和应用具有重要影响。
《溶质的质量分数说》 PPT课件
本课件将带您深入了解溶质的质量分数,涵盖了溶质的定义和分类、溶解度 和饱和溶解度、质量分数的概念和计算方法、质量分数的作用和应用范围、 溶解度曲线和共沸现象、实验方法和结果分析以及案例分析和总结讨论。
溶质的定义和分类
1 定义
溶质是指在溶液中被溶解的物质。
2 分类
溶质可以分为固体溶质、液体溶质和气体溶质。
互溶性是指两种溶质在一定温 度下可以以任意比例相互溶解 的性质。
溶解度 PPT教学课件
因为溶解度实质上是溶质的质量,在此质量的单位为克。 8
溶解度概念 的四要素
①必要条 一定温度 件: ②标准: 100g溶剂
③状态: 饱和状态
④单位: 溶质质量(g)
9
影响因素
内部因素:溶质和溶剂本身的性质 外部因素:温度
我理解
例:蔗糖在20℃时的溶解度是203.9g。 在20℃时,100g水中最多可溶解203.9g蔗糖。 在20℃时,100g水中溶解203.9g蔗糖时,溶液达到饱和。
4
饱和溶液的浓度一定比不饱和溶液的浓度大。
同温度下,同溶质的饱和溶液比不 饱和溶液浓度大!
5
小结:浓稀溶液与饱和溶液、不饱和溶液的关系
6
二、物质溶解性的定量表示——溶解度(S)
1、概念 固体物质的溶解度: 指在一定温度下,该物质在100g 溶剂(通常指水)里达到饱和 状态时所溶解溶质的质量.
7
16
溶 解
150
140 130
度/ 克
120
110
100
硝酸钾
A
90
80
70
60
50
40
B
氯化钠
30
20
10
0
10 20 30 40 50 60 70 80 90温度/℃ 17
\g
250
溶
解 度
200
150
100
50
\g
溶 解
0 0
度
0.18
0.13
0.08 0
硝酸钾
硝酸钠 认真读 图,你
氯化钠 肯定会
13
·上海教育版
固体溶解度与溶解性的关系
人教版九年级下册化学 第九单元 溶液 滚动小专题(二) 溶解度及溶解度曲线
【解析】 t1℃时,相同质量的甲与丙两种物质的饱和溶液中溶质 质量相等,故A错误;乙溶解度受温度变化影响小,降 低温度时甲物质的溶解度变化较大,则乙中混有少量甲 时,应采用蒸发结晶的方法提纯乙,故B项错误;20 ℃ 时,溶解度大于10g的物质为易溶物质,根据图像,0 ℃ 时甲物质的溶解度为10 g,且随温度的升高,甲物质的 溶解度不断增大,所以甲属于易溶物质,故C正确; t2℃时,甲的溶解度为50 g,则在50 g水中最多只能溶解 25 g甲,形成75 g溶液,故D项错误。
减小,会析出晶体,溶质质量分数会减小,但t2℃时丙的溶解度 大于t1℃时甲的溶解度,故两种溶液中的溶质的质量分数丙大于 甲,B错误;甲的溶解度随温度的升高而增大,将t2℃时甲的饱和 溶液变为t3℃时甲的饱和溶液,可以采用蒸发水的方法,C正确; t3℃时三种物质的溶解度关系为甲>乙>丙,将t3℃时三种物质的 饱和溶液恒温蒸发等量水后,析出溶质的质量甲>乙>丙,D正确。
典例1 (2015•河北)甲、乙、丙三种固体物质的溶解度曲线如图所示,下 列叙述错误的是( B )
A.t1℃时,将等质量的甲、乙分别配成 饱和溶液,所得溶液质量:甲>乙
B.将t1℃时甲、丙的饱和溶液升温到t2℃, 两种溶液中溶质的质量分数相等
C.将t2℃时甲的饱和溶液变为t3℃时甲的饱和溶液,可以采用蒸 发水的方法
【解析】 比较②③数据可知,②中所得溶液是不饱和溶液,故A
错误;20 ℃ 时10 g 水最多溶解3.6 g NaCl,故B错误;
由表中数据可知,③④溶液都是饱和溶液,在相同温度
下,同种物质的饱和溶液的溶质质量分数相等,故C正
确;①所得溶液的溶质质量分数为
2g 100% 16.7% 2g+10g
初中科学化学难点之溶解度与质量分数关系20页PPT
谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳
40、学而不思则罔,思而不学则殆。——孔子
初中科学化学难点之溶 解度与质量分数关系
6、纪律是自由的第一条件。——黑格 尔 7、纪律是集体的面貌,集体的声音, 集体的 动作, 集体的 表情, 集体的 信念。 ——马 卡连柯
8、我们现在必须完全保持党的纪律, 没有纪律便如磨坊没有水。— —夸美 纽斯
