化学反应工程与工艺专业实验讲义
化学反应工程与工艺专业实验讲义-2014年版本(全部)

化学工程与工艺专业实验讲义化工学院2014年改编实验一双驱动搅拌器测定气液传质系数气液传质系数是设计计算吸收塔的重要数据。
工业上应用气液传质设备的场合非常多,而且处理物系又各不相同,加上传质系数很难完全用理论方法计算得到,因此最可靠的方法就是借用实验手段得到。
测定气液传质系数的实验设备多种多样,而且都具有各自的优缺点。
本实验所采用的双驱动搅拌吸收器不但可以测定传质系数,而且可以研究气液传质机理。
本实验的目的是通过了解双驱动搅拌吸收器的特点,明暸该设备的使用场合以及测定气液传质系数的方法,进而对气液传质过程有进一步的了解。
一、实验目的:1. 了解和掌握气液传质过程的一般原理和流程;2.了解和掌握双驱动搅拌器测定气液传质系数设备的操作方法二、实验原理:气液传质过程中由于物系不同,其传质机理可能也不相同,被吸收组分从气相传递到液相的整个过程决定于发生在气液界面两侧的扩散过程以及在液相中的化学反应过程,化学反应又影响组分在液相中的传递。
化学反应的条件、结果各不相同,影响组分在液相中传递的程度也不同,通常化学反应是促进了被吸收组分在液相中的传递。
或者将这个过程的传质阻力分成气膜阻力与液膜阻力,就需要了解整个传质过程中哪一个是传质的主要阻力,进而采取一定的措施,或者提高某一相的运动速度,或者采用更有效的吸收剂,从而提高传质的速率。
气膜阻力为主的系统、液膜阻力为主的系统或者气膜阻力与液膜阻力相近的系统在实际操作中都会存在,在开发吸收过程中要了解某系统的吸收传质机理必须在实验设备上进行研究。
双驱动搅拌吸收器的主要特点是气相与液相搅拌是分别控制的,搅拌速度可以分别调节,所以适应面较宽。
可以分别改变气、液相转速测定吸收速率来判断其传质机理,也可以通过改变液相或气相的浓度来测定气膜一侧的传质速率或液膜一侧的传质速率。
测定某条件下的气液传质系数必需采取切实可行的方法测出单位时间单位面积的传质量,并通过操作条件及气液平衡关系求出传质推动力,由此来求得气液传质系数。
化学反应工程全套教学课件

可逆反应 不可逆反应
❖ 按照反应分子数分
单分子反应 双分子反应
多分子反应
❖ 按照反应机理分 单一反应
多重反应
平行反应 同时反应 连串反应 平行连串反应 集总反应
平行反应:一例如:氯苯的再氯化 k1
C6H5Cl + Cl2
k2
对-C6H4Cl2 + HCl 邻-C6H4Cl2 + HCl
❖ 本征动力学:又称化学动力学,是在理想条件下研究化学反 应进行的机理和反应物系组成、温度、压力等参数,不包括 传递过程及反应器结构等参数对反应速率的影响。
❖ 宏观反应动力学与本征动力学的区别:宏观反应动力学除了 研究化学反应本身以外,还要考虑到质量、热量、动量传递 过程对化学反应的交联作用及相互影响,与反应器的结构设 计和操作条件有关。
❖传递工程:涉及到动量传递、热量传递和质量传递。
❖工程控制:反应器的运转正常与否,与自动控制水平 相关。
1.4 化学反应工程学中涉及的定义
❖ 宏观反应过程:在工业规模的化学反应器中,化学反应过程 与质量、热量及动量传递过程同时进行,这种化学反应与物 理变化过程的综合称为宏观反应过程。
❖ 宏观反应动力学:研究宏观反应过程的动力学称为宏观反应 动力学。
❖ 停留时间分布:在非理想流动中,不同的质点在反应器中的停 留时间不同,形成停留时间分布。
寿命分布:指质点从进入到离开反应
停留时间分布有两种
器时的停留时间分布
年龄分布:指仍然停留在反应器中的
质点的停留时间分布。
寿命和年龄的关系:寿命是反应器出口处质点的年龄。
❖ 返混:不同停留时间的质点或粒子的混合称为返混,又称为 逆向混合。是不同年龄质点的混合,逆向是时间的概念上的 逆向,不同于一般的搅拌混合。
化学工程与工艺专业分析化学实验讲义
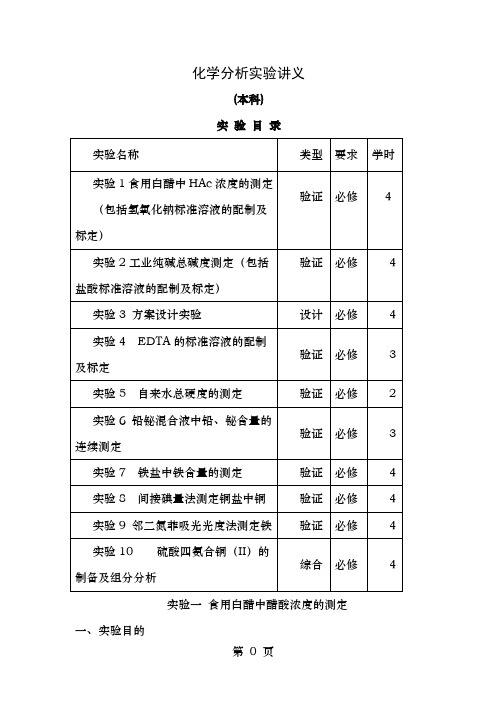
化学分析实验讲义(本科)实验目录实验一食用白醋中醋酸浓度的测定一、实验目的1.了解基准物质邻苯二甲酸氢钾的性质及其应用。
2.掌握NaOH 标准溶液的配制、标定的操作。
3.掌握强碱滴定弱酸的反应原理及指示剂的选择。
4.巩固分析天平操作,熟悉滴定操作方法,学习移液管与容量瓶等量器的正确使用。
二、实验原理1.食用白醋中的主要成份为醋酸,醋酸的Ka=1.8×10-5,可用标准NaOH 溶液直接滴定,滴定终点产物是醋酸钠,滴定突跃在碱性范围内,pHsp≈ 8.7,选用酚酞作指示剂。
从而测得其中醋酸的含量。
HAc+NaOH=NaAc+H 2O2. NaOH 标准溶液采用标定法,这是因为NaOH 固体易吸收空气中的CO 2与水蒸汽,故只能选用标定法来配制。
常用来标定碱标准溶液的基准物质有邻苯二甲酸氢钾、草酸等。
本实验用基准物质邻苯二甲酸氢钾标定,滴定产物为邻苯二甲酸钠钾,滴定突跃在碱性范围内,pHsp≈9,用酚酞作指示剂。
反应式如下:三、仪器台秤、半(全)自动电光分析天平、称量瓶、量筒(10mL)、烧杯、试剂瓶、碱式滴定管(50 mL)、锥形瓶(250mL)、移液管(25 mL )、容量瓶(250 mL )、电炉。
四、试剂NaOH(s)(A.R.)、酚酞指示剂(0.2%乙醇溶液)、食用白醋(市售)。
CO CO+ N a CO + H 2 O CO邻苯二甲酸氢钾(KHC8H4O4)基准物质(烘干温度100-1250C)。
五、实验步骤1.0.1mol/LNaOH标准溶液的配制用台秤称取4.0g NaOH固体于1000mL烧杯中,加去离子水溶解,然后转移至试剂瓶(聚乙烯)中,用去离子水稀释至1000mL,充分摇匀,贴上标签(溶液名称,姓名,配制日期),备用。
2.0.1mol/L NaOH溶液的标定准确称取邻苯二甲酸氢钾0.4~0.8g三份,分别置于250mL锥形瓶中,各加入约40mL热水溶解,冷却后,加入3滴酚酞指示剂,用NaOH溶液滴定至溶液刚好由无色变为微红色且30s内不褪,停止滴定。
《化学反应工程》课件

部分模化法
将反应器的一部分进行放大或缩小, 以研究其放大效应或缩小效应。
相似放大法
通过相似理论来预测大试实验结果, 需要保证相似条件得到满足。
04
流动与混合
流动模型与流型
1 2
层流模型
适用于低雷诺数的流体,流速较低,流体呈层状 流动。
湍流模型
适用于高雷诺数的流体,流速较高,流体呈湍流 状态。
3
过渡流模型
化学反应影响流动特性
化学反应释放的热量和产生的压力变化会影响流体的流动状 态。
流动与混合实验技术
实验设备
包括管式反应器、搅拌釜式反应器、喷射式反应器等。
实验方法
通过测量流体的流速、压力、温度等参数,分析流动与混合对化学反应的影响 。
05
传递过程与反应器的热力学基础
传递过程基础
传递过程定义
物质和能量的传递是自然界和工程领域中普遍存在的现象,传递 过程是研究物质和能量传递规律的科学。
通过调节进料浓度来控制反应物浓度,保证反应的稳定性和效率。
催化剂选择与优化
选择合适的催化剂并优化其用量,提高反应效率和选择性。
反应器放大与缩小
经验放大法
根据小试实验数据和经验公式,通过 比例放大来预测大试实验结果。
数学模拟放大法
通过建立数学模型来模拟反应过程, 并利用计算机技术进行放大和缩小实 验。
管式反应器
适用于连续操作和大量生产,传热效果好, 适用于高粘度液体和悬浮液。
流化床反应器
适用于固体颗粒的反应,传热效果好,适用 于大规模生产。
反应器设计基础
反应动力学
研究反应速率和反应机理,为反应器设计提 供基础数据。
热力学
研究反应过程中的能量变化和物质平衡,为 反应器设计提供热力学依据。
化学反应工程与工艺专业实验讲义

实验一反应精馏合成乙酸乙酯一实验目的1 了解反应精馏过程原理及适用场合.2 掌握反应精馏装置的操作方法和反应精馏研究方法。
3 了解反应精馏与常规精馏的区别。
4 学会用色谱-热导检测器分析塔内物料浓度组成。
二实验原理反应精馏法是将化学反应过程与精馏分离过程同时进行生产产品的操作。
由于物理过程与化学过程同时存在,使过程更加复杂。
(1)对可逆平行反应,通过精馏将反应产物中的高沸物或低沸物连续的从系统中排出,可使总转化率超过平衡转化率,大大提高生产效率。
(2)对于异构体混合物分离比较困难时,若其中的某组分能发生化学反应并生成沸点不同的物质,就可以加以分离。
本实验用乙酸、乙醇为原料,加入少量浓硫酸为催化剂通过反应精馏合成乙酸乙酯。
边反应边将乙酸乙酯分离出来,提高乙酸的转化率。
操作方式:间歇过程;塔釜连续进料过程;塔身某处连续进料过程。
产物分析方法:采用色谱-热导检测分析,色谱工作站处理。
GDX分离柱(φ3mm,L 2m) , 柱温110度,汽化温度130度,检测温度120度;载气压力0.04Mpa;桥流100mA.出峰的先后顺序为:H2O , CH3CH2OH , CH3COOH ,CH3COOC2H5.它们的摩尔校正因子分别为:3.03, 2.09, 1.39, 0.91。
三实验装置与试剂反应精馏装置一套,直径20mm, 内装填料,可自动加热、保温、回流控制。
操作过程见说明书。
无水乙醇200mL ;含浓硫酸0.3%(wt)的冰乙酸200mL.四实验步骤1 配置1:1.3(mol)酸醇混合液250mL,加入到塔釜中。
并用色谱准确测其组成。
2 开启色谱-热导检测分析仪及色谱工作站,按分析方法操作。
3 通冷却水,接通电源。
按操作说明书对反应精馏装置加热升温,并开启保温电流。
待塔顶有液体出现时,全回流30分钟。
以微量注射器在塔身不同高度取样口取样分析,作出塔内各组分的浓度分布曲线。
4 开启回流比3:1 ,塔顶开始出产品。
化学反应工程课件-PPT

k/
k
K
1/ p
E
E
1
H
r
ln
k
ln
k
1
ln
K
p
d ln k dT
d ln k dT
1
d ln K p dT
1
H r 1R4T 2
E
E
1
H r
对于吸热反应,ΔHr>0 对于放热反应,ΔHr<0
EE
EE
●反应 速率与 温度的 关系
r k f (X A) k g(X A)
r
dk
dk
( T ) xA f ( X A ) dT g( X A ) dT
kcA0 (1 X A ) (cB0
B A
cA0 X A )
(2.48)
XA——t
● 变
AA BB PP
ci
ni V
XA
容
过 程
* rA kcAcB
1 V
dnA dt
kcA cB
30
AA BB PP
组分
A B
反应前(XA=0)
nA0
1 j A1 2 j A2 ij Ai 0 rj
1M A1 2M A2 iM Ai 0 rM
M
i ij r j (*) j 1
rj
?
i
●忽略次要反应,确定独立反应数M;
●测M个组分的 i
●对每个组分按(*)式,建立M个线 性方程;
●求解代数方程组,得 rj.
22
例:乙苯催化脱氢反应可以用下列方程式表示
不受其他反应的反应组分浓度的影响。
特殊 情况
●多相催化反应; ●变容气相反应.
化学工程与工艺专业分析化学实验讲义
化学工程与工艺专业分析化学实验讲义化学工程与工艺专业是一门应用型科学,主要研究化学反应工程原理、化工过程及相关技术的综合性学科。
作为该专业的学生,实验课程是非常重要的一部分,通过实验可以帮助学生更好地理解理论知识、掌握实际操作技能,提高实践能力。
本文将介绍一份分析化学实验讲义,主要包括分析化学实验的目的、原理、实验步骤和结果分析等方面。
一、实验目的本次实验的目的是学习和掌握分析化学中的常用分析技术,并运用这些技术进行物质的定性与定量分析。
通过本次实验,学生应能够了解和掌握气相色谱分析的原理和操作方法,能够正确使用气相色谱仪进行样品分析。
二、实验原理气相色谱是一种常用的分离和分析技术,它基于物质在气相中的分配行为实现物质的分离和定性/定量分析。
其主要原理是通过溶剂和样品之间的分配和移动过程来实现样品中各种组分的分离。
在气相色谱仪中,样品首先被蒸发成气体,然后通过色谱柱中的固定相进行分离,最后通过检测器检测各组分的峰信号,并对其进行定性和定量分析。
三、实验步骤1.样品制备:取适量的待分析物样品,按照一定比例配制成溶液或气体样品。
2.样品进样:将制备好的样品以一定速度进样到气相色谱仪的进样口。
3.色谱柱选择:根据待分析物的性质选择合适的色谱柱。
4.色谱柱调试:根据待分析物的特性进行色谱柱的调试优化,如优化气相流速、柱温等条件。
5.实验测定:开启气相色谱仪,运行待分析物样品,记录峰面积、峰高等数据。
6.数据处理:根据测得的数据进行定性和定量分析,生成实验报告。
四、实验结果与分析通过实验测定,可以得到样品中各组分的峰面积或峰高数据。
通过对比样品和标准品的测定数据,可以进行定性和定量分析。
定性分析主要通过对比待分析物样品的色谱图与标准品的色谱图,判断样品中是否存在目标成分。
定量分析主要通过计算待分析物样品的峰面积或峰高与标准品之间的比例关系,从而推算出待分析物样品中目标成分的含量。
五、实验注意事项1.实验操作要严谨,遵循实验安全规范。
化学工程与工艺专业实验教材
6
表 2 乙醇、水、苯的常压沸点 物质名称(简记) 沸点温度(℃) 乙醇(A) 78.3 水(W) 100 苯(B) 80.2
从表1和表2列出沸点看,除乙醇一水二元共沸 物的共沸点与乙醇沸点相近之外,其余三种共沸物 的沸点与乙醇沸点均有10℃左右的温度差。因此, 可以设法使水和苯以共沸物的方式从塔顶分离出 来,塔釜则得到无水乙醇。 整个精馏过程可以用图1 来说明。图中A、B、 W分别为乙醇、苯和水的英文字头;AB Z 、AW Z 、 BW Z 代表三个二元共沸物,T表示三元共沸物。图 中的曲线为 25℃下乙醇、水、苯三元混合物的溶解度曲线。该曲线下方为两相区,上方为 均相区。图中标出的三元共沸组成点T是处在两相区内。 以T为中心,连接三种纯物质A、B、w及三个二元共沸点组成点AB Z 、AW Z 、BW Z ,将 该图分为六个小三角形。 如果原料液的组成点落在某个小三角形内。 当塔顶采用混相回流时 精馏的最终结果只能得到这个小三角形三个顶点所代表的物质。 故要想得到无水乙醇, 就应 该保证原料液的组成落在包含顶点A的小三角形内,即在ΔATABz或ΔATAWz内。从沸点 看,乙醇—水的共沸点和乙醇的沸点仅差0.15℃,就本实验的技术条件无法将其分开。而乙 醇一苯的共沸点与乙醇的沸点相差10.06℃,很容易将它们分离开来。所以分析的最终结果 是将原料液的组成控制在ΔATABz中。 图1中F代表未加共沸物时原料乙醇、水混合物的组成。随着共沸剂苯的加入,原料液 的总组成将沿着FB连线变化,并与AT线交于H点,这时共沸剂苯的加入量称作理论共沸剂 用量,它是达到分离目的所需最少的共沸剂量。 上述分析只限于混相回流的情况, 即回流液的组成等于塔顶上升蒸汽组成的情况。 而塔 顶采用分相回流时,由于富苯相中苯的含量很高,可以循环使用,因而苯的用量可以低于理 论共沸剂的用量。 分相回流也是实际生产中普遍采用的方法。 它的突出优点是共沸剂的用量 少,共沸剂提纯的费用低。
化学工程与工艺专业实验
' yCO,d =0.062 低变出口CO组分:yCO ,d
=0.023
α1 =
0.120 − 0.062 = 0.455 0.120 × (1 + 0.062)
低变反应变换率:y'0
CO,d
= yCO,d = 0.062
α2 =
0.062 − 0.023 = 0.615 0.062 × (1 + 0.023)
0 y1CO = yCO (1 − α1 )
0 0 y1 C O 2 = y C O 2 + y C O α 1
0 0 y1H 2 = yH 2 + yCOα1
f i ( Pi ) = P
P总 =
0.5 总
yCO y
− 0.5 CO2
(1 −
yCO2 y H 2 K P1 yCO y H 2 O
)
760 + 150 × 1 0 1 .3 = 1 2 1 .3 K p a 760
化学工程与工艺专业实验 — 一氧化碳中温—低温串联变换反应
一、实验项目的来源与技术背景
来源与背景
1、实验项目的来源 变换反应(Shift Reaction)是CO和水蒸汽反应生成H2和CO2。借 助变换反应可实现粗合成气中CO/H2比例的调节,广泛应用于合成氨、 制甲醇合成气、制氢和IGCC发电等项目。 (1) 在合成氨中的应用 一氧化碳与水发生变换反应生成氢和二氧化碳是合成氨生产中的 重要过程。合成氨主要用于制造氮肥和复合肥料,农业对化肥的需求 是合成氨工业发展的持久推动力。经过近百年的发展,合成氨技术趋 于成熟,形成了一大批各有特色的工艺流程,但都是由三个基本部分
一、实验项目的来源与技术背景
来源与背景
专业实验-反应工程实验讲义2013..
反应工程实验室安全注意事项1、在反应釜上合成产物特别是在100L釜内合成产物,必须有完善的工艺控制手段。
2、100L、10L反应釜皆为常压釜,严禁超压使用。
3、使用有毒、有害、易燃、易爆危险化学品时,必须加强室内通风,必要时要采取强制通风。
4、使用易燃、易爆危险化学品时,要密闭操作,严防物料泄漏,所用设备需防爆,同时还要防止由静电火花导致的火灾爆炸。
5、必须严格控制导热油温度,严禁超温。
反应物需冷却时,要及时打开内盘管及夹套循环冷油,防止超温引发危险。
6、在开关阀门之前要确认该阀门的功能。
7、开真空泵时要先打开进水阀门。
8、导热油热油罐及热油输送管道、反应釜体等温度较高,严禁触摸。
9、反应釜、水泵、油泵等皆为用电设备,在操作过程中要注意用电安全。
10、实验室内机械设备较多,操作时要预防机械伤害。
11、实验室内设备布置较密,空间狭小,在工作中严禁打闹、嬉戏。
12、实验室内严禁烟火。
反应工程实验室基础知识一、反应工程实验的重要意义反应工程是化工类技术基础课程,而实验是教学中的实践环节;是学生巩固理论知识,从实践中进一步学习新知识的重要途径,培养学生应用这些理论解决工程实际问题的能力,并掌握一定的实际操作技能。
为此,反应工程实验的目的是:1.加深对反应工程专业知识的理解与运用,学习并掌握各种仪器设备的安装、使用。
2.通过实验使学生掌握一定的实验研究方法和技巧。
并培养学生实事求是的科学态度。
3.通过实验数据的分析处理,编写实验报告,培养、训练学生的实际计算能力和组织报告的能力二、反应工程实验要求(一)实验前的预习工作1、阅读实验指导书,弄清本实验的目的和要求。
2、进入实验室后,要要遵守实验室安全注意事项,详细了解实验装置的流程、主要设备的结构、测量仪表的使用及实验操作方法,并认真思考实验操作步骤,测量记录的内容和测定数据的方法。
(二)实验小组的分工和合作反应工程实验一般都是由6-8人为一小组合作进行的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应工程与工艺专业实验讲义实验一反应精馏合成乙酸乙酯一实验目的1了解反应精馏过程原理及适用场合.2掌握反应精馏装置的操作方法和反应精馏研究方法。
3了解反应精馏与常规精馏的区别。
4学会用色谱-热导检测器分析塔内物料浓度组成。
二实验原理反应精馏法是将化学反应过程与精馏分离过程同时进行生产产品的操作。
由于物理过程与化学过程同时存在,使过程更加复杂。
(1)对可逆平行反应,通过精馏将反应产物中的高沸物或低沸物连续的从系统中排出,可使总转化率超过平衡转化率,大大提高生产效率。
(2)对于异构体混合物分离比较困难时,若其中的某组分能发生化学反应并生成沸点不同的物质,就可以加以分离。
本实验用乙酸、乙醇为原料,加入少量浓硫酸为催化剂通过反应精馏合成乙酸乙酯。
边反应边将乙酸乙酯分离出来,提高乙酸的转化率。
操作方式:间歇过程;塔釜连续进料过程;塔身某处连续进料过程。
产物分析方法:采用色谱-热导检测分析,色谱工作站处理。
GD某分离柱(φ3mm,L2m),柱温110度,汽化温度130度,检测温度120度;载气压力0.04Mpa;桥流100mA.出峰的先后顺序为:H2O,CH3CH2OH,CH3COOH,CH3COOC2H5.它们的摩尔校正因子分别为:3.03,2.09,1.39,0.91。
三实验装置与试剂反应精馏装置一套,直径20mm,内装填料,可自动加热、保温、回流控制。
操作过程见说明书。
无水乙醇200mL;含浓硫酸0.3%(wt)的冰乙酸200mL.四实验步骤1配置1:1.3(mol)酸醇混合液250mL,加入到塔釜中。
并用色谱准确测其组成。
2开启色谱-热导检测分析仪及色谱工作站,按分析方法操作。
3通冷却水,接通电源。
按操作说明书对反应精馏装置加热升温,并开启保温电流。
待塔顶有液体出现时,全回流30分钟。
以微量注射器在塔身不同高度取样口取样分析,作出塔内各组分的浓度分布曲线。
4开启回流比3:1,塔顶开始出产品。
当塔顶温度有明显变化时,停止出料,降温冷却,直到塔内液体全部流入塔釜。
称产品与残液质量、体积及浓度组成。
5改变回流比,重复上述操作。
五实验数据记录与处理1原料液的质量、摩尔数,各组分的浓度。
2全回流塔顶温度:塔釜温度:不同塔高度各组分的浓度,作各组分浓度分布曲线。
取样位置乙酸乙酯浓度乙酸浓度乙醇浓度3回流比3时,观察塔顶温度变化。
产品的质量、体积及各组分含量;残液质量、体积及各组分含量。
质量体积乙酸乙酯浓度乙酸浓度乙醇浓度原料液产品釜残液水4对乙酸、乙醇、乙酸乙酯作全塔物料衡算,计算乙酸转化率和乙酸乙酯的收率。
六注意事项1实验开始时必须先通冷却水,实验结束后待塔顶无回流液后最后关冷却水。
2开色谱仪时,先开载气;关色谱仪时,先关桥流,待检测温度下降后最后关载气。
七思考题1怎样提高酯化收率?2如何控制乙酸乙酯的纯度?3回流比对反应精馏过程有什么影响?实验二多釜串联反应器停留时间分布测定一实验目的1通过实验了解停留时间分布测定的基本原理和实验方法。
2掌握停留时间分布的统计特征值的计算方法3学会用理想反应器的串联模型来描述实验系统的流动特性。
二实验原理测定方法主要采用示踪响应法。
示踪剂加入方式有脉冲输入、阶跃输入法等。
本实验采用脉冲输入法:装置采用3个等体积反应釜串联,在第一釜中脉冲输入一定体积的饱和的KNO3溶液,并同时在每一釜出口测定电导率的变化。
通过计算机同时记录3个釜的电导率随时间的变化曲线。
通过处理实验曲线,得到停留时间分布的统计特征值。
故有:E(t)=CA/C0=(ΣtiCAiΔti)/(ΣCAiΔti);=(ΣtiCAiΔti)/(ΣCAiΔti)2对多釜串联模型,理论上的停留时间分布密度函数为:模型参数N与对比方差的关系为:,并计算出模型参数N。
三实验装置与试剂四实验步骤1将水槽中注满水,将信号线与计算机相连。
预先装好数据采集软件。
2将各釜的电导率测定仪调零。
3开电源,开泵。
调水流量为20—30m3/h,依次流过各釜,赶走系统气泡。
开启搅拌装置,调转速300r.p.m。
4稳定后,用鼠标开启脉冲电磁阀1—3秒,进样。
电脑开始记录电导率变化曲线。
当3条线重合时,采集信号结束。
保存数据并处理。
5实验完毕,电磁阀切换到蒸馏水槽,用水冲洗电磁阀。
停泵,关电源。
五数据记录与处理水流量:脉冲时间:转速:1实验原始曲线2统计特征值的计算六思考题1既然反应器的个数有3个,模型参数N又代表了全混流反应器的个数。
那么N值是否就等于3,若不是,为什么?2全混流反应器应具有什么样的特征,如何用实验方法判断搅拌釜是否达到全混流反应器的模型要求?如果尚未达到,如何调整实验条件使其接近这一模型?实验三沸石催化剂的制备与成型一实验目的:1掌握离子交换法制备Y型沸石催化剂的原理和方法。
2掌握催化剂挤条成型的方法。
二实验原理:Y型沸石催化剂是目前广泛应用的沸石类型。
Y型沸石催化剂的制备主要由以下几步组成:NaY离子交换洗涤过滤干燥成型焙烧成品三实验装置与试剂:四实验方法及步骤:1离子交换在天平上称取50克NaY分子筛装入四口烧瓶中,用量筒量取500毫升1mol/L氯化铵倒入四口烧瓶中,然后在100℃加热搅拌1小时,重复两次置换后,进行过滤和洗涤。
2过滤洗涤将滤纸铺在布氏漏斗内,倒入沉淀液体,抽真空过滤后用蒸馏水洗涤多次,至无氯离子后,洗涤完毕,取出滤饼放在蒸发皿内置于烘箱中,在120℃下烘干。
3成型4焙烧五结果与讨论:(1)列出实验条件和实验数据。
(2)测出成型后催化剂的外观形状与尺寸。
(3)画出实验流程图实验四乙醇气-固相脱水反应动力学测定一实验目的:1巩固所学的有关动力学方面的知识。
2掌握获得反应动力学数据的方法和手段。
3学会动力学数据的处理方法,根据动力学方程求出相应的参数值。
4熟悉内循环无梯度反应器的特点以及气相色谱的分析方法,提高自己的实验技能。
二实验原理:实验室中乙醇脱水是制备纯净乙烯的最简单方法,常用催化剂有:浓硫酸,液相反应,温度170℃;γ-Al2O3,气-固相催化反应,温度360℃;分子筛催化剂,气-固相催化反应,温度300℃。
本实验采用γ-Al2O3为催化剂。
乙醇脱水属平行反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚;反应如下:C2H5OH→C2H4+H2O(主)2C2H5OH→C2H5OC2H5+H2O(副)采用气相色谱热导仪在线分析反应产物中各组分的含量。
2分析条件为:GD某柱,内径3mm,长2m;载气柱前压力0.5Kgf/cm;柱温110℃;汽化温度130℃;检测室温度120℃;桥电流100mA.出峰的先后顺序为乙烯、水、乙醇、乙醚。
乙烯、水、乙醇、乙醚热导检测器的摩尔校正因子分别为2.08,3.03,1.39,0.91.由气相色谱工作站处理色谱峰得各组分的面积百分数,再校正得摩尔百分含量。
三实验装置与试剂:1实验装置:采用磁驱动内循环无梯度气-固相催化反应装置一套,进口平流泵。
实验流程图如右。
2试剂:无水乙醇(分析纯)500ml;γ-Al2O3催化剂,60—80目,3g。
四实验方法及步骤:1将反应器拆下来,在催化筐中装入3g左右的催化剂样品,然后将整个反应系统接好。
通N2气至一定流量,检查整个装置的气密性,直到不漏气为止。
2打开氢气钢瓶通载气,确认检测器出口有载气时开启色谱。
将各温度调节到所需值,待温度稳定后开桥流至100mA。
3在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启管路保温加热器升温至150℃。
4在气氛中按实验装置操作说明书打开装置的温控开关进行升温,预热器温度150℃,反应器的加热温度一般超过反应实际温度100-150℃。
同时向反应器夹套通冷却水。
5打开微量泵,以小流量通原料乙醇。
先将三通阀通大气,待有液体排出时,再转向反应系统。
同时关闭N2气截止阀。
6用阀箱内的旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
7在250——380℃之间选取四个温度点,每一温度下改变三次进料速度,测定各种条件下的数据。
8实验结束后,先停泵,关闭加热电流,待反应器内温度降到200℃以下,再关冷却水。
关闭热导电流和温度控制开关,待检测器温度降到150℃以下关载气。
五实验数据记录与处理:1原始数据表实验号1进料量ml/min0.050.10.150.050.10.150.050.10.150.050.10.15温度阀箱保温反应器产物含量c(归一法)乙烯水乙醇乙醚2342数据处理结果表实进料反应产物组成y(mol%)验量温度号ml/min乙水乙乙烯醇醚0.0510.10.150.0520.10.150.0530.10.150.050.10.15乙醇乙烯转化率收率r乙烯生成速度乙醇浓度速度常数K4有关计算公式如下:每一组分的摩尔含量yi=fici/Σfici;乙醇的转化率某A=1-y乙醇/(y乙醇+y乙烯+2y乙醚)乙烯的收率YC2H4=y乙烯/(y乙醇+y乙烯+2y乙醚)乙醇的进料速率nA=0.7893v0/46(mol/min)乙烯生成速率r=(nA.YC2H4)/催化剂用量反应时乙醇的浓度CA=pA/RT=PyA/RT,P=1atm生成乙烯反应速率常数K=r/CA将每一温度下的K先取对数,再取平均值。
以1/T为横坐标,lnK为纵坐标作图。
由斜率和截距可求出活化能E、指前因子K0lnk=lnk0-Ea/RTlnk0=32.264,Ea/R=21007活化能Ea=174.6KJ/mol指前因子k0=1.028-E14(L/g.min)乙醇脱水动力学实验曲线-1-2-3-4y=-21007某+32.264-5-61/T(1/K)-70.00160.00170.00180.0019lnk此外通过皂沫流量计测乙烯的体积流量可以进行反应过程的物料衡算。
六思考题:1用无梯度反应器测定化学反应动力学的优、缺点是什么?2要想证明测定的是本征动力学数据,还需补充哪些实验内容?3分别画出温度和乙醇进料速度与乙烯收率的关系曲线,并解释其规律。
实验五填料塔分离效率的测定一实验目的:1了解系统表面张力对填料精馏塔效率的影响机理;2测定甲酸-水系统在正、负系统范围的HETP。
二实验原理三实验装置与试剂。
