Ch7电化学
国内外电化学大牛

电化学大牛汪尔康院士化学家。
江苏镇江人。
1952年结业于沪江大学化学系。
1959年获捷克斯洛伐克科学院副博士学位。
1993年被选为第三世界科学院院士。
外国科学院长春利用化学研究所研究员。
50年代末发觉了阳离女促使汞电极氧化发生极谱氧化波的遍及纪律,提出界面形成汞配合及汞盐膜理论。
系统地研究了钌的极谱动力催化波和吸附催化波并提出其电极过程机理,&127;发觉锑(ⅲ)取各类氨羧配合剂形成配合物,锰(ⅱ)取酒石酸双核配合物等的极谱波,系统研究配合物的极谱电极过程。
研究了各类染料、外性载体、配体等正在液/液界面的离女转移及对金属离女的鞭策过程并切磋其机理及离女转移纪律。
系统研究各类微电极、化学润色电极、电化学检测器取液相色谱和毛细管电泳联用。
进行电化学扫描地道显微学和生物电化学研究。
颁发论著500多篇册。
1991年被选为外国科学院院士(学部委员)。
俞汝勤院士分析化学家。
湖南长沙人。
1953年入苏联列宁格勒矿业学院进修,1959年列宁格勒大学化学系结业。
回国后正在外国科学院长春利用化学研究所工做。
1962年调湖南大学,历任化学化工系副传授、传授、博士生导师、校长。
1991年被选为外国科学院化学部委员,1994年改称外科院院士。
是外国化学学会、外国仪器仪表学会、分析仪器协会理事,英国皇家化学会《分析家》纯志、国际《分析化学学报》参谋编纂,《化学传感器》从编,《高档学校化学学报》、《电化学》副从编,湖南省化学化工学会副理事长。
持久处放分析化学根本取利用的教学和研究,长于无机分析试剂和化学计量学研究。
正在无机试剂用于电化学、催化动力学及光度分析的研究方面合成了一系列新的无机分析试剂,研制了可测试10缺类离女和药物的电化学传感器,发觉了多类新的催化动力学反当并研制了多类删敏分析试剂。
80年代起头化学计量学研究,正在多元校反、滤波体例等方面取得功效。
掌管完成的“氟离女电极研究”获1978年全国科学大会奖;“无机试剂用于电化学、催化动力学及光度分析”获1987年国家天然科学三等奖;“多组份分析系统分类理论及化学计量学算法研究”获1995年国家教委科技前进一等奖。
高考高中化学电化学方程式汇总

高中电化学方程式汇总电极反应方程式一、原电池电极反应方程式1、Cu—H2SO4—Zn原电池(1)总反应:Zn+2H+==Zn2++H2↑(2)负极:Zn-2e-==Zn2+↑(3)正极:2H++2e-==H2、Cu—FeCl3—C原电池(1)总反应:2Fe3++Cu==2Fe2++Cu2+(2)负极:Cu-2e-==Cu2+(3)正极:2Fe3++2e-==2Fe2+3、钢铁在潮湿的空气中发生吸氧腐蚀(1)总反应:2Fe+O2+2H2O==2Fe(OH)2↓(2)负极:2Fe-4e-==2Fe2+(3)正极:O2+2H2O+4e-==4OH-4、钢铁在潮湿的空气中发生析氢腐蚀(1)总反应:2Fe+2H+==Fe2++H2↑(2)负极:Fe-2e-==Fe2+(3)正极:2H++2e-==H2↑5、氢氧燃料电池(中性介质)(1)总反应:2H22==2H2O(2)负极:2H2-4e-==4H+(3)正极:O2+2H2O+4e-==4OH-6、氢氧燃料电池(酸性介质)(1)总反应:2H2+O2==2H2O(2)负极:2H2-4e-==4H+(3)正极:O2+4H++4e-==2H2O7、氢氧燃料电池(碱性介质)(1)总反应:2H2+O2==2H2O(2)负极:2H2-4e-+4OH-==4H2O(3)正极:O2+2H2O+4e-==4OH-8、铅蓄电池(放电)(1)总反应:Pb+PbO2+4H++2SO42-==2PbSO4↓+2H2O(2)负极(Pb):Pb-2e-+SO42-==PbSO4↓(3)正极(PbO2):PbO2+2e-+SO42-+4H+==PbSO4↓+2H2O 9、铅蓄电池(充电)(1)总反应:2PbSO 4+2H2O Pb+PbO2+4H++2SO42-(2)阳极:PbSO4-2e-+2H2O==PbO2+SO42-+4H++2e-==Pb+SO42-(3)阴极:PbSO10、Al—NaOH—Mg原电池(1)总反应:2Al+2OH-+2H2O==2AlO2-+3H2↑(2)负极:2Al-6e-+8OH-==2AlO2-+4H2OO+6e-==3H2↑+6OH-(3)正极:6H11、CH4燃料电池(碱性介质)(1)总反应:CH4+2O2+2OH-33H2O(2)负极:CH4-8e-+10OH-==CO32-+7H2O(3)正极:2O2+4H2O+-==8OH-12、CH3CH2OH燃料电池()(1)总反应:CH2OH+3O2+4OH-==2CO32-+5H2O(2)负极:CH32OH-12e-+16OH-==2CO32-+11H2O(3)正极:3O2+6H2O+12e-==12OH-13、含碳燃料电池(碱性介质)的通式(1)总反应:含碳燃料+O2+OH-==CO32-+H2O(未配平)(2)负极:含碳燃料-e-+OH-==CO32-+H2O(未配平)(3)正极:O2+2H2O+4e-==4OH-14、熔融碳酸盐燃料电池(Li2CO3和Na2CO3熔融盐作电解液,CO作燃料)(1)总反应:2CO+O2==2CO2(2)负极:2CO+2CO32--4e-==4CO2(3)正极:O2+2CO2+4e-==2CO32-(持续补充CO2气体)15、银锌纽扣电池(碱性介质)(1)总反应:Zn+Ag2O==ZnO+2AgO(2)负极(Zn):Zn+2OH--2e-==ZnO+H(3)正极(Ag2O):Ag2O+H2O+2e-==2Ag+2OH-二、电解电极反应方程式1、电解CuCl2溶液(电解电解质型)(1)阳极:2Cl--2e-==Cl2↑(2)阴极:Cu2++2e-==Cu(3)总反应:2Cl-+Cu2+Cl 2↑+Cu2、电解精炼铜(1)阳极(粗铜):Cu-2e-==Cu2+(2)阴极(纯铜):Cu2++2e-==Cu3、电镀铜(1)阳极(纯铜):Cu-2e-==Cu2+(2)阴极(镀件,如Fe):Cu2++2e-==Cu4、电解饱和食盐水(放氢生碱型)(1)阳极:2Cl--2e-2↑(2)阴极:2H2O+2e-==H2↑+2OH-(3)总反应:2Cl-+2H 2O H2↑+Cl2↑+2OH-5、电解HCl溶液(电解电解质型)(1)阳极:2Cl-2e-==Cl2↑(2)阴极:2H++2e-==H2↑(3)总反应:2Cl-+2H+Cl 2↑+H2↑6、电解NaOH溶液(电解水型)(1)阳极:4OH--4e-==O2↑+2H2O(2)阴极:4H2O+4e-==2H2↑+4OH-(3)总反应:2H 2O2H2↑+O2↑7、电解H2SO4溶液(电解水型)(1)阳极:2H2O-4e-==O2↑+4H+(2)阴极:4H++4e-==2H2↑(3)总反应:2H 2O2H2↑+O2↑8、电解KNO3溶液(电解水型)(1)阳极:2H2O-4e-==O2↑+4H+(2)阴极:4H2O+4e-==2H2↑+4OH-(3)总反应:2H 2O2H2↑+O2↑9、电解CuSO4溶液(放氧生酸型)(1)阳极:2H2O-4e-==O2↑+4H+(2)阴极:2Cu2++4e-==2Cu↓(3)总反应:2Cu2++2H 2O2Cu↓+O2↑+4H+10、电解AgNO3溶液(放氧生酸型)(1)阳极:2H2O-4e-==O2↑+4H+(2)阴极:4Ag++4e-==4Ag↓(3)总反应:4Ag++2H 2O4Ag↓+O2↑+4H+。
压轴题05 电化学原理(原卷版)-高考化学压轴题专项训练(全国通用)

压轴题05电化学原理电化学是氧化还原反应知识的应用和延伸,是高考每年必考内容,通常会以新型二次电池为载体考查原电池原理与电解原理。
试题以新型电源及含有离子交换膜的原电池、电解池为背景,通过陌生电化学装置图,在复杂、新颖的研究对象和真实问题情境下,主要考查电极反应式的正误判断与书写,电池反应式的书写,正负极的判断,电池充、放电时离子或电子移动方向的判断,电极附近离子浓度的变化,电解的应用与计算,金属的腐蚀与防护等,体现了对电化学知识基础性、综合性、创新性和应用性的考查。
一、选择题:本题共20小题,每小题只有一个选项符合题意。
1.(2022·湖北·统考高考真题)含磷有机物应用广泛。
电解法可实现由白磷直接制备()2Li P CN ⎡⎤⎣⎦,过程如图所示(Me 为甲基)。
下列说法正确的是A .生成()21molLi P CN ⎡⎤⎣⎦,理论上外电路需要转移2mol 电子B .阴极上的电极反应为:()---42P +8CN -4e =4P CN ⎡⎤⎣⎦C .在电解过程中-CN 向铂电极移动D .电解产生的2H 中的氢元素来自于LiOH 2.(2022·辽宁·统考高考真题)某储能电池原理如图。
下列说法正确的是A .放电时负极反应:()()-+3242433Na Ti PO -2e =NaTi PO +2NaB .放电时-Cl 透过多孔活性炭电极向4CCl 中迁移C .放电时每转移1mol 电子,理论上4CCl 吸收20.5mol Cl D .充电过程中,NaCl 溶液浓度增大3.(2023·浙江·高考真题)在熔融盐体系中,通过电解2TiO 和2SiO 获得电池材料()TiSi ,电解装置如图,下列说法正确的是A .石墨电极为阴极,发生氧化反应B .电极A 的电极反应:2228H TiO SiO 8e TiSi 4H O=+-++++C .该体系中,石墨优先于Cl -参与反应D .电解时,阳离子向石墨电极移动4.(2022·重庆·统考高考真题)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。
2025年高考化学总复习(人教版)第38讲多池、多室的电化学装置
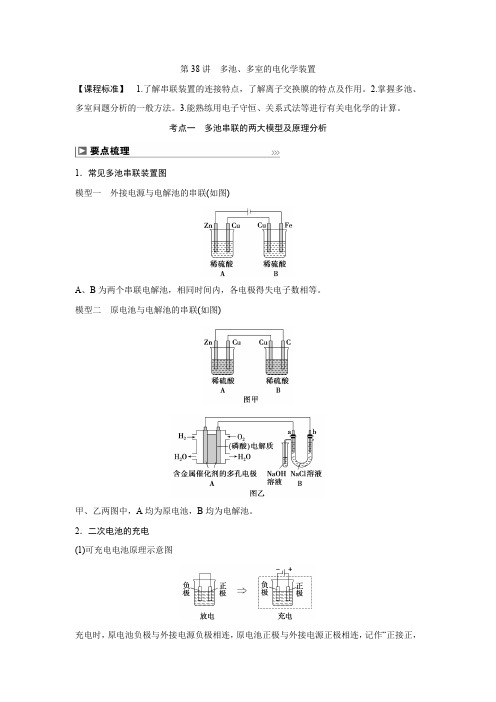
第38讲多池、多室的电化学装置【课程标准】 1.了解串联装置的连接特点,了解离子交换膜的特点及作用。
2.掌握多池、多室问题分析的一般方法。
3.能熟练用电子守恒、关系式法等进行有关电化学的计算。
考点一多池串联的两大模型及原理分析1.常见多池串联装置图模型一外接电源与电解池的串联(如图)A、B为两个串联电解池,相同时间内,各电极得失电子数相等。
模型二原电池与电解池的串联(如图)甲、乙两图中,A均为原电池,B均为电解池。
2.二次电池的充电(1)可充电电池原理示意图充电时,原电池负极与外接电源负极相连,原电池正极与外接电源正极相连,记作“正接正,负接负”。
(2)可充电电池有充电和放电两个过程,放电时是原电池反应,充电时是电解池反应。
充电、放电不是可逆反应。
学生用书↓第214页(3)放电时的负极反应和充电时的阴极反应相反,放电时的正极反应和充电时的阳极反应相反。
将负(正)极反应式变换方向并将电子移项即可得出阴(阳)极反应式。
Fe(OH)2+2Ni(OH)2,放电时负极的电极反应式为Fe-2e-+例:Fe+Ni2O3+3H2O放电充电2OH-===Fe(OH)2,则充电时阴极的电极反应式为Fe(OH)2+2e-===Fe+2OH-。
3.电化学计算的三种方法如以电路中通过4 mol e-为桥梁可构建以下关系式:(式中M为金属,n为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
(双选)(2022·山东卷)设计如图装置回收金属钴。
保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。
已知电极材料均为石墨材质,右侧装置为原电池。
下列说法正确的是()A.装置工作时,甲室溶液pH逐渐增大B.装置工作一段时间后,乙室应补充盐酸C.乙室电极反应式为LiCoO2+2H2O+e-===Li++Co2++4OH-D.若甲室Co2+减少200 mg,乙室Co2+增加300 mg,则此时已进行过溶液转移答案:BD解析:电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,Co2+在另一个电极上得到电子,被还原产生Co单质,CH3COO-失去电子后,H+通过阳膜进入阴极室,甲室溶液pH减小,A错误;对于乙室,正极上LiCoO2得到电子,被还原为Co2+,同时得到Li+,其中的O与溶液中的H+结合H2O,因此电池工作一段时间后应该补充盐酸,B正确;电解质溶液为酸性,不可能大量存在OH-,乙室电极反应式为LiCoO2+e-+4H+===Li++Co2++2H2O,C错误;若甲室Co2+减少200 mg,电子转移物质的量为n(e-)=0.2 g59 g/mol×2≈0.006 8 mol,乙室Co2+增加300 mg,转移电子的物质的量为n(e-)=0.3 g59 g/mol×1≈0.005 1 mol,说明此时已进行过溶液转移,D正确。
电化学中一些疑难电极反应式的书写

总反应式 :H。 C OH ̄昔 O - C O 十+2 : HO
3 甲烷 、 . 空气 、 OH 溶液 足量 , 孔两碳 棒 构成燃 K 多 料 电池 , 写出其电极反应及总反应式 。
总反应 :Al OH +2 2 +2 H O一
负极 : H -8 -1 O ——c X - 7 ) C e4 0H ( 4 H(
正 极 : 0 8 - 4 O—— 8 2 - e 4 H2 4 OH 总反应 : CH 2 - 2 4 - 0 4 OH一 - 一 C + 3 ( ( H )
() 2 写出 Al g 浓 HN 。 、 、 A O 构成的电池反应 。
分析: 在浓 HNO 中, 1 。 A 钝化 , 溶解 ” A 作还原 剂 ,
H 十+2 OH K
二 、 关燃 料 电池 的反 应 有
原理简析 : 燃料 电池并 非燃 料 ( 原剂 如 H 、 O、 还 C C 。C O 等) H 、 H。 H 在氧化剂 ( O 、 l等) 如 2c。 中燃 烧 ( 这 若 样, 则化学能转 变为热 能 、 能 了) 而是直 接将 化学 能 光 , 转变为电能 。因为在燃料 电池 中, 燃料 ( 原剂) 还 与氧 化 剂分别附着在多孔 的两 电极 ( 常是惰 性 电极 如 C、 tN P、 i 等) , 上 电极 插入 电解质 溶液 中, 电极存 在 电势差 , 两 电 子流动 , 发生氧化还原反应 , 产生 的化学 能转变 为电能 , 从而构成燃料电池 。 书写燃料 电池 的 电极 反应 式 , 注意 放 电“ 要 环境 ” 。
阳 极 反应 : Mn Y —2 一 2 ( 4 e一 2 O4 Mn
由 {
三、 几种新型蓄 电池( 原电池 、 电解池 ) 反应
专题07 电化学及其应用-三年(2022-2024)高考化学真题分类汇编(全国通用)(学生卷)

专题07电化学及其应用考点三年考情(2022-2024)命题趋势考点1电化学及其应用◆原电池、化学电源:2024安徽卷、2024全国甲卷、2024新课标卷、2024河北卷、2024江苏卷、2024北京卷、2023广东卷、2023全国乙卷、2023新课标卷、2023山东卷、2023辽宁卷、2022全国甲卷、2022全国乙卷、2022福建卷、2022广东卷、2022浙江卷、2022辽宁卷、2022山东卷、2022湖南卷◆电解池的工作原理及应用:2024黑吉辽卷、2024湖北卷、2024山东卷、2024湖南卷、2024甘肃卷、2024广东卷、2023全国甲卷、2023湖北卷、2023辽宁卷、2023北京卷、2023广东卷、2023湖南卷、2023浙江卷、2022广东卷、2022天津卷、2022海南卷、2022辽宁卷、2022重庆卷、2022湖北卷、2022北京卷、2022河北卷、2022浙江卷◆金属的腐蚀与防护:2024浙江卷、2024广东卷、2022辽宁卷、2022河北卷、2022湖北卷、2022广东卷高考对于电化学板块内容的考查变化变化不大,主要考查陌生的原电池装置和电解池装置的分析,对于电解池的考查概率有所提高,特别是利用电解池生产化工品和处理环境污染物成为命题特点。
问题的落脚点主要是在电极的极性判断、两极发生的反应情况和电解液成分的参与情况这些问题上。
考法01原电池、化学电源1.(2024·安徽卷)我国学者研发出一种新型水系锌电池,其示意图如下。
该电池分别以Zn-TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn 为电极,以ZnSO 4和KI 混合液为电解质溶液。
下列说法错误的是A.标注框内所示结构中存在共价键和配位键B.电池总反应为:-2+-3I +Zn Zn +3I 放电充电C.充电时,阴极被还原的Zn 2+主要来自Zn-TCPPD.放电时,消耗0.65gZn ,理论上转移0.02mol 电子2.(2024·全国甲卷)科学家使用δ-MnO 2研制了一种MnO 2-Zn 可充电电池(如图所示)。
电化学中电极反应式的书写技巧
技法点拨电化学中电极反应式的书写技巧■付延芳高考试题年年新,但在新情境中却会发现有些内容是惊人的相似,抓住这些核心主干知识的考查规律是高考获取高分的秘籍,但是对高考数据分析却发现,学生丢分点拉开差距的并不是那些偏难的内容,恰恰是这些中等难度高频出现的知识点,例如氧化还原反应规律的考查。
探索那些大家必须掌握的高频率高考热点,大道至简,有好的思维模式和突破思路,将大大降低这些考点的难度,提高正确率,今天我们通过氧化还原反应的电化学中电极反应式的书写规律来管中窥豹,旨在“抛砖引玉”。
还原产物CH 4两个半反应:失电子得电子CH -4-8e -+10OH -=CO 2-3+7H 2O2O 2+4H 2O+8e -=8OH --++首先,电化学中电极反应式的书写和氧化还原离子方程式的书写规律是一致的,遵循原子守恒、电荷守恒、得失电子守恒。
它是一个完整的氧化还原反应同时在两极发生完成的,可以按照上图思维框架来着笔半反应方程式的书写。
同时在书写半反应时要考虑介质环境,这是在配平半反应时所必需的。
一般而言,根据酸性或碱性环境水溶液的判断,要H 2O/OH-或者H 2O/H +来调配才能满足电子、原子和电荷三大守恒关系;根据熔融盐或熔融氧化物等电解质环境,可以用熔融盐或熔融氧化物中的离子等来配平,如Li+、CO 32-、O 2-等。
下面将在规律总结的同时加以说明。
一、原电池中电极反应式的书写先确定原电池的正负极,列出正负极上的反应物质(氧化剂和还原剂),并标出相同数目电子的得失。
然后在主要参与物质氧化剂和还原剂以及得失电子的基础上,通过观察来增加其他物质或离子来配平。
分析历年高考题阅卷统计数据不难发现,细节决定成败,学生丢分点往往是在不起眼的符号“+”和“-”上,其实我认为这恰恰是老师的疏忽所在,如果让学生死记“+”和“-”,肯定要颠三倒四,但是如果讲讲中国汉字的学问,讲讲符号无非是为了理解的方便,从字面上就不难理解“-”为失,“+”为得,那么在书写时准确率就会达到100%,通过这个简单的符号“+”和“-”在高考中得分率并不高,我们就更应该通过推理而不是记忆来学好化学。
CHI760D电化学工作站操作手册
CHI760D电化学工作站操作手册一、仪器介绍CHI760D系列电化学分析仪/工作站为通用电化学测量系统.CHI600B系列仪器集成了几乎所有常用的电化学测量技术,包括恒电位,恒电流,电位扫描,电流扫描,电位阶跃,电流阶跃,脉冲,方波,交流伏安法,流体力学调伏安法,库仑法,电位法,以及交流阻抗等.可以进行各种电化学常数的测量。
二、仪器组成1. 整机由电化学工作站、微机、三电极系统组成(1) 电化学工作站(2) 三电极系统(3) 电源线红夹线:接辅助电极;绿夹线:接工作电极;白夹线:接参比电极;黑夹线:为地线三、操作程序1. 使用前先将电源线和电极连接:红夹线接辅助电极;绿夹线接工作电极;白夹线接参比电极。
2. 电源线和电极连接好后,将三电极系统插入电解池3. 打开工作站开关4. 双击桌面CHI快捷方式图标,打开CHI工作站控制界面4.1 快捷菜单常用符号及意义:新建;:打开文件;:选择实验技术;:参数设置;:运行;:暂停;:停止;:反向扫描;:放大;:手动设置结果;:定义峰;:图形设置;:颜色设置;:字体设置;:细化曲线;4.2 菜单栏及意义4.2.1 File 文件Open 打开文件用此命令打开数据文件。
数据会显示在屏幕上。
多文件界面允许打开多个文件。
读文件时,将鼠标器指向文件名,然后双击该文件名就行。
也可单击文件名,然后按OK键。
Save As 存储文件用此命令储存数据。
数据是以二进制格式储存的。
二进制格式最节省磁盘空间,而且实验参数和控制参数都一起存入文件中。
如果要运行与以前完全相同条件的实验,可读入以前的文件,然后运行实验。
存数据时,只要输入文件名,然后按OK键。
文件类型"。
BIN"会被自动加上。
如果该文件名已经存在,会有警告给出。
如果要取代以前的文件,用鼠标器选择已有的文件名,然后按OK键。
Delete 删除文件用此命令删除文件。
若要同时删除多个文件,可按住键盘上的CTRL键,同时用鼠标器一个个地选择文件名,然后按OK键,你会得到一个文件删除的警告。
CHI760D电化学工作站操作手册
CHI760D电化学工作站操作手册一、仪器介绍CHI760D系列电化学分析仪/工作站为通用电化学测量系统.CHI600B系列仪器集成了几乎所有常用的电化学测量技术,包括恒电位,恒电流,电位扫描,电流扫描,电位阶跃,电流阶跃,脉冲,方波,交流伏安法,流体力学调伏安法,库仑法,电位法,以及交流阻抗等.可以进行各种电化学常数的测量。
二、仪器组成1. 整机由电化学工作站、微机、三电极系统组成(1) 电化学工作站(2) 三电极系统(3) 电源线红夹线:接辅助电极;绿夹线:接工作电极;白夹线:接参比电极;黑夹线:为地线三、操作程序1. 使用前先将电源线和电极连接:红夹线接辅助电极;绿夹线接工作电极;白夹线接参比电极。
2. 电源线和电极连接好后,将三电极系统插入电解池3. 打开工作站开关4. 双击桌面CHI快捷方式图标,打开CHI工作站控制界面4.1 快捷菜单常用符号及意义:新建;:打开文件;:选择实验技术;:参数设置;:运行;:暂停;:停止;:反向扫描;:放大;:手动设置结果;:定义峰;:图形设置;:颜色设置;:字体设置;:细化曲线;4.2 菜单栏及意义4.2.1 File 文件Open 打开文件用此命令打开数据文件。
数据会显示在屏幕上。
多文件界面允许打开多个文件。
读文件时,将鼠标器指向文件名,然后双击该文件名就行。
也可单击文件名,然后按OK键。
Save As 存储文件用此命令储存数据。
数据是以二进制格式储存的。
二进制格式最节省磁盘空间,而且实验参数和控制参数都一起存入文件中。
如果要运行与以前完全相同条件的实验,可读入以前的文件,然后运行实验。
存数据时,只要输入文件名,然后按OK键。
文件类型"。
BIN"会被自动加上。
如果该文件名已经存在,会有警告给出。
如果要取代以前的文件,用鼠标器选择已有的文件名,然后按OK键。
Delete 删除文件用此命令删除文件。
若要同时删除多个文件,可按住键盘上的CTRL键,同时用鼠标器一个个地选择文件名,然后按OK键,你会得到一个文件删除的警告。
离子排序,电化学
变式训练2 室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同 的盐酸,直至盐酸过量,在下表中,分别讨论了上述实验 过程中离子浓度的大小顺序、对应溶质的化学式和溶液的 pH。试填写表中空白:
离子浓度由大到小的顺序 ① ②
精设大专题,构建知识网络
实 干 铸 就 辉 煌
抓住“四因素” 水的 电离平衡 弱电解质 电离平衡
水溶液中 的离子平衡
盐类的水 解
沉淀的溶 解平衡
精设大专题,构建知识网络
实 干 铸 就 辉 煌
改变条件 移动 C(CH3COO-) C(H+) 电离 导电 方向 程度 能力
加水 升高温度
加冰醋酸
K
同离子效应
电化学作业题:
3.上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。 写出阳极产生ClO2的电极反应式 。
解题思路1:
关注题干中给出的 信息,判断产物, 书写电极反应式。
归类讲评:习题讲评微课--陌生电极反应书写
实 干 铸 就 辉 煌
电化学作业题: 4.用吸收H2后的稀土储氢合金作为电池负极材料(用MH) 表示),NiO(OH)作为电池正极材料,KOH溶液作为 电解质溶液,可制得高容量,长寿命的镍氢电池。电池充 放电时的总反应为: 电池放电时,负极的电极反应式为____________。
④
教师分析点③分解动作
④
学生分析点①分解动作
④
学生分析点④分解动作
④检验
实 干 铸 就 辉 煌
25】 ℃时,向体积为10mL 0.1mol/L NaOH溶液中逐滴加入 0.1mol/L的CH3COOH溶液,曲线如右图所示,有关离子浓 度关系的比较中,错误的是( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ch.7电化学是化学中的分支学科课程中包括:电解质溶液(导电)电化学反应(热力学)电极过程(动力学)§7.1 电解质溶液的导电机理及法拉第定律电解质溶液导电,为离子导电离子定向运动:负离子向正极(电势高)正离子向负极(电势低)电极上物质发生变化(按电极上得失电子):阳极上,阴离子失去电子,氧化过程电极反应:还原态=氧化态+ze- 阴极上,阳离子得到电子,还原过程电极反应:氧化态+ze-=还原态电解池中,电解HClH+ + e =12H2(g) 阴极反应Cl- = 12Cl2(g) + e 阳极反应H+ + Cl- = 12H2(g) +12Cl2(g) 电解反应原电池, Cu-ZnZn = Zn 2++ 2e 阳极反应 Cu 2++ 2e = Cu 阴极反应Zn + Cu 2+ = Cu + Zn 2+电池反应 法拉第定律 当量关系(电子参与) 1mol 反应电量, Q = zF ,法拉第常数 F = Le = 6.022×1023×1.602×10-19 =9.65×105(C ·mol -1) 若反应进度为ξ, 则电量 Q =zF ξ 适用于电解,电池,所有电极反应 电量计(库仑计)§7.2 离子的迁移数每一种离子的定向运动,对导电贡献的划分 1. 离子迁移数的定义在电场中,离子定向运动称为电迁移(并非包括所有的离子运动)。
HCl 形式的电解质 (1—1型电解质)t + =I I I -+-+ = Q Q Q ++-+t- =I I I ++-+ = Q Q Q ++-+某离子运载的电流(电量)占总量的比例称为该离子迁移数例如:б mol 正离子,бmol 负离子,共通过4F 电子,而且-+=v v 3 t + =v v v ++-+ = 34 , t- = v v v -+-+ = 14Q Q +-=v v +-=尔数阴离子迁出阴极区的摩尔数阳离子迁出阳极区的摩离子的电迁移率U (淌度):电场强度E=1V ·m -1时的电迁移速率 U =v E, 单位:m 2· V -1·s -12.离子迁移数的测定 (1)希托夫法 (2)界面移动法§7.3 电导、电导率和摩尔电导率 1. 定义电导G , G = 1R , 单位: S(西门子) 1S = 1Ω-1电导率, R =ρAs, ρ电阻率 单位: Ω·mG =1ρAs = κAs , 电导率κ=1ρ, 单位:S ·m -1摩尔电导率 m Λ =k c, 单位:S ·m -1·mol -1 (c 单位mol ·m -3) 2.测定 惠斯通电桥3.摩尔电导率与浓度的关系c ↑, κ↑. c ↑, m Λ↓ 离子间存在相互影响 强电解质,稀溶液中, 存在直线关系m m ∞Λ=Λ- 柯尔劳施公式m ∞Λ无限稀释的摩尔电导率 , C →0时的m Λ, 极限摩尔电导率。
强电解质可用外推法求极限摩尔电导率。
弱电解质 C 很小时(极稀溶液) C ↓, m Λ↑↑(急剧增加) ,但无直线关系图3外推法,适用于强电解质,不适于弱电解质 4.离子独立运动定律和离子的摩尔电导率由数据: m ∞Λ(KCl ), m ∞Λ(LiCl ), m ∞Λ(KNO 3), m ∞Λ(LiNO 3)m ∞Λ(KCl )- m ∞Λ(LiCl )= m ∞Λ(KNO 3)-m ∞Λ(Li NO 3) ,与阴离子无关 m ∞Λ(KCl )- m ∞Λ(KNO 3)= m ∞Λ(LiCl )- m∞Λ(Li NO 3) ,与阳离子无关 离子间互不影响m ∞Λ(KCl )等于 m ∞Λ(K +)和m ∞Λ(Cl -)之和这就是离子独立运动定律。
由此可定义 离子的无限稀释的摩尔电导率1mol 电解质溶液中离子 ν+ mol 阳离子和ν- mol 阴离子,,m m m νν∞∞∞++--Λ=Λ+Λ , 适用于所有电解质。
用此方法可由强电解质间接求弱电解质极限摩尔电导率。
如:m ∞Λ(CH 3COOH )= m ∞Λ(H +) + m ∞Λ(CH 3COO -)= m ∞Λ(H +) + m ∞Λ(Cl -) + m ∞Λ(CH 3COO -) + m ∞Λ(Na +) -m ∞Λ(Cl -) - m ∞Λ(Na +)= m ∞Λ(HCl) + m ∞Λ(CH 3COONa) - m ∞Λ(NaCl)无限稀释时离子的迁移数 ,m mt ν∞++∞+∞Λ=Λ, ∞∞--∞-ΛΛ=mm t,ν讨论离子的摩尔电导率 指明基本单元 Mg 2+或12Mg 2+ , m Λ(Mg 2+)= 2m Λ(12Mg 2+) 离子电荷数为B Z ,1BZ 离子为基本单元 K +,12Mg 2+ , 13Al 3+, 12SO 42- 5.电导测定的应用*计算弱电解质的解离度和解离常数CH 3COOH = H + + CH 3COO -, 解离度α 解离前 c 0 0解离平衡时 c(1+α) c α c α()21c c k ccθθαα⎛⎫ ⎪⎝⎭=-=21αα- c cθ近似 mmα∞Λ=Λ *计算难溶盐的溶解度 测电导率κκ(溶液) = κ + κ(H 2O) , 已知 κ(H 2O)=1.60×10-4s ·m -1m ∞Λ = m ∞Λ(Ag +) + m ∞Λ(Cl -)m Λ ≈ m ∞Λmkc =Λ§7.4 电解质的平均离子活度因子 R 德拜-休克尔极限公式 1. 平均离子活度和平均活度因子HCl = H + + Cl -μ(HCl) = μ+ + μ_+μ=θμ+++a RT ln =θμ++θγbb RT ++ln-μ=θμ-+-a RT ln =θμ-+θγb b RT --ln)(HCl μ=θμ++θμ-+-+a a RT ln =)(HCl θμ+2ln ±a RTa ±=)(HCl μ=)(HCl θμ+()⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛⋅⋅-+-+θθγγb b b b RT ln-+±⋅=γγγ平均活度因子 ,b ±=平均质量摩尔浓度θγbb a ±±±⋅= 对 zzC A C A γγνν+-+-+-=+ z z νν++--=μνμνμ++--=+θθθμνμνμ++--=+ ()ννν1-+-+±⋅=a a a , -++=νννb a b θν±±±=⋅1()νννννν+-±+-=⋅ , ()ννν1-+-+±⋅=b b bln ln()b RT a RT bθνθνθμμμν±±±=+=+⋅ 2. 离子强度±γ与b 有关,与价型有关。
稀溶液中 b ↓,±γ↑ 稀溶液中,相同价型电解质,b 相同时,ν±近乎相等。
b 与价型 → 离子强度 212B B I b z =∑ , 单位 mol ·kg -1稀溶液范围内:I ∝±γlg 路易斯(Lewis)经验公式3.德拜-休克尔极限公式(Debye-H ückel 理论)离子氛 理论模型 非缔合式电解质理论单个离子活度因子 lg i i Az ν=-,平均活度因子 lg Az z ν±+-=-25℃水溶液中,A =0.509g (mol ·kg -1)-½德拜-休克尔极限公式适用于溶液非常稀释时。
§7.5 可逆电池及其电动势测定 电化学反应电解: △G >0, W ’>0, 电能 → 化学能 原电池:△G <0, W ’<0 化学能 →电能 1. 可逆电池△ G 热力学状态函数 可逆的概念 原电池的表示符号Zn| ZnSO 4(aq) ┆ CuSO 4(aq)︱Cu︱ 相与相间的界面 ┆ 两相可互溶溶液的分界面 ┆┆ 盐桥 阳极︱ 阳极物质 ┆┆ 阴极物质︱ 阴极 氢电极(阳极), 银-氯化银电极 (阴极), 单液电池阳极-++=e b H p H )()(212 阴极 )()(b Cl Ag e AgCl s --+=+电池反应)()()(21)(2b Cl b H Ag AgCl p H s -+++=+ Pt ︱H 2(p)︱HCl(b)︱AgCl(s)︱Ag可逆电池满足:①电极反应可逆向进行,②I 无限小,③其它过程均可逆。
2.韦斯顿(Weston)电池 标准电池 Cd(汞齐) ︱CdSO 4·83H 2O(s)︱CdSO 4(饱和溶液)︱Hg 2SO 4(s)︱Hg 阳极 Cd(汞齐)=Cd 2++ 2e -Cd 2++ SO 42-+83H 2O(l) = CdSO 4·83H 2O(s) Cd(汞齐) + SO 42- + 83H 2O(l) = CdSO 4·83H 2O(s) + 2e - 阴极 Hg 2SO 4(s) + 2e - = 2Hg(l) + SO 42-电池反应 Cd(汞齐)+Hg 2SO 4(s)+83H 2O(l) = 2Hg(l)+CdSO 4·83H 2O(s)3. 电池电动势的测定电池电动势 任意状态下可逆电池电动势 E (I →0,完全可逆)反向电动势 对消法 在此基础上测定E§7.6 原电池热力学可逆电池的电动势E 与热力学状态函数(,,r m r m r m H G S ∆∆∆)间关系。
①r m G zFE ∆=-可逆电池 1mol 反应, 电量Q=zF 法拉第定, 电功 '()r W zF E =- 可逆时, 'r m r G W zFE ∆==- 最基本的关系 ②()r m p ES zF T∂∆=∂ ()()r m p r m p G E S zF T T ∂∆∂=-∆=-∂∂,()r m p ES zF T ∂∆=∂ ()p ET ∂∂ 原电池电动势的温度系数 V ·K -1 有()p E T ∂∂ =0, ()p E T ∂∂>0, ()p ET∂∂<0三种不同情况。
③()r m p E H zFE zFT T∂∆=-+∂ r m r m r m H G T S ∆=∆+∆, ()r m p EH zFE zFT T∂∆=-+∂④,()r m p E Q zFT T ∂=∂ 原电池可逆放电 热 r Q T S =∆r Q H ≠∆ (恒压 , W ≠0)当()p ET∂∂=0 时, r Q =0 T ↑,E ↑ ()p ET∂∂>0, r Q >0, 电池吸热T ↑,E ↓ ()p ET∂∂<0, r Q <0 电池放热 ⑤能斯特方程ln Br m r m B BG G RT a νϑ∆=∆+∏ 等温方程r m G zFE ∆=-, 设r m G zFE ϑϑ∆=- ,E ϑ为标准电动势。
